Professional Documents
Culture Documents
Laboratorio de Hidrometalurgia
Uploaded by
josemiguel_455Original Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Laboratorio de Hidrometalurgia
Uploaded by
josemiguel_455Copyright:
Available Formats
LABORATORIO DE HIDROMETALURGIA DE : ALIAGA MITA JOSE MIGUEL PARA: ING VICTOR ASCUA ASUNTO: PREAPARACION Y TITULACION DEL CUANURO
DE SODIO
ARGUMENTO
INTRODUCCIN La cianuracin es el principal mtodo de produccin de oro en Mxico y en el mundo, debido a su gran efectividad y bajo costo, comparado contra otros mtodos en desuso o en desarrollo. Durante la lixiviacin, el oro es oxidado (Au Au+) y se enlaza con el cianuro formando iones aurocianuro Au(CN)2-. Para la recuperacin del oro presente en la solucin, esta puede ser sometida al mtodo de adsorcin en carbn activado para aumentar la concentracin de oro, con el fin de aplicar eficientemente la electrodeposicin del metal precioso. Alternativamente se puede aplicar el proceso Merrill-Crowe (precipitacin con zinc) para obtener oro en forma metlica. Durante la produccin de oro, un parmetro importante para el control del proceso es la concentracin de cianuro libre, ya que es necesario mantener una concentracin suficiente para lixiviar al oro y no agregar cantidades extra de cianuro. Las cantidades extra de cianuro representan un mayor gasto de reactivo, as como mayor contaminacin ambiental, cuando los efluentes son almacenados en las presas de residuos (Mudder y Botz, 2004). Para lograr un control efectivo de la concentracin de cianuro libre, en este proceso comnmente se aplica el mtodo analtico de determinacin por volumetra, comnmente llamado titulacin. El anlisis de cianuro libre por titulacin con una solucin de nitrato de plata consiste en la reaccin de iones de plata (Ag+) con el cianuro libre (CN-) para formar el in argentocianuro (Ag(CN)2-) (Clesceri y col.,1989; Nava-Alonso y col., 2007); esta reaccin ocurre mientras exista cianuro disponible para complejarse con la plata. Una vez que todo el cianuro ha reaccionado, la plata adicionada posteriormente reacciona con el in argentocianuro para formar un slido de cianuro de plata (AgCN), en caso de no existir algn agente indicador, o se lleva a cabo la reaccin de la plata adicionada con el in yoduro (I-) para precipitar yoduro de plata (AgI), en caso de estar presente yoduro de potasio (KI) como agente indicador. El volumen consumido de solucin de nitrato de plata de concentracin conocida puede relacionarse directamente con la concentracin de cianuro libre en la solucin problema titulada. La titulacin de cianuro libre con una solucin de nitrato de plata es una prctica comn en las plantas de produccin de oro y representa una forma muy confiable para determinar la concentracin de cianuro libre en una solucin cuando no existen especies que interfieran en la titulacin del cianuro. Sin embargo, al existir minerales con cobre soluble en la solucin de cianuro se forman especies cobrecianuro (Cu(CN)2-, Cu(CN)32-, Cu(CN)43-) que interfieren con la titulacin. La presencia de especies cobre-cianuro ocasiona una sobreestimacin de la concentracin de cianuro libre, cuando se compara contra la concentracin de cianuro libre pronosticada por la termodinmica del sistema cobre-cianuroagua (Shantz y Reich, 1978). Lo anterior origina un control ineficaz del cianuro libre en solucin y conlleva a una ineficiente disolucin de los metales preciosos, adems de las consecuencias ambientales mencionadas. La sobreestimacin en la Determinacin del cianuro libre en presencia de las especies cobre-cianuro podra analizarse desde el punto de vista termodinmico al comparar la energa libre de Gibbs de las reacciones que se llevan a cabo durante la titulacin. Esto se muestra en las ecuaciones [1], [2], [3], [4], [5] y [6] (HSC Chemistry v. 6.12). Ag+ + 2CN- = Ag(CN)2G= -27.701 kcal [1] Ag+ + 2Cu(CN)43- = Ag(CN)2- + 2Cu(CN)32- G= -23.581 kcal Ag+ + I- = AgI Ag+ + 2Cu(CN)2- = Ag(CN)2- + 2CuCN Ag+ + Ag(CN)2- = 2AgCN G= -21.853 kcal G= -16.742 kcal G= -16.462 kcal [ 2] [3] [4] [5]
Ag+ + 2Cu(CN)32- = Ag(CN)2- + 2Cu(CN)2- G= -13.944 kcal
[6]
Al adicionar la solucin tituladora de nitrato de plata a la solucin de cianuro a titular, las reacciones ocurriran en el orden de energa libre de Gibbs ms negativa a menos negativa. Para el caso en que se emplea el KI como agente indicador, implica que posterior al agotamiento del cianuro libre (ecuacin [1]) ocurrir la titulacin de la especie tetra-cianuro de cobre (Cu(CN)43-) (ecuacin [2]), antes que la aparicin del slido AgI (ecuacin [3]), con lo que se estara consumiendo un determinado volumen extra de solucin de nitrato de plata para reaccionar con la especie tetra-cianuro de cobre y por consiguiente se sobreestimara la concentracin de cianuro libre en la solucin problema; tal sobreestimacin resulta despreciable si se toma en cuenta la mnima concentracin de especie tetracianuro de cobre en una solucin comn de cianuracin. concentracin real que existe en las soluciones industriales de cianuracin de cada una de las especies, modifica el sistema hacindose necesario recalcular la energa libre de Gibbs para condiciones diferentes a la estndar (actividades unitarias, 25 C y 1 atm). El orden de reaccin y su valor de energa libre de Gibbs quedara de la siguiente forma: Ag+ + 2CN- = Ag(CN)2-20.552 kcal [1] Ag+ + 2Cu(CN)43- = Ag(CN)2- + 2Cu(CN)32-20.549 kcal [2] Ag+ + 2Cu(CN)32- = Ag(CN)2- + 2Cu(CN)2-20.543 kcal [6] Ag+ + I-12.287 kcal [3] Ag+ + Ag(CN)2-3.726 kcal [5] Ag+ + 2Cu(CN)2- = Ag(CN)2- + 2CuCN G= -0.981 kcal [4] Para el caso en que se empleen las energas libres de Gibbs para condiciones no estndar implica que posterior al agotamiento del cianuro libre (ecuacin [1]), ocurrir la titulacin de la especie tetra-cianuro de cobre (Cu(CN)43-) (ecuacin [2]) y de la especie tri-cianuro de cobre (Cu(CN)32-) (ecuacin [5]), antes que la aparicin del slido AgI (ecuacin 3); la concentracin de la especie tri-cianuro de cobre podra ser muy alta en las soluciones de cianuracin con cobre soluble, por lo que en este caso la sobreestimacin resulta considerable, pudiendo llegar al 46.5% (JimnezVelasco y col., 2011). Se ha encontrado una respuesta a este problema en un mtodo basado en la titulacin potenciomtrica. La titulacin potenciomtrica es un mtodo relativamente sencillo de llevar a cabo (existen incluso, equipos que pueden realizar la titulacin potenciomtrica automticamente) y es adems, muy confiable para la determinacin de cianuro libre. En este mtodo, se mide el potencial de la solucin mediante un electrodo de trabajo de plata pura y un electrodo de referencia mientras se adiciona la solucin tituladora de nitrato de plata; el potencial que se registra durante la titulacin se puede relacionar con la presencia y aparicin o desaparicin de las diferentes especies. De esta forma, al notar un gran cambio en el potencial medido, es posible determinar el punto final de la titulacin. Sin embargo, en soluciones que contienen cobre, no aparece un gran cambio en el potencial y la determinacin de cianuro libre es complicada. La tcnica se basa en el cambio de potencial que existe entre una solucin cuyo potencial est dominado por el potencial de la media celda del cianuro. CNO- + 2H+ + 2e = CN- + H2O E = -0.14 V [7] A una solucin cuyo potencial est dado por el potencial de la media celda de plata (esta media celda es la razn del uso del electrodo de plata, en lugar de otro electrodo inerte). Ag+ + e = Ag E = 0.799 V [8] Breuer y Henderson (2010) han propuesto un mtodo para poder determinar la concentracin de cianuro libre an cuando estn presentes complejos cobre-cianuro en la titulacin con nitrato de plata; este mtodo es bsicamente una titulacin potenciomtrica y la mejora propuesta por el estudio radica en la interpretacin de los datos obtenidos en la titulacin. En este estudio se introduce el empleo de una variable de respuesta, esta es la diferencia absoluta entre dos potenciales medidos con respecto a la adicin de una cierta cantidad de solucin de nitrato de plata (cambio de potencial) (ecuacin [9]). Cambio de potencial = |(Potencial 2 Potencial 1)| |(Volumen 2 Volumen 1)| [9] A una solucin cuyo potencial est dado por el potencial de la media celda de plata (esta media celda es la razn del uso del electrodo de plata, en lugar de otro electrodo inerte).
Ag+ + e = Ag E = 0.799 V
[8]
Breuer y Henderson (2010) han propuesto un mtodo para poder determinar la concentracin de cianuro libre an cuando estn presentes complejos cobre-cianuro en la titulacin con nitrato de plata; este mtodo es bsicamente una titulacin potenciomtrica y la mejora propuesta por el estudio radica en la interpretacin de los datos obtenidos en la titulacin. En este estudio se introduce el empleo de una variable de respuesta, esta es la diferencia absoluta entre dos potenciales medidos con respecto a la adicin de una cierta cantidad de solucin de nitrato de plata (cambio de potencial) (ecuacin [9]). Cambio de potencial = |(Potencial 2 Potencial 1)| |(Volumen 2 Volumen 1)| consumido de solucin de nitrato de plata en ese intervalo. Al graficar los datos como se describe anteriormente es posible observar un pico en el cambio de potencial, este pico identifica el trmino de la titulacin del cianuro libre, como se muestra en la Figura 1.
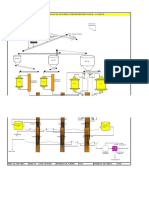
Figura 1.- Titulacin potenciomtrica (Breuer y Henderson, 2010). METODOLOGA Para establecer las concentraciones reales y sobreestimadas de cianuro libre que existen durante la titulacin de soluciones de cianuro con cobre, es necesario la preparacin de tres soluciones sintticas, para posteriormente: distribucin de especies. Titular las soluciones de cianuro empleando nicamente la determinacin visual. Titular las soluciones y medir su potencial redox empleando el arreglo mostrado en la Figura 2. Aplicar el mtodo de cambio de potencial a partir de la medicin de potencial. Con esto se obtienen tres estimaciones de cianuro libre: la termodinmica, la visual y la potenciomtrica. Trmino de la titulacin Para desarrollar las pruebas en este estudio se emple cianuro de potasio y cianuro de cobre para la preparacin de las soluciones sintticas. Para titular un volumen de 40 ml de solucin problema se emple una solucin tituladora de nitrato de plata (0.01537 M) y 12 gotas de solucin indicadora de yoduro de potasio (5% KI). Se prepararon tres soluciones sintticas de acuerdo a la Tabla I, todas con un pH de 12, ajustado con hidrxido de sodio (NaOH).
Tabla I.- Soluciones sintticas.
Para efectuar la titulacin potenciomtrica se emplea un electrodo de plata y un electrodo de referencia de calomel como se recomienda en la literatura (Breuer y col., 2011), estos estn inmersos en la solucin y conectados a un medidor de pH/mV. La solucin de nitrato de plata se adiciona mediante una bureta para medir el volumen consumido; la Figura 2 muestra el arreglo experimental empleado.
PROCEDIMIENTOS PARA LA PREPARACION 1. El personal que opere con cianuro debe estar entrenado en el manejo correcto de este producto. 2. Antes de abrir los envases se debe verificar que estos se encuentren completamente sellados y no se haya producido derrame o prdida alguna. Los cilindros o contenedores de cianuro son materiales no retornables ni reciclables, por lo que no se deber utilizar estos envases para almacenar ningn tipo de producto. Los envases de cianuro deben ser eliminados dentro de las instalaciones de la planta, nunca comercializados. Los efluentes del lavado de los envases vacos deben ir directamente a la poza de solucin barren y de all al circuito de cinuracion. El cianuro deber ser preparado para su uso en soluciones concentradas al 10%, en tanques especialmente diseados para este efecto.
3.
4.
5.
6.
7.
Para la disolucin del cianuro se emplear agua con lechada de cal o soda custica, con un pH (grado de alcalinidad) mayor a 10 y as impedir la formacin del cido Cianhdrico en forma de gas. Para la limpieza de los tanques de preparacin y/o distribucin de cianuro se verificar que estos hayan sido debidamente ventilados, verificando que no haya existencia de gases. La limpieza deber realizarse con personal debidamente entrenado en el manejo del cianuro, siempre en parejas y bajo la supervisin directa de una tercera persona. Los trabajadores debern contar con el equipo completo de proteccin personal y un kit conteniendo el antdoto respectivo.
8.
9.
Accidentes frecuentes ocurren cuando el personal ingresa a la zona de preparacin de cianuro, con las botas mojadas o con barro con los que el polvo existente en el piso, reacciona con esta humedad generando instantneamente cido cianhdrico.
PREPARACION DE LA SOLUCION DE NITRATO DE PLATA a) Se pesa la botella de vidrio marrn de un litro vaca y luego se le agrega agua hasta que su peso sea el peso en vaco ms un kilo (esto corresponde a agregar un litro de agua). Luego se marca el nivel alcanzado por el agua, se vaca y se seca la botella. b) Se pesan 17.33 gramos de nitrato de plata y se introduce en la botella, luego se la llena con agua destilada hasta la marca de un litro obtenindose la solucin de nitrato de plata. PREPARACION DE LA SOLUCION DE YODURO DE POTASIO 3 a) Se pesa la botella de vidrio vaca de 100 cm y se le agrega agua, hasta que su peso sea el peso en vaco ms 100 gramos. Luego se marca el nivel de agua en la botella, se vaca y se seca. b) Se pesa tres gramos de yoduro de potasio y se introduce en la botella. Luego se agrega agua destilada hasta la marca que corresponde a 100 cm.
You might also like
- Informe #1 - OperacionesDocument8 pagesInforme #1 - OperacionesJuana Bessie Diaz SanchezNo ratings yet
- Planta ProcesosDocument9 pagesPlanta ProcesosJuan Livia VilcaNo ratings yet
- Laboratorio 6 Procesos Metalúrgicos I (Autoguardado)Document10 pagesLaboratorio 6 Procesos Metalúrgicos I (Autoguardado)Adrian Chacchi LuqueNo ratings yet
- Pepino XDDocument10 pagesPepino XDJoseph ArgumeNo ratings yet
- TecsupDocument1 pageTecsupJhackson Nhoel Jove HalanocaNo ratings yet
- Lab 2 PCM IIDocument16 pagesLab 2 PCM IIJuan Livia VilcaNo ratings yet
- DIAGRAMA DE POURBAIX PARA EL SISTEMA Cu-S-H2O - y Cu-O-H2O1Document10 pagesDIAGRAMA DE POURBAIX PARA EL SISTEMA Cu-S-H2O - y Cu-O-H2O1Stefany ZacquerNo ratings yet
- Laboratorio de PCM II n4 y 5 PDFDocument20 pagesLaboratorio de PCM II n4 y 5 PDFhermelindaNo ratings yet
- Unidad V FLOTACION DE MINERALES EN CELDA COLUMNADocument20 pagesUnidad V FLOTACION DE MINERALES EN CELDA COLUMNAHector Suarez RiosNo ratings yet
- Determinaciones de Cianuro y CalDocument4 pagesDeterminaciones de Cianuro y CalJoel Gonzalo Aviles Sandoval100% (1)
- Lab 10 Método de VolhardDocument6 pagesLab 10 Método de VolhardJames Junior Rojas SanchezNo ratings yet
- Laboratorio N 1 de Hidrometalurgia 55Document16 pagesLaboratorio N 1 de Hidrometalurgia 55Yesi SalvadorNo ratings yet
- Hidro 1Document13 pagesHidro 1Yesica RiveraNo ratings yet
- Marcha AnalíticaDocument13 pagesMarcha AnalíticaDelta AméricaNo ratings yet
- Unidad 7.2 Determinacion Del Cianuro LibreDocument11 pagesUnidad 7.2 Determinacion Del Cianuro LibreFiorela RivasNo ratings yet
- Informe 1Document10 pagesInforme 1luiguiNo ratings yet
- LABORATORIO N 1 Quimica Analitica Instrumental Termindo11Document14 pagesLABORATORIO N 1 Quimica Analitica Instrumental Termindo11Gian Carlos Dheyvi Quispe Rivera0% (1)
- Determinación de Hierro Diaz-ChavezDocument11 pagesDeterminación de Hierro Diaz-ChavezRosarioNo ratings yet
- Negociacion y Seleccion de ProveedoresDocument14 pagesNegociacion y Seleccion de ProveedoresXiomiBellQuispeRiveraNo ratings yet
- Examen 1 CorregidoDocument3 pagesExamen 1 CorregidoFranklin Charca MamaniNo ratings yet
- LABORATORIO10d 1Document6 pagesLABORATORIO10d 1James J. Rojas SanchezNo ratings yet
- Hidrometalurgia - Laboratorio 14Document4 pagesHidrometalurgia - Laboratorio 14Joseph ArgumeNo ratings yet
- Procesos Pirometalurgicos - Tratamiento de EscoriasDocument15 pagesProcesos Pirometalurgicos - Tratamiento de EscoriasBaruc Lopez TorresNo ratings yet
- BBBBBBBBBBBBBBDocument75 pagesBBBBBBBBBBBBBBJordan anthonyNo ratings yet
- Pract2 1 4Document1 pagePract2 1 4Alexandra MolinaNo ratings yet
- Laboratorio 9 Analitica InstrumentalDocument4 pagesLaboratorio 9 Analitica InstrumentalIvan Cerquera PerezNo ratings yet
- Industrial 8Document4 pagesIndustrial 8Flor De Maria Mamani ParilloNo ratings yet
- Determinacion de Cu Por Volume Tri A RedoxDocument7 pagesDeterminacion de Cu Por Volume Tri A RedoxRodrigo Fuentes ValladaresNo ratings yet
- Hidro Informe 6Document19 pagesHidro Informe 6mariaNo ratings yet
- LaboratorioN°2 PlantaDocument14 pagesLaboratorioN°2 PlantaNicole Flores GenebrozoNo ratings yet
- 1186380081-Lab 3 PiroDocument8 pages1186380081-Lab 3 PiroluiguiNo ratings yet
- Laboratorio 7 de Hidro y Electrometalurgia-Preci (Itación Por CementaciónDocument13 pagesLaboratorio 7 de Hidro y Electrometalurgia-Preci (Itación Por CementaciónPjanoo1989No ratings yet
- Informe 7 FisicoquimicaDocument11 pagesInforme 7 FisicoquimicaMichael Alexander Baltazar CondorNo ratings yet
- Hidro Lab02Document10 pagesHidro Lab02luiguiNo ratings yet
- LIXIVIACION DE MALAQUITA CuCO3Document27 pagesLIXIVIACION DE MALAQUITA CuCO3FRANKNo ratings yet
- Cuestionario 4 PqiDocument5 pagesCuestionario 4 PqiGiancarlo MendizabalNo ratings yet
- 1186369541-Labo3 PiroDocument15 pages1186369541-Labo3 PiroluiguiNo ratings yet
- CuestionarioDocument5 pagesCuestionarioMichael Alexander Baltazar CondorNo ratings yet
- Laboratorio 10Document13 pagesLaboratorio 10Angel HernandezNo ratings yet
- Fire Assay 02Document13 pagesFire Assay 02Danielle KaufmanNo ratings yet
- Módulo de Merrill Crowe PDFDocument30 pagesMódulo de Merrill Crowe PDFEder Aranda CarbonellNo ratings yet
- GoetittaDocument5 pagesGoetittaluiguiNo ratings yet
- Cianuracion BatchDocument1 pageCianuracion BatchPaul Mamani BernedoNo ratings yet
- FermentacionDocument10 pagesFermentacionGian Carlos Dheyvi Quispe RiveraNo ratings yet
- Lab 2 HidroDocument13 pagesLab 2 HidroPaolo Gabriel Diaz LopezNo ratings yet
- Metalurgia Del OroDocument37 pagesMetalurgia Del Orodavidnavarrete1991No ratings yet
- Determinacion de OroDocument11 pagesDeterminacion de Orooskar0706No ratings yet
- 3 HidroDocument3 pages3 HidroNicole Flores GenebrozoNo ratings yet
- Actividades de Labortaorio #5Document5 pagesActividades de Labortaorio #5Luigui Laureano Ano ApazaNo ratings yet
- Curva de Partición de Un ClasificadorDocument7 pagesCurva de Partición de Un ClasificadorOliviet Wilfredo Roca CuyubambaNo ratings yet
- Laboratorio Numero 13 PCMDocument15 pagesLaboratorio Numero 13 PCMJoseph ArgumeNo ratings yet
- Fundidión de Metales Parte II Proceso de ColadaDocument15 pagesFundidión de Metales Parte II Proceso de ColadaLuzAngelaSaraNo ratings yet
- Lab 7 HidroDocument9 pagesLab 7 HidroJoseph ArgumeNo ratings yet
- Control Del Set Chancadora de MandibulasDocument20 pagesControl Del Set Chancadora de Mandibulasluisantonio2No ratings yet
- Flow Sheet - TentativoDocument2 pagesFlow Sheet - TentativoJuan Carlos Ramos Centeno100% (1)
- Ultimo ReporteDocument5 pagesUltimo ReporteYesica RiveraNo ratings yet
- Laboratorio MetalurgiaDocument6 pagesLaboratorio MetalurgiaFernandoMANo ratings yet
- Determinacion Volumetrica de HierroDocument0 pagesDeterminacion Volumetrica de HierroquimicaunsaNo ratings yet
- Determinacion de Cianuro Libre Por VolumetriaDocument12 pagesDeterminacion de Cianuro Libre Por Volumetrialuisantonio2100% (1)
- Medición de Cianuro Libre Por Volumetría en Presencia de Especies Cobre-CianuroDocument12 pagesMedición de Cianuro Libre Por Volumetría en Presencia de Especies Cobre-CianuroAlvaro SvNo ratings yet
- Articulaciones Del Miembro InferiorDocument3 pagesArticulaciones Del Miembro Inferiorjose goiteNo ratings yet
- Jesús en Galilea DRAMADocument4 pagesJesús en Galilea DRAMArigo daniel mirandaNo ratings yet
- 2da Parte Del Proyecto CocaDocument28 pages2da Parte Del Proyecto Cocavictor constancio encinas floresNo ratings yet
- Cuchillas Seccionadoras GiratoriasDocument6 pagesCuchillas Seccionadoras GiratoriasHéctor HernándezNo ratings yet
- Region PacificaDocument10 pagesRegion PacificaLuis MendozaNo ratings yet
- Wa0124.Document2 pagesWa0124.Maria Andrea Sandoval GalvanNo ratings yet
- Factores Que Influyen Positiva o Negativamente en La Salud FamiliarDocument1 pageFactores Que Influyen Positiva o Negativamente en La Salud FamiliarAna AlvarezNo ratings yet
- Trabajo de Campo 3 - Grupo 1Document17 pagesTrabajo de Campo 3 - Grupo 1EverJoelParaguayOcasNo ratings yet
- AV800 User Manual - SpanishDocument52 pagesAV800 User Manual - SpanishJhimmy MamaniNo ratings yet
- Lentejas Estofadas Velocidad CucharaDocument1 pageLentejas Estofadas Velocidad CucharaMarRuizCuadraNo ratings yet
- Presentacion 11 BIOLOGIADocument18 pagesPresentacion 11 BIOLOGIAOscar Alberto Cotrina PerezNo ratings yet
- Segunda Ley y Tercera LeyDocument3 pagesSegunda Ley y Tercera Leyeutectic1992No ratings yet
- Manual de Inst Plyrock Amarillo 16 MarzoDocument7 pagesManual de Inst Plyrock Amarillo 16 MarzoCesar ArciaNo ratings yet
- Informe LiofilizaciónDocument10 pagesInforme LiofilizaciónSANTIAGO RODRIGUEZ GARCIANo ratings yet
- Ficha Ruta Paseo Por Las Lagunas de Jarambel y Las LagunillasDocument2 pagesFicha Ruta Paseo Por Las Lagunas de Jarambel y Las LagunillasClub Amo AlláNo ratings yet
- Manual Plancha de Calentamiento Con Agitación y Temporizador Jjbmwm2 MedianaDocument3 pagesManual Plancha de Calentamiento Con Agitación y Temporizador Jjbmwm2 MedianaJeison Janner Rodriguez NoriegaNo ratings yet
- Tomografia Coherencia OpticaDocument166 pagesTomografia Coherencia Opticapumanei100% (5)
- Shocker PDFDocument3 pagesShocker PDFING_PUICONNo ratings yet
- Santiago - Liceo de Adultos Herbert Vargas WallisDocument8 pagesSantiago - Liceo de Adultos Herbert Vargas WallisRó Stroskoskovich100% (1)
- Morfofuncion CuestionarioDocument51 pagesMorfofuncion CuestionarioPaula CarrascoNo ratings yet
- Historia de La BromatologiaDocument2 pagesHistoria de La BromatologiaJheymer BaronNo ratings yet
- Cartas de Invitación Alcades - Gobernadores +Document4 pagesCartas de Invitación Alcades - Gobernadores +JP ZavaletaNo ratings yet
- Manual Kit Cristal I Zac I OnDocument12 pagesManual Kit Cristal I Zac I OnsusiferreyraNo ratings yet
- Modulo 1 Procesos Contables MJR Tito S.A.CDocument22 pagesModulo 1 Procesos Contables MJR Tito S.A.CAngel Vilca poloNo ratings yet
- CriminologiaDocument9 pagesCriminologiaErica RossNo ratings yet
- Célula ProcariotaDocument26 pagesCélula Procariotakaren.vazquez5325No ratings yet
- Introducción A Los HidrocarburosDocument24 pagesIntroducción A Los HidrocarburosFabian FernandezNo ratings yet
- PDF 20230623 161142 0000Document12 pagesPDF 20230623 161142 0000Liseth Berenice Borja AcevedoNo ratings yet
- Diatomeas Exposición (Sandra Virguez)Document37 pagesDiatomeas Exposición (Sandra Virguez)Sandra Milena Virgüez BernalNo ratings yet
- Guía El Cerebro AdolescenteDocument1 pageGuía El Cerebro AdolescenteJose Zeballos BelmarNo ratings yet