Professional Documents
Culture Documents
Teoría Fase 1de Análisis Químico I 2012
Uploaded by
Rosmery Cardenas HurtadoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Teoría Fase 1de Análisis Químico I 2012
Uploaded by
Rosmery Cardenas HurtadoCopyright:
Available Formats
ING ARMANDO SALINAS SANCHEZ 1 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
UNIDAD I
CONCEPTOS GENERALES DE ANLISIS QUMICO
DEFINICION La qumica es la ciencia que se ocupa de la materia por cuanto a la composicin de las sustancias que la integran, de los cambios que stas sufren y las leyes que rigen esos cambios. La qumica analtica es una rama de la qumica que comprende los mtodos empleados para determinar los componentes de una sustancia, su relacin de composicin, sus propiedades qumicas y su comportamiento qumico frente a otras sustancias.(qumica analtica por Luna Rangel) La qumica analtica es la parte de la qumica que estudia especialmente los principios y mtodos tericos de anlisis qumico, empleando los mtodos para separar y caracterizar los elementos y compuestos que se encuentren en una muestra dada. La qumica analtica trata de la deteccin de la naturaleza (anlisis cualitativo) y de la medida de las cantidades (anlisis cuantitativo) de las diversas sustancias presentes en un material. Comprende no solo tcnicas manipulatorias, sino tambin las consideraciones teoras en que se fundamenta las separaciones, detecciones y medidas.(Anlisis qumico cuantitativo de Gilbert Ayres) Segn Fischer yPeters( Anlisisis Qumico Cuantitativo), la Qumica analtica es la ciencia de caracterizacin de las sustancias qumicas. En la prctica, la qumica analtica recurre a todos los mtodos, mediciones y tcnicas para obtener informacin acerca de la estructura y la composicin de la materia. La caracterizacin qumica completa de la composicin de toda porcin de materia ha de comprednder informacin cualitativa y cuantitativa Segn Skoog/wesT/Holler, la Qumica analtica comprende la separacin, identificacin y determinacin de las cantidades relativas de los componentes que forman una muestra de materia. Segn Gary Christian (Qumica Analtica), la qumica analtica se ocupa de la caracterizacin qumica de la materia, tanto cualitativa como cuantitativamente. Todo est hecho de productos qumicos, los qumicos analticos determinan cules y cunto. El fundamento de un anlisis qumico radica en que los diversos materiales presentan propiedades fsicas, propiedades que estn sujetas a ser detectables o medidas, estas propiedades que son llamadas seales analticas su medicin son tiles con fines analticos. Entre ellas figuran propiedades mecnicas, como la densidad, tensin superficial, viscosidad, propiedades trmicas, elctricas, etc. CLASIFICACIN La qumica analtica incluye Lo siguiente :
A)
El Anlisis Cualitativo El anlisis cualitativo, permite descubrir e identificar los componentes que constituyen la muestra que se analiza, revela la identidad qumica de los analitos y sus resultados se expresan en palabras, nombres o smbolos de las clases o agrupamientos especiales de tomos, iones o molculas. Por ejemplo, el material en estudio presenta el elemento cobre, est como cobre (II) y su frmula molecular es sultato de cobre (II).
B)
El Anlisis Cuantitativo En este anlisis se determinan las cantidades relativas o absolutas de uno o varios de los componentes, proporciona la cantidad, en trminos numricos, de uno o ms de estos analitos, la informacin obtenida en un anlisis cuantitativo se expresa en nmeros con
ING ARMANDO SALINAS SANCHEZ 2 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
indicacin de las unidades que estos nmeros expresan, como porcentaje, partes por milln o miligramos por litro, etc. Antes de practicar un anlisis cuantitativo se necesita la informacin cualitativa, porque los resultados de esta sirven de gua necesaria para la seleccin del mtodo y el procedimiento que han de emplearse en la segunda.
OBJETIVOS DE LA QUIMICA ANALITICA
Son objetivos de la qumica analtica: El desarrollo ms completo de la teora de los mtodos de anlisis El perfeccionamiento y argumentacin cientifica de los mtodos de anlisis existentes La elaboracin cientifica de nuevos mtodos de anlisis que correspondan a los requerimientos de la ciencia avanzada y la produccin moderna El anlisis de las sustancias naturales y del medio ambiente(suelos, aire, aguas) como tambin de los materiales tcnicos y sintticos cada vez ms complejos El control qumico analtico de la produccin y de los trabajos de investigacin cientifica en la rama de la qumica, tecnologa qumica, bioqumica, medicina, mineria, etc. METODOS DE LA QUMICA ANALTICA A) Mtodos qumicos de Anlisis En el anlisis cualitativo, para determinar la composicin de una sustancia a analizar, a sta se aaden otras sustancias que causan unas transformaciones qumicas que van acompaadas con la formacin de nuevas sustancias poseedoras de propiedades especficas. Estas propiedades pueden ser : un estado fsico (precipitado, lquido, gas); solubilidad conocida en agua, cidos, lcalis y otros disolventes qumicos; color caractersticos, estructura cristalina o amorfa, olor, etc. B) Mtodos fsicos de anlisis La presencia de un elementos qumico en la composicin de la sustancia que se somete al anlisis puede ser descubierta sin recurrir a las reacciones qumicas. Esto se logra basndose directamente en los datos obtenidos del estudio de las propiedades fsicas de la sustancia a investigar y se denominan mtodos fsicos de anlisis. Entre los mtodos fsicos de anlisis ms conocidos pueden citarse los siguientes: 1) Anlisis Espectral, basado en la investigacin de los espectros de emisin y de absorcin de las sustancias que se investigan 2) Anlisis por luminiscencia(Fluorescencia), basado en la observacin del brillo de las sustancias a analizar provocada por la accin de los rayos ultravioleta 3) Anlisis por Difraccin de rayos X, basado en el empleo de stos para la investigacin de la estructura de la sustancia 4) Mtodos basados en la medicin de la densidad de las sustancias a investigar C) Mtodos Fsico-Qumicos Estn basados en el estudio de los fenmenos fsicos que tienen lugar en el curso de las reacciones qumicas. Estas reacciones pueden ir acompaadas con el cambio de color de la solucin, la intensidad del color, conductividad elctrica, etc.
QUIMICA ANALITICA CUALITATIVA
En anlisis qumico cualitativo orgnico los compuestos orgnicos tienen enlaces covalentes y la mayor parte de ellos carecen de enlaces inicos y sus propiedades fsicas son diferentes de la mayora de los compuestos inorgnicos que generalmente son inicos. Los ensayos cualitativos de los elementos se basan en reacciones inicas, como los elementos presentes en compuestos orgnicos generalmente no son ionicos han de idearse otras formas de ensayo para convertirse en sales ionizables. Un ejemplo, los constituye el reconocimiento del carbn bajo la forma de bixido de carbono hacindolo reaccionar con hidrxido de bario y transformndose en un precipitado de carbonato de bario.
ING ARMANDO SALINAS SANCHEZ 3 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
El anlisis qumico cualitativo inorgnico se basa fundamentalmente en la identificacin de los elementos en su forma inica y mediante mtodos adecuados. Los objetivos del anlisis cualitativo pueden ser muy diversos, pero todos ellos se reducen a ls deteccin cualitativa de: Elementos qumicos que entran en la composicin de la sustancia a analizar, ejemplo, hierro, azufre. Iones simples que se forman al disolver la sustancia problema en agua otros disolventes, por ejemplo, iones Fe +2, o Fe +3. Grupos de tomos o iones complejos que cosntituyen la sustancia a investigar, por ejemplo,grupos CO3 -2, SO4 -2 Molculas, por ejemplo, CuSO4, CaCO3. Descubrir en un compuesto dado ciertos elementos estructurales y establecer su estructura. Por ejemplo, hallar en la sustancia a investigar los grupos hidroxilo o carboxilo, los dobles enlaces, ciertos radicales de hidrocarburos, etc. Establecer la frmula de una sustancia desconocida. Por ejemplo, de un preparado medicinal extrado de una planta.
ETAPAS DE UN ANALISIS CUALITATIVO
El anlisis cualitativo consta de los siguientes pasos:
1.- INVESTIGACIN ANALITICA PREVIA
Antes de proceder al anlisis completo de cierta muestra, preliminarmente se efecta su investigacin organolptica, es decir,se examinan las caractersticas fsicas sensibles al sentido humano: Color( las sustancias pueden ser coloridas o incoloras) olor(picante, ftido,irritante,inodoro) sabor(pueden ser agro, salado, dulce, cido, desabrido, amargo) impresin al tacto(aspero, blanda, dura, untuosa, cortante) Otras propiedades fsicas que se toman en consideracin es el examen visual con la muestra bruta son: Aspecto (la textura puede ser terrosa, fibrosa, granular, escamosa, cristalina, vitrea, amorfa) Diafanidad (transmiten luz en mayor o menor proporcin, puede ser transparente, opacidad, translcido) Lustre(metlico, submetlico, no metalico) Refraccin(refractan la luz, es decir, desvan la direccin de los rayo luminosos de acuerdo con si ndice de refraccin) Dureza(resistencia a ser rayadas las sustancias y se hace uso de una clasificacin de durezas de una escala de 1 a10, el que se deja rayar es ,ms blando, la escala va del talco, yeso, calcita, fluorita, apatito, ortosa, cuarzo,, topacio, corindn, diamante) Fluorescencia (emisin de luz por un cuerpo, al ser sometido a una radiacin electromagntica, ejemplo, rayos ultravioleta, X, beta, etc) Fosforescencia (se presenta cuando una sustancia sigue emitindo ondas electromagnticas visibles (luz) por cierto tiempo, a pesar de que haya cesado la exposicin de la sustancia a las radiaciones electrmagnticas) Magnetismo(algunos compuestos son capaces de ser atrados por un imn, es decir, tienen propiedades magnticas), etc. Tambin se presta atencin a la forma y tamao de las partculas. Esos ensayos fsicos y/o organolpticos se caracterizan por ser un examen que se realiza con la muestra bruta tal como llega al laboratorio, de este examen visual de la muestra no se pueden sacar conclusiones definitivas sobre la base de tales observaciones. Sin embargo, stas son, de todos modos tiles, puesto que al ser confrontadas con Muestras tipos con los resultados del anlisis incrementan nuestra seguridad en su ejecucin correcta.
ING ARMANDO SALINAS SANCHEZ 4 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
2.- PREPARACIN DE LA SUSTANCIA PARA EL ANALISIS
Si la sustancia es slida, se tritura ya que en este caso se disuelve mejor, Adems la trituracin es tambin necesaria porque tan solo con triturar bien la muestra a analizar se puede lograr una mezcla bastante uniforme de sus componentes. Las sustancias que se desmenuzan fcilmente se trituran en un mortero de porcelana o gata hasta reducirlas a polvo fino. Las muestras de dificil trituramiento,por ejemplo, los minerales se fragmentan primeramente en trozos, los ms pequeos en un mortero de acero y luego en un mortero de gata. Se tritura hasta obtener un tamao adecuado empleando tamices (MALLA 80 o 100 de la norma tyler). La muestra por analizar, finamente pulverizada, se divide en porciones que se emplean en los ensayos preliminares.
3- Pruebas Preliminares
En la identificacin de la muestra problema, adems de evaluar la informacin obtenida al haber considerado las propiedades fsicas, es necesario correr algunos ensayos , ya que en muchos casos si la muestra consiste en una sola sustancia, slo basta complementar con este tipo de ensayo para tener la completa identificacin de la muestra problema. Las pruebas preliminares se clasifican en:
A) Ensayos por Va Seca
En estos ensayos se requiere el uso del mechero de Bunsen. Estas pruebas son:
Ensayos a la Flama
La temperatura de la flama del mechero de bunsen, en algunos casos, es suficiente para vaporizar algunos elementos, y por ende, efecta la promocin de electrones a diferentes niveles superiores energticos, siempre mayores que los que ocupan a la temperatura ambiente. Al regresar los electrones a sus niveles de energa originales se desprende la energa absorbida en forma de ondas electromagnticas de mayor longitud de onda Si esta ondas desprendidas se encuentran en la zona del espectro visible, se podrn observar coloraciones que van del violeta al rojo, esto es lo que sucede cuando se lleva a la flama un catin que sea bastante voltil. Cada elemento, al vaporizarse, prcticamente produce un espectro nico y diferente de cualquier otro elemento. Los cloruros se encuentran entre los compuestos ms voltiles y se les prepara in situ mezclando el compuesto con un poco de cido clorhdrico concentrado antes de efectuar los ensayos.
COLORACIN
Elemento Color flama Sodio Amarillo Potasio violeta Calcio Rojo ladrillo estroncio Carmes
Ensayo a la Perla
Las reacciones de fusin con el brax (NaB4O0.10 H2O), que por calentamiento pasan a ser respectivamente una perla incolora , esta perla en contacto con una pequea cantidad de muestra a ensayar y llevando a calentamiento en flama oxidante o reductora, desarrolla una perla de color caracterstico de acuerdo al elemento presente en la muestra. Al calentar el brax la sal se hincha al perder su agua de cristalizacin y luego se contrae formando una perla vtrea, incolora que se compone de una mezcla de metaborato de sodio y anhdrido brico Na2 B4 O7 ------- 2 NaBO2 + B2O3
ING ARMANDO SALINAS SANCHEZ 5 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
La coloracin de las perlas de brax se debe a la formacin de boratos coloreados; cuando con una misma sustancia se obtienen perlas diferentemente coloreadas en la llama oxidante y reductora, ello se debe a que producen boratos que corresponden a diversos estados de oxidacin del metal. As, con las sales de cobre en llama oxidante, se tiene: Na2B4O7 -------- 2 NaBO2. B2O3 CuO + B2O3 ----- Cu ( BO2)2 metaborato cprico CUO + NaBO2 ---- NaCu BO3 ortoborato En la llama reductora se pueden producir dos reacciones: (I) La sal cprica coloreada se reduce a metaborato cuproso incoloro 2 Cu ( BO2) + 2 Na BO2 + C -------- Cu2 (BO2)2 + Na2 B4O7 + CO
( II ) El borato cprico se reduce a cobre metlico, de modo que la perla se torna roja y opaca 2 Cu ( BO2)2 + 4 NaBO2 + 2 C -- 2 Cu + 2 Na2B4O7 + 2 CO
COLORACIN
zona elemento Cobre manganeso Hierro Fro Azul plido violeta Amarillo a incoloro Oxidante Caliente Verde Violeta Amarillo pardo a rojo Zona Fro Rojizo Incoloro Verde reductora caliente Incoloro incoloro verde
Ensayo de calentamiento en tubo
Son mtodos basados en el calentamiento de la sustancia slida que se ensaya, unas sustancias, al ser calentadas, se funden, otras se subliman, de manera que en las paredes fras del tubo de ensayo aparece precipitado caracterstico a cada sustancia, algunas se descomponen durante el calentamiento con el desprendimiento de productos gaseosos, la sustancia cambia de color, etc. Manteniendo el tubo en posicin horizontal, ste se somete a un lento calentamiento sobre la llama del mechero de gas observando atentamente las trasformaciones que transcurren en la sustancia. La sustancia a ensayar puede sublimarse completamente, parcialmente o no sublimarse, si la sustancia se sublima debe suponerse que no existen componentes no voltiles. Por el color del sublimado se pueden plantear una serie de deducciones, por ejemplo, un sublimado de color blanco manifiesta la posible presencia de sales de amonio, cloruro y bromuro mercricos, xidos de arsnico y antimonio. El amarillo indica la presencia de compuestos sulfurosos de mercurio, arsnico, ioduro mercrico y azufre. En el curso del calentamiento de la sustancia en el tubo de calentamiento puede suceder, el desprendimiento de vapores y gases. As la formacin de gotas de agua es indicio de la presencia de sales que contienen agua de cristalizacin, compuestos orgnicos, hidrxidos, sales bsicas o cidas.
ING ARMANDO SALINAS SANCHEZ 6 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
B- Ensayos por va hmeda
Son ensayos orientados a identificar aniones. Dentro de ellos tenemos las pruebas con cidos, como, sulfrico o clorhidrico, que aadida sobre una muestra experimenta un desprendimiento gaseoso, que puede ser reconocido por alguna reaccin secundaria. Los resultados que se obtendrn de la accin del cido sobre la sustancia, adems de las conclusiones obtenidas en los ensayos preliminares por va seca, suministran una abundante informacin que puede ser til para las reacciones subsiguientes, en especial para la investigacin de los cationes. En la siguiente tabla se han agrupado las caractersticas que presentan algunos aniones considerando un ataque con cido sulfrico. Anin Yoduro Bromuro Nitrito Cloruro Carbonato Gas producido I2 Br2 NO2 HCl CO2 color violeta Caf amarillento Rojizo pardo Amarillo verdoso incoloro Olor Irritante, ftido Irritante, ftido Fuerte, sofocante Picante Inodoro, produce efervescencia con cidos
Para el reconocimiento del in amonio la sustancia se trata con solucin de hidrxido de sodio, el amonaco que se desprende se reconoce por su olor y su accin sobre el papel de filtro humedecido con solucin de nitrato mercurioso.
4. DISOLUCIN DE MUESTRAS SLIDAS
Para identificar los cationes y anions que integran una muestra problema requiere que la sustancia desconocida se encuentre al estado de solucin. Los disolventes que se usan para solubilizar una muestra son: agua, cido clorhdrico diluido y concentrado, ntrico diluido y concentrado, y agua rega, caso contrario se emplean los mtodos por va seca. Primero se prueba la solubilidad en fro y depus en caliente; si se duda si se ha disuelto la sustancia o una porcin de ella, se evapora sobre un vidrio de reloj un poco de la solucin lmpida. Si toda la sustancia se diuelve en agua, de inmediato se puede empezar el anlisis de los iones de metale, o cationes Una vez encontrado el disolvente de una muestra , se procede a preparar u obtener la solucin problema para ensayar cationes y aniones presentes. Para preparar la solucin problema se toma habitulmente cerca de 25 mg (0.02 o 0.03g) de sustancia y al disolverla se lleva el volumen de la solucin aproximadamente a 1 ml.
5.- RECONOCIMIENTO DE CATIONES
|Permite identificar o no la presencia de los cationes empleando reactivos especficos o selectivos, a travs del mtodo fraccionado o por el mtodo de la marcha analtica que consiste en separar los iones y proceder luego a sus respectivas reacciones de reconocimiento. El anin del reactivo reacciona con el catin formando un producto precipitado, o un compuesto complejo cracterstico que nos permite su respectiva identificacin.
6.- INVESTIGACIN DE ANIONES
Considera su estudio los mtodos de anlisis de separacin y identificacin de los aniones, se utilizan en estos ensayos reactivos especificos o selectivos, que forman con el catin respectivo un producto con caractersticas definidas.
ING ARMANDO SALINAS SANCHEZ 7 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
EL ANLISIS Y SUS REACCIONES
Las reacciones que tienen lugar en solucin acuosa pueden incluir molculas, iones o ambos. Las reacciones de carcter puramente molecular, que slo incluyen no-electrlitos, son las ms comunes en el campo de la qumica orgnica; a menudo son relativamente lentas y conducen a equilibrios en los que slo cantidades pequeas de los reactivos iniciales se convierten en productos finales. Las reacciones de carcter puramente inico son muy comunes en el anlisis cualitativo, pues la mayora de las sustancias estudiadas son electrolitos, son reacciones casi instantneas. Toda reaccin qumica se puede describir mediante una ecuacin, la cual debe indicar, con la mayor exactitud posible, las sustancias reaccionantes y los productos finales de la reaccin. Al describir una reaccin qumica mediante una ecuacin inica, se incluye solamente las especies, tanto reactivos como productos, que tienen una intervencin efectiva en la modificacin qumica observada., todas las otras(iones o molculas), se omiten, ya que no contribuyen en nada a la reaccin. Las reacciones analticas pueden realizarse por va seca o por va hmeda.
REACCIONES POR VA SECA
En algunos casos las sustancias se analizan por va seca sin disolverlas. Emplean el calor como medio para la identificacin de las muestras, porque muchas sustancias expuestas al calor en forma directa o indirecta presentan una forma caracterstica de reaccionar a travs de la cual es identificada. Para algunas sustancias, como indicios de su composicin cualitativa, sirve su volatilidad, capacidad de sublimarse o descomponerse al ser calentadas. Estos ensayos utiliza la llama no luminosa de Bunsen, la cual presenta una estructura siguiente:
Para los ensayos por va seca debe regularse la entrada del aire y la alimentacin de gas a manera de obtener una flama casi incolora a azul. La temperatura que alcanza la zona ms caliente de la flama es de unos 2000 o C como resultado del calor de reaccin que se produce al combinarse el hidrgeno del gas combustible con el oxgeno del aire. La reaccin es : 2C3 H8 + 10 O2 -------- 6 CO2 + 8 H2O + calor
Esta reaccin es vlida slo si se usa como comburente oxgeno puro en lugar de aire, al emplear el aire, la combustin del propano es bastante incompleta y la temperatura que se alcanza es de unos 800 oC. La luminosidad de la flama se debe al carbono que procede de la pequea cantidad de hidrocarburos no saturados que se encuentran como impurezas en el gas comercial, por ejemplo, etileno, propileno, acetileno, benceno, etc. As si el etileno se
ING ARMANDO SALINAS SANCHEZ 8 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
calienta a una determinada temperatura se descompone en metano y carbono segn la siguiente reaccin: C2H4 + calor ------ CH4(g) + C
El carbono al ponerse incandescente, le comunica su brillo a los gases. De manera anloga se comportan los dems hidrocarburos no saturados. Los dems componentes del gas arden con una flama no luminosa. Si al mechero se le suministra aire en exceso, se quemar el carbono y la flama perder su luminosidad. En la llama del mechero bien regulada permite distinguir las siguientes zonas: Base de la flama, su temperatura es baja, se usa para el ensayo de compuestos muy voltiles y que se reconocen por los colores caractersticos que toma la flama b) Zona de fusin, se utiliza para los ensayos de fusin de sustancias poco voltiles y a la perla c) Zona inferior de oxidacin, es adecuada para oxidar los compuestos disuletos en fundentes vtreos, tales como el brax d) Zona superior de oxidacin, se emplea para la tostacin de sustancias que quieran oxidarse y no requieran temperaturas elevadas. e) Zona inferior de reduccin, se utiliza para reducir los xidos disueltos en sustancias vtreas f) Zona superior de reduccin, se emplea para la reduccin enrgica de xidos metlicos.
a)
REACCIONES POR VA HUMEDA
La mayora de las reacciones qumicas ocurren en disoluciones acuosas. La sustancia a analizar primeramente se disuelve, y luego la solucin obtenida obtenida se trata con los correspondientes reactivos. Las disoluciones acuosas de sales, cidos y bases transmiten la corriente elctrica y por lo tanto pertenecen a la categora de electrlitos. En el curso de la disolucin las molculas de los electrlitos se disocian en partculas positivas o negativas; estas partculas cargadas elctricamente se denominan iones. Las propiedades de los iones (partculas cargadas) se distinguen considerablemente de las propiedades de los tomos neutros. Las reacciones entre sustancias que se encuentran en solucin, son los ms utilizados en el anlisis cualitativo, las sustancias problemas al interaccionar con el reactivo presentan manifestaciones externas fcilmente perceptibles, como por ejemplo, cambio de color, formacin de precipitados o desprendimiento de un producto gaseoso. Una reaccin de precipitacin, por la formacin de un precipitado ya puede juzgarse sobre la presencia de ciertos iones: La reaccin siguiente es un ejemplo de una reaccin de formacin deun producto insoluble, llamado precipitado CrO4 2 (ac) + 2 Ag + (ac) ----------- Ag2CrO4 (s)
Por el aspecto exterior del precipitado pueden hacerse unas u otras deducciones, por ejemplo, el precipitado de cromato de plata es de color pardo rojizo. En otros casos se aplican reactivos que provocan coloracin caracterstica de la solucin a investigar Fe +3 (ac) + SCN - (ac) Problema reactivo ---- [ Fe ( SCN ) ] +2 (ac) solucin de color rojo sangre
En algunos casos se utilizan reactivos que se combinan con la sustancia a analizar desprendiendo gas, por ejemplo, cuando se descubren sales de amonio por el desprendimiento del amonaco.
ING ARMANDO SALINAS SANCHEZ 9 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
(NH4)2SO4(ac) problema
+ 2NaOH(ac) ------- NH3 (g) + Na2SO4(ac) reactivo producto gaseoso
REQUISITOS DE LAS REACCIONES CUALITATIVAS
No cualquier reaccin puede usarse en anlisis cualitativo, esta debe satisfacer los siguientes requisitos: Transcurrir rpidamente, cas instantneamente Ser acompaada con la formacin de un precipitado cracterstico, gas o la aparicin de un color Ser prcticamente irreversible, es decir, transcurrir con preponderancia en una direccin Ser lo ms especfica posible y muy sensible
ESPECIFICIDAD Y SENSIBILIDAD DE LAS REACCIONES
Para el descubrimiento de los iones individuales tienen especial importancia las llamadas reacciones especficas, selectivas. Reacciones especficas (o reactivos especficos) se denominan las reacciones (o reactivos) que en determinadas condiciones permiten descubrir unos iones en presencia de otros a travs de la variacin especfica de color, la formacin de un precipitado caracterstico, el desprendimiento de gas, etc. Las reacciones que dan un mismo resultado solo con pocos iones se denominan selectivas. Cuanto menor es el nmero de los iones que reaccionan de este modo, tanto ms efectiva es una reaccin determinada, por ejemplo, el cido clorhdrico es ms selectivo para el amonaco. El grado de selectividad es tanto mayor cuanto menor es el nmero de iones con el cual esta resulta positiva. La sensibilidad de una reaccin se determina por la cantidad mnima de sustancia problema que puede ser detectada con el reactivo a determinadas condiciones de ejecucin.. El mnimo detectable se denomina la cantidad mnima de sustancia contenida en la solucin que se investiga y puede ser descubierta con cierto reactivo, en determinadas condiciones de la reaccin, el mnimo detectable es, generalmente muy pequeo (1 microgramo =10 6 g).
ANALISIS FRACCIONADO Y ANALISIS SISTEMTICO
Para realizar el anlisis de una mezcla de varias sustancias semejantes en cuanto a sus propiedades qumicas, es necesario separarlas previamente y slo despus de ello verificar las reacciones especiales para detectar los iones por separado. Las reacciones que permiten descubrir los iones problema en porciones aisladas de mezcla compleja, con la condicin de eliminar la influencia de los iones ajenos, se denomina anlisis fraccionado. El mtodo fraccionado consiste en el tratamiento de pequeas muestra de disolucin a investigar con unos reactivos o mezclas de reactivos que eliminan la infuencia de los iones ajenos perturbadores del descubrimiento de los iones buscados, luego los iones buscados se descubren por medio de reacciones carctersticas, en est mtodo se utilizan los reactivos selectivos de alta sensibilidad, que permiten descubrir un ion dado en presencia de los otros. Los reactivos especficos forman compuestos caractersticos con un solo ion individual. En el caso del anlisis sistemtico, llamadas tambin reacciones analticas generales, se denominan a las reacciones en las cuales el reactivo se combina con varios iones, la identificacin de los iones se realiza a travs de una sucesin de reacciones de separacin y de identificacin de iones. En el anlisis sistemtico los iones se separan en grupos aprovechando el similar comportamiento de un cierto nmero de iones respecto a un determinado reactivo denominado reactivo de grupo, este tratamiento es lo que se llama marcha analtica. La utilizacin de estas reacciones permite juzgar sobre la presencia o ausencia del grupo de iones
CLASIFICACIN ANALTICA DE CATIONES
ING ARMANDO SALINAS SANCHEZ 10 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Los iones se dividen en grupos analticos, esta clasificacin de los cationes en grupos analticos se basa en la solubilidad de algunas sales por ellos formados. En el desarrollo sistemtico del anlisis los iones se separan de la mezcla no uno a uno de la solucin a analizar sino por grupos los cuales se forman por su comportamiento similar ante la presencia de un reactivo que se denomina REACTIVO DE GRUPO, este reactivo debe cumplir los siguientes requisitos: A) Debe precipitar completamente a los cationes B) El precipitado formado debe disolverse con disolventes adecuados C) El exceso de reactivo no debe interferir los pasos posteriores del anlisis. Cuando se forman los precipitados de grupos, para la identificacin de cada in debe ser comenzada slo despus de que todos los otros iones que impiden su identificacin, hayan sido identificados previamente y eliminados de la solucin, esto implica tambin reacciones de separacin de los mismos. Existen varios esquemas de clasificacin de los cationes por grupos analticos, pero la ms aceptada y divulgada es aquella basada en la propiedad de los sulfuros. Los reactivos de grupo se agregan sistemticamente a las soluciones despus de haber separado todos los iones de los rupos anteriores. De este modo, primero se agrega HCl a la solucin original, despues se pasa sulfuro de hidrgeno por el fltrado del grupo I, luego se agrega NH4OH y NH4Cl al filtrado del grupo II y as sucesivamente. La clasificacin tradicional de los cationes es la siguiente: La clasificacin indicada de cationes se basa en el uso de los siguientes reactivos generales: Al grupo I se le precipita con el cido clorhdrico diluido formando cloruros, por ello se le denomina grupo del cido clorhdrico o de la plata Al grupo II de cationes se les precipita como sulfuros en medio clorhdrico con sulfuro de hidrgeno. Los sulfuros de arsnico, antimonio y estao son solubles en sulfuro de amonio o en solucin de hidrxido de sodio, mientras los de los cationes restantes son prcticamente insolubles. Por eso, es comn subdividir este grupo en el grupo del cobre o grupo II A que comprende el mercurio, plomo, bismuto, cobre y. Cadmio, y el grupo del arsnico o grupo II B que incluye el arsnico, antimonio y estao. Los cationes del grupo III no son precipitados por los reactivos del grupo correspondientes a los grupos I y II; pero son precipitados, en solucin alcalinizada con hidrxido de amonio, en presencia de cloruro de amonio por sulfuro de amonio. El hierro, aluminio y cromo son precipitados como hidrxidos por la solucin de hidrxido de amonio en presencia de cloruro de amonio, mientras que los otros metales del grupo permanecen en solucin y pueden ser precipitados despus por el sulfuro de amonio. Por eso es comn subdividir este grupo en el grupo del hierro(hierro, aluminio y cromo) o grupo III A y en el grupo del zinc(nquel, cobalto, manganeso y zinc) o grupo III B El grupo IV comprende los tres metales alcalino-trreos, se distinguen de los metales de los grupos precedentes por el hecho de que sus sales no precipitan con cido clorhdrico, sulfuro de hidrgeno o sulfuro de amonio y se caracterizan porque precipitan con solucin de carbonato de amonio en presencia de cloruro deamonio e hidrxido de amonio. El grupo V se caracteriza porque los cationes de este grupo no precipitan con los reactivos de los grupos anteriores. El sodio, potasio y litio son metales alcalinos; el amonio se incluye en este grupo porquesus compuestos se asemejan a los de los metales alcalinos, en particular a los de potasio. Aunque el magnesio est asciado a los alcalino-trreos en la tabla peridica, se lo incorpora a este grupo porque el carbonato no precipita por solucin de carbonato de amonio en presencia de cloruro de amonio.
CLASIFICACIN ANALITICA DE LOS CATIONES
Grupo
I de la plata
Reactivo grupo
HCl 4-6M
Cationes
Ag+ Pb ++
Productos insolubles
AgCl ( blanco) PbCl2 (blanco)
ING ARMANDO SALINAS SANCHEZ 11 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
II grupos del cobre y del H2S en medio cido arsnico
Hg2 +2 Hg ++ Bi+++ Cu ++ Cd++ As+++ Sn++ Sb +++
Hg 2Cl2 (blanco) HgS ( negro) Bi2S3 (marrn) CuS (negro) CdS (amarillo) As2S3 (amarillo) SnS (amarillo) Sb2S3 (naranja) Fe(OH)3 (pardo rojizo) Al(OH)3 (blanco) Cr(OH)3 (gris verde) CoS (negro) NiS (negro) MnS (rosado) ZnS (blanco) CaCO3 ( blanco) BaCO3 (blanco) SrCO3 ( blanco) Sin precipitado de grupo
Fe+++ Al+++ III Grupos del hierro y (NH4)2S en presencia Cr+++ del cinc de NH4OH e NH4Cl Co++ Ni++ Mn++ Zn++ Ca++ (NH4)2CO3 en Ba++ presencia de NH4OH y Sr++ NH4Cl Na+ V Grupo de los metales sin reactivo de grupo K+ alcalinos NH4 + Mg++ IV grupo del calcio
CLASIFICACIN DE ANIONES
Los mtodos usados para la investigacin de radicales de cidos o aniones no son tan sistemticos como los cationes. No se han propuesto un esquema realmente satisfatorio que permita la separacin de los aniones comunes en grupos principales y luego la separacin inequvoca en cada grupo, de cada uno de los componentes. Para la identificacin de aniones se puede utilizar las soluciones de sales de cationes como, por ejemplo, Fe+3 que forman con los aniones Fe(CN)6 -4 o SCN- los correspondientes compuestos caractersticos. La divisin de los aniones en grupos se basa en la actitud de stos con respecto a los diferentes reactivos, con estos reactivos los aniones forman precipitados poco solubles, sustancias gaseosas, y compuestos de color caractersticos. No existe una clasificacin analtica de los aniones comnmente adoptada. Sin embargo, se debe mencionar que es posible separar los aniones en grupos en base a las solubilidades de las sales de plata o bario, que es la clasificacin a continuacin se detalla:
ANIONES DEL PRIMER GRUPO
A diferencia de los iones del I grupo analtico, cuyas sales de bario son solubles en agua, todas las sales de bario de los aniones son insolubles en agua, pero se disuelven, excepto el sulfato de bario, en los cidos actico, clorhdrico, y ntrico. Se dividen en tres subgrupos: Las sales de carbonatos, fosfatos y arseniatos; las sales de magnesio de estos aniones son insolubles en agua Los sulfatos, la sal de bario de este anin es insoluble en cidos minerales Los sulfitos, tiosulfitos, cromatos, las sales de magnesio de estos aniones son solubles en agua, y las sales de bario son solubles en cidos minerales.
ING ARMANDO SALINAS SANCHEZ 12 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
PRIMER GRUPO DE ANIONES
REACTIVO DE GRUPO BaCl2 en una solucin neutra o dbilmente alcalina ANIONES QUE FORMAN EL GRUPO SO4 2 ( in sulfato) SO3 2 ( in sulfito) CO3 2 (in carbonato) CrO4 2 ( in cromato) PO4 2 ( in fosfato) Cr2O7 2( in dicromato) CARACTERSTICA Las sales de bario son poco solubles en agua
ANIONES DEL SEGUNDO GRUPO
Los aniones de este grupo no precipitan bajo la accin de las sales solubles de bario, las sales solubles de plata forman precipitados con los aniones de este grupo, cuyas sales de plata son prcticamente insolubles en agua y en cido ntrico fro diluido.
SEGUNDO GRUPO DE ANIONES
REACTIVO DE GRUPO AgNO3 en presencia de HNO3 ANIONES DE FORMEN EL GRUPO Cl (in cloruro) Br - (in bromuro) I (in yoduro) S-2 (in sulfuro) CN (in cianuro) BrO3 (in bromato) IO3 - (in iodato) ClO - (in hipoclorito) CARACTERSTICAS DEL GRUPO Las sales de plata son poco solubles en agua y HNO3 diludo.
ANIONES DEL TERCER GRUPO
Los aniones de este tercer grupo lo constituyen los aniones cuyas sales de plata y de bario son solubles en agua, no existe un reactivo que logre reaccionar con cada uno de estos aniones formando compuestos insolubles similares.
TERCER GRUPO DE ANIONES
REACTIVO DEL GRUPO No existe reactivo de grupo ANIONES DE FORMAN EL GRUPO NO3 (in nitrato) NO2 (in nitrito) CH3 COO (in acetato) ClO3 (in clorato) MnO4 (in permanganato) CARACTERSTICAS
Sales de bario y de plata son solubles en agua
ING ARMANDO SALINAS SANCHEZ 13 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
UNIDAD lI
OPERACIONES Y ETAPAS DE UN ANLISIS QUIMICO CUANTITATIVO
ANALISIS CUANTITATIVO El anlisis cualitativo revela la identidad qumica de los analitos, mientras que al anlisis cuantitativo proporciona la cantidad, en trminos nmericos, de uno o ms analitos (los componentes que se van a determinar en una muestra se conocen como analitos). Antes de que se practique un anlisis cuantitativo se necesita la informacin cualitativa. El anlisis qumico cuantitativo responde a la interrogante En que cantidad o proporcin est presente los analitos en una muestra? IMPORTANCIA DEL ANALISIS CUANTITATIVO Aunque la qumica analtica constituye una rama ya antigua de la qumica, ha tenido lugar un desarrollo rpido de nuevos mtodos de anlisis a partir de la tercera o cuarta dcada del siglo actual. Este desarrollo ha sido motivado en gran parte por las necesidades inherentes a la rpida expansin de la economa industrial y tambin al desarrollo intenso de programas de investigacin en diversos campos. El anlisis cuantitativo es indispensable en una amplia variedad de operaciones tcnicas y comerciales: agricultura, alimentos, medicina, minera, metalurgia, suministro de agua, aprovechamiento de desperdicio, etc. No hay ningn material relacionado con la vida moderna en la que la qumica analtica no tome parte. FINALIDAD DEL ANALISIS CUANTITATIVO El objetivo primario de un curso de anlisis cuantitativo es ensear la qumica correspondiente a dicho campo, que comprende principios fundamentales, reacciones qumicas, aplicaciones, tcnicas y clculos. Es indispensable un conocimiento completo de los principios, reacciones, limitaciones, y fuentes de error para desarrollar inteligente y eficazmente el trabajo de laboratorio. El curso de anlisis cuantitativo extiende el conocimiento y formacin del estudiante a nuevos campos. Los principios y mtodos presentan una utilidad directa como parte de la preparacin profesional de los alumnos que vayan a dedicarse a qumica, ingeniera, medicina, farmacia, metalurgia, geologa, biotecnologa, etc. APLICACIN DE LA QUMICA ANALTICA El anlisis cuantitativo es necesario no slo en qumica, sino tambin en otros campos de la ciencia, tecnologa y comercio. Algunas aplicaciones importantes de la qumica analtica son las siguientes : A)Control de Calidad El anlisis qumico es vital para mantener la buena calidad del aire que respiramos y del agua que bebemos. Es necesario establecer normas y realizar anlisis frecuentes para verificar que las normas se cumplan. En la industria el anlisis es necesario para comprobar que las materias primas cumplan con las especificaciones y para verificar la pureza del producto terminado. B)Diagnstico El anlisis qumico se emplea cada vez ms para diagnosticar enfermedades. Por ejemplo, la presencia de una cantidad mensurable de bilirubina y de ms de 12
ING ARMANDO SALINAS SANCHEZ 14 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
mg de fosfatasa alcalina ( una enzima ) en el suero de la sangre de un paciente, indica un mal funcionamiento del hgado. C)Investigacin La qumica analtica es de importancia fundamental en muchos proyectos de investigacin. Algunos ejemplos son determinar trazas de metal que pasan a la solucin, en estudios de corrosin, analizar el producto de la competencia, analizar mezclas de reaccin para ver qu condiciones de reaccin dan el mejor rendimiento del producto deseado, y medir las proporciones de distribucin en extraccin para encontrar las condiciones ptimas para llevar a cabo un proceso de extraccin en gran escala.
METODOS DE ANALISIS CUANTITATIVO
Un anlisis cualitativo o cuantitativo en sus diversos aspectos puede considerarse desde varios puntos de vista; como materiales analizados, mtodos empleados, proporcin del componente buscado en la muestra, etc. 1. POR EL TIPO DE MUESTRA A ANALIZAR ANLISIS INORGNICO Y ORGANICO Normalmente, el primer curso de anlisis cuantitativo trata principalmente del anlisis de materiales inorgnicos; el anlisis de las sustancias orgnicas (compuestos del carbono) trata del estudio de los compuestos orgnicos o derivados. Los principios fundamentales son los mismos, independientemente de la naturaleza inorgnica u orgnica de la muestra.
2.
POR EL NUMERO O PROPORCION DEL COMPONENTE ANLISIS PARCIAL O COMPLETO Para muchos propsitos puede ser suficiente medir solamente uno o unos cuantos componentes de la muestra; por ejemplo, el anlisis del contenido en cobre un mineral de cobre es un anlisis parcial. Un anlisis completo involucra la determinacin de todos los componentes de la muestra que puedan ser determinados mediante ensayos sensibles. ANLISIS INMEDIATO Y ULTIMO El anlisis inmediato de una muestra consiste en determinacin de las sustancias que reaccionan de forma anloga ante un cierto tratamiento o determinado reactivo. Por ejemplo, la prdida de peso por calcinacin de una caliza comprende todos los cambios de peso que tienen lugar cuando se calienta fuertemente la muestra, como volatilizacon de agua, dixido de carbono, dixido de azufre y materia orgnica. As como la oxidacin de sulfuros a sulfatos y de xidos inferiores a superiores. El anlisis de "R2O3" o "mezcla de xidos" en la caliza comprende todas las sustancias precipitadas por amoniaco; el precipitado calcinado puede contener Fe2O3, Al2O3, TiO2 y otras sustancias. En un anlisis ultimo, tambin llamado anlisis elemental, se determina el contenido de cada elemento presente; por ejemplo, en el anlisis ultimo del Nitrobenceno, C6H5NO2, se determina el porcentaje de carbono, hidrogeno, nitrgeno y oxigeno.
3. POR EL TAMAO DE LA MUESTRA ESCALA DE ANLISIS O AMBITO A veces se clasifican los mtodos analticos atendiendo al tamao de la muestra tomada o a la cantidad de material que se determina. Los limites
ING ARMANDO SALINAS SANCHEZ 15 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
que se dan a continuacin no deben considerarse fijos, sino solo aproximados. Macro anlisis de 0.1 a 1 2 gramos de uestra Semimicroanlisis aproximadamente de 0.01 a 0.1 gramos de muestra Microanlisis de 1 a 10 miligramos El anlisis ultramicro o microgramo determina una cantidad de material del orden de unos cuantos microgramos ( 0.001 mg. = 1 ug. llamado tambin "gamma", ). El anlisis microgramo se aplica a la determinacin de trazas de sustancias en muestras grandes o al anlisis de muestras muy pequeas. En la tabla siguiente se dan las clasificaciones aproximadas segn el peso o volumen de la muestra. Las clasificaciones volumtricas son las que se emplean en laboratorios clnicos. En las operaciones de micro y ultramicro anlisis se tienen tcnicas especiales para manejar la muestra y pesarla.
CLASIFICACIN DE LOS MTODOS DE ANLISIS SEGN EL TAMAO DE LA MUESTRA
Mtodo Macro Semimicro Micro Ultramicro Peso de la Muestra > 100 mg 10 - 100 mg 1 - 10 mg < 1 mg Volumen de la Muestra >100 L 50 - 100 L < 50 L
L = MICROLITRO = 10 -3 ml = 10 -6 litros. 4. POR EL METODO DE MEDIDA QUE UTILIZA Los mtodos cuantitativs pueden calsificarse por el mtodo de medida que utlicen. Estos mtodos son; 1. METODO GRAVIMETRICO La cantidad de sustancia buscada se determina mediante el peso de la propia sustancia pura, o de algn compuesto qumico que la contiene o equivale qumicamente a ella. Se clasifican en los siguientes mtodos : A) PRECIPITACIN El constituyente buscado se determina como producto insoluble de una reaccin; el mtodo es qumico por estar implicadas en las relaciones estequiomtricas definidas (en peso). Un ejemplo, es la determinacin de cloruro por precipitacin como cloruro de plata, cuyo, peso se determina. c) VOLATILIZACION El mtodo puede ser fsico, como en la prdida de peso por desecacin en una estufa, o qumico, como en la expulsin del dixido del carbono de los carbonatos por calcinacin o por la accin de un cido. La medida puede ser directa, por la determinacin del aumento de el peso de un absorbente del constituyente voltil, o indirecta, por la determinacin de la prdida de peso. 2. MTODOS VOLUMTRICOS
ING ARMANDO SALINAS SANCHEZ 16 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
La determinacin se realiza por medida del volumen de una fase relacionada cuantitativamente con el constituyente buscado. A) MTODOS TITRIMETRICOS Se efecta la medida del volumen de una disolucin de concentracin conocida que es necesario para consumir exactamente el constituyente buscado, o con otra sustancia equivalente qumicamente a el. Estos mtodos implican una reaccin estequiomtrica definida. Pueden subdividirse por el tipo de reaccin que emplea por ejemplo, cuando utiliza una reaccin entre un cido y una base se denomina volumetra por neutralizacin, una reaccin de precipitacin volumetra por precipitacin, redox, etc otra criterio es por los mtodos de indicacin del punto final (indicadores coloreados, mtodos elctricos) y otros por el tipo de titulacin que utilizan. 3. MTODOS FISICOQUMICOS Se mide alguna propiedad del sistema en observacin que este cuantitativamente relacionado con la cantidad del constituyente que se determina en la muestra de que deriva el sistema. En estos mtodos se precisa una calibracin, sea directa o indirecta, contra patrones. Gran parte de estos mtodos se fundamentan en fenmenos pticos o elctricos; estos dos tipos de mtodos se citan a continuacin A) MTODOS PTICOS Se basan fundamentalmente en las propiedades de la energa radiante y el comportamiento en su interaccin con el sistema a medir. Pueden utilizarse con afinidad analtica varias clases de propiedades pticas. La colorimetra y la espectrofotometra se basan en el hecho de que la energa radiante es absorbida por el sistema, en proporcin a su contenido de material absorbente. Existen una amplia gama de estos mtodos basados en este principio. B) MTODOS ELECTRICOS Aunque algunas propiedades elctricos de los sistemas estn relacionados de forma cuantitativa con su composicin, los mtodos elctricos se utilizan normalmente para poner de manifiesto los cambios bruscos que tienen lugar en el sistema bajo observacin, como resultado de una reaccin qumica. Por ejemplo, en ciertas propiedades elctricas se presentan normalmente cambios rpidos o bruscos en el punto final de una valoracin. El uso de los instrumentos qumicos es una parte atractiva y fascinante del anlisis qumico que interacciona con todas las reas de la qumica y con muchos otros campos de la ciencia pura y aplicada. A menudo es necesario usar varias tcnicas de esa clase a fin de obtener la informacin requerida para resolver un problema de anlisis. La instrumentacin qumica juega un papel importante en la produccin y en la evaluacin de nuevos productos y en la proteccin de los consumidores y del medio ambiente.
CLASIFICACIN DE LOS MTODOS ANALTICOS DE MEDICIN
1.- Gravimtricos Se asla y pesa el precipitado ( a ) Volatilizacin ( b ) Precipitacin 2.- Volumtricos Se mide el volumen de solucin estndar necesario para reaccionar con la sustancia que se desea determinar.
ING ARMANDO SALINAS SANCHEZ 17 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
( a ) Formacin de precipitados ( b ) Acido - base ( C) Formacin de complejos ( d ) Oxidoreduccin. 3.- Absorcin de energa radiante Se mide la cantidad de energa que se absorbe en una longitud de onda determinada. ( a ) Espectrometra Visible ( colorimetra ) ( b) Espectrometra ultravioleta ( c ) Espectrometra en el Infrarrojo ( d ) Rayos X ( e ) Resonancia magntica nuclear 4.- Emisin de energa radiante se bombardea la muestra con grandes cantidades de energa ( elctrica, calorfica, etc. ), Lo cual ocasiona que la sustancia pase a un estado excitado y emita alguna forma de energa. Se mide la cantidad de energa emitida. ( a ) Espectroscopia de emisin. Excitacin por arco elctrico o chispa ; se emite luz . ( b ) Fotometra de flama. Se roca la muestra a la flama ; emite luz ( c ) Fluorescencia de rayos X. Los rayos X chocan contra la muestra ; la muestra emite otros rayos X caractersticos de la muestra. 5.- Elctricos ( a ) Polarografa. Se mide la corriente elctrica, que es proporcional a la concentracin de la sustancia que se reduce u oxida en una reaccin electroqumica que se efecta en un microelectrodo. ( b ) Coulometra. Se mide la cantidad de corriente que se necesita para causar una reaccin electroqumica cuantitativa. ( c ) potenciometra. Se mide el potencial de un electrodo en equilibrio con la sustancia que se va a determinar. ( d ) Conductimetra. Se mide la conductividad de una solucin. 6.- Diversos ( a ) Polarimetra. Se mide el grado al cual una solucin de la sustancia desva la luz polarizada ( b ) Refractometra. El Indice de refraccin la composicin de una mezcla simple. ( c ) Espectrometra de masa. Se mide la cantidad de iones de diversas cargas en relacin con sus masas. Los mtodos llamados gravimtricos y volumtricos son los denominados mtodos clsicos de anlisis.
PROCESO ANALITICO
Es una serie de etapas o pasos lgicos y sistemticos que experimenta una sustancia problema durante una determinacin analtica. Aunque los mtodos que se emplean en la qumica analtica son muy variados, la mayora de los anlisis cuantitativos tienen operaciones comunes. Un anlisis cuantitativo tpico comprende una secuencia de etapas que se sealan en el esquema siguiente, teniendo presente que en algunos casos se puede omitir una o ms de estas etapas. El proceso analitico sigue una secuencia lgica: Definicin del problema Obtencin de la muestra Disolucin de la muestra Llevar a cabo las separaciones necesarias
ING ARMANDO SALINAS SANCHEZ 18 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Realizar las mediciones necesarias Clculo e interpretacin de las mediciones Presentaciones de datos
El desarrollo de cada etapa de las operaciones unitarias de qumica analtica es importante, porque de cada una de ellas debidamente ejecutadas depende el resultado del anlisis.
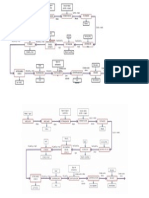
ESQUEMA GENERAL DE UN ANALISIS CUANTITATIVO
OPERACIONES
ELECCION DE UN MTODO DE ANLISIS OBTENCION DE LA MUESTRA
PREVIAS
AL ANALISIS PREPARACION DE LA MUESTRA
ETAPAS
SECADO
MEDICIN DE LA MUESTRA
DE
DISOLUCION
ING ARMANDO SALINAS SANCHEZ 19 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
UN
SEPARACION DE SUSTANCIAS INTERFERENTES MEDICION Del Analito X
ANALISIS
CUANTITATIVO
CALCULO Y EVALUACION DE LOS RESULTADOS
EXPRESION DEL RESULTADO
OPERACIONES PREVIAS DEL ANALISIS CUANTITATIVO
Los aspectos siguientes darn una idea de lo que es un anlisis cuantitativo tpico:
ELECCION DE UN MTODO DE ANLISIS
La seleccin del mtodo para resolver un problema analtico es el primer paso fundamental de cualquier anlisis cuantitativo. Para la eleccin de un mtodo se toma en consideracin los siguientes aspectos: Naturaleza y complejidad de la muestra La cantidad de componentes en la matriz de la muestra Concentracin del analito Sensibilidad del mtodo Nmero de muestras por analizar Disponibilidad de equipo y reactivos Tiempo para dar los resultados Costo del anlisis Exactitud y precisin
La matriz de una muestra, es el medio que contiene al analito. Los componentes que se van a determinar en una muestra comnmente se conocen como analitos. Para un anlisis en particular, pueden existir uno o ms procedimientos, es funcin del laboratorista definir el problema analtico. Una vez definido el problema el siguiente paso es comenzar el anlisis.
1.
Para practicar un anlisis cuantitativo el siguiente paso es obtener la muestra.Para que un anlisis arroje informacin importante, debe efectuarse en una muestra que tenga una composicin tal que sea represenattiva del amterial de donde se tom. La muestra que se somete al anlisis, ya sea por uno u otro mtodo, viene a ser una porcin reducida que se extrae del material a ensayar y que el resultado final del anlisis esta ntimamente ligado a la forma correcta y exacta obtencin y preparacin de la correspondiente muestra. La muestra debe ser homognea y representativa.
OBTENCION DE MUESTRA
ING ARMANDO SALINAS SANCHEZ 20 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
El mtodo de obtencin es muy importante puesto que la muestra que se analice debe representar al todo. Las muestras lquidas, que tienden a ser homogneas, no suelen plantear problemas graves, pero la obtencin de muestras slidas puede ser difcil. Las condiciones en que se obtiene la muestra, por ejemplo, cuando el paciente acaba de comer, pueden ser importantes en el caso de los fluidos biolgicos. La composicin de la sangre vara considerablemente antes y despus de las comidas, y para muchos anlisis es necesario recoger la muestra despus de las comidas, y en otros casos despus de que el paciente haya ayunado varias horas. Al recoger las muestras de sangre pueden aadirse preservativos como fluoruro de sodio para preservacin de la glucosa. El valor de los resultados de un anlisis qumico sobre una muestra de laboratorio bien preparada depender de qu tan representativa es la muestra del lote, serie, paquete, por ejemplo, los productos comestibles y los ingredientes de alimentos son materiales en realidad heterogneos, por lo que es difcil obtener una sola muestra absolutamente representativa para el anlisis de laboratorio, el problema puede ser disminuido seleccionando, ya sea al azar o en forma planeada, varias muestras del lote. Para la obtencin de una muestra no se pueden sealar normas fijas, ya que la operacin dependen de: Naturaleza del material. Cantidad que debe tomarse para tener una muestra representativa.
2.- PREPARACIN DE LAS MUESTRAS DE LABORATORIO
A fin de obtener resultados analticos precisos, la muestra de laboratorio debe hacer tan homognea como sea posible dentro de los lmites del mtodo analtico usado, para que los anlisis duplicados coincidan lo ms que se pueda.
MUESTRAS SOLIDAS Si la muestra es slida, generalmente se deber disolver antes de efectuar el anlisis. En ocasiones los fluidos biolgicos pueden analizarse directamente, no obstante, a menudo las protenas interfieren y deben eliminarse mediante alguna tcnica de destruccin, como la digestin cida o calcinacin o puede precipitarse para obtener un filtrado libre de protenas. De ordinario se debe tomar una muestra bruta mayor que la que puede someterse a anlisis en el laboratorio. El peso esta condicionado en especial al tamao de los fragmentos constitutivos del materia. Los procedimientos para la obtencin de la muestra bruta varan segn la presentacin o envase del material como por ejemplo, envase en sacos, lotes de medicinas, vagones, etc. a) Reduccin de tamao La conversin de la muestra bruta en una muestra adecuada para anlisis en el laboratorio requiere reducir el tamao de partcula a la vez que reducir la muestra,para las operaciones de molienda se usan diversos equipos. Para esto se procede a desmenuzar el material bruto con diversos equipos como trituradores, pulverizadores, molinos o morteros. Han de tomarse precauciones para tener la seguridad de que la muestra no debe ser contaminada en el aparto de molienda. De ordinario es satsifactorio un tamao de partcula final de una 100 mallas. b) Clasificacin por tamaos El material reducido se tamiza generalmente de 65, 80, o 100 M del sistema Tyler, para muestras de ataque difcil o lento se pasa por tamices de 150 o 200 M. La muestra pulverizada y tamizada, se extiende sobre una lmina de papel satinado
ING ARMANDO SALINAS SANCHEZ 21 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
o sobre una tela especial y se mezcla cuidadosamente para lograr una homogeneizacin perfecta. c) Cuarteo La reduccin y homogeneizacin de la cantidad total de la muestra, se realiza por medio de la operacin llamada "cuarteo" que consiste en formar una pirmide con la muestra. se extiende sobre el hule y se juntan partes iguales externas y opuestas del hule con la finalidad de homogeneizar, luego se extiende sobre una lamina en forma de una capa de espesor uniforme y circular, luego se divide en 4 partes iguales, mediante dos ejes transversales, se apartan 2 porciones opuestas por el vrtice y las dos restantes se mezclan; estas constituyen la muestra problema y las partes retiradas se descartan si es necesario se repite la operacin hasta obtener una porcin de muestra adecuada. Los alimentos slidos hmedos, por ejemplo, los productos de carne son homogeneizados mejor molndolos que picndolos. Los alimentos fluidos son emulsionados mejor en una licuadora; los aceites y grasas son preparados con facilidad por calentamiento suave y mezclado.
Muestras Lquidas
Si el lquido que va a ser analizado es homogneo, el procedimiento de muestreo es fcil. El proceso es mucho ms difcil si el lquido es heterogneo. Por ejemplo, en el caso de un lquido que circula en un sistema de tubera, muchas veces las muestras se toman en diferentes puntos del sistema. En un lago o en un rio, las muestras se pueden tomar en varios sitios y a diferentes profundidades.
Muestras de Gases
El muestreo vara segn la composicin , localizacin y presin del gas. Para obtener la muestra se emplea recipientes especiales. Hoy en da se tiene mucho inters de la atmsfera, debido a los intentos de mejorar la calidad del aire que respiramos.
ALMACENAMIENTO DE LA MUESTRA
Es necesario tomar ciertas precauciones para manejar y guardar muestras, con el objeto de evitar o minimizar la contaminacin, prdidas y descomposicin. En general, es necesario evitar contaminacin y alteracin de la muestra por (1) el recipiente, (2) la atmsfera, o (3) la luz En algunos casos es necesario considerar la estabilidad de la muestra, por ejemplo, la glucosa es inestable, por tanto, a las muestras de sangre se les aade un preservativo como el fluoruro de sodio, estos preservativos no deben interferir en el anlisis. Las muestras de orina son inestables porque el fosfato de calcio se precipita y atrapa iones metlicos y otras sustancias importantes, la precipitacin puede evitarse manteniendo el pH cido( pH 4.5). La muestra ya preparada se guarda de forma que queden reducidos al mnimo los cambios que pueda sufrir la muestra antes del anlisis. Generalmente se almacenan en recipientes de boca ancha; oscuros y de cierre hermtico. Se rotula con todos los datos pertinentes a la identificacin y registro de la muestra, entre estos datos se consignan fecha, procedencia, tipo de anlisis que se desea, etc.
2.- SECADO
Los resultados analticos conseguidos con una muestra perfectamente seca podran diferir de modo significativo de los valores obtenidos cuando la misma muestra contiene cierta cantidad de humedad cuando se pesa para las determinaciones. Por consiguiente , el contenido de agua ha de ser un factor conocido para que los resultados analtiocs tengan significado.
ING ARMANDO SALINAS SANCHEZ 22 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
As, si se usa una muestra hmeda se pueden convertir los resultados a una base seca o se pueden modificar los resultados obtenidos con una muestra seca a fin de que representen el anlisis de la sustancia originalmente hmeda Los materiales inorgnicos generalmente se secan antes de pesarlos. Esto se hace colocndolos en una estufa de secado a 105 - 110 oc, por un periodo de 1 a 2 horas. Para remover otro tipo de agua, como la que se encuentra atrapada en el interior de los cristales, puede ser necesario emplear temperaturas mas elevadas. Este mtodo de secado se puede aplicar solo cuando: a) El agua es el nico componente voltil. b) Que su desprendimiento sea completo a la temperatura de trabajo. c) Que en el desprendimiento no se desprenda otro componente voltil. Una muestra que ha experimentado estos cambios ya no es represenatativa del material original. El agua en los cuerpos slidos se encuentran, ya sea combinada qumicamente como hidratos, o en forma de agua higroscpica, ocluida, etc. El contenido de agua de diversas sustancias varia dentro de limites muy amplios por ejemplo, el agua forma parte inherente de la mayora de las sustancias biolgicas y constituyen en algunos casos mas del 90% del peso fresco de algunas plantas. Ciertos compuestos como los orgnicos, las muestras de plantas y tejidos se descomponen a una temperatura relativamente baja, se los puede privar de agua por calentamiento al vaco a temperaturas tan bajas como sea posible (empleo de estufa al vaco), o por exposicin a la atmsfera seca de un desecador cargado con un agente deshidratante energtico, ejemplo, cido sulfrico, perclorato de magnesio, o pentxido de fsforo, o haciendo pasar aire seco sobre la muestra. En ocasiones conviene analizar las muestras "como se reciben" y entonces se informa como anlisis sobre "muestra hmeda" y cuando la muestra es desecada sobre "base seca".
3.- MEDICIN DE LA MUESTRA
Las muestras problemas para someterlas al anlisis son medidas en una balanza analtica por que los resultados del anlisis, efectuados por cualquier mtodo, esta relacionado con una porcin de sustancia previamente pesada que luego se somete al anlisis. Para pesar muestras slidas se recomienda usar vidrio de reloj, si la muestra slida es inestable se debe utilizar un recipiente especial (pesar sustancias) provisto con tapa esmerilada. Si la muestra es liquida se mide un volumen adecuado por medio de una pipeta o Bureta de una manera rpida y cmoda pero menos exacta que la operacin de pesada. Estas muestras liquidas pueden ser pesadas en matracitos con tapones de vidrio esmerilado o pesa sustancias. En algunos casos es preferible pesar una sola muestra y de mayor volumen, disolverla, dividirla por volumen en varias porciones iguales; llamndose a esta porcin "alcuota". El tamao de la muestra tomada para el anlisis depender entre otros factores del contenido del constituyente a determinar.
TAMAO DE MUESTRA EN FUNCIN DE LOS CONSTITUYENTES
Constituyente
Principal Secundario Trazas
% aproximado
>1% 1 - 0.01 % < 0.01 %
Peso de muestra
0.1 - 1 g 1 - 10 g > 10 g
ING ARMANDO SALINAS SANCHEZ 23 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
La mayora de los anlisis qumicos se llevan a cabo en muestras repetidas cuya masa o volumen se ha definido mediante cuidadosas mediciones con una balanza analtica o un aparato volumtrico preciso, La obtencin de datos repetidos de las muestras mejora la calidad de los resultados y proporciona una medida de su confiabilidad. Las muestras repetidas son porciones, de aproximadamente el mismo tamao. De un material en las que simultneamente y bajo las mismas condiciones se lleva a cabo un procedimiento analtico.
4.-DISOLUCION DE MUESTRAS
Las muestras pesadas deben ser convenientemente descompuestas para ser transformado en compuestos solubles y ser aptas para ser sometidas a los procedimientos analticos. La mayora de los anlisis se realizan en soluciones de la muestra. DISOLUCION DE SUSTANCIAS INORGANICAS La descomposicin de la muestra se puede realizar por 2 vas: Va hmeda. Va seca. La va hmeda emplea disolventes selectivos y la eleccin del disolvente viene limitada por varias consideraciones. En general, es de desear que el disolvente sea capaz de disolver todos los componentes de la muestra y no solamente a la especie a determinar, adems se escoger un disolvente que no interfiera en los pasos posteriores del anlisis y que el proceso de disolucin debe tener lugar en un perodo de tiempo razonable. Los disolventes que se emplean son:
AGUA
Muchas sales inorgnicos y algunos compuestos orgnicos se disuelven con facilidad en el agua destilada comn. Los metales muy activos reaccionan con el agua desprendimiento hidrgeno .
HCL
Disuelve todos los metales comunes con excepcin de cobre, bismuto, mercurio, arsnico, y plata. Los minerales xidos de hierro son solubles en general por digestin con cido clorhdrico y pueden disolver sales de las que forman molculas de cidos dbiles como los carbonatos. La composicin tpica del cido concentrado es de 37 %, densidad 1.19 g / ml, es un cido no oxidante til para muchos metales xidos, sulfuros, carbonatos y fosfatos. El in cloruro no es un agente oxidante como el ion nitrato, pero tiene una fuerte tendencia a formar complejos solubles con muchos elementos. Ejemplos: MnO2 + 4H+ + 2Cl- ------> Mn ++ + Cl2 + 2H20
HNO3
Se utiliza principalmente por su fuerte accin oxidante por lo que ataca a sustancias no disueltas por el HCl ataca a metales situados un poco por debajo del hidrgeno en la serie de actividades (Hg, Ag, Cu, Sb). 3Cu(s) + 2NO3- + 8H+ -------> 3Cu+2 + 2NO + 4H2O
En un ataque puede eliminarse por desplazamiento con H 2SO4 o por destruccin con HCl.
EL AGUA REGIA
ING ARMANDO SALINAS SANCHEZ 24 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Es un solvente muy poderoso que se obtiene al mezclar estos dos cidos en relacin 3 partes de HCl y 1 de HNO3. Esta combinacin produce cido clorhdrico en un medio oxidante.
H2SO4
A causa de su punto de ebullicin de 338 o C, se utiliza para desplazar cidos ms voltiles cuando han de ser eliminados, es tambin un buen agente deshidratante. Disuelve todos los metales comunes excepto plomo, bismuto. Cobre plata, y deshidrata y oxida compuestos orgnicos.
HClO4
Es un reactivo excelente para completar la oxidacin de la materia orgnica despus de ser oxidada en su mayor parte por HNO3; la materia orgnica fcilmente oxidable no debe tratarse en primer trmino con HNO4. por que habra peligro de explosin, es un buen oxidante ( muy fuerte). VIA SECA Cuando una muestra es insoluble en cidos se emplean los mtodos por va seca. La disolucin de las muestras slidas por medio de la fusin se llama desintegracin. Para destruir una muestra se emplean reactivos fundentes, un crisol adecuado y una temperatura relativamente alta. El mtodo es empleado para aquellas sustancias que son insolubles en cidos. La finalidad del fndente es bajar el punto de fusin de la muestra, oxidar o reducir, y sustituir el anin del fndente en la muestra. Los fundentes pueden ser alcalinos Ejemplo, carbonato de sodio ( Na2C03), cidos : sulfato cido de potasio (kHSO4 ), oxidantes tales como, nitrato de potasio (KNO3 ) y clorato de potasio (KClO3 ) , reductores como el azufre y el carbn. Es frecuente un ataque alcalino oxidante; por ejemplo, los sulfuros insolubles se funden con carbonato y oxidantes: (empleando crisol de nquel). 2FeS2 + 4Na2CO3 + 5KClO3 ------> Fe2O3 + 4Na2SO4 + 5KCl + 4CO2
Se puede sealar otro ejemplo en el tratamiento del sulfato de bario que es insoluble en cidos pero se solubiliza con el fndente carbonato de sodio formando COO producto de la fusin carbonato de bario, esta sustancia se solubiliza fcilmente con cido clorhdrico diluido. BaSO4 + BaCO3 + NaCO3 ------ > BaCO3 + Na2SO4 + H2O
2HCl -------> BaCl2
+ CO2
DESTRUCCION DE MATERIA ORGANICA
Los compuestos orgnicos, los fluidos biolgicos, los tejidos de animales y plantas, generalmente se descomponen por digestin hmeda o por calcinacin seca. METODO POR CALCINACION SECA En la calcinacin seca, se opera a temperatura elevada(400 - 700 o C), el oxigeno atmosfrico sirve como oxidante, es decir, la materia orgnica se quema dejando un residuo inorgnico. Se aplica a muestras del tipo orgnico y biolgico; la calcinacin seca sin ayuda de productos qumicos probablemente sea la tcnica ms comn; generalmente emplea como material crisol de porcelana. En algunos casos se aade un material oxidante a la muestra incrementando la eficiencia de la calcinacin ejemplo; el nitrato de magnesio es uno de los que ms se emplea, y permite recuperar arsnico, cobre y plata, adems de plomo, cinc, cobalto hierro ,etc.. En el caso de los lquidos y de los tejidos hmedos se secan en un bao de
ING ARMANDO SALINAS SANCHEZ 25 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
vapor o por calentamiento suave antes de colocarlos en la mufla. El calor de la mufla debe aplicarse gradualmente hasta alcanzar la temperatura final para evitar la combustin rpida y formacin de espuma. Una vez terminada la calcinacin, por lo general el residuo se solubiliza en el recipiente aadiendo 1 o 2 ml. de HCL 6M caliente y se transfiere a un vaso de precipitado para continuar el anlisis. VENTAJAS - Es sencilla. - No se contamina por presencia de reactivos - No se agrega reactivos DESVENTAJAS - Puede producir volatilizacon de elementos - Puede darse perdidas por sustancias en las paredes del recipiente - Tarda 2 o 4 horas METODOS POR DIGESTION HUMEDA En la digestin hmeda los cidos en ebullicin oxidan la materia orgnica a xido de carbono, agua y otros productos voltiles, que son expulsados, y dejan tras ellos las sales o cidos de los constituyentes inorgnicos. La digestin hmeda con una mezcla de cidos HNO3 y H2SO4 es el proceso de oxidacin que sigue en importancia. Generalmente se emplea cantidades (Por ejemplo 5 ml. ) de H2SO4 y volumen mayores de HNO3 ( 20 - 30 ml.). La digestin hmeda generalmente se efectan en matraz Kjeldahl. El HNO3 destruye la parte principal de la materia orgnica, pero no se calienta lo suficiente para destruir los ltimos trozos . Se elimina por ebullicin durante el proceso de digestin hasta que queda nicamente H2SO4 y se producen vapores densos y blancos de SO3, que comienzan a reflejar en el matraz. En este punto la solucin se calienta mucho y el H2SO4 acta en la materia orgnica restante. Puede producirse carbonizacin cuando quedan cantidades considerables de materia orgnica, o cuando esta es muy resistente. Si persiste la materia orgnica, puede aadirse ms HNO3. La digestin se continua hasta que la solucin queda transparente. Otra mezcla de digestin de mayor eficiencia es la de HNO 3, HClO4 y H2SO4 en relacin de volumen de aproximadamente 3:1:1 10 ml. de esta mezcla suelen ser suficiente para 10 g. de tejido fresco o sangre. El HClO4 es un agente oxidante de gran eficacia cuando est deshidratado y caliente y destruye hasta las ltimas trazas de materia orgnica con relativa facilidad. Las muestras se calientan hasta que el HNO3 se expulsa y queda HClO4 fumante; cuyo vapores son menos densos que los de SO3, y llenan el matraz con ms rapidez, el HClO4 caliente se mantiene a ebullicin hasta que aparecen los vapores de SO3, que sealan la evaporacin de todo el HClO4. VENTAJAS DE LA DIGESTIN HUMEDA - Son ms rpidas ; a 1 hora. - No ocasiona perdidas por retencin - Trabaja a bajas temperaturas DESVENTAJAS - Introduce reactivos que pueden impurificar el mtodo. - Requiere mayor atencin y cuidado.
5.- SEPARACION DE SUSTANCIAS INTERFERENTES
El mtodo ideal para determinar una sustancia seria un mtodo especfico, es decir, un mtodo que mida el analito con precisin en presencia de cualquier combinacin de sustancias extraas. Desafortunadamente muy pocos mtodos analticos son
ING ARMANDO SALINAS SANCHEZ 26 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
especficos, no obstante muchos son selectivos. Se puede emplear un mtodo selectivo para determinar cualquier, in o compuesto de grupos pequeos en presencia de ciertos iones o compuestos extraos. En ocasiones existen algunas sustancias extraas que impiden la medicin directa de una especie; estas se llaman interferencias. La separacin de las interferencias y la especie que se va ha determinar es un paso importante en muchos procedimientos de anlisis cuantitativo. Un mtodo de separacin que se usa mucho es la precipitacin cuantitativa de las sustancias que interfieren o de la especie que se va ha analizar, tambin se emplea las tcnicas por enmascarmiento formando un compuesto complejo que se inhibe de participar en la reaccin, otra separacin se pueden efectuar mediante la electrodeposicin o mediante intercambio inico. Otra tcnica de gran utilidad es la extraccin con disolvente.
6.- MEDICION DE LA SUSTANCIA QUE SE VA A ANALIZAR
En este paso se mide realmente la cantidad de la sustancia que se est determinando. El mtodo que se emplee para medir al analito, depender de muchos factores, y uno de los ms importantes es la cantidad de sustancia presente y la exactitud necesaria. Todos los resultados analticos dependen de la medicin final de una propiedad fsica del analito, la cual debe variar de manera conocida y reproductible con la concentracin del analito. Con frecuencia la propiedad fsica (X) medida es directamente proporcional a la concentracin. CA = X En el anlisis gravimtrico, la sustancia que se va a analizar se separa selectivamente mediante precipitacin y a continuacin se efecta una medicin no selectiva del precipitado. En el anlisis volumtrico o por titulacin, la sustancia por analizar reacciona con un volumen medido de reactivo de concentracin conocida, en el proceso llamado titulacin. En los mtodos instrumentales, que se basan en la medicin de una propiedad fsica de la muestra emplean modernos instrumentos complicados y suelen ser ms sensibles, menos pasos de separacin y ser ms selectivos, que los mtodos volumtricos y gravimtricos.
7.- CALCULOS Y EVALUACION DE LOS RESULTADOS
Despus de efectuado la medicin se cuenta con los datos necesarios para calcular la cantidad de cada especie presente en la muestra. Generalmente los anlisis suelen efectuarse por triplicado. Una vez obtenidos los resultados se debe indicar la confiabilidad que tienen; esto se lleva a cabo tomando en cuenta la exactitud del mtodo empleando y sometiendo los datos numricos a un tratamiento estadstico.
8.- EXPRESION DE LOS RESULTADOS
Los resultados de un anlisis suelen expresarse en funcin de conversiones existentes al tipo de muestra que se emplea, y se pueden dar en: a) Concentracin en porcentaje Es frecuente expresar la concentracin en trminos de porcentaje (partes por cien). La composicin por cien de una solucin se puede expresar de distintas maneras. Las ms comunes son: 1.- Porcentaje en peso(P/ P ) = masa de analito( g) masa de Muestra (g) X 100 %
El porcentaje en peso se usa con frecuencia para expresar la concentracin de reactivos acuosos comerciales, Por ejemplo, el cido clorhdrico se vende como solucin al 36 %, Lo cual significa que el reactivo contiene 36 gramos de HCl por 100 gramos de solucin.
ING ARMANDO SALINAS SANCHEZ 27 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
2.- Porcentaje en volumen (v/v) =
volumen de analito X 100 % volumen de muestra
El porcentaje en volumen comnmente se usa para especificar la concentracin de una solucin preparada al diluir un lquido puro con otro lquido. Por ejemplo, una solucin acuosa de metanol al 5 % generalmente significa que la solucin se prepar al diluir 5 ml de metanol puro con agua hasta dar 100 ml 3.- Porcentaje peso - volumen (p/v) = masa de analito ( g ) X 100% volumen de muestra (ml) El porcentaje peso/ volumen se emplea con frecuencia para indicar la composicin de soluciones acuosas diluidas de reactivos slidos. Por ejemplo, una solucin acuosa de nitrato de plata al 5 % frecuentemente se refiere a una solucin preparada mediante la solucin de nitrato de plata en suficiente agua para dar 100 ml de solucin. b) Partes por milln La concentracin de soluciones muy diluidas conviene expresarla en partes por milln (ppm) Este trmino especifica el nmero de partes de un componente en un milln de partes de la mezcla a la que pertenece. Esto lo podemos expresar utilizando unidades de peso en forma similar a como expresamos el por ciento en peso: Concentracin ppm = masa de analito ( g ) X 10 6 masa de muestra ( g ) Una regla muy prctica para calcular parte por milln es recordar que para soluciones acuosas diluidas cuyas densidades son de aproximadamente 1 g / ml, 1 ppm = 1.00 mg / L, es decir: Cppm = masa de analito (mg) volumen de muestra (L) C) Partes por Billn Para soluciones aun ms diluidas, se emplea el sistema de partes por billn (ppb) La ecuacin anterior queda de la siguiente manera: ppb = masa de analito ( g ) X 10 9 masa de muestra ( g ) . D) En miligramos por ciento( mg/% ) A veces, se prefiere emplear la unidad de miligramos por ciento (mg/%) en vez de ppm para pequeas concentraciones. Esta de define como miligramos de sustancia analizada por 100 g de muestra. Se representa de la siguiente forma: mg / % = masa del analito ( mg ) X 100 peso de la muestra ( g )
EXPRESION DEL RESULTADO DEL ANALISIS DE ACUERDO AL TIPO DE MUESTRA
Los resultados de los anlisis se expresan de acuerdo a ciertas normas establecidas: Los anlisis de agua, desages desechos industriales, muestras liquidas de concentracin muy diluidas sus resultados se expresan en ppm ( mg/ L)
ING ARMANDO SALINAS SANCHEZ 28 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Los anlisis de minerales se expresan al estado elemental, en formas porcentuales y con 2 cifras decimales. Ejemplo: 58.42% Calcio Los anlisis de arcillas, cementos, rocas, cales, arenas, calizas, etc. su resultado se expresa en forma de xidos y con dos cifras decimales: Ejemplo: 30.10 % de xido de calcio Los anlisis de drogas, sustancias farmacuticas, reactivos qumicos, se expresan en porcentaje del elemento o de la sustancia y con dos cifras decimales. El anlisis de metales preciosos (oro y plata) se expresan en onzas/tonelada mtrica o gramos /tonelada mtrica. Los anlisis de ciertos fluidos biolgicos se expresan en porcentaje( %) del elemento o del compuesto o en gramos por mil ( o/o o ) o en partes por milln o miligramos por ciento. En anlisis de alimentos como la leche, derivados, carnes, pescados, leguminosas, frutas, cereales, aceites, grasas, etc. sus resultados se expresan en porcentaje ( % ) o miligramos por ciento ( mg % ). En anlisis clnicos se prefieren unidades distintas en peso, para expresar la cantidad de los electrolitos principales en los fluidos biolgicos como miliequivalente (meq.) de Na+, Ca+2, C l -, K+, etc.
UNIDADES COMUNES PARA EXPRESAR CONCENTRACION EN TRAZAS.
UNIDAD partes por milln ( 1 ppm = 10 -4 % ) ABREVIACI PESO/PESO PESO/VOLU VOL/VOL N ppm mg / Kg. mg / l l / l g / g g / ml nl / ml g / Kg. ng / g mg / 100 g g / l ng / ml mg / 100 ml nl / l pl / ml
partes por billn ppb (1ppb =10 -7%=10 -3 ppm) miligramos por mg % ciento pl = picolitro = 10 -12 litros
UNIDAD BASICA DE MASA
Gramo Decigramo centigramo Miligramo Microgramo Nanogramo picogramo g dg = 10 -1 g cg = 10 - 2 g mg = 10-3 g. g = 10-6 g. ng = 10-9 g. pg = 10 -12 g
UNIDAD BASICA DE VOLUMEN
Litro Decilitro Centilitro mililitro Microlitro L dl = 10 -1 L cl = 10 - 2 L ml = 10 -3 L l. = 10-6 L
ING ARMANDO SALINAS SANCHEZ 29 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Nanolitro Picolitro L = litro
nl. = 10-9 L p l = 10-12 L
REACTIVOS QUIMICOS
Los reactivos qumicos que se emplean en el anlisis cuantitativo deben ser de pureza comprobada porque de ellos dependen los resultados que se obtienen. De acuerdo a su pureza los reactivos se clasifican en: A) CALIDAD TIPO PRIMARIO Cumplen con las especificaciones de la American Chemical Society (acs) y poseen propiedades qumicas deseables como alto grado de pureza, estabilidad, alto peso molecular, reacciona estequiomtricamente, en forma rpida y sencilla. Adems contienen cantidad conocida del componente fundamental e impurezas. Se usa para anlisis volumtrico (preparacin de soluciones estndar).
B) CALIDAD REACTIVO ANALTICO O PRO ANALISIS Son los recomendados para efectuar anlisis. La A.C.S. contiene informacin respecto de las condiciones mximas de pureza que se exigen a los productos qumicos. Estos reactivos explican en su etiqueta, lo siguiente "Calidad R.A. cumple con las especificaciones de A.C.S.", presentan alta pureza y cumple con las especificaciones mnimas impuestas por el comit de Reactivos Qumicos de la sociedad Qumica Americana. C) CALIDAD U.S.P. (UNITED STATES PHARMACOPEA) Son aquellos que cumplen los requisitos establecidos por la farmacopea de los E.E.U.U. y fijan las cantidades mximas de impureza en los productos qumicos, estas especificaciones se dirigen al control de la presencia de impurezas peligrosas para la salud y para su uso en farmacia y medicina. Se encuentra dentro de las tolerancias impuestas por la Farmacopea de los Estados Unidos de Norteamrica para contaminantes peligrosos para la salud. D) CALIDAD QUIMICAMENTE PURO (Q.P) Los reactivos clasificados en esta calidad son ms refinados que los tcnicos, pero en algunos casos procede la comprobacin de que el reactivo no contiene impurezas que pueden interferir y tambin puede ser necesario realizar frecuentes anlisis en blanco con el reactivo. E) CALIDAD TECNICA O COMERCIAL Son de calidad indeterminada, y solo se deben utilizar en casos en los que interesa la mxima pureza. En general estos productos no encuentran aplicacin en el trabajo analtico. Este grado de pureza se utiliza principalmente en los procesos industriales a gran escala y rara vez se emplea en el laboratorio analtico, puede usarse solamente para preparar soluciones limpiadoras.
PROBLEMAS
1.- Se analiz una muestra de 25 l. y se determin su contenido de glucosa encontrndose 26.7 g. Calcule la concentracin de glucosa en partes por milln y miligramo por decilitro
ING ARMANDO SALINAS SANCHEZ 30 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Expresado como ppm ( g / ml ) 26.7 ug. -------------- x 25.0 ul. 1ul. ------10-3 ml. = 1068 ug/ml
Expresado como mg/dl. 26.7 g 10-6 g. 1 mg. 1 l 100 ml ----------- x ------------ x----------- x ----------- x --------- = 106.8 mg 25l 1g 10-3g. 10-3ml 1 dl. dl 2.- La concentracin de cloruro se reporta como 300mg./dl. Cual es la concentracin en meq/l? mg dl meq 1000 ml meq 300 -------- x ------- x --------- x --------------- = 84.63 ----dl. 100ml. 35.45mg. 1litro litro 3.- La concentracin de calcio se reporta como 5 meq/ L . Cual es la concentracin en mg/dl? 5 meq X 20 mg X 100 ml X 1litro L meq 1 dl 1000 ml = 10 mg dl
4.- Una muestra de un fluido biolgico tiene una concentracin de Cl- de 150 meq/L si se supone que el Cl- esta presente como NaCl . Calcule cual es la concentracin en g/l? 150 meq X 0.05845g NaCl litro meq = 8.77 g litro
5.- Una muestra de 200 mg de peso se analiza en ella y se encuentra 8.5 mg de agua y 40.2 mg de protenas. Determinar l % de protenas de la muestra en base seca y en base humedad a) Solucin en base humedad AGUA % = 8.5 mg H20 x 100 200 mg muestra b) Solucin en base seca PROTEINAS % P = 40.2 mg protenas x 100 = 20.99% protenas (100 8.5) mg muestra seca 6.- una muestra de harina presenta 8% de humedad y 10% de protenas. Cual seria el % de protenas en una muestra seca? % protenas = 10 % protenas X 100 % = ( 100 - 8 ) % 10.87 % = 4.25% H2O PROTEINAS %= 40.2 mg protenas x 100 = 20.1% 200 mg muestra
ING ARMANDO SALINAS SANCHEZ 31 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
7.- Un alimento se analiza en base humedad y arroja el resultado de 14.57 % de protena y 10.4 % de H2O. Calclese el % de protena en base seca. x = % de protena = 14.57 % protenas x 100 % (100 - 10,4 ) % = 16.26 %
8.- Una sustancia de 500 mg. de peso se someti a anlisis y se encontr que presenta 15mg. de agua y 80mg. de R2O3. determinar el % de agua y el % de R2O3 en base seca y en base hmeda. Calculo en base hmeda ( agua) % H2O = 15 mg H2O x 100 -----------------500 mg MP % H20 = 3. 00 b) Solucin en base seca Calculo de R203 : %= x = 16.49 % R203. 80 mg . R203 x 100 (500 15) mg muestra %R2O3 Clculo de R2O3 = 80 mg R2O3 x ----------------500 mg MP % R203 = 16. 00 100
9.- El anlisis qumico del sulfato de sodio arrojo los resultados siguiente Na2SO4 NaCl H2O 88.00% 1.00% 11.00% ----------100.00%
Convertir la composicin centesimal del sulfato de sodio (% de sus componentes) en contenido de sustancia seca. El contenido total de sustancia seca en el sulfato es igual a: 100 - 11 = 89% El porcentaje de sus componentes en base seca es: Clculo del % Na2SO4 % Na2SO4 = 88 % Na2SO4 X 100 = ( 100 - 11 ) % % Na2SO4 = 98.88 % La composicin en base seca: Na2SO4 NaCl TOTAL 98.88% 1.12% ----------100.00% Clculo del % NaCl. % NaCl = 1 % NaCl X 100
( 100 - 11 ) % % NaCl = 1.12 % NaCl
10.- Cul es el peso que presenta un mol de glucosa (C6H12O6)
ING ARMANDO SALINAS SANCHEZ 32 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
6 mol C x mol mol C6H12O6
12 g mol C
+ 12 mol H mol C6H12O6
x 1g mol H
6 mol O mol C6H12O6
x 16 g
== 180 g /
mol O
11.- Cul es la molaridad de iones K+ en una solucin acuosa que contiene 63.3 ppm de K3Fe(CN)6 = 329.2 g / mol 63.3 mg K3Fe(CN)6 x ( 1mol K3Fe(CN)6 x 1g) mol L ( 329.2 g K3Fe(CN)6 x 1000mg) x 3 mol K + 1mol K3Fe(CN)6 = 5.77 x 10 4
UNIDAD l l I
PRINCIPIOS DEL ANALISIS VOLUMETRICO
Los mtodos por titulacin comprenden un grupo grande y poderoso de procedimientos cuantitativos que se basan en la medicin de la cantidad de un reactivo de concentracin conocida que se consume por el analito. El reactivo puede ser una solucin patrn de un compuesto qumico de concentracin conocida. PRINCIPIOS GENERALES Un mtodo de anlisis volumtrico se base en una reaccin qumica como: aA + analito tT --------> P titulante producto
En donde "a" representa las molculas de analito A, que reaccionan con "t" molculas del reactivo T. El reactivo T se adiciona, por lo general con una bureta, en forma creciente como una solucin de concentracin conocida. A esta solucin se le conoce como standard su concentracin se determina mediante un proceso llamado estandarizacin. La adicin del titulante es continua hasta que se ha aadido una cantidad de T qumicamente equivalente a la de A, entonces se dice que se ha alcanzado el punto de equivalencia en la titulacin. El punto de equivalencia es aquel en el que la cantidad de titulante agregado es igual a la cantidad exactamente requerida para que reaccione estequiomtricamente con el analito Para saber cuando detener la adicin de titulante, se utiliza una sustancia qumica llamada indicador, que cambia de color cuando hay un exceso de titulante. El momento en el que el indicador cambia de color se le denomina PUNTO FINAL de la titulacin, este punto puede o no ocurrir en el punto de equivalencia exacto, esa diferencia marca el error de titulacin. El punto final se caracteriza por un cambio brusco en una propiedad fsica o qumica de la solucin. FUNDAMENTO
ING ARMANDO SALINAS SANCHEZ 33 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Los mtodos volumtricos se llaman tambin mtodos titulomtricos Estos constituyen algunos de los procedimientos mas importantes que se emplean en el anlisis cuantitativo. Los mtodos por titulacin volumtrica comprenden un grupo de mtodos analticos que se basan en determinar la cantidad de reactivo de concentracin conocida que se necesita para reaccionar por completo con el analito. En el anlisis volumtrico el componente de inters (analito) se determina en forma indirecta, midiendo el volumen de una solucin de concentracin conocida, que necesita para que reaccione con el constituyente que se analiza( analito ) o con otra sustancia qumicamente equivalente. La operacin se llama titulacin, que es el proceso por el cual se mide la cantidad de volumen requerido para alcanzar el punto de equivalencia. En este anlisis se utiliza una solucin patrn de concentracin conocida, la titulacin se lleva a cabo aadiendo lentamente, de una bureta, una solucin valorada a la solucin con el analito hasta que la reaccin sea completa. El volumen de reactivo requerido para completar la titulacin se determina por diferencia entre las lecturas inicial y final en la lectura. La titulacin o valoracin es un procedimiento en el que se aade un patrn a la solucin de un analito hasta que se considere completa la reaccin entre el analito y el reactivo titulante.
Ventajas del anlisis Volumtrico
Presenta las siguientes ventajas : 1.- Son mtodos rpidos 2.- Sus resultados presentan precisin aceptable 3.- No emplea exceso de reactivo titulante 4Requiere material de vidrio simple ( buretas, vasos, varillas, etc. ) 5Son ensayos econmicos. 6Se pueden automatizar fcilmente APLICACIONES DE LOS MTODOS VOLUMTRICOS En la determinacin de cidos y bases naturales y sintticos Permite determinar un gran nmero de iones metlicos Determina una variedad de especies inorgnicas, orgnicas y bioqumicas.
REQUISITOS FUNDAMENTALES Para que una reaccin qumica pueda emplearse en anlisis volumtrico debe reunir las siguientes requisitos : 1.- La reaccin entre el componente buscado y el reactivo titulante debe ser simple, libre de reaccin secundaria, la reaccin debe ser especfica. Cuando hay sustancias que interfieren, deben removerse. 2.- La reaccin debe ser estequiomtrica, es decir, debe existir una reaccin bien definida y conocida entre la sustancia que se va ha analizar y el titulante debido a que los clculos a efectuar con los datos exigen una reaccin definida. 3.- La reaccin debe ser rpida e instantnea, con la finalidad de que la valoracin puede realizarse en poco tiempo. 4.- La reaccin debe ser completa en el momento que se han aadido cantidades equivalentes de las sustancias reaccionantes, lo cual permite que puedan realizarse clculos. 5.- Al terminar, debe haber un cambio marcado de alguna propiedad de la solucin. Puede consistir en un cambio de color de la solucin indicadora o un cambio de alguna otra propiedad fsica o elctrica de la misma. 6.- La reaccin debe ser cuantitativa, es decir, el equilibrio de la reaccin debe encontrarse desplazado hacia la derecha. Esto es necesario para que el cambio sea suficientemente notable en el punto final y permita lograr la exacxtitud deseada, cuando el equilibrio no est desplazado hacia la derecha, se producir
ING ARMANDO SALINAS SANCHEZ 34 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
un cambio gradual en la propiedad que seala el punto final(por ejemplo el pH) que ser difcil de detectar. PUNTOS DE EQUIVALENCIA Y PUNTOS FINALES El punto de equivalencia de una titulacin es un valor terico que no se puede determinar experimentalmente. Es el punto en una titulacin en el que la cantidad de titulante patrn aadido equivale a la del analito En el punto de equivalencia se tiene:
Nmero de equivalentes de titulante= Nmero de equivalentes del analito Nmero de miliequivalente de titulante = Nmero de miliequivalentes del analito
El punto final de una titulacin es el cambio fsico observado que se asocia con una condicin de equivalencia qumica. En una titulacin es muy comn aadir un indicador a la solucin del analito para obtener un cambio fsico apreciable ( el punto final) en o cerca del punto de equivalencia. Los cambios ms grandes en la concentracin relativa del analito o del titulante se dan, precisamente, en la zona del punto de equivalencia; estos cambios de concentracin son los que hacen que cambie la forma del indicador, siendo los ms tpicos la aparicin o desaparicin de un color, el cambio de color, o la aparicin o desaparicin de turbiedad. Para detectar los puntos finales tambin se utilizan instrmentos que responden a los cambios de ciertas propiedades de la solucin durante una titulacin, los instruementos ms utilizados para este fin son los colormetros, turbidmetros, potencimetros, conductmetros, etc. La diferencia de volumen entre el punto de equivalencia y el punto final es el error de titulacin.
Error titulacin = Volumen punto final Volumen terico de reactivo para alcanzar el punto de equivalencia
CLASIFICACION DE LAS REACCIONES QUIMICAS EMPLEADAS EN VOLUMETRIA
Pertenecen a 2 tipos principales: A) INTERIONICAS Son aquellas en las que no hay cambios de valencia y son tan solo combinaciones interionicas. B) REACCIONES XIDOS- REDUCCIN Involucran cambios de valencia, o dicho de otra forma, transferencia de electrones. CLASIFICACION DE LOS METODOS DE ANALISIS VOLUMETRICOS Los mtodos se pueden clasificar en base a dos criterios: 1. POR EL TIPO DE REACCIN QUIMICA De acuerdo con ello se puede dividir en los mtodos siguientes: MTODOS DE NEUTRALIZACIN Comprende las determinaciones de cidos o bases con un lcali o cido valorado. Muchos compuestos, orgnicos e inorgnicos, suelen ser cidos o bases que pueden titularse con una solucin estndar de una base fuerte o un cido fuerte. Estas reacciones implican la combinacin de [H+] y [OH-], para formar agua.
OH - + H + <-------> H+ + OH- <====> analito titulante
H2 O H2O. producto
ING ARMANDO SALINAS SANCHEZ 35 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
MTODOS POR PRECIPITACIN Y FORMACIN DE COMPLEJOS En el caso de la precipitacin, el titulante forma un producto insoluble con la sustancia analizada. Un ejemplo es la titulacin de iones sulfocianuro con solucin de nitrato de plata. Ag+ + SCN- =====> AgSCN Insoluble En las titulaciones complejomtricas el titulante es un agente complejante que forma un complejo soluble en agua con la sustancia analizada, un ion metlico, el titulante suele llMrse agente quelante. 2CN+ Ag+ =====> Ag(CN)2 - Ion complejo.
analito titulante productos MTODO POR OXIDO- REDUCCIN Estos mtodos involucran reacciones que experimentan una transferencia de electrones entre las sustancias reaccionantes. Emplean soluciones valoradas de sustancias oxidantes o reductoras, en las titulaciones redox se titulan un agente oxidante con un agente reductor o viceversa.
5H2O2 analito
2MnO4titulante oxidante
6H+ ====> medio
5O2 + 2Mn+2 + 8H2O producto
2.- POR EL TIPO DE TITULACION Por este criterio los mtodos volumtricos se pueden clasificar en : MTODO DE TITULACION DIRECTA En este caso el ion que se determina se titula con la solucin valorada y reacciona en forma directa. HCO3- + H+ ====> CO2 + H2O analito titulante productos
MTODO DE TITULACION POR DESPLAZAMIENTO En este caso no se titula directamente el elemento a determinar y este mtodo se emplea en el caso en que ciertas razones es difcil establecer el punto de equivalencia. Se denomina tambin mtodo indirecto. El analito o componente por analizar se hace reaccionar con un reactivo agregado en exceso y como resultado de la reaccin se forma un compuesto qumico en cantidad equivalente al contenido del componente por analizar, el compuesto formado se titula con una solucin de concentracin conocido. De este modo, no se titula el compuesto por determinar sino un nuevo compuesto formado por reaccin qumica.
En el siguiente ejemplo, se quiere determinar cobre (II), se agrega una solucin de yoduro de potasio y como consecuencia de la reaccin se forma una cantidad de yodo equivalente al contenido de cobre. 2Cu++ + 4I=====> 2CuI- + I 2 analito reductor yodo liberado El yodo formado se titula con una solucin titulante de tiosulfato de sodio ( solucin reductora). I2 + 2S2O3- 2 =====> 2I- + S4O6 - 2 yodo titulante productos MTODO POR RETROCESO Llamado tambin por retrovaloracin, retitulacion o valoracin residual consiste en aadir un exceso de la solucin valorada de un reactivo que reacciona con el elemento de inters, el exceso de reactivo se titula con otro reactivo; determinndose as la
ING ARMANDO SALINAS SANCHEZ 36 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
cantidad del mismo que no a participado en la reaccin qumica. Se emplea en los siguientes casos: 1.- Cuando la velocidad de reaccin entre el analito y el reactivo es lenta. 2.- Cuando no se dispone de un indicador adecuado. 3.- Cuando la solucin patrn es inestable Por ejemplo, para la determinacin de carbonato de calcio, la porcin pesada muestra se trata con cido clorhdrico valorado aadido en exceso: CaCO3 + 3H+ ====> analito exceso El cido remanente se titula con una solucin de lcali, determinando de esta manera la cantidad de cido que no ha participado en la reaccin con el carbonato de calcio H+ exceso de cido + OH=======> H2O retitulante producto Ca++ + H2O + CO2 + H+ cido en de
SOLUCIONES La mayora de las reacciones que se realizan en el anlisis qumico se verifican teniendo a los reactantes en solucin y en general en medio acuosos. Una solucin es una dispersin molecular o inica de una o varias sustancias(solutos) en el seno de otra(solvente), en una relacin que vara dentro de ciertos lmites. Una solucin presenta dos componentes: A) Soluto, sustancia que se dispersa B) Solvente, medio en el cual un componente se encuentra disuelto. Existen condiciones en una solucin en la que no es fcil distinguir el solvente del soluto, pero se acepta que el solvente sea el componente que est en mayor proporcin con respecto al otro u otros. En el caso de que en una solucin los componentes estn en la misma proporcin, el solvente ser aquel componente que desde el punto de vista qumico, se menos activo. CONCENTRACIN La concentracin de una solucin, es la relacin que existe entre una cantidad definida de un soluto disuelta en una determinada cantidad de solvente. Esta relacin puede expresarse en unidades fsicas o qumicas. Las unidades fsicas establecen la composicin de una solucin en trminos del peso de soluto que est en un determinado peso o volumen de solvente.(peso de soluto por unidad de peso o de volumen de solvente. Por ejemplo, 30 g de sulfato de cobre en 500 g de agua. En porcentaje, ya sea en peso o volumen de soluto, referido a 100 partes en peso o volumen de solucin. Esta relacin de concentracin expresada matemticamente es: % = a1 100 = a1 + a2 a1 100 b
a1 = cantidad de soluto o masa de la sustancia disuelta a2 = cantidad de disolvente o masa de disolvente b= cantidad de solucin Se puede expresar de los siguientes modos:
ING ARMANDO SALINAS SANCHEZ 37 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Porcentaje en peso (%, P/P) , indica el nmero de gramos de soluto disuelto en 100 g de solucin, por ejemplo, una solucin de 10% de NaCl indica 10 g de NaCl en 100 g de solucin , es decir, 10 de sal ms 90 g de agua. Porcentaje Peso/volumen (%P/V) indica el nmero de gramos de soluto por 100 ml de solucin Porcentaje Volumen /volumen (%V/V) indica el nmero de mililitro de soluto en 100 ml de solucin.
En unidades qumicas, para expresar la concentracin de una solucin est supeditado a la forma de indicar los valores del soluto que se encuentra en una cantidad definida de solvente o el aforamiento a un volumen determinado de solucin, estas unidades tienen la ventaja que son directamente aplicables a las interpretaciones cuantitativas de las soluciones y a las reacciones qumicas que se verifiquen entre estas. Las formas qumicas son: A) Molaridad B) Normalidad C) Molalidad D) Formalidad SOLUCIONES PATRN En los mtodos de anlisis por titulacin las soluciones patrn ocupan un lugar muy importante. Una solucin patrn o valorada es la que contiene una concentracin conocida de una especie qumica dada, y reciben tambin el nombre de soluciones estndares o disoluciones patrones. Propiedades esperadas en las soluciones patrones La solucin valorada ideal para un anlisis volumtrico deber : 1.- Ser suficiente estable, de modo que slo sea necesario determinar una vez su concentracin 2.- Reaccionar rpidamente con el analito, con el fin de reducir al mnimo el tiempo requerido entre las adiciones de reactivo 3.- Reaccionar con el analito de manera completa para que se alcance satisfatoriamente el punto final 4.- Reaccionar de manera selectiva con el analito, para que esta reaccin pueda describirse por una simple ecuacin balanceada. PREPARACION DE SOLUCIONES VALORADAS Existen 2 mtodos de preparacin: 1. MTODO DIRECTO Se prepara a partir de una sustancia patrn primario. Se pesa la cantidad de reactivo deseado, se disuelve, se trasvasa a una fiola y se diluye a la marca de enrase del matraz. La concentracin se calcula a partir del peso y volumen conocido. Para que una sustancia pueda considerarse como patrn primario debe tener: Pureza conocida (las impurezas no deben exceder de un 0.01 a un 0.02%). Debe presentar estabilidad atmsfrica Peso equivalente alto para minimizar los errores al pesarlo. Reaccin en forma estequiomtrica. Fcil adquisicin Ausencia de agua de hidratacin para evitar que cambie la composicin del slido con las variaciones en la humedad relativa Solubilidad suficiente en el medio de titulacin.
ING ARMANDO SALINAS SANCHEZ 38 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Muy pocos reactivos cumplen con todos estos criterios, de ah que solo se tiene acceso a un nmero limitado de patrones primarios. Por esta razn, a veces es necesario utilizar compuestos menos puros, o patrones secundarios, en lugar de un patrn primario; teniendo qque determinar la pureza de ese patrn secundario mediante anlisis cuidadosos. Un patrn secundario es un compuesto cuya pureza se ha determinado por medio de un anlisis qumico y sirve de referencia para un mtodo de anlisis por titulacin. Ejemplo Calcule el peso en gramos de carbonato de sodio anhidro con una pureza del 98.5 % para preparar 250 ml de una solucin 0.150 N . El carbonato de sodio se va a titular con HCl de acuerdo a la siguiente ecuacin : CO 3 -2 + Clculo del peso
0.150 meq carbonato puro X 0.05299 g carbonato puro X 100 g reactivo fbrica ml 1 meq 98.5 g carbonato puro X 250 ml
2H+
----------
CO2 + H2O
=2.0173 g Na2 CO3 para preparar la solucin respectiva.
2.
MTODO INDIRECTO La mayora de los compuestos qumicos que se emplean como reactivos valorantes no cumplen con los requisitos de los reactivos patrn primario, por lo que sus soluciones no pueden prepararse por el mtodo directo. As, la mayora de las veces compuestos con pureza menor son empleados en lugar de un patrn primario. Por el mtodo indirecto se prepara una solucin valorada midiendo en forma aproximada el peso o el volumen de una sustancia, se disuelve y se diluye al enrase. La solucin presenta una concentracin aproximada y la verdadera concentracin se encuentra titulando la solucin con otra solucin preparada en forma directa que acta como patrn. La preparacin de una solucin en forma indirecta implica dos procesos: Preparado de la solucin Determinar la concentracin de la solucin.
TIPOS DE SOLUCIONES VALORADAS Las unidades de concentracin que se utilizan con mas frecuencia en los anlisis volumtricos son la molaridad y la normalidad y en menor incidencia las soluciones empricas. El trmino por ciento en pesos se emplea comnmente para expresar la concentracin aproximada de los reactivos de laboratorio.
SOLUCIONES MOLARES
La concentracin molar de la solucin de la especie qumica es el nmero de moles de esta especie que est contenido en un litro de la solucin. La unidad de concentracin molar es la molaridad ( M ), la cual tiene dimensiones de mol / litro. Se expresa de la siguiente manera : N MOLES DE SOLUTO -------------------------------= VOLUMEN DE SOLUCION EN LITROS mol ------------L
Tambin se puede expresar de la manera siguiente :
ING ARMANDO SALINAS SANCHEZ 39 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Milimoles de soluto mmol ----------------------------- = --------------mililitros de solucin ml
Para efectuar clculos en anlisis volumtrico se debe manipular expresiones en las cuales aparezcan moles y soluciones molares. MOL : Una mol es el peso de la frmula de una sustancia, expresado en gramos moles = Masa de A ( gramos) peso de la frmula de A ( g/mol) Milimol : Una milimol es el peso de la frmula de una sustancia mmoles = Masa de A ( miligramos) peso de la frmula milimolar A ( g/ mol) Ejemplo Cuntos moles y milimoles de cido benzoico ( 122.1 g/ mol ) estn contenidos en 5 gramos de cido puro ?. Nmero de moles
5 g X 1 mol 122.1 = g 0.04095 mol
Nmero de milimoles
5 g X 1 mmol =
0.1221
40.95 mmol g
Ejemplo Calclese la concentracin molar de Etanol en una solucin acuosa que contiene 5 g de C2H5OH ( cuyo peso molecular es de 46.07 g / mol ) en 4 litros de solucin
5 g C2H5OH X 1 mol C2H5OH = 4L 46.07 g 0.0271 mol / L
o:
5 g C2H5OH X 1 mmol C2H5OH = 4L 0.046.07 g 0.0271 mmol /ml
SOLUCIONES EMPIRICAS
Son aquellas que tienen una concentracin arbitraria en relacin a la aplicacin especifica de la solucin o de las necesidades del ensayo y que valoran directamente una cantidad definida del componente de inters. Se le llaman tambin soluciones con titulo y pueden ser de dos tipos:
a)
El titulo a partir de la sustancia patrn Indica el nmero de gramos de sustancia contenido en 1 mililitro de solucin patrn. Ttulo H Cl = 0.003610 g/ml. Significa que 1 ml. contiene 0.003610 g. de HCl.
ING ARMANDO SALINAS SANCHEZ 40 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Ejemplo Calcular que volumen de HCl del reactivo de fbrica con concentracin 36.5 % y densidad 1.15 g/ ml , se debe medir para preparar 1000 ml de una solucin emprica cuyo ttulo sea 1ml = 0.00361 g de HCl. Clculo de peso de HCl para un litro de solucin
0.00361g HCl X 1000 ml = 3.61 g HCl 1ml
Clculo del volumen por medir
3.61 g HCl X 100 g Reactivo fbrica X 1 ml reactivo fbrica 36.45 g HCl 1.15 g reactivo fbrica = 8.6121 ml
Medir 8.6121 ml de HCl y llevar a un volumen de un litro en fiola. b) El titulo a partir de la sustancia que se determina. Indica el numero de gramos de sustancia que se determina, correspondiente a 1ml. de solucin patrn. T H2SO4/ CaO = 0.0028 g CaO/ml H2SO4 Significa que 1mililitro de solucin de H2SO4 reacciona con 0.0028 g. de CaO. Ejemplo Calcular que volumen de H2SO4 concentrado de fbrica con los datos de concentracin 95 % y densidad 1.84 g / ml, se debe medir para preparar un litro de una solucin cuyo ttulo sea : 1 ml = 0.0028 g CaO. Clculo del volumen de cido para preparar un litro de solucin
0.0028 g Cao X 98.08 g cido puro X 100 g reactivo fbrica X 1ml reactivo fbrica 1 ml 56 g CaO 95 g cido puro 1 84 g reactivo fbrica X 1000 ml
= 2.805 ml de cido sulfrico de fbrica.
Soluciones Normales
Son aquellas que contienen un equivalente gramo de una sustancia en un litro de solucin. Se expresa como: N = eq. --------litro = meq ----------mililitro
Un equivalente est definido en forma tal, que un equivalente de titulante reaccionar con un equivalente de la sustancia titulada, o un miliequivalente de titulante reaccionar con un miliequivalente de la sustancia titulada. En el trabajo analtico es frecuente el uso de volmenes normales fraccionados utilizando comnmente soluciones N/10, N/20, N/100, etc. La relacin entre la normalidad y la molaridad es : N = nM
ING ARMANDO SALINAS SANCHEZ 41 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
En donde n es el numero de moles de in hidrgeno. electrones o cationes monovalentes suministrados o combinados con la sustancia reaccionante. Ejemplo Determinar que normalidad presenta una solucin de nitrato de nquel preparada al disolver 3 gramos de nquel metlico puro en cido ntrico y diluyendo a 500 ml. Al titular el nquel con KCN ocurre la siguiente reaccin : Ni +2 + 4 CN - --------- Ni ( CN ) 4 -2 El peso equivalente del nquel es igual a la mitad de su peso atmico debido a que el nquel es un in divalente. Por lo tanto : Peso equivalente = 58.70 = 29.35 g / eq 2 clculo de la normalidad
2g Ni 500 ml X 1 eq Ni X 1000 ml = 0.1362 eq / L 29.35 g 1L
Estandarizacin o valoracin de la solucin es el proceso mediante el cual se determina con exactitud la concentracin de una solucin que titula una cantidad cuidadosamente medida de un patrn primario. Consiste en encontrar la verdadera concentracin que presenta una solucin preparada en forma indirecta . Las soluciones de preparacin indirecta casi nunca resultan de la concentracin deseada. Las concentraciones de las soluciones patrn suelen expresarse en unidades de molaridad o normalidad. La molaridad proporciona el nmero de moles de reactivo contenidos en un litro de solucin; a su vez, la normalidad da el nmero de equivalentes de reactivo en el mismo volumen. Para valorar una solucin se dispone de tres mtodos: MTODO DE PIPETEO Consiste en pesar una porcin del reactivo patrn primario, se disuelve, se lleva una fiola, se diluye, enrasa y se homogeniza la solucin. De esta solucin se extrae varias porciones de solucin exactamente medida que contiene una parte determinada de la porcin pesada, esta porcin llamada alcuota es una parte de la totalidad, por lo general es una fraccin pequea, es una porcin de una muestra que se toma de una fiola utilizando una pipeta. Este mtodo permite realizar mayor nmero de ensayos pero presenta mayor error. Se utiliza tambin para valorar soluciones que presentan concentraciones muy diluidas.
MTODOS PARA ESTABLECER LAS CONCENTRACIONES DE LAS SOLUCIONES PATRN
MTODO DE LAS PORCIONES INDIVIDUALES (PATRN PRIMARIO) Se pesa una porcin de sustancia patrn primario, se disuelve en un volumen de agua cualquiera y luego se procede a titular con la solucin cuya concentracin se quiere determinar. Determinado su gasto y en funcin del reactivo patrn pesado se calcula la concentracin exacta de la solucin aplicando relaciones de equivalencia qumica.
MTODO DE LA SOLUCIN VALORADA (ESTANDAR SECUNDARIO)
ING ARMANDO SALINAS SANCHEZ 42 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Se denomina tambin mtodo del patrn secundario, que es un compuesto cuya pureza se ha determinado por medio de un anlisis qumico y sirve de referencia para un mtodo de anlisis por titulacin. La concentracin de la solucin se encuentra titulndola con otra solucin que presenta una concentracin exactamente conocida, es decir, la solucin que previamente ha sido estandarizada se puede utilizar como un patrn secundario para obtener la normalidad de otra solucin. En trabajos que son de exactitud elevada es preferible estandarizar ambos soluciones con su respectivo standard primario.
FORMAS DE ENCONTRAR LA VERDADERA CONCENTRACIN
Usualmente se emplean las siguientes formas: 1.- FACTOR DE CORRECCIN Es un factor o nmero que al multiplicar los mililitros de una solucin supuestamente de una concentracin se convierte en un volumen exactamente de la concentracin requerida o exacta. Suponer una reaccin de titulacin en la que el analito se ha agotado por reaccin con el titulante. En el punto de equivalencia se tiene que: No miliequivalente de titulante = No miliequivalente del estndar Donde: No miliequivalente de titulante = volumen titulante ( ml ) x Normalidad ( meq/ ml ) No miliequivalente de estndar = peso del estndar medido x meq estndar igualando ambos trminos volumen titulante x normalidad = peso estndar x meq estndar se despeja el volumen que se llamar volumen terico volumen ( terico ) = peso estndar o reactivo patrn medido = meq estndar del reactivo patrn x Normalidad Como en la parte experimental se tiene un gasto o volumen prctico, el factor de correccin se calcula en base a la siguiente frmula : Factor de correccin = volumen terico volumen practico Este factor se multiplicar por los mililitros gastados de la solucin que se ha factorizado. 2.- Encontrar la verdadera concentracin de la solucin Para ellos se emplea la ecuacin de dilucin siguiente: Volumen A x Normalidad B = Volumen A x Normalidad B
aplicando la siguiente relacin: Peso standard primario tomado ------------------- ------------------------------------------------------
ING ARMANDO SALINAS SANCHEZ 43 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Miliequivalente standard primario X volumen practico
Ejemplo de valoracin por el mtodo del Pipeteo
Una muestra de CaCO3 puro que pesa 0.4148 g se disuelve en cido clorhdrico 1 M y se diluye a 500 ml en una fiola. Con una pipeta se toma una alcuota de 50 ml y se coloca en un matraz erlenmeyer, la solucin se titula con 40.34 ml de una solucin de Etilen diamino tetraactico ( EDTA ) utilizando como indicador negro de eriocromo T. Calcular el factor de correccin y la verdadera molaridad de la solucin de EDTA por el mtodo del pipeteo La reaccin de esta titulacin es : Ca +2 + H2 Y - 2 ---------- Reactivo patrn titulante clculo del peso de CaCO3 en la alcuota
0.4148 500 ml g X 50 ml (alcuota) = 0.04148 g de CaCO3
Ca Y - 2
2H + in complejo
En el punto de equivalencia se tiene : Relacin estequiomtrica = 1 mmol EDTA 1 mmol CaCO3 V ml x M EDTA = mmol CaCO3 clculo del volumen terico V ml = mmol de Ca CO3 MEDTA mmol de CaCO3 =
peso de CaCO3 en la alcuota X mmol de CaCO3 0.10009 g
reemplazando en la ecuacin anterior V ml = peso ( g )de CaCO3 en la alcuota
0.10009 g / mmol X 0.01 mmol/ ml
V ml = 0.04148 g
= 41.4427 ml 0,10009 g / mmol X 0.01 mmol/ ml
clculo del factor de correccin Factor de correccin = Volumen terico = 41.4427 ml = 1.02733 volumen prctico 40.34 ml Clculo de la verdadera molaridad M EDTA = peso ( g ) de CaCO3 en la alcuota mmol CaCO3 X volumen prctico M EDTA =
0.04148 g de CaCO3 0.10009 g/ mmol X 40.34 ml = 0.01027 mmol / ml
O tambin se puede calcular de la siguiente manera:
ING ARMANDO SALINAS SANCHEZ 44 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
0.04148 g CaCO3 x 1 mmol CaCO3 x 1mmol EDTA = 0.01027 mmol/ ml 40.34 ml EDTA 0.10009 g CaCO3 1 mmol CaCO3
Ejemplo de valoracin por el mtodo de la porcin pesada
Se prepar una solucin de hidrxido de sodio N / 10 y se procedi a estandarizar la solucin con un reactivo patrn de biftalato de potasio ( PM = 204.22 g ) , pesando para ello 0.2000 g del reactivo slido y en la titulacin se gast 10 ml de la solucin del lcali. Calcular el factor de correccin y la normalidad verdadera ( mtodo de la porcin individual pesada ). La reaccin de la valoracin es : KH C8H4O4 + NaOH ------- KNaC8H4O4 reactivo patrn titulante peso equivalente del biftalato : PE = 204.22 = 204.22 g / eq 1 clculo del volumen terico Volumen terico = peso del reactivo patrn = meq reactivo patrn X Normalidad base Volumen terico = 0.2000 g 0.20422 g/ meq X 0.100meq/ ml = 9.79336 ml + H2O
clculo del factor de correccin Factor = Volumen terico = 9.79336 ml = 0.97933 volumen practico 10 ml clculo de la verdadera normalidad Normalidad verdadera = 0.2000 g 0.20422 g / meq X 10 ml O:
0.2000 g KHC8H4O4 x 1 meq 10 ml NaOH 0.20422 g KHC8H4O4 x 1 meq NaOH = 0.09793 meq/ ml meq KHC8H4O4
= 0.09793 meq / ml
relacin = 1 mmol KHC8H4O4 1 mmol NaOH clculo de la molaridad:
0.2000 g KHC8H4O4 x 1 mmol KHC8H4O4 x 1 mmol NaOH = 0.09793 mmol/ ml 10 ml NaOH 0.20422 g 1 mmol KHC8H4O4
EJEMPLO DE VALORACIN POR EL MTODO DEL ESTANDAR SECUNDARIO
ING ARMANDO SALINAS SANCHEZ 45 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
En una estandarizacin de una solucin de yodo 0.1N por el mtodo del estndar secundario, se toma 20 ml de una solucin de yodo ( I2 ), y se titula con una solucin de tiosulfato de sodio (Na2 S2O3 ) 0.100N con factor de correccin de 1.0062 siendo su gasto de 19.8 ml. Calcular el factor de correccin y la verdadera normalidad de la solucin de yodo. Clculo del factor de correccin Factor = ml de tiosulfato de sodio X factor de correccin ml de solucin de yodo Factor = 19.8 ml X 1.0062 = 0.9961
20 ml
clculo de la verdadera normalidad N1 x V1 = N2x V2
20 ml
N = 0.1000 Meq/ ml X 19.8 ml X 1.0062 = 0.09961 meq / ml O: 20 ml x N 1 = 0.10062 N2 x 19.8 ml N 1 = 0.09961 meq/ mlz Ejemplo Exactamente 50.0 ml de una solucin requirieron 29.71 ml de una solucin 0.01963 M de Ba(OH)2 para alcanzar el punto final, usando como indicador verde de bromocresol. Calclese la molaridad del HCl. Reaccin qumica: 2HCl + Ba(OH) 2 --------- BaCl2 + H2O
En la titulacin, 1 mmol de Ba(OH)2 reacciona con 2 mmol de HCl, y por lo tanto la relacin estequiomtrica es: Relacin estequiomtrica = 2 mmol HCl 1 mmol Ba(OH)2 El nmero de milimoles del patrn se determina de la siguiente manera:
Cantidad de Ba(OH)2 = 29.71 ml Ba(OH)2 x 0.01963 mmol Ba(OH)2 = 0.5832 mmol Ba(OH)2 ml Ba(OH)2
Para obtener el nmero de milimoles de HCl, se multiplica este resultado por la relacin estequiomtrica anterior: Cantidad de HCl = 0.5832 mmol Ba(OH)2 x 2 mmol HCl
1 mmol Ba(OH)2 = 1.1664 mmol HCl
El nmero de milimoles de HCl por ml se obtiene dividiendo lo anterior entre el volumen del cido, Molaridad HCl = 1.1664 mmol HCl = 0.0233 mmol
ING ARMANDO SALINAS SANCHEZ 46 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
50 ml
ml
Ejemplo En la estandarizacin de una solucin de permanganato de potasio se emple 0.2121 g de Oxalato de sodio puro ( Na2C204 = 134 g/mol) y se necesit en la titulacin 43.31 ml de KMn04. Cul es la molaridad de la solucin de KmnO4 ?. La reaccin de titulacin es: 2 MnO4 - + 5 C2O4 2 + 16 H + ------- 2 Mn +2 + 10 CO2 + 8 H2O La relacin estequiomtrica es la siguiente: Relacin estequiomtrica = 2 mmol KMnO4 5 mmol Na2C2O4 La cantidad de oxalato de sodio es : Cantidad de Na2C2O4 = 0.2121 g Na2C2O4 x 1 mmol Na2C2O4 = 1.5828 mmol
0.134 g Na2C2O4
El nmero de milimoles de KmnO4 se obtiene multiplicando este resultado por la relacin estequimtrica Cantidad de KMnO4 = 1.5828 mmol Na2C204 x 2 mmol KMnO4 = 0.63312 mmol KMnO4
5 mmol Na2C2O4
La molaridad se obtiene dividiendo entre el volumen de KMnO4 gastado. Molaridad del KMn04 = 0.63312
43.31 mmol KMn04 = 0.01462 mmol ml KMn04 ml
PRINCIPIOS GENERALES DE TITULACION
En todo el anlisis volumtrico, sea para la normalizacin de soluciones o para el anlisis de muestras, deben observarse los siguientes principios: 1.- La muestra tomada no debe ser demasiado pequea, para que los errores de pesada, den lugar a errores relativos pequeos 2.- El volumen consumido de reactivo titulante no debe ser demasiado pequeo 3.- La muestra tomada no debe ser tan grande que d lugar a que haya que volver a llenar la bureta para completar la valoracin. Esto no slo es molesto, sino que implicara errores de lectura 4.- La concentracin de la solucin titulante debe elegirse en concordancia con las condiciones 1 a 3. Es evidente que el tamao de la muestra, la concentracin del titulante y su volumen estn tambin relacionados con la concentracin del analito presente en la muestra a valorar. 5.- En general, es recomendable efectuarse la valoracin directa hasta el punto final. Sobrepasar este punto y valorar por retroceso con otra solucin patrn es molestoso y presenta mayor posibilidad de error. 6.- cuando sea posible, deben efectuarse determinaciones en blanco con el indicador y restarse las cantidades de reactivo que en ellas se consume de la cantidad gastada en la valoracin
ING ARMANDO SALINAS SANCHEZ 47 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
7.- La normalizacin o el anlisis deben fundamentarse en los resultados de al menos tres valoraciones en estrecha concordancia, preferiblemente con cantidades algo diferentes de muestra para evitar cualquier prejuicio personal en la deteccin del punto final. Para trabajos de la ms elevada exactitud, o para la evaluacin estadstica de la veracidad de un mtodo, deben valorarse muchas muestras repetidas.
CONSERVACIN DE SOLUCIONES ESTANDARES
Para conservar y guardar soluciones estndares es necesario tomar precaciones especiales: El frasco debe conservarse hermticamente cerrado para evitar evaporacin del disolvente Antes de extare la solucin, el frasco se agitar con mucho cuidado para asegurar uniformidad de composicin La solucin estndar no debe mojar el tapn de vidrio del frasco de la solucin Las soluciones deben protegerse de los gases atmosfricos, como bixido de carbono. Algunas soluciones deben conservarse en frascos de vidrio de color mbar o guardarse en la obscuridad mientras no se usan, para prevenir su descomposicin por efecto cataltico.
CALCULOS VOLUMETRICOS
La forma mas usual de expresar la concentracin de las soluciones en anlisis volumtrico es, mediante la normalidad. La disolucin 1 N contiene un equivalente gramo de soluto por litro de disolucin para un determinado tipo de reaccin. La ventaja de expresar las concentraciones basndose en el equivalente qumico es la relacin sencilla 1:1 implicada en reacciones del mismo tipo. Por ejemplo, un equivalente de hidrxido de sodio reacciona con un equivalente de cido clorhdrico y con un equivalente de cido sulfrico o de cualquier otro cido independientemente del nmero de iones hidrgeno por molcula de cido. El modo de definir estos pesos depende del tipo de, valoracin en la que participe la sustancia en estudio, segn se trate de una valoracin de neutralizacin, de una precipitacin, de una formacin de complejos o de una de oxido reduccin. 1. VOLUMETRA DE NEUTRALIZACION El peso equivalente de una sustancia que participa en una reaccin de neutralizacin es el peso en gramos de la misma que proporciona o reacciona con un peso frmula o mol (1.008) de ion hidrgeno (H+) Tambin se le define como el peso frmula dividido entra el nmero de tomos de hidrogeno reactivos en un cido. En una base, es el numero de tomos de hidrgenos que se necesitan para neutralizar cada molcula de la base. Para encontrar el equivalente gramo se debe escribir la ecuacin de reaccin y calcular cuantos gramos de sustancia dada corresponden en la ecuacin a 1 tomo o a un in de hidrogeno. Por ejemplo en la reaccin : HCl + KOH ---------> KCl + H2O
Un equivalente gramo de cido es igual a una molcula gramo (mol) de cido clorhdrico por que precisamente estas cantidades de cido (36.46 g.) corresponden durante la reaccin a un in gramo de hidrogeno que interacciona con los iones hidroxilo de lcali. En el caso de las bases se encuentran de manera anloga a los cidos, con la diferencia de que sus molculas gramo se deben dividir en este caso por el numero de iones OH que participan en la reaccin. Ejemplos: PM PM
ING ARMANDO SALINAS SANCHEZ 48 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
HCl
----------1 PM ----------1
Na2CO3
= ----------2 PM ------1
H2SO4 =
NaOH
H2SO4
PM ------------2 PM PM ---------- ; ---------- ; 1 2
Ba(OH)2 PM -------3
PM = ---------2
H3PO4
2. VOLUMETRA DE PRECIPITACIN - COMPLEJOS
El peso equivalente es el peso de la sustancia que reacciona o es qumicamente equivalente a un tomo gramo de un catin monovalente, 1/2 mol de un catin divalente, 1/3 mol de un catin trivalente en el precipitado o complejo formado. El peso equivalente de un in metlico es el peso de la frmula del in dividido entre la carga del in. Peso equivalente Peso de la frmula = -----------------------------carga del catin
ejemplo: a) En la reaccin volumtrica del cloruro de plata: ClPM --------1 = PM --------1 + Ag+ -------> AgCl
PE (AgNO3)
PE (K Cl)
Un mol de nitrato de plata contiene un equivalente, por que es la cantidad de dicha sustancia que aporta un tomo gramo de plata, catin monovalente, en el precipitado. En la misma reaccin el peso equivalente del cloruro de potasio coincide con su peso molecular, pues dicho compuesto aporta la cantidad de in cloruro que reacciona con un tomo gramo del catin monovalente plata. En la reaccin: 2CN- + A g+ ------> A g (CN)2PE (2KCN) = PM ------
ING ARMANDO SALINAS SANCHEZ 49 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
2 El peso equivalente del cianuro de potasio es 2KCN, pues se necesitan 2CN- para completar la reaccin con tomo gramos del catin monovalente plata en la formacin del complejo. 3. VOLUMETRA POR OXIDO REUCCIN O REDOXIMETRICA El peso equivalente de una sustancia es el peso de la misma sustancia que reacciona o se equivale a un mol de electrones transferidos en la reaccin que tenga lugar. En este caso es el peso de la formula de la sustancia que se pega o que se va a calcular, dividido entre el numero de electrones ganados o perdidos en la reaccin de dicha sustancia. En forma general se tiene: PE = PM ------n
Donde n = nmero de moles de H +, electrones o cationes monovalentes combinados con la sustancia reaccionante. Ejemplo: En la semireaccin siguiente: Cr2O7- 2 + 14 H+ + 6e<====> 2Cr3+ + 7H2O
En este caso el nmero de oxidacin de 2 tomos de cromo pasa de +12 a 6+ sea, experimenta un cambio de 6 unidades. El equivalente gramo del dicromato de potasio es 1/6 de mol. PM K2Cr2O7. 294.22 g ----------------- = -----------------6 6 En la semi reaccin: Pe =
49.036 g / eq
MnO4- + 8H+ + 5e- ------> Mn+2 + 4H2O Para ajustarla atmicamente se necesitan 8H+ y para ajustarla elctricamente se requieren 5 electrones en el miembro de la izquierda, por lo tanto el in permanganato toma 5 electrones por lo que su peso equivalente es igual a un quinto de mol. Pe = PM KMnO4 158.03 g ----------------- = ---------------- = 31.606 g / eq 5 5
RELACIONES VOLUMTRICAS IMPORTANTES Las siguientes relaciones matemticas sirven de base a los clculos volumtricos comunes: 1. Para calcular el nmero de equivalentes gramo o miliequivalente gramo se utiliza la siguiente relacin: Equivalente gramo (soluto) = Normalidad x Volumen en litros.
ING ARMANDO SALINAS SANCHEZ 50 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Ejemplo: Calcular el equivalente gramo que presenta una solucin si tiene una normalidad de 1.5 eq/ litros y un volumen de 2 litros. Eq Equivalente gramo = 1.5 -----x 2 litros = 3 Eq. Gramo litro miliequivalente gramo (meq) =Normalidad (meq) meq = 1.5 = x (N) mililitros x (ml)
meq ----- x 2000 ml = 300 meq ml
2. En el punto de equivalencia, el nmero de equivalentes gramo de la sustancia que se titula, es igual al nmero de equivalentes gramo de la solucin valorada que se emplea., Si los volmenes de las soluciones de dos sustancias A y B, que corresponden al punto de equivalencia son Va ml y Vb ml. respectivamente, entonces, dichos volmenes contienen el mismo nmero de equivalentes gramo o bien de miliequivalente gramo de A y B. As:. Esta relacin se puede emplear para calcular la dilucin necesaria para preparar determinada solucin a cierta concentracin, a partir de otra solucin ms concentrada. ml a x Na = ml B x NB
Se tiene que: ml a x N a = Nmero de meq de A. ml b x N b = Nmero de meq de B. Ejemplo: 50 ml. de cido 0.1000N se neutralizan exactamente con 40.0 ml. de base. Cul es la normalidad de la base?. 50 ml x 0.1000N = 40 ml x N NB = 0.1250 N. 3.- Los nmeros de la meq de las sustancias; para el mismo tipo de reaccin pueden sumarse y restarse, debido a que el meq es la unidad reaccionante. Ejemplo: Se mezcla 25 ml de HC1 0.0800N y 30 ml de H2SO4 0.1100N calcular la normalidad de la solucin. ml x N = No de meq 25 x 0.080 = 2.00 meq de HCL 30 x 0.110 = 3.30 meq de H2SO4 ----------------------------------------Total 55 x N = 5.3 meq de cido N = 5.3 meq ------------ = 55.0 ml 0.0963 meq ---------ml
4. El nmero de meq de un reactivo, multiplicado por el peso en gramos de 1 meq del mismo o de cualquier sustancia equivalente a l, es el nmero de gramos del reactivo ( o de la sustancia equivalente).
ING ARMANDO SALINAS SANCHEZ 51 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Ml a
x N a x meq a = gramos a
Ejemplo: Cuntos gramos de cido sulfrico pueden neutralizarse con 40 ml. de una solucin 0.100N de hidrxido de sodio. meq H2SO4 40 ml x 0.100 --------- x 0.4904g ---------- = 0.19616 g ml meq 5. Los gramos de una sustancia dividido por el peso de su Meq dan el nmero de meq de dicha sustancia, o de cualquier otra que reaccione con ella o sea equivalente qumicamente a ella. Ejemplo: Cuntos meq de base representan 0.5000 g. Ba (OH)2 ? Ba (OH)2 171.36 PE = --------------- = ----------- = 85.68 g / eq. = 0.08568 g /meq 2 2 N meq = peso de la sustancia (g) ----------------------------------------peso de miliequivalente (g/meq) 0.5000 g. --------------------0.08568 g./meq = 5,836 meq de Ba(OH)2
No Meq =
Ejemplo: Preparar 10000 ml. de una solucin Acido Clorhdrico N/10 a partir del reactivo de fbrica que presenta los siguientes datos: Densidad = 1.185 g/ml. Concentracin = 36.5 % P/P Peso Formula = 36.465 g Calcular el volumen del reactivo de fbrica a medir Peso equivalente del cido 36.465 g PE = ------------ = 36.465 g 1 N/1 = 36.465 g N/10 = 3.6465 g Clculo con la concentracin: 100 g de cido al 36.5 % contiene 36.5 g HCL puro x --------> 3.6465 g. x = 9.99 g. Clculo con la densidad (d= M/V) 9.99 g V = --------------- = 8.4 ml. para 1000 ml. 1.185 g/ml
Se mide 8.4 ml. de HCL de fbrica. se deposita en una fiola de 1000 ml. que contiene H 2O destilada, se diluye, enrasa y homogeneiza.
ING ARMANDO SALINAS SANCHEZ 52 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Empleando el mtodo dimensional se tiene:
0.1 eq X 36.465 g cido puro X 100 g Reactivo fbrica X L 1 eq 36.5 g cido puro 1ml reactivo fbrica X 1 L = 1.185 g reactivo fbrica
= 8.43 ml. Para preparar una solucin uno molar se efectan los siguientes clculos:
0.1000 mmol HCl x 0.036465 g HCl x ml 1 mmol 100 g reactivo x 1 ml reactivo x 36.5 g HCl 1.185 g reactivo 1000 ml = 8.43 ml
Ejemplo: Preparar una solucin emprica de permanganto de potasio cuyo ttulo es 1 ml. = 0.005 g. Fe para un volumen de 250 ml. a partir de una solucin Stock 1 N.de KMnO4 Calculo del peso de hierro que corresponda a un litro de solucin. 0.005 g Fe X 1000 = 5 g Fe 1 ml KMnO4 X = 5 g. Fe. Luego se determina la normalidad correspondiente:
1N 55.85 X 5 g = 0.0895 N g Fe
Clculo del volumen que se debe tomar de la solucin Stock de KMnO4 250 ml x 0.0895 N. V Se mide 22.37 ml. de la solucin de KMnO4 1 N Ejemplo: Cuntos ml. de agua deben aadirse a 500 ml de cido 0.0955 N. para que la solucin sea exactamente 0.0900? Clculo del volumen total 500 ml. x 0.0955 N. = V x 0.0900N x = 5 30.55 ml de H2O Clculo del volumen que debe aadirse a 500 ml (530.55 - 500 ) = 30.55 ml. de agua. Ejemplo Se desea preparar 500 ml de una solucin 0.1000 M de K2Cr2O7 a partir de una solucin 0.250 M Qu volumen de solucin de 0.250 M debe diluirse a 500 ml? M final x ml final = 0.1000 M x M
original
1N
V.
= 22.37 ml.
x ml original
500 ml = 0.250 M x ml original
ING ARMANDO SALINAS SANCHEZ 53 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Ml original = 200 ml Ejemplo El yodo (I2 ) es un agente oxidante que en presencia de agentes reductores se reduce a ion yoduro ( I - ). Cuntos gramos de I2 ser necesario pesar para preparar 100 ml de una solucin de 0.1000 N de I 2? Se parte de la reaccin siguiente: I 2 + 2 e --- 2I-
El peso equivalente es la mitad del peso frmula Peso equivalente = peso frmula I 2 2 Peso equivalente = 254 / 2 = 127 g/eq 1 meq = 0.127 g/ meq Clculo del peso 0.1000 meq/ ml x 0.127 g I 2 x 100 ml 1 meq = 1.2700 g de I2
ING ARMANDO SALINAS SANCHEZ 54 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
ING ARMANDO SALINAS SANCHEZ 55 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
CONDICIONES PARA LA PRECIPITACION ANALITICA.
Se dice que una solucin es sobre saturada cuando contiene una concentracin de soluto superior a la que tiene una solucin saturada. La sobresaturacin se puede definir como: Sobre saturacin = Q - S Donde: Q = Concentracin del soluto en la solucin en un instante dado. S = Concentracin de equilibrio en una solucin saturada. Idealmente, un precipitado analtico debera estar formado por cristales de tamao grande para poderlos filtrar con facilidad. Los cristales perfectos estaran libres de impurezas en el anterior y presentaran una superficie de contacto mnima para la absolucin de impurezas. En el anlisis gravimtrico es importante obtener un precipitado puro y bien formado, de tamao de partcula bastante grande como para poder filtrarlo y lavarlo con facilidad. En 1925 Von Weirmar descubri que el tamao de partcula de los precipitados es inversamente proporcional a la sobresaturacin relativa de la solucin en el curso de la precipitacin: Sobresaturacin Relativa = Donde: Q-S --------S
ING ARMANDO SALINAS SANCHEZ 56 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
Q = Concentracin molar de los reactivos mezclados antes de que ocurra la precipitacin, es decir en la etapa de induccin. S= Solubilidad molar del precipitado cuando el sistema ha alcanzado el equilibrio.
1. 2.
La velocidad de precipitacin aumenta conforme la sobresaturacin relativa aumenta. Por consiguiente, para obtener un precipitado puro de tamao de partcula grande, la sobresaturacin relativa deber ser tan baja que la velocidad de precipitacin sea lenta. 3. Para obtener el mejor precipitado posible sera necesario ajustar las condiciones para que Q tenga el valor ms bajo posible y S sea relativamente grande. 4. Se debe evitar que S no sea muy grande, porque de lo contrario la precipitacin no ser cuantitativa.
TECNICAS PARA EFECTUAR UNA BUENA PRECIPITACION.
Para efectuar la precipitacin se emplea comnmente las siguientes tcnicas: Utilizacin de soluciones diluidas de problema y reactivo, de esta forma Q se mantiene baja. Adicin lenta del reactivo precipitante, con buena agitacin.- Se aade el precipitante gota a gota. Cuando se aade el agente precipitante con lentitud, Q se mantiene baja, la agitacin impide que el agente precipitante se concentre en determinadas zonas. Precipitacin de un pH cercano a la regin cida en donde la precipitacin es cuantitativa.- Muchos precipitados son muy solubles a pH cido o bajo; por consiguiente la velocidad de precipitacin es menor. Precipitacin es una solucin caliente.- La solubilidad S del precipitado aumenta con la temperatura; por consiguiente un aumento de S hace disminuir la sobresaturacin. Digestin del precipitado.- La digestin se efecta cuando el precipiado est en contacto con la solucin madre (la solucin de la cual precipit), mientras se est calentando. La digestin hace que el precipitado envelesca, su superficie total disminuye y el tamao promedio de sus partculas aumenta. La digestin ocasiona que en cierto grado las partculas pequeas se disuelvan y vuelvan a precipitar sobre los cristales de mayor tamao y forma ms perfecta. Por ltimo la digestin logra cierta perfeccin interna en la estructura cristalina del precipitado, esto se denomina maduracin del precipitado.
PRECIPITACION DE UNA SOLUCION HOMOGENEA.
En este procedimiento el reactivo o ion precipitante no se adiciona como tal, sino que la precipitacin se provoca generando lentamente el reactivo en el propio seno de la solucin del ion a precipitar, por medio de una reaccin qumica adecuada. Las caractersticas que presenta son: a) La reaccin de formacin del reactivo es lenta. b) Durante el proceso de la precipitacin la solucin es homognea. c) El reactivo precipitante no se agrega a la solucin problema. d) La sobresaturacin Q - S se mantiene a un valor extremadamente bajo. e) Forma un precipitado muy puro y denso. f) Tiene lugar en toda la solucin la formacin gradual del slido. Ejemplos de Mtodo de precipitacin homognea. 1. PRECIPITACIN POR MEDIO DE UREA Un ejemplo importante de este tipo es el de la urea, utilizada para producir iones hidroxilo (OH -) en la precipitacin del aluminio, hierro (III), del torio y de otros iones de los metales pesados. El reactivo precipitante se forma segn la ecuacin:
ING ARMANDO SALINAS SANCHEZ 57 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
NH2CONH2 + H2O ------ 2NH4+ + CO2 + 2OH(NH2CONH2) + H2O ----- 2NH3 + CO2 El amoniaco que se libera lentamente aumenta el pH de la solucin homognea y ocaciona que los iones metlicos que se forman hidrxidos insolubles (u xidos hidratados) precipiten. El amoniaco aparece lentamente en la reaccin, subiendo el pH de la solucin poco a poco, favoreciendo as una precipitacin lenta. El NH3 reacciona con el agua: NH3 + H2O ------- NH4+ + OHPrecipitacin del Al+3 Al+3 + 3OH- ------ Al (OH)3 2.GENERACIN HOMOGNEA DE IONES SULFATOS Se genera a partir del cido sulfmico por hidrlisis y en caliente. H2SO3NH2 + H2O ----- H+ + SO4-2 + NH4+
Precipitacin del Ba+2 Ba+2 + SO4-2 ----- BaSO4 (s) 3. PRECIPITACIN DE SULFUROS Se genera sulfatos a partir de la tioacetamida por hidrlisis y por calentamiento cataltico por cido o por base, de acuerdo a la siguiente reaccin: CH3-CSNH2 + H2O ----------- CH3-COO- + NH4+2 + H2S Se utiliza para precipitar iones metlicos formando sulfuros insolubles. Precipitacin del Cu+2: Cu+ + S-2 ------ CuS (s) 4. PRECIPITACIN POR CAMBIO DE pH Modificando el pH de la solucin problema se puede conseguir que el precipitado sea soluble y que este ion modificado aparezca lentamente de tal manera que se produce una precipitacin homognea, gradual y paulatinamente. El ion precipitante aparece lentamente y produce una precipitacin homognea. Ejemplo: Precipitacin del calcio como oxalato de calcio. Ca+2 + C2O4-2 + H2O ------ CaC2O4.H2O (s) Si se acidifica la solucin se tiene:
ING ARMANDO SALINAS SANCHEZ 58 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
C2O4-2 + H+ ------ HC2O4HC2O4- + H+ ----- H2C2O4Si se neutraliza la solucin con NHOH se va generando o deja en libertad el ion precipitante C2O4 -2 en forma gradual y produce la precipitacin del calcio: Ca+2 + C2O4-2 + H2O ----- CaC2O4.H2O ( S)
IMPUREZAS EN LOS PRECIPITADOS
Los precipitados que se obtienen en el desarrollo de un anlisis, arrastran consigo diversas sustancias que impurifican o contaminan este precipitado. Las sustancias solubles que al formarse un precipitado son arrastradas por ste, se dice que quedan coprecipitadas. Este fenmeno de coprecipitacin depende de: a) Condiciones de precipitacin. b) Naturaleza del precipitado. c) Tipo y concentracin de los iones presentes. Las formas de coprecipitacin son: a) ADSORCIN SUPERFICIAL En el anlisis gravimtrico pueden distinguirse por lo menos cuatro tipos de coprecipitacin. Uno de ellos es la adsorcin superficial. La adsorcin es un proceso mediante el cual tomos, molculas o iones se adhieren a una superficie. Los precipitados amorfos y gelatinosos, son apropiados para quedar contaminados por adsorcin, si se tiene en cuenta la elevada superficie especfica que presenta. De las aguas madres son absorbidas iones sobre las superficies de partculas precipitadas. Esta adsorcin supone una capa inica primaria adsorbida, la cual es retenida muy fuertemente y una capa secundaria contrainica, que est retenida de manera dbil. Estos iones son arrastrados con el precipitado y por ello son causa de que el precipitado sea impuro. En sntesis el precipitado resulta impurificado por un compuesto constituido por los iones absorbidos en la superficie del slido y los contraiones de carga opuesta presentes en la pelcula lquida inmediatamente adyacente a la partcula.
b)
OCLUSION Es un tipo de coprecipitacin, en el cual las impurezas son atrapadas dentro de un cristal en crecimiento. En este caso las impurezas coprecipitadas no se hallan sobre la superficie sino en el interior de las partculas del precipitado. Las causas de la oclusin son:
Captura de impurezas en el proceso de cristalizacin. Adsorcin en el proceso de cristalizacin. Formacin de compuestos qumicos entre el precipitado y las impurezas coprecipitados.
Los cristales que se forman en realidad no forman una red cristalina absolutamente regular, siempre contiene grietas, rendijas o vacos que se llenan con la solucin madre. La mejor manera de evitar la oclusin es digestar adecuadamente o utilizar el mtodo de reprecipitacin. El lavado no sirve para remover sustancias ocluidas.
ING ARMANDO SALINAS SANCHEZ 59 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
c) INCLUSIN ISOMORFA Los compuestos que tienen frmulas del mismo tipo y cristalizan en formas geomtricas similares se denominan isomorfas. Cuando las dimensiones de la red cristalina de 2 componentes isomorfos son aproximadamente igual, es posible que parte de un compuesto sustituya a otro en un cristal.. Ejemplo: El MgNH4PO4 y MgKPO4 son isomorfos, los radios inicos del K+ y del NH4+ son idnticos. Durante la precipitacin de Mg+2 como MgNH4 PO4 el potasio sustituye a parte del NH4+ en los cristales del precipitado. As el precipitado principal contiene un poco de MgKPO4. El error que causa es grave pero no es muy comn. d) POSTPRECIPITACIN Es la separacin de una segunda fase slida despus de a formacin de otro precipitado. El fenmeno se produce debido a que la segunda sustancia cristaliza lentamente de su disolucin sobresaturada. Ejemplo: En la separacin del calcio y el magnesio con oxalato de precipitado de oxalato de calcio debe filtrarse despus de un periodo corto de digestin, caso contrario puede resultar muy contaminado por oxalato magnesico, que postprecipita
LAVADO Y FILTRADO DE PRECIPITADOS
Las impurezas coprecipitadas, especialmente las que se encuentran en la superficie, pueden removerse lavando el precipitado despus de filtrarlo. El precipitado estar hmedo debido al licor madre, que tambin se remueve mediante lavado. Muchos de los precipitados no se pueden lavar con agua pura, porque se produce peptizacin, este fenmeno es el inverso de la coagulacin. El proceso de coagulacin, es reversible, las partculas coaguladas tienen una capa neutra de iones primarios adsorbidos de iones contrarios. El lavado con agua diluye la capa contraria, desarrollando fuerzas de repulsin entre las partculas individuales. Por tanto, se efecta una peptizacin entre las partculas coaguladas y se forman partculas coloidales que atraviesan el filtro. Esto se evita aadiendo un electrlito al agua de lavado. El electrlito deber ser voltil a la temperatura empleada para secar o calcinar, y no deber disolverse en el precipitado. Por ejemplo, se emplea HNO3 diluido como solucin de lavado para el cloruro de plata. El HNO3 substituye a la capa absorbida de Ag+ anin - y se volatiliza al secar a 100 o C. El nitrato de amonio se emplea como electrlito para lavar el xido de fierro hidratado. Se descompone en NH3, HNO3, N2 y xidos de nitrgeno al secar el precipitado calcinndolo a temperaturas elevadas. Al lavar el precipitado, debe efectuarse una prueba para determinar si el lavado ha sido completo. Esto suele hacerse probando el precipitado para ver si hay presente un ion del agente precipitante. Despus de varios lavados con pequeos volmenes de lquido, se recogen unas cuantas gotas de filtrado para efectuar la prueba.
SECADO Y CALCINACIN DE LOS PRECIPITADOS
Despus de la filtracin, el precipitado gravimtrico se calienta hasta que su masa se haga constante. El calentamiento elimina el disolvente y cualquier especie voltil arrastrada con el precipitado. Algunos precipitados tambin se calcinan para descomponer el slido y obtener un compuesto de composicin conocida, este nuevo compuesto se denomina con frecuencia forma de pesada. La temperatura necesaria para que se forme un producto adecuado vara segn el precipitado.
CLCULOS DE LOS RESULTADOS DEL ANLISIS GRAVIMTRICO
ING ARMANDO SALINAS SANCHEZ 60 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
En general, los resultados de un anlisis gravimtrico se calculan a partir de dos mediciones experimentales : 1. La masa de la muestra 2. La masa de un producto de composicin conocida que se forma a partir del analito Los clculos se realizan con ayuda de los pesos tomicos y molculares de las sustancias puras y la relacin estequiomtrica que guarda con el analito. El peso de un elemento o ion que se va a determinar se calcula a partir del peso del producto de composicin qumica conocida y con la ayuda de un factor gravimtrico. El factor gravimtrico, llamado tambin factor qumico o factor de conversin viene a ser la relacin entre el peso molecular de la sustancia que se desea determinar y el peso de la sustancia que se pes : Factor gravimtrico = peso tomico o molecular de la sustancia por determinar Peso molecular del precipitado Debe tenerse en cuenta que el mismo nmero de tomos del elemento clave debern estar presentes en el numerador del factor gravimtrico y en el denominador. Para calcular el resultado se emplea la siguiente relacin : % analito = Forma de pesada ( g ) x Factor gravimtrico X 100 % peso de muestra
APLICACIONES DE LOS MTODOS GRAVIMTRICOS
Los mtodos gravimtricos se han desarrollado para la mayor parte de aniones y cationes inorgnicos, as como para especies neutras como agua, dixido de carbono y yodo, tambin se puede determinar diversas sustancias orgnicas por este mtodo.
DETERMINACIONES GRAVIMETRICAS DE VARIOS ELEMENTOS
Elemento Potasio Calcio Aluminio Silicio Fsforo Azufre Cloro plata Zinc Escandio Titanio Vanadio Cromo Manganeso Hierro Cobalto Niquel precipitado KClO4 CaC2O4 Al2O3.xH2O SiO2.xH2O MgNH4PO4.6H2O BaSO4 AgCl AgCl ZnNH4PO4 Oxinato de escandio Cupferrato de titanio HgVO3 Cr2O3.XH2O MnO2 Fe2O3.xH2O CoS Dimetilglioximato de niquel Sustancia pesada KClO4 CaO Al2O3 SiO2 Mg2P2O7 BaSO4 AgCl AgCl Zn2P2O7 Oxinato de escandio TiO2 V2O5 Cr2O3 Mn2O3 Fe2O3 CoSO4 dimetilglioximato de niquel
ING ARMANDO SALINAS SANCHEZ 61 ________________________________________________________________________________________
ANLISIS QUMICO I INGENIERA BIOTECNOLOGICA
You might also like
- 116 402 1 PB PDFDocument7 pages116 402 1 PB PDFRosmery Cardenas HurtadoNo ratings yet
- Ecotoxicología y Seguridad AmbientalDocument14 pagesEcotoxicología y Seguridad AmbientalRosmery Cardenas HurtadoNo ratings yet
- Yemas PDFDocument116 pagesYemas PDFRosmery Cardenas HurtadoNo ratings yet
- Infome Animal 4Document9 pagesInfome Animal 4Rosmery Cardenas HurtadoNo ratings yet
- Infome Animal 5Document9 pagesInfome Animal 5Rosmery Cardenas HurtadoNo ratings yet
- Colorante Del Maiz Morado PDFDocument110 pagesColorante Del Maiz Morado PDFRosmery Cardenas HurtadoNo ratings yet
- V42n4a7 PDFDocument6 pagesV42n4a7 PDFKilian MeraNo ratings yet
- Infome Animal 1Document11 pagesInfome Animal 1Rosmery Cardenas HurtadoNo ratings yet
- Practica 2 USO de MicropipetasDocument12 pagesPractica 2 USO de MicropipetasRosmery Cardenas HurtadoNo ratings yet
- Examen de Unidad de Investigacion IngDocument2 pagesExamen de Unidad de Investigacion IngRosmery Cardenas HurtadoNo ratings yet
- Infome Animal 3Document9 pagesInfome Animal 3Rosmery Cardenas HurtadoNo ratings yet
- Ficha Aspergillus FumigatusDocument4 pagesFicha Aspergillus FumigatusRosmery Cardenas Hurtado0% (1)
- AserrinDocument2 pagesAserrinRosmery Cardenas HurtadoNo ratings yet
- Mejor InformeDocument34 pagesMejor InformeRosmery Cardenas HurtadoNo ratings yet
- LivrosDocument2 pagesLivrosRosmery Cardenas HurtadoNo ratings yet
- Español GeneDocument16 pagesEspañol GeneRosmery Cardenas HurtadoNo ratings yet
- Dirección EstratégicaDocument14 pagesDirección EstratégicaRosmery Cardenas Hurtado100% (1)
- Sistema Bloqueo para Produccion de Acido CitricoDocument2 pagesSistema Bloqueo para Produccion de Acido CitricoRosmery Cardenas HurtadoNo ratings yet
- Manual de Laboratorio de Análisis Químico I-2012 (Autoguardado)Document93 pagesManual de Laboratorio de Análisis Químico I-2012 (Autoguardado)Rosmery Cardenas Hurtado100% (1)
- Reporte 5 CorregidoDocument25 pagesReporte 5 CorregidoRosmery Cardenas HurtadoNo ratings yet
- 059 - Matematica FinancieraDocument22 pages059 - Matematica FinancieraBincer PalaciosNo ratings yet
- Bio Electromagnetism oDocument2 pagesBio Electromagnetism oRosmery Cardenas HurtadoNo ratings yet
- Practica #4 BV..Document11 pagesPractica #4 BV..Rosmery Cardenas HurtadoNo ratings yet
- Cruce de Mosca DrosophilaDocument9 pagesCruce de Mosca DrosophilaRosmery Cardenas HurtadoNo ratings yet
- Informe de Viaje A TarapotoDocument20 pagesInforme de Viaje A TarapotoRosmery Cardenas HurtadoNo ratings yet
- Practica N 8 EmbrionesDocument10 pagesPractica N 8 EmbrionesRosmery Cardenas HurtadoNo ratings yet
- Biquimica 2Document14 pagesBiquimica 2Rosmery Cardenas HurtadoNo ratings yet
- Termo - Práctica 2Document1 pageTermo - Práctica 2Rosmery Cardenas HurtadoNo ratings yet
- AdicionalDocument2 pagesAdicionalRosmery Cardenas HurtadoNo ratings yet
- 497907672.sintesis en Quimica InorganicaDocument4 pages497907672.sintesis en Quimica InorganicaLaura FajardoNo ratings yet
- Smibc Catalogo ReactivosDocument179 pagesSmibc Catalogo ReactivosMartín JiménezNo ratings yet
- Quimica Trabajo Numero 8Document16 pagesQuimica Trabajo Numero 8Yosselin Flores EscalanteNo ratings yet
- Propiedades físicoquímicas y termodinámicas del gas naturalDocument312 pagesPropiedades físicoquímicas y termodinámicas del gas naturalRicardo Canchano100% (1)
- Productos químicos para la industria de limpieza y cuidado personalDocument8 pagesProductos químicos para la industria de limpieza y cuidado personalOASIS productos de aseo100% (1)
- Problemas FlotacionDocument3 pagesProblemas FlotacionNESTOR100% (7)
- Test Cianuros: SpectroquantDocument1 pageTest Cianuros: SpectroquantAnonymous UbW05lJNo ratings yet
- Examen Nº4 GorosDocument11 pagesExamen Nº4 GorosCarlos Alvarez GarciaNo ratings yet
- Caso Práctico 7Document2 pagesCaso Práctico 7López López AntonioNo ratings yet
- Problemas Resueltos de La Lección 6Document31 pagesProblemas Resueltos de La Lección 6Ayde Rosario Alconz IngalaNo ratings yet
- Cobres Verde Negro (EXCEL)Document44 pagesCobres Verde Negro (EXCEL)Jorge Rios RNo ratings yet
- PROCEDIMIENTO Analisis de Oro 1Document27 pagesPROCEDIMIENTO Analisis de Oro 1Sergio AntonNo ratings yet
- Cuestionario Remedial Tercero Bgu - QuimicaDocument4 pagesCuestionario Remedial Tercero Bgu - QuimicaJose Tinoco A100% (1)
- Practica 7 y 8Document12 pagesPractica 7 y 8Efraín100% (1)
- Cuestionario de Lab 2 y 4Document2 pagesCuestionario de Lab 2 y 4Molina Callejas Hector OwenNo ratings yet
- Clasificacon de La Funcion Oxidos para Tercero de SecundariaDocument5 pagesClasificacon de La Funcion Oxidos para Tercero de SecundariaANTONIO MONCAYO MOLINANo ratings yet
- Lixiviación en Bateas Por Percolación A Escala de LaboratorioDocument2 pagesLixiviación en Bateas Por Percolación A Escala de Laboratorioarnaldo_ibarrolaNo ratings yet
- Angelica QuimicaDocument3 pagesAngelica QuimicaGerman Octavio Sanchez ReyesNo ratings yet
- Trabajo de Mineralogia Sobre La Enargita.Document8 pagesTrabajo de Mineralogia Sobre La Enargita.Victor RodriguezNo ratings yet
- Informe N7Document13 pagesInforme N7Soledad Mamani HinchoNo ratings yet
- Taninos PDFDocument12 pagesTaninos PDFMarco Antonio Cabana Meza0% (1)
- 001 Guia de Aprendizaje Quimica Grado 11Document16 pages001 Guia de Aprendizaje Quimica Grado 11Melissa Filizzola MerlanoNo ratings yet
- Determinacion de Alcalinidad en El Bicarbonato y Determinacion de Acides en El VinagreDocument5 pagesDeterminacion de Alcalinidad en El Bicarbonato y Determinacion de Acides en El VinagreMelissa A Romero0% (1)
- Recuperacion de PlataDocument4 pagesRecuperacion de PlataGiovannaAmayaSilvaNo ratings yet
- Trabajo QuimicaDocument13 pagesTrabajo QuimicaBRAYAN ANDRES PARDO MORANo ratings yet
- Composicion QuimicaDocument9 pagesComposicion QuimicaLisseth JessicaNo ratings yet
- Aminas y sus reaccionesDocument6 pagesAminas y sus reaccionesIván BriseñoNo ratings yet
- Glosario de Términos Relacionados Con Conductores EléctricosDocument2 pagesGlosario de Términos Relacionados Con Conductores EléctricosBertha PammelaNo ratings yet
- Manual de Ejercicios de Quimica GeneralDocument92 pagesManual de Ejercicios de Quimica Generalvicente urbinaNo ratings yet
- Lección 04 - Los GlúcidosDocument18 pagesLección 04 - Los GlúcidosPatrik SanchezNo ratings yet