Professional Documents
Culture Documents
Informe de Liquidos y Soluciones Quimica
Uploaded by
Juan Jose MFOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe de Liquidos y Soluciones Quimica
Uploaded by
Juan Jose MFCopyright:
Available Formats
INFORME DE LABORATORIO 5
LABORATORIO DE QUIMICA N5
CUETO MENDOZA, Josas Edison HUAYAS INGA, Rommel ngel Cod: 20124532I Cod: 20121084E
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
CONTENIDO
INTRODUCCIN................................................................................................................. 1 OBJETIVOS ........................................................................................................................ 3 INSTRUMENTOS Y MATERIALES ..................................................................................... 4 PROCEDIMIENTO .............................................................................................................. 8 EXPERIMENTO 3: DETERMINACION DE LA MASA MOLECULAR DE UNA SOLUCION NO VOLATIL ........................................................................ Error! Bookmark not defined. RESULTADOS OBTENIDOS ............................................................................................ 10 CONCLUSIONES .............................................................................................................. 13 RECOMENDACIONES ...................................................................................................... 13
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 1
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
INTRODUCCIN
Qu tienen en comn el vinagre, el zumo de naranja o el zumo de limn? Entre otras cosas, su sabor cido. En qumica, decimos que estas sustancias son cidos. Otras sustancias, con propiedades diferentes, se llaman bases. Ejemplos: leja, amoniaco, sosa... Pero, qu tienen en comn las sustancias cidas? Y las sustancias bsicas? No obstante, para saber si una sustancia es un cido o una base, no es necesario probarla (ten presente que algunas sustancias de las que se emplean habitualmente en un laboratorio son muy txicas). Escala de pH Para cuantificar el carcter cido o bsico de una sustancia empleamos la escala de pH, que es una escala de nmeros del 1 a 14.
Si el pH es menor que 7, la sustancia es cida. Ejemplo: disolucin de cloruro de hidrgeno (cido clorhdrico) en agua. Si el pH es mayor que 7, la sustancia es bsica. Ejemplo: disolucin de hidrxido de sodio (sosa) en agua. Si el pH es igual a 7, entonces la sustancia es neutra. Ejemplo: el agua. Esta escala de nmeros se asocia a una escala de colores. Estos colores son los que adopta el papel indicador en contacto con el cido o la base.
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 2
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
OBJETIVOS
Es de realizar un estudio de manera experimental las propiedades generales de los lquidos y algunas propiedades de las soluciones acuosas .
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 3
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
INSTRUMENTOS Y MATERIALES
Figura 1. Mechero de bunsen
Figura 2. Vaso precipitado
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 4
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
Figura 3. Bureta
Figura 4. Probeta
Figura 5. Pipeta
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 5
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
Figura 6. Piceta
Figura 7. Termmetro
Figura 8. Rejilla de asbesto
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 6
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
Figura 9 tubos de ensayo
Figura 10 Densmetro
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 7
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
PROCEDIMIENTO
EXPERIMENTO 1: DETERMINACION DEL PUNTO DE EBULLICION DEL ALCOHOL ETILICO Tomar un tubo de prueba limpio y enjuagarlo con 1 ml de alcohol etlico. Llenar el tubo con 2.5 ml de alcohol etlico. Introducir un capilar en el tubo que contiene el alcohol etlico con el extremo cerrado hacia arriba. Sujetar el tubo de prueba a un termmetro mediante una liga de jebe. Sujetar el termmetro con una cuerda. Sumergir todo el conjunto en un vaso precipitado. Calentar el vaso con un mechero de gas suavemente a travs de una rejilla de asbesto y agitando el agua con movimientos verticales de un agitador en forma de anillo Retire inmediatamente la llama en el momento que se note el desprendimiento de la primera burbuja en el tubo que contiene el alcohol Observe el desprendimiento de burbujas y la temperatura en el momento que sale la ltima burbuja en el tubo capilar
EXPERIMENTO 2: USO DEL INDICADOR ACIDO BASE
a) Con tubos separados y rotulados echar las siguientes sustancias: HCl,NH4Cl , NaHCO3 ,CH3COONa, Na2CO3 , NaOH b) En el papel indicador universal echar 1 gota de todas las sustancias y observar el pH de cada una de las soluciones
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 8
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
c) Agregar en cada tubo un agota de fenolftalena y observar el color. Finalmente echar una gota de anaranjado de metilo para las muestras no coloreadas por la fenolftalena y observar el color Cambio de pH 8.0 -9.8 3.1 -4.5 Cambio de color Incoloro grosella Rojo _naranja
fenolftalena anaranjado de metilo
EXPERIMENTO 3: DETERMINACION DE LA CONCENTRACCION DE UNA SOLUCION DE CLORURO DE SODIO
Colocar en un tubo de prueba 8 gramos de naftaleno y 2 gramos de la sustancia de masa molecular desconocida Fijar el tubo con una pinza Sumergir el tubo en un vaso Calentar el agua para que se funda el contenido ,introducir untermmetro y retirar rpidamente el tubo del agua
Agitar circularmente la masa fundida con el u termmetro y controlar la temperatura cuando se torne turbia anotar latemperatura Usar la tabla de constante molales del punto de congelacin y ebullicin , y calcular la masa molecular de la sustancia desconocida
EXPERIMENTO 4: DETERMINACION DE LA CON CENTRACION DE UNA SOLUCION DE CLORURO DE SODIO Vierta la solucin de cloruro de sodio al recipiente tubular , mida la temperatura e introducir el densmetro para la lectura correspondiente Usar la tabla para determinar la concentracin en % en peso Lavar el densimetro
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 9
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
RESULTADOS OBTENIDOS
EXPERIMENTO 1: DETERMINACION DEL PUNTO DE EBULLICION DEL ALCOHOL ETILICO Presin externa 752.95 mmHg Temperatura de ebullicin 22 Temperatura primera burbuja 34 Temperatura ultima burbuja 45
EXPERIMENTO 2: USO DEL INDICADOR ACIDO BASE
HCl
NH4Cl
NaHCO3 CH3COONa Na2CO3 rosado grosella rosado
NaOH
fenolftalena Incoloro Incoloro grosella anaranjado Rojo naranja de metilo
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 10
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
VALORES DEL INDICADOR DE PAPEL UNIVERSAL HCl NH4Cl NaHCO3 CH3COONa Na2CO3 NaOH 1 6 8 7 12 13
EXPERIMENTO 3: DETERMINACION DE LA CONCENTRACCION DE UNA SOLUCION DE CLORURO DE SODIO
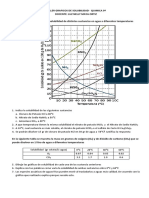
Temperatura 24 C Densidad 1015 %P NaCl 1 2 4 6 8 10 12 14 16 18 20 22 24 26 Densidad 20 4 1.0053 1.0125 1.0268 1.0413 1.0559 1.0707 1.0857 1.1008 1.1162 1.1319 1.1478 1.1640 1.1804 1.1972
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 11
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
El porcentaje se encuentra aproximadamente a 2
en peso
EXPERIMENTO 4: DETERMINACION DE LA CON CENTRACION DE UNA SOLUCION DE CLORURO DE SODIO
Tc =k * m=k * 2 gramos
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 12
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
CONCLUSIONES
La existencia de una influencia de la presin baromtrica en el punto de ebullicin de un liquido La fenolftalena sirve para identificar sustancias bsicas de color grosella Hay propiedades de las soluciones que de penden del numero de partculas de soluto ,tal como las descenso del punto de congelacin y aumento del punto de ebullicin de la solucin con respecto al solvente puro La relacin entre el descenso del punto de congelacin y la molalidad es
proporcionalmente directa en soluciones diluidas
RECOMENDACIONES
Verificar que uno e los extremos del tubo capilar este cerrado Cuidado de que el agitador no choque con el vaso o tubo de prueba En el tercer experimento cuan do la solucin torne turbia inmediatamente retire el termmetro para que no quede atrapado en la masa solida
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 13
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
IMAGENES DE LABORATORIO
Experimento 1:
El termmetro atado al tubo capilar EXPERIMENTO 2:
Despus de haber agregado la fenolftalena y el papel indicador universal
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 14
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
EXPERIMENTO 4:
El naftaleno
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 15
UNIVERSIDAD NACIONAL DE INGENIERA Facultad de Ingeniera Mecnica FIM
LABORATORIO N5 : LIQUIDOS Y SOLUCIONES
Pgina 16
You might also like
- Química Orgánica Manual de LaboratorioDocument86 pagesQuímica Orgánica Manual de LaboratorioMaria78% (9)
- Proyecto Completo de CarreterasDocument97 pagesProyecto Completo de Carreterasrodolfo201282% (38)
- CÁLCULO DE NPT EN NEONATOS (Carmen Curso Safe)Document6 pagesCÁLCULO DE NPT EN NEONATOS (Carmen Curso Safe)Everardo René Ruiz Nieto100% (5)
- Informe de Quimica Liquidos y SolucionesDocument12 pagesInforme de Quimica Liquidos y SolucionesJorge AnglasNo ratings yet
- Informe de Quimica Laboratorio 6Document21 pagesInforme de Quimica Laboratorio 6Angel Rodrigo Condori Ccahuana75% (4)
- Conductividad Eléctrica y solubilidad-GRUPO 01Document5 pagesConductividad Eléctrica y solubilidad-GRUPO 01ISMAEL ALFONZO GUTIERREZ LLAPAPASCANo ratings yet
- Cómo usar el mechero Bunsen de forma seguraDocument17 pagesCómo usar el mechero Bunsen de forma seguraEnrique DonayreNo ratings yet
- Identificacion GlucidosDocument3 pagesIdentificacion Glucidoscapi8081100% (2)
- Solubilidad sustancias agua temperaturaDocument1 pageSolubilidad sustancias agua temperaturaLuz Nelly Maya OrtizNo ratings yet
- Laboratorio de Quimica 1Document12 pagesLaboratorio de Quimica 1Danfer GonzalesNo ratings yet
- Reacciones químicas orgánicas en laboratorio de químicaDocument6 pagesReacciones químicas orgánicas en laboratorio de químicaDAYANARA DENNISE NAVARRO PALOMINONo ratings yet
- Aldehídos y CetonasDocument21 pagesAldehídos y CetonasIvette Pebes Cabrera50% (2)
- Agentes DesecantesDocument44 pagesAgentes DesecantesRossy Moral100% (1)
- Laboratorio Semana 5 QuimOrg NicaDocument11 pagesLaboratorio Semana 5 QuimOrg NicaMi KelNo ratings yet
- 3 - Calibracion de Una BuretaDocument3 pages3 - Calibracion de Una BuretaGAR BRSNo ratings yet
- En El Método REDOXDocument11 pagesEn El Método REDOXRocio LópezNo ratings yet
- Curva de SolubilidadDocument4 pagesCurva de SolubilidadJD BenavidesNo ratings yet
- MONOGRAFIA MasaDocument35 pagesMONOGRAFIA MasaAnthony AlvarezNo ratings yet
- Trig IntegralesDocument23 pagesTrig Integralesconejo8119No ratings yet
- PROBLEM SELECC Clase de MaribelDocument4 pagesPROBLEM SELECC Clase de MaribelgloriaNo ratings yet
- Funciones Químicas Inorgánicas (MONOGRAFÍA)Document14 pagesFunciones Químicas Inorgánicas (MONOGRAFÍA)hans ventura rengifoNo ratings yet
- Taller 1 - EJERCICIOS RESUELTOSDocument11 pagesTaller 1 - EJERCICIOS RESUELTOSPIERO ALESSANDRO ALFEREZ ABARCANo ratings yet
- Padilla Azaña QuimicaDocument8 pagesPadilla Azaña QuimicaYosman Padilla azaña100% (1)
- AlquenosDocument8 pagesAlquenosJhean Pierre FuentesNo ratings yet
- Determinacion de Acidez FinalDocument9 pagesDeterminacion de Acidez FinalKristian Nn'ga JulcaNo ratings yet
- Universidad Nacional Del CallaoDocument12 pagesUniversidad Nacional Del Callaobeatriz tito chaconNo ratings yet
- Reacciones QuimicasDocument11 pagesReacciones QuimicassidergioNo ratings yet
- Informe Laboratorio QuímicaDocument9 pagesInforme Laboratorio Químicajesu100% (1)
- Informe Reacciones de Óxido Reducción RedoxDocument7 pagesInforme Reacciones de Óxido Reducción RedoxHeiman Ochoa67% (3)
- Determinación de Hipoclorito de Sodio en Una Muestra de BlanqueadorDocument4 pagesDeterminación de Hipoclorito de Sodio en Una Muestra de BlanqueadorKener GuzmanNo ratings yet
- Informe N°4Document27 pagesInforme N°4JACKELIN ROSARIO PAUCAR POMAHUALINo ratings yet
- Reciclaje aluminio 40Document5 pagesReciclaje aluminio 40Waldir AltamiranoNo ratings yet
- Identificación Grupos FuncionalesDocument10 pagesIdentificación Grupos FuncionalespipeponciomonNo ratings yet
- Informe de Tabla PeriodicaDocument11 pagesInforme de Tabla PeriodicaLuis Yupanqui100% (1)
- Cuarto Taller de OrganicaDocument8 pagesCuarto Taller de OrganicaJeniffer Katerine Carrillo GomezNo ratings yet
- OBTENCIÓN DEL CROMO Articulo TecDocument2 pagesOBTENCIÓN DEL CROMO Articulo TecGonzalo ZambranoNo ratings yet
- Medidas del pH de ácidos, bases y salesDocument4 pagesMedidas del pH de ácidos, bases y salesValentina Sanín RestrepoNo ratings yet
- Funciones NitrogenadasDocument22 pagesFunciones NitrogenadasadrianaflorezgNo ratings yet
- Ramas de La QuimicaDocument3 pagesRamas de La QuimicaJose Aldemar Guerrero Paredes100% (1)
- El BarioDocument4 pagesEl BariodianaNo ratings yet
- Informe 1 PolimerosDocument21 pagesInforme 1 PolimerosAnton ValveNo ratings yet
- Ejemplos de DCLDocument7 pagesEjemplos de DCLEdwin PérezNo ratings yet
- Hidrofilas y SolubilidadDocument3 pagesHidrofilas y Solubilidademilio1917No ratings yet
- Laboratorio 01 Ley de CoulombDocument18 pagesLaboratorio 01 Ley de Coulombjorge severinoNo ratings yet
- Mechero de Bunsen Quimica Organica UnacDocument16 pagesMechero de Bunsen Quimica Organica UnacGiaco TRNo ratings yet
- Segundo Principio de La TermodinámicaDocument28 pagesSegundo Principio de La TermodinámicaPorras PaúlNo ratings yet
- Soluciones químicasDocument2 pagesSoluciones químicasAlbertMartinez0% (1)
- Ejercicios ResueltosDocument14 pagesEjercicios ResueltosSteward Flores100% (1)
- Alfred WernerDocument4 pagesAlfred WernerraquelbcoNo ratings yet
- Alótropos Del CarbonoDocument8 pagesAlótropos Del CarbonoGianella Zoraya Torres AscurraNo ratings yet
- Reacciones Redox en La Vida DiariaDocument4 pagesReacciones Redox en La Vida DiariaViviana CalderónNo ratings yet
- Informe Ácidos, Bases y SalesDocument8 pagesInforme Ácidos, Bases y SalesJeffersonCárdenasNo ratings yet
- Ejercicios QuimicaDocument26 pagesEjercicios QuimicaMauro Fernando Hoyos Moya0% (1)
- Guia Ejercicios Estructura AtomicaDocument3 pagesGuia Ejercicios Estructura AtomicaLiesther DiazNo ratings yet
- Determinación de Acidez en El Vinagre y en El VinoDocument21 pagesDeterminación de Acidez en El Vinagre y en El VinoDeyson amayaNo ratings yet
- INFORME SUSTANCIAS POLARES Y NO POLARES (Listo)Document6 pagesINFORME SUSTANCIAS POLARES Y NO POLARES (Listo)9615120No ratings yet
- Propiedades Físicas y Químicas de Los Ácidos CarboxílicosDocument11 pagesPropiedades Físicas y Químicas de Los Ácidos CarboxílicosFernanda Mateus100% (1)
- Quimica MonografiaDocument24 pagesQuimica MonografiaRuth Zaida Morales QuispeNo ratings yet
- Informe Final de Quimica General LAB 5Document15 pagesInforme Final de Quimica General LAB 5Lucho Payano0% (1)
- Manual Prácticas de Laboratorio Quimica OrganicaDocument35 pagesManual Prácticas de Laboratorio Quimica OrganicaHéctor Azcaray RiveraNo ratings yet
- SEGUNDO INFORME-Velocida de ReaccionDocument13 pagesSEGUNDO INFORME-Velocida de ReaccionAnonymous kujsL7vpNo ratings yet
- Estequiometría de la reacción entre BaCl2 y Na2SO4Document10 pagesEstequiometría de la reacción entre BaCl2 y Na2SO4Justo Manuel Fernández De LeónNo ratings yet
- 9 EstequiometriaDocument4 pages9 EstequiometriaAngie SanchezNo ratings yet
- Valvuls PDFDocument12 pagesValvuls PDFJuan Jose MFNo ratings yet
- Inteligencia Emocional en La EmpresaDocument47 pagesInteligencia Emocional en La EmpresaJuan Jose MF100% (1)
- T0000904 PDFDocument589 pagesT0000904 PDFpeterboadaNo ratings yet
- Practicantes Cajamarquilla 2021Document12 pagesPracticantes Cajamarquilla 2021Juan Jose MFNo ratings yet
- Calidad de SoldadurasDocument54 pagesCalidad de SoldadurasOrueta ClaudioNo ratings yet
- S13.s1 - Gestion Electronica Diesel PDFDocument6 pagesS13.s1 - Gestion Electronica Diesel PDFJuan Jose MFNo ratings yet
- Editorial LPB - Ingles PDFDocument1 pageEditorial LPB - Ingles PDFMARIA KAROLAY TAMAYO HILARIONo ratings yet
- Temario PDFDocument1 pageTemario PDFJuan Jose MFNo ratings yet
- Bomba sumergible drenaje hasta 408m3/hDocument6 pagesBomba sumergible drenaje hasta 408m3/hJuan Jose MFNo ratings yet
- PC02 - Mci PDFDocument3 pagesPC02 - Mci PDFKennedy Vargas MarceloNo ratings yet
- Brochure 38 PDFDocument5 pagesBrochure 38 PDFJuan Jose MFNo ratings yet
- Galvanizado de Tubos de Acero Al Carbono PDFDocument11 pagesGalvanizado de Tubos de Acero Al Carbono PDFJuan Jose MFNo ratings yet
- Brochure 64 PDFDocument13 pagesBrochure 64 PDFJuan Jose MFNo ratings yet
- Cisco WebexDocument7 pagesCisco WebexLEONARDO BRYAN PONCE GARCIANo ratings yet
- Tramte Virtual Orce PDFDocument3 pagesTramte Virtual Orce PDFAnthony RojasNo ratings yet
- Módulo 1Document95 pagesMódulo 1JavierNo ratings yet
- Diseño Hidraulico de Una RapidaDocument66 pagesDiseño Hidraulico de Una Rapidaadolfo377100% (1)
- MC654 - Ingenieria de MantenimientoDocument6 pagesMC654 - Ingenieria de MantenimientoJuan Jose MFNo ratings yet
- Presentacion Monografia 1, Metodologia de La InvestigacionDocument10 pagesPresentacion Monografia 1, Metodologia de La InvestigacionJuan Jose MFNo ratings yet
- 3 MaterialesDocument275 pages3 MaterialesJuan Jose MFNo ratings yet
- Tablas de Tuberías de ConcretoDocument22 pagesTablas de Tuberías de ConcretoJuan Jose MFNo ratings yet
- Tabla Metodo GraficoDocument13 pagesTabla Metodo GraficoJuan Jose MFNo ratings yet
- Cap05 Mantenimiento CorrectivoDocument9 pagesCap05 Mantenimiento CorrectivoJuan Jose MFNo ratings yet
- Cap03 Ciclo de Vida de Los Activos FísicosDocument18 pagesCap03 Ciclo de Vida de Los Activos FísicosJuan Jose MFNo ratings yet
- Cap04 Sistema Informativo Del MantenimientoDocument8 pagesCap04 Sistema Informativo Del MantenimientoJuan Jose MFNo ratings yet
- Cap02 Tipos de MantenimientoDocument9 pagesCap02 Tipos de MantenimientoJuan Jose MFNo ratings yet
- Cap06 Mantenimiento PredictivoDocument19 pagesCap06 Mantenimiento PredictivoJuan Jose MFNo ratings yet
- Cap10 Sistemas de Gestion para Mejorar El MantenimientoDocument10 pagesCap10 Sistemas de Gestion para Mejorar El MantenimientoJuan Jose MFNo ratings yet
- Cap01 Introducion A Ing MantenimientoDocument7 pagesCap01 Introducion A Ing MantenimientoJuan Jose MFNo ratings yet
- Reconocimiento de Carbono, Hidrógeno y NitrógenoDocument4 pagesReconocimiento de Carbono, Hidrógeno y NitrógenoMaikoll brayanNo ratings yet
- 2 - Informe Sobre La Influencia Que Tienen Los Lubricantes Minerales y Sintéticos en La Vida Útil de Los Cargadores Frontales de Impala TerminalsDocument9 pages2 - Informe Sobre La Influencia Que Tienen Los Lubricantes Minerales y Sintéticos en La Vida Útil de Los Cargadores Frontales de Impala TerminalsRhonald Andrés Ortega GutiérrezNo ratings yet
- Reacciones Redox 2021BDocument2 pagesReacciones Redox 2021BSandra CbNo ratings yet
- Movilización, Beta Oxidación y Cetogénesis - 4.0 Con AudioDocument21 pagesMovilización, Beta Oxidación y Cetogénesis - 4.0 Con AudioPamela VillalobosNo ratings yet
- Clasificacion de ProductosDocument5 pagesClasificacion de ProductostaniaNo ratings yet
- KMKPDocument17 pagesKMKPMiguel Murga MirandaNo ratings yet
- Solubilidad y MiscibilidadDocument11 pagesSolubilidad y MiscibilidadGW casasNo ratings yet
- Compuestos CíclicosDocument9 pagesCompuestos CíclicosGeometria Chimbotano Manuel LunaNo ratings yet
- Sustitución aromática y nitración anilinaDocument6 pagesSustitución aromática y nitración anilinaSacha OrdazNo ratings yet
- Oro 1Document19 pagesOro 1Paul Acosta MamaniNo ratings yet
- Clasificacion Estructural de Los SilicatosDocument18 pagesClasificacion Estructural de Los SilicatosGonzalo Guzman MartinezNo ratings yet
- A10 McCabe Viscosidad en Líquidos (Nomográma)Document2 pagesA10 McCabe Viscosidad en Líquidos (Nomográma)PRizila Gomez RodriguezNo ratings yet
- 2 - INTRODUCCIÓN A La Química OrgánicaDocument25 pages2 - INTRODUCCIÓN A La Química OrgánicaDonIncognitoNo ratings yet
- Los fosfatos: esenciales en la vidaDocument5 pagesLos fosfatos: esenciales en la vidaMauricio Restrepo SierraNo ratings yet
- Taller 2 - Balance de Materia - DisolucionesDocument1 pageTaller 2 - Balance de Materia - DisolucionesAndrea Paola100% (1)
- Nomenclatura químicaDocument2 pagesNomenclatura químicayauli sanchezNo ratings yet
- Diapositivas RedoxDocument10 pagesDiapositivas RedoxALEX DANTE MENDOZA JARANo ratings yet
- Lab. de CuevasDocument9 pagesLab. de CuevasChoque FrancoNo ratings yet
- Rocas Calcareas PDFDocument5 pagesRocas Calcareas PDFGuido PintoNo ratings yet
- Halogenuros de Alquilo para PrintDocument39 pagesHalogenuros de Alquilo para PrintLibelula SonitaNo ratings yet
- Marcha Fitoquimica Preliminar PreliminarDocument4 pagesMarcha Fitoquimica Preliminar PreliminarMayra RengifoNo ratings yet
- Sem 6 Q.O. CromatografiaDocument25 pagesSem 6 Q.O. CromatografiaSusan NicoleNo ratings yet
- Métodos de Obtencíon de EstresDocument10 pagesMétodos de Obtencíon de EstresLuis Adiel Cote ValdésNo ratings yet
- Reacciones de Precipitación Lab 6 AimedDocument13 pagesReacciones de Precipitación Lab 6 AimedAmelia WebsterNo ratings yet
- FormulacionDocument8 pagesFormulacionAntonio LopezhillNo ratings yet
- Isomil 2 IQ Plus ImmunifyDocument1 pageIsomil 2 IQ Plus ImmunifyAylin Monserrat ChinoNo ratings yet
- Examen Química Orgánica Básica CON RESPUESTASDocument4 pagesExamen Química Orgánica Básica CON RESPUESTASGarcia Mora Marlene MonserratNo ratings yet
- Preguntas Quimica - 25añosDocument9 pagesPreguntas Quimica - 25añosCarla TraficanteNo ratings yet