Professional Documents
Culture Documents
Diels Alder
Uploaded by
Laura GuidoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Diels Alder
Uploaded by
Laura GuidoCopyright:
Available Formats
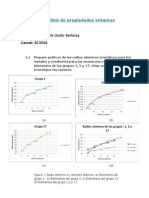
Sntesis de Anhdrido endo-norborneno-5,6-dicarboxlico Laura Guido Barboza B23066 Laboratorio de Qumica Orgnica II, QU-255, Profesor: Diego Ulate
Asistente: Felipe Orozco, Grupo: 05, Escuela de Qumica, Universidad de Costa Rica, 10/09/13 Introduccin: Algunas molculas presentan enlaces dobles, estas tienen caractersticas segn la distribucin de dichos enlaces, vindose afectada as su reactividad; los dobles enlaces pueden interactuar entre s si estn separados por un solo enlace, se dice que tales enlaces dobles que interactan son conjugados. Los dobles enlaces separados por dos o ms enlaces tienen poca interaccin y se les llama enlaces dobles aislados. Debido a la interaccin entre los enlaces dobles, los sistemas que contienen enlaces dobles conjugados tienden a ser ms estables que los sistemas similares con enlaces dobles aislados. (Smith & Cristol, 1979). La diferencia entre los dienos conjugados y los no conjugados es que los dienos conjugados experimentan una reaccin de adicin con alquenos para formar productos sustituidos de ciclohexeno, este proceso se llama reaccin de cicloadicin de Diels-Alder. Es bastante til en la sntesis orgnica debido a que forma enlaces C-C en una sola etapa y es uno de los pocos mtodos generales disponibles para la produccin de molculas cclicas. El mecanismo de la cicloadicin de Diels-Alder no es polar ni radical, en lugar de eso, la reaccin es un proceso pericclico. Las reacciones pericclicas, suceden en un solo paso por una redistribucin cclica de sus electrones de enlace. Las reacciones de Diels-Alder cumplen con algunas caractersticas para que se lleven a cabo, son: el dieno debe de tener conformacin s-cis, la cicloadicin tienen estereoqumica sin con respecto al dieno y al dienfilo (alqueno), estereoselectividad endo y regioselectividad 1,2 y 1,4. En la figura 1 se puede observar la reaccin que se da para que se forme el Anhdrido endo-norborneno-5,6-dicarboxlico, en el cual se forma el producto endo, que tambin se le puede llamar cintico, ya que depende de la velocidad de su formacin.
Figura 1: Reaccin de Diels-Alder en la formacin de Anhdrido endo-norborneno-5,6-dicarboxlico
Resultados y observaciones: Cuadro I. Cantidad de reactivo utilizado Reactivo Ciclopentadieno Acetato de etilo Hexano Anhdrido maleico
Cantidad 0,7 mL 2,5mL 7mL 0,6938g
Cuadro III. Datos de rendimiento Gramos experimentales 0,744
Gramos tericos 1,16
Porcentaje de rendimiento (%) 64
Cuadro IV. Punto de fusin experimental y reportado de la literatura del Anhdrido endonorborneno-5,6-dicarboxlico Punto de fusin experimental (oC) 147-150 Punto de fusin reportado (oC) 165-167
Figura 2: Espectro infrarrojo de Anhdrido endo-norborneno-5,6-dicarboxlico
Discusin: Los dienos conjugados son molculas con dobles enlaces adyacentes; caracterizados por ser ms estables que los no conjugados debido a la posibilidad de solapamiento (figura 3) entre los orbitales p de los dobles enlaces vecinos.
Figura 3: Solapamiento de los orbitales p del butadieno. La reaccin de adicin que sufren los dienos conjugados con ciertos alquenos y alquinos es llamada Reaccin de Diels-Alder. A cada una de las especies involucradas en la Reaccin de DielsAlder se les denomina como: Dieno (dieno conjugado), dienfilo (alqueno) y aducto (producto de reaccin) (Davis & Whitten, 2008) , en la figura 4 se muestra la reaccin de Diels-Alder se lleva a cabo entre un dieno conjugado (un sistema de 4 electrones ) y un compuesto con un doble enlace (un sistema con 2 electrones ). En esta reaccin se forman dos nuevos enlaces a expensas de los dos enlaces del dieno y del dienfilo. En esta reaccin de cicloadicin [4 + 2], el producto es un ciclo (anillo). Los enlaces son ms fuertes que los enlaces , lo que energticamente favorece la formacin del aducto de DielsAlder.
Figura 4: Dieno, dienfilo y aducto, respectivamente. En el laboratorio se llev a cabo la sntesis del anhdrido endo-norborneno-5,6-dicarboxlico a partir de ciclopentadieno como dieno y anhdrido maleico como dienfilo(Figura 1), esto es una reaccin de Diels-Aldre (Davis & Whitten, 2008). Algunas reacciones de Diels-Alder son reversibles, a estas reacciones se les llama retro reacciones de Diels-Alder. Como se observa en la figura 5, la reaccin de diciclopentadieno a ciclopentadieno es una reaccin del tipo retro Diels-Alder si se hace reaccionar en un medio 3
adecuado. En el laboratorio se separ el monmero del dmero llevando a cabo una destilacin fraccionada, ya que el calor produce la reversin de la reaccin de Diels-Alder, puesto que el calor hace que los electrones se exciten y vuelvan a cambiar a su estado inicial. El punto de ebullicin del ciclopentadieno es de 42 oC (Ficha de seguridad, 2008) y el del diciclopentadieno es de 166 oC (Ficha de seguridad, 2006), por lo cual va a destilar primero el monmero. El monmero se debi de recolectar en un baln colocado en un bao fro para evitar que se dimerizara en diciclopentadieno de nuevo, ya que cualquier calentamiento (hasta temperatura ambiente) puede generar la reaccin de dimerizacin del ciclopentadieno por su gran reactividad.
Figura 5: Reaccin de ciclopentandieno a diciclopentadieno Los orbtales p del dieno y del dienfilo se superponen antes de que pueda ocurrir la reaccin, lo que requiere que el dieno adopte la conformacin s-cis. El mecanismo propuesto y aceptado, en base a los resultados cinticos y estereoqumicos, implica la formacin y rompimiento simultneos de enlaces en el estado de transicin; es decir, un proceso concertado. (Wade, 2011). En la figura 6 se muestra que la cicloadicin es una reaccin de un solo paso en donde los electrones se mueven formando nuevos enlace. La reaccin Diels-Alder se favorece por la presencia en el dienfilo de grupos atractores de electrones y por grupos en el dieno dadores de electrones. Los otros enlaces carbono-carbono del dieno, en este caso el ciclopentadieno, tienen el papel de dadores de electrones, esta molcula presenta gran densidad electrnica y por lo tanto es una molcula muy reactiva. Por otra parte, est el alqueno, el anhdrido maleico posee dos grupos que atraen la densidad electrnica en la molcula, dejando as el doble enlace pobre en densidad electrnica, perfecto para aceptar los electrones del dieno y formar nuevos enlaces. (Sauer & Sustmann, 2003).
Figura 6: Mecanismo de reaccin de Anhdrido endo-norborneno-5,6-dicarboxlico
El mecanismo de esta reaccin se inicia con el solapamiento de los orbitales moleculares frontera del dieno y del dienfilo. Como el dienfilo presenta un doble enlace unido a un grupo electrn-atrayente juega el papel de electrfilo de la reaccin y por tanto es su orbital vaco de menor energa (el LUMO) el que participa en el proceso. La reaccin de Diels-Alder es una adicin sin tanto con respecto al dieno como al dienfilo. El dienfilo se agrega a una cara del dieno y el dieno se agrega a una cara del dienfilo. En el estado de transicin no hay oportunidad para que los sustituyentes cambien su posicin estereoqumica durante el transcurso de la reaccin. Los sustituyentes que estn en el mismo lado en el dieno, o en el dienfilo, se encontrarn en el mismo lado (cis) en el anillo ciclohexnico. Esto se observa en la reaccin realizada en el laboratorio ya que la conformacin cis se puede observar en el aducto formado (figura 7). Cuando un dieno reacciona con un dienfilo se pueden formar dos productos Diels-Alder isomricos denominados aducto endo y aducto exo. Cuando el grupo electrn-atrayente del dienfilo se encuentra prximo al nuevo enlace doble formado, el compuesto se denomina producto endo. Cuando el grupo electrn-atrayente del dienfilo se encuentra lejos del nuevo enlace doble formado el compuesto se denomina producto exo. (Danishefsky & Kitahara, 1974) Al obtener el producto de la reaccin de Diels-Alder entre el ciclopentadieno y el anhdro maleico, se obtuvo un producto al el cual se le realiz una caracterizacin y se obtuvo tenemos este espectro de infrarrojo(Figura 2). En la banda de 1700-1800 cm-1 se observa una seal, la cual es caracterstica de la vibracin del grupo carbonilo, en la seal entre 1300-1400 cm-1 corresponde a tensiones CO-O-CO en el compuesto, una seal similar se observa cerca de 1000 cm-1, entre 2800-3000 cm-1 se observa la seal del C-H de carbono terciario. Las seales pequeas entre 2300-2100 cm-1 indican la presencia de un compuesto aromtico y la seal alrededor de 3400 cm-1 se puede deber a la presencia de contaminantes tales como agua en la muestra. Conclusiones: Se observo que a temperatura ambiente en una reaccin de Diels-Alder se va a obtener el producto endo, que el Anhidro Maleico tiene que estar completamente Anhidro para que la reaccin se lleve a cabo correctamente, que la reaccin de Diels-Alder puede ser reversible. Bibliografa 1. Aldabe, S., Bonazzola, C., Aramenda, P., & Lacreu, L. (2004). Qumica 2. Qimica en Accin. Espaa: Colihue. 2. Arias, F. (2006). Qumica Orgnica. Costa Rica: Universidad Estatal a Distancia. 3. Danishefsky, S., & Kitahara, T. (1974). Useful diene for the Diels-Alder reaction. J. Am. Chem. Soc. , 25, 78077808. 5
4. Davis, R., & Whitten, K. (2008). Qumica (8 ed.). Mxico: Cengage Learning Editores. 5. Ficha de seguridad. (2006). Diciclopentadieno. MSDS ICSC: 0873.Fichas Internacionales de Seguridad Qumica . Espaa. 6. Ficha de seguridad. (2008). MSDS ICSC: 0857. Fichas Internacionales de Seguridad Qumica . Espaa. 7. Gerald C, S., & Green, B. (1969). Products and kinetics of photoreduction of acetophenone by amines and alcohols. J. Am. Chem. Soc. , 68246829. 8. Sauer, J., & Sustmann, R. (2003). Mechanistic Aspects of Diels-Alder Reactions: A Critical Survey. Angewandte Chemie International Edition , 19, 779-807. 9. Smith, L., & Cristol, S. (1979). Qumica Orgnica. Mxico: Editorial Revert. 10. Stein, N. (1969). Kinetics of photoreduction of aromatic ketones by primary, secondary, and tertiary. J. Am. Chem. Soc. , 36903691. 11. Wade, L. (2011). Qumica Orgnica. (Stima ed., Vol. I). Mxico: Pearson Educacin.
You might also like
- Ejercicios Resueltos Bonos y Obligaciones 2Document12 pagesEjercicios Resueltos Bonos y Obligaciones 2percy100% (3)
- Enlace Quimico (TEST) PDFDocument6 pagesEnlace Quimico (TEST) PDFEloy MedinaNo ratings yet
- Prac 3 Diels AlderDocument10 pagesPrac 3 Diels AlderRochelleMorenoNo ratings yet
- Reacciones de Derivados de Ácidos CarboxílicosDocument8 pagesReacciones de Derivados de Ácidos CarboxílicosErnesto ZavalaNo ratings yet
- Trabajo Covalente OrganometalicosDocument3 pagesTrabajo Covalente OrganometalicosJimmyMartinezNo ratings yet
- Nitracion Del Acido SalicilicoDocument7 pagesNitracion Del Acido SalicilicoSebastianQuirogaNo ratings yet
- Repaso General ParcialDocument174 pagesRepaso General ParcialMiguel Reyes100% (1)
- Estudio Experimental de La Síntesis Orgánica Por Reordenamiento de Benzopinacol A BenzopinacolonaDocument6 pagesEstudio Experimental de La Síntesis Orgánica Por Reordenamiento de Benzopinacol A BenzopinacolonaDavidNo ratings yet
- IR BenzopinacolDocument1 pageIR BenzopinacolLaura GuidoNo ratings yet
- Previo CiclofosfacenosDocument17 pagesPrevio CiclofosfacenosEmiliano LopezNo ratings yet
- Síntesis de TrifenilmetanolDocument7 pagesSíntesis de TrifenilmetanolLaura Guido100% (1)
- Pruebas Generales y Deshidratación de Alcoholes, Fenoles y ÉteresDocument6 pagesPruebas Generales y Deshidratación de Alcoholes, Fenoles y ÉteresJuana Peralta RodgersNo ratings yet
- Informe 9 Compuestos de Coordinación Labo Inorganica Uni FiqtDocument10 pagesInforme 9 Compuestos de Coordinación Labo Inorganica Uni FiqtAdorian FārNo ratings yet
- Reporte Vanadio 20210111Document9 pagesReporte Vanadio 20210111Erick Amador SolìsNo ratings yet
- Lab.4 OrgDocument8 pagesLab.4 OrgElvis RenzoNo ratings yet
- Preinforme Practica Isomeros Nitro y NitritoDocument5 pagesPreinforme Practica Isomeros Nitro y Nitritoferney romerocaperaNo ratings yet
- Práctica 08 - OxigenoDocument3 pagesPráctica 08 - OxigenoJ S.TNo ratings yet
- REVISADO - Reporte Vainillina.Document12 pagesREVISADO - Reporte Vainillina.Ale MontoyaNo ratings yet
- TetrazolesDocument6 pagesTetrazolesAlan CabreraNo ratings yet
- BoranosDocument17 pagesBoranosUriel VázquezNo ratings yet
- Previo 1 Covalente Explosivos y Reacciones ViolentasDocument5 pagesPrevio 1 Covalente Explosivos y Reacciones ViolentasEsther G Islas MNo ratings yet
- Laboratorio de Química Analítica IDocument8 pagesLaboratorio de Química Analítica ISara VenturaNo ratings yet
- PRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Document11 pagesPRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Oscar UrielNo ratings yet
- Informe 6 COMPLEJOS DE COBRE Carol y Paola PDFDocument15 pagesInforme 6 COMPLEJOS DE COBRE Carol y Paola PDFcarolm1p100% (1)
- Efecto Quelato en La Estabilidad de ComplejosDocument8 pagesEfecto Quelato en La Estabilidad de Complejoscamiloca1No ratings yet
- Explosivos Practica 1 QCODocument4 pagesExplosivos Practica 1 QCOEdwin DavidNo ratings yet
- PREINFORME PRÁCTICA N 6 FinalDocument7 pagesPREINFORME PRÁCTICA N 6 FinalDiego Fernando TorresNo ratings yet
- Preparacion de Un Coloide - Propiedades Clásicas.Document7 pagesPreparacion de Un Coloide - Propiedades Clásicas.omariluapNo ratings yet
- Sintesis y Analisis de Una Sal de Mohr Lu y PDRDocument10 pagesSintesis y Analisis de Una Sal de Mohr Lu y PDRAngelo MolinaNo ratings yet
- InorganicaDocument17 pagesInorganicaRicardo A RoweNo ratings yet
- Síntesis e isómeros geométricos de compuestos de CoordinaciónDocument6 pagesSíntesis e isómeros geométricos de compuestos de CoordinaciónsandraNo ratings yet
- Práctica 5 Heterrociclos InorganicosDocument3 pagesPráctica 5 Heterrociclos InorganicosVani UchiromiyaNo ratings yet
- Cuestionario Previo de Práctica 4Document3 pagesCuestionario Previo de Práctica 4Teresa EscobedoNo ratings yet
- Informe 7 Preparación de 3-CarbetoxicumarinaDocument11 pagesInforme 7 Preparación de 3-CarbetoxicumarinaDani SantoyoNo ratings yet
- Practica 6 Tris Dialquilditiocarbamatos de Bismuto IIIDocument11 pagesPractica 6 Tris Dialquilditiocarbamatos de Bismuto IIIBrandon CarrilloNo ratings yet
- Teoría Ácidos y Bases Blandos y DurosDocument2 pagesTeoría Ácidos y Bases Blandos y Durosfama_20No ratings yet
- INFORME 6. UV-VisDocument8 pagesINFORME 6. UV-VisDany PandaNo ratings yet
- Ácido Cinámico FINALDocument8 pagesÁcido Cinámico FINALAndres Felipe Vargas GaviriaNo ratings yet
- Preparación de Etil Tritil Éter (F) R. Abonia Sin Comentarios PDFDocument4 pagesPreparación de Etil Tritil Éter (F) R. Abonia Sin Comentarios PDFjffm77No ratings yet
- Benzo Pina Colon ADocument2 pagesBenzo Pina Colon AAdrian MoraNo ratings yet
- ReporteDocument3 pagesReporteOscar UrielNo ratings yet
- Informe BenzalacetonaDocument14 pagesInforme BenzalacetonaCristian DiazNo ratings yet
- Sintesis de 2 4 DinitrofenilhidrazinaDocument2 pagesSintesis de 2 4 DinitrofenilhidrazinaLuis Angel Perez GonzalezNo ratings yet
- Síntesis y Análisis de Un Compuesto de Oxalato de AluminioDocument5 pagesSíntesis y Análisis de Un Compuesto de Oxalato de AluminioJulian Arango100% (2)
- Coordinacion Reporte 1-3Document4 pagesCoordinacion Reporte 1-3Javier PerezNo ratings yet
- Obtención de Ácido Fenoxiacético Por Medio de Una SN2Document11 pagesObtención de Ácido Fenoxiacético Por Medio de Una SN2nashniNo ratings yet
- Examen Preliminar P - CLOROANILINADocument4 pagesExamen Preliminar P - CLOROANILINAAlejandra ZeaNo ratings yet
- Determinación de la concentración de ácido acético en vinagre blancoDocument22 pagesDeterminación de la concentración de ácido acético en vinagre blancoUriel VázquezNo ratings yet
- Oxidación de n-butanol a n-butiraldehidoDocument17 pagesOxidación de n-butanol a n-butiraldehidoAldo Gonzalez Contreras0% (1)
- Síntesis de complejos de cobalto (II) transportadores de oxígenoDocument13 pagesSíntesis de complejos de cobalto (II) transportadores de oxígenoalejandra vegaNo ratings yet
- Historia Quimica OrganometalicaDocument12 pagesHistoria Quimica OrganometalicaCamila MolanoNo ratings yet
- Catalisis y Cinetica Quimica - InformeDocument7 pagesCatalisis y Cinetica Quimica - InformeJeanette Farfan RamosNo ratings yet
- UNAM-FQ: Síntesis de p-terc-butilfenol mediante alquilación de Friedel-CraftsDocument6 pagesUNAM-FQ: Síntesis de p-terc-butilfenol mediante alquilación de Friedel-CraftsAlan ZamudioNo ratings yet
- Electroanalitica P2Document30 pagesElectroanalitica P2Toni QuesadaNo ratings yet
- Ley de reparto y equilibrio químicoDocument8 pagesLey de reparto y equilibrio químicoFelipe VilchesNo ratings yet
- Síntesis de Ferrioxalato de PotasioDocument14 pagesSíntesis de Ferrioxalato de PotasioKarina CortesNo ratings yet
- PAVIA Small Escala 430 450 Converted - En.esDocument22 pagesPAVIA Small Escala 430 450 Converted - En.esLouis StylinsonNo ratings yet
- Trifluoruro de BromoDocument2 pagesTrifluoruro de BromoBrian BerrioNo ratings yet
- Practica 6 ADocument6 pagesPractica 6 AMiguel Angel LlunaNo ratings yet
- Obtencion de Acetileno y Propiedades de Alquinos y AlcanosDocument5 pagesObtencion de Acetileno y Propiedades de Alquinos y AlcanosLuisa ValenciaNo ratings yet
- Biciclos PDFDocument28 pagesBiciclos PDFCarlo ChacaltanaNo ratings yet
- Foro 6.2Document2 pagesForo 6.2Patricia CastellanosNo ratings yet
- C LORDANODocument28 pagesC LORDANOFrancisco Cruz CalderonNo ratings yet
- Reacción de Diels-Alder: Formación de anillos por cicloadición 1,4Document4 pagesReacción de Diels-Alder: Formación de anillos por cicloadición 1,4Xi FernandezNo ratings yet
- PRACTICA 1 - Diels-Alder ORGANICADocument7 pagesPRACTICA 1 - Diels-Alder ORGANICAEren GarciaNo ratings yet
- 10 Reaccion de Diels-AlderDocument7 pages10 Reaccion de Diels-AlderGabriel Castañeda CuadrosNo ratings yet
- Lab de Fisica Fuerza CentripetaDocument2 pagesLab de Fisica Fuerza CentripetaLaura GuidoNo ratings yet
- La Base de La Espectroscopia de Absorción Atómica Consiste en QueDocument1 pageLa Base de La Espectroscopia de Absorción Atómica Consiste en QueLaura GuidoNo ratings yet
- Análisis de Propiedades AtómicasDocument8 pagesAnálisis de Propiedades AtómicasLaura GuidoNo ratings yet
- Densidad y Principio de ArquimedesDocument7 pagesDensidad y Principio de ArquimedesLaura GuidoNo ratings yet
- Informe de Lab de FísicaDocument5 pagesInforme de Lab de FísicaLaura GuidoNo ratings yet
- Diels AlderDocument6 pagesDiels AlderLaura GuidoNo ratings yet
- Sales de DiazonioDocument9 pagesSales de DiazonioLaura GuidoNo ratings yet
- Ejercicios1 LHospitalDocument3 pagesEjercicios1 LHospitalLaura GuidoNo ratings yet
- Fotorreducción de La BenzofenonaDocument5 pagesFotorreducción de La BenzofenonaLaura GuidoNo ratings yet
- Informe 1 Ley de NewtonDocument2 pagesInforme 1 Ley de NewtonLaura GuidoNo ratings yet
- Bioética Mapa Conceptual 2Document3 pagesBioética Mapa Conceptual 2Laura GuidoNo ratings yet
- Formulario Segundo Colegiado Fs 0210Document1 pageFormulario Segundo Colegiado Fs 0210Laura GuidoNo ratings yet
- Mi Perspectiva Sobre GattacaDocument3 pagesMi Perspectiva Sobre GattacaLaura GuidoNo ratings yet
- LeyesMovimientoForzasNetasMasaDocument18 pagesLeyesMovimientoForzasNetasMasaLaura GuidoNo ratings yet
- As Con Doble ChocolateDocument2 pagesAs Con Doble ChocolateLaura GuidoNo ratings yet
- Cuadro de Constantes 2Document1 pageCuadro de Constantes 2Laura GuidoNo ratings yet
- Tabla de DisolventesDocument4 pagesTabla de DisolventesLaura GuidoNo ratings yet
- Quimica 10 Per 3Document2 pagesQuimica 10 Per 3betina_nizNo ratings yet
- Resumen del cierre de mercados de bonos soberanos en dólares, euros y cupones PBIDocument10 pagesResumen del cierre de mercados de bonos soberanos en dólares, euros y cupones PBISaul tapiaNo ratings yet
- NomenclaturaDocument2 pagesNomenclaturaJuanjo Peña SantosNo ratings yet
- Programación lineal aplicaciones marketing, manufactura, recursos humanos, finanzasDocument13 pagesProgramación lineal aplicaciones marketing, manufactura, recursos humanos, finanzasAnthony SerranoNo ratings yet
- T2QG1Document4 pagesT2QG1Edvin Alvarado Granillo100% (2)
- Quimica InorganicaDocument46 pagesQuimica InorganicaMarcos Alfredo Abreu100% (2)
- Tamarin Capitulo 9Document38 pagesTamarin Capitulo 9madrugaegNo ratings yet
- Propiedades Quimicas Delos AlcoholesDocument6 pagesPropiedades Quimicas Delos AlcoholesSebastianQuiroga100% (1)
- Composición química de los seres vivos: átomos, moléculas y enlacesDocument74 pagesComposición química de los seres vivos: átomos, moléculas y enlacesJhon Kevin Mory JaraNo ratings yet
- Acidos CarboxilicosDocument16 pagesAcidos CarboxilicosSebastián CarpioNo ratings yet
- Informe Práctica VDocument7 pagesInforme Práctica VTina Posada ZapataNo ratings yet
- Factores que afectan la actividad enzimáticaDocument4 pagesFactores que afectan la actividad enzimáticaDeisonDiazAcostaNo ratings yet
- Web Quest Unidad IIIDocument38 pagesWeb Quest Unidad IIIlUiSflOrSNo ratings yet
- DetergentesDocument5 pagesDetergentesro.king123No ratings yet
- Nomenclatura y FormulacionDocument13 pagesNomenclatura y FormulacionReal BañilNo ratings yet
- Evaluación bimestral de Química 3o gradoDocument4 pagesEvaluación bimestral de Química 3o gradoCarmen Rosa Castro DíazNo ratings yet
- Parcial Sobre Enlace QuimicoDocument2 pagesParcial Sobre Enlace QuimicoDario GasparNo ratings yet
- Reporte 2Document6 pagesReporte 2GabrielVazquezOlvera100% (1)
- Ejercicios de Funcionalidad y Nomenclatura JhoinerDocument8 pagesEjercicios de Funcionalidad y Nomenclatura JhoinerDeymer Lopez SalazarNo ratings yet
- Enlaces intermoleculares: D-D, P.H. y V.D.WDocument3 pagesEnlaces intermoleculares: D-D, P.H. y V.D.WodalisNo ratings yet
- Cuestionario Practica 13Document2 pagesCuestionario Practica 13JAr MAc100% (3)
- Hidrocarburos aromáticosDocument6 pagesHidrocarburos aromáticosAlison DuarteNo ratings yet
- Isomeros ConfiguracionalesDocument4 pagesIsomeros ConfiguracionalesJonatan Suarez ReyesNo ratings yet
- Aldehidos y CetonasDocument6 pagesAldehidos y CetonasAnonymous phosYMdhRNo ratings yet
- EXPERIMENTO 6 Reacciondes de HidrocarburosDocument6 pagesEXPERIMENTO 6 Reacciondes de HidrocarburosSergio Bazan Salinas0% (1)