Professional Documents
Culture Documents
Analisis Gravimetrico
Uploaded by
Eudoro Trejos UrbinaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Analisis Gravimetrico
Uploaded by
Eudoro Trejos UrbinaCopyright:
Available Formats
Anlisis Gravimtrico
ANLISIS GRAVIMETRICO
El anlisis gravimtrico es una de las principales divisiones de la Qumica Analtica, en la cual la cantidad de analito se determina por medio de una pesada. ste se separa de los dems componentes de la mezcla, as como del solvente.
El mtodo ms utilizado de separacin es el de precipitacin, otros mtodos importantes son electrlisis, extraccin con solventes, cromatografa y volatilizacin.
ANLISIS POR PRECIPITACIN
El precipitado debe ser tan poco soluble, de manera tal que el constituyente en cuestin precipite cuantitativamente y la cantidad de analito que no precipite no sea detectable analticamente.
La sustancia que se pesa debe tener una composicin estequiomtrica definida o ser convertible en ella de manera simple y, por ltimo, ser de alta pureza. Este ltimo requisito es el ms difcil de cumplir.
CLCULOS EN EL ANLISIS GRAVIMTRICO
En el procedimiento gravimtrico usual, se pesa el precipitado y a partir de este valor se calcula el peso de analito presente en la muestra analizada. Por consiguiente, el porcentaje de analito A es: % A = (peso de A / peso de la muestra) * 100
Para calcular el peso de analito a partir del peso del precipitado, con frecuencia se utiliza un factor gravimtrico. Este factor se define como el valor numrico de la relacin de un equivalente gramo del constituyente buscado, a un equivalente gramo del compuesto pesado.
Peso de A = peso del precipitado * factor gravimtrico
Por lo tanto:
% A = (peso del precipitado * factor gravimtrico / peso de la muestra) * 100
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
Ejemplo: Una muestra de 0,6025 g de un cloruro soluble, da un precipitado de cloruro de plata que pesa 0,7134 g. Calcular el porcentaje de cloruro en la muestra. Solucin: Reaccin: Cl- + Ag+ AgCl Elemento buscado : Cloruro Precipitado conocido: Cloruro de plata
Entonces el factor gravimtrico ser: F = Peso molecular de Cl / Peso molecular de AgCl = 35,453 / 143,321 = 0,2474 g
Por lo tanto el peso de cloruro presente en el precipitado ser: Peso Cl = F * peso AgCl = 0,2474 * 0,7134 = 0,1764 g Cl
% Cl = (Peso de Cl / Peso muestra) * 100 = (0,1764 / 0,6025) * 100 = 29,3 %
Para establecer un factor gravimtrico se deben sealar, en primer lugar, el peso molecular o el peso atmico del analito en el numerador y el de la sustancia pesada en el denominador; en segundo lugar, el nmero de tomos o molculas que aparecen en el numerador y en el denominador deben ser equivalentes qumicamente (esto es, surgir de la relacin estequiomtrica).
EJEMPLOS DE ALGUNOS FACTORES GRAVIMTRICOS:
SUSTANCIA PESADA BaSO4 BaSO4 Fe2O3 Fe2O3 Mg2P2O7 Mg2P2O7
SUSTANCIA BUSCADA S SO3 FeO Fe3O4 MgO P2O5
FACTOR GRAVIMETRICO S / BaSO4 SO3 / BaSO4 2 FeO / Fe2O3 2 Fe3O4 / 3 Fe2O3 2 MgO / Mg2P2O7 P2O5 / Mg2P2O7
Anlisis Gravimtrico
FORMACIN Y PROPIEDADES DE LOS PRECIPITADOS
El dimetro de los iones es el de algunas dcimas de angstroms (1 = 10-10 m = 10-8 cm). Cuando se sobrepasa el producto de solubilidad de un compuesto, los iones comienzan a unirse, formando una red cristalina que crece lo suficiente para que la fuerza de gravedad la lleve al fondo del recipiente.
Como regla general, se dice que una partcula (esfrica) debe tener un dimetro mayor de 10-4 cm, aproximadamente, para que pueda precipitarse en una solucin.
Durante el proceso de crecimiento de la partcula, sta pasa por una etapa coloidal, cuyo dimetro va de 10-4 a 10-7 cm.
Podemos representar el proceso de precipitacin como:
iones en solucin partculas coloidales precipitados 10-8 cm 10-7 a 10-4 cm >10-8 cm
Cuando comienza la precipitacin, se forman pequeas partculas llamadas ncleos. Sobre stas, se pueden depositar partculas ms pequeas que causarn el crecimiento de los ncleos.
Si la velocidad de formacin de los ncleos, proceso llamado nucleacin, es pequea comparada con la velocidad de crecimiento de los ncleos, al final del proceso se producen menos partculas con un tamao real relativamente grande. Este tipo de material se filtra con mayor facilidad y con frecuencia es ms puro que el que se forma con partculas pequeas. Para obtener este resultado, la precipitacin se lleva a cabo mezclando lentamente soluciones diludas bajo condiciones en las que aumenta la solubilidad del precipitado evitando la sobresaturacin.
Adems de controlar las condiciones durante el proceso real de precipitacin, el analista tiene otro recurso despus que se forma el precipitado. ste es digerir o aejar el precipitado, lo cual consiste en permitir que el precipitado est en contacto con el licor madre durante algn tiempo antes de filtrarlo, con frecuencia a una temperatura elevada.
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
PUREZA DE LOS PRECIPITADOS
El problema ms difcil al que se enfrenta el analista en gravimetra es el obtener un precipitado con elevado grado de pureza. ste puede contaminarse durante su formacin o luego de terminada la precipitacin, por los siguientes procesos:
COPRECIPITACIN:
Es el proceso mediante el cual una sustancia, que en condiciones normales es soluble, es acarreada junto al precipitado deseado.
Puede ocurrir por formacin de cristales mezclados, permitiendo que la impureza penetre en la red cristalina del precipitado, a lo que se llama oclusin; o por adsorcin de iones que son arrastrados con el precipitado durante el proceso de coagulacin.
En la coprecipitacin por oclusin, las sustancias contaminantes pueden ser iones extraos o el mismo disolvente; mientras que en la adsorcin las impurezas son solamente iones retenidos en la superficie del precipitado.
Mtodos de minimizacin de la coprecipitacin: Adicin de dos reactivos: se puede utilizar para controlar la concentracin de la impureza y la carga elctrica de las partculas elementales de las partculas elementales del precipitado. En el caso de los xidos hidratados, la carga se puede controlar utilizando el pH adecuado. Lavado: empleado con precipitados gelatinosos y coagulados, se debe adicionar al agua de lavado un electrlito para evitar la peptizacin. Digestin: es til para los precipitados cristalinos, algo benfica para los precipitados coagulados, pero no se emplea para precipitados gelatinosos. Reprecipitacin: se utiliza cuando se puede disolver el precipitado con facilidad, principalmente en el caso de xidos hidratados y sales cristalinas de cidos dbiles. Separacin: se realiza antes de formar el precipitado, separando la impureza o cambiando su naturaleza qumica por medio de alguna reaccin. Precipitacin homognea: la velocidad de formacin del precipitante en la solucin que contiene el constituyente a precipitar se controla cinticamente, evitando regiones locales de alta concentracin, de manera de mantener la sobresaturacin siempre pequea.
Anlisis Gravimtrico
El precipitante se produce como resultado de una reaccin que ocurre dentro de la solucin, dando lugar a la formacin de ncleos relativamente pequeos, los cuales crecern a medida que contina la formacin de precipitante, generando cristales grandes con alto grado de perfeccin y pureza. El precipitante puede generarse por variacin de pH, con un reactivo que consuma lentamente iones hidrgeno o hidroxilos, o bien por descomposicin lenta de un compuesto adecuado. Por ejemplo: 100C CO(NH2)2 (ac) + H2O (l) CO2 (g) + 2 NH3 (ac)
calor NH2SO3H (ac) + H2O (l) NH4+ (ac) + H+ (ac) + SO4= (ac)
CH3CSNH2 (ac) + H2O (l) CH3CONH2 (ac) + H2S (ac)
POSPRECIPITACIN:
Se denomina de esta manera al proceso mediante el cual se deposita una impureza luego de haber precipitado la sustancia deseada. Difiere de la coprecipitacin por el hecho de que la contaminacin aumenta al dejar el precipitado deseado con el licor madre; por lo cual debe filtrarse inmediatamente despus de su formacin.
Por ejemplo: El oxalato de magnesio forma soluciones sobresaturadas estables y, a menos que se tomen precauciones, posprecipita sobre el oxalato de calcio cuando se digiere por largo tiempo la suspensin antes de la filtracin.
Se ha encontrado que el sulfuro mercrico promueve la posprecipitacin del sulfuro de cinc a pH en que este ltimo no precipitara. En este caso y en otros de similares caractersticas, se prefiere actualmente la denominacin de precipitacin inducida, ya que durante la formacin del sulfuro de mercurio (II) ste adsorbe con frecuencia iones sulfuro en la interfase del slido y la solucin, rebasando el producto de solubilidad del sulfuro de cinc ms en la interfase que en el seno de la solucin, por lo que aumenta la velocidad de precipitacin.
TEMA IV. TCNICAS CLSICAS DE ANLISIS.
Leccin 6. INTRODUCCIN AL ANLISIS CUANTITATIVO (GRAVIMETRAS Y VOLUMETRAS).
El conjunto de las tcnicas operatorias puestas al servicio de la Qumica Analtica constituye el Anlisis Qumico. La finalidad del anlisis cuantitativo es conocer en qu proporcin se encuentran presentes determinados compuestos o elementos en una muestra y en muchas ocasiones sus posibles relaciones qumicas. Es por esto que deben conocerse muy bien los conceptos de exactitud, precisin, reproducibilidad y por supuesto los conceptos de errores en Qumica Analtica y que ya han sido estudiados en el primer tema de esta asignatura.
La metodologa empleada en Qumica Analtica se puede clasificar segn diversos criterios, siendo uno de los ms utilizados los que distinguen entre mtodos clsicos o qumicos y los que emplean algn instrumento diferente de la balanza y de la bureta.
Los mtodos clsicos tienen como base la estequiometra y sus leyes. Consisten en medir (masa o volumen) una muestra del material que se analiza y someterla a reacciones qumicas que tengan lugar de forma completa, deducindose la cantidad buscada del peso de un producto de reaccin (anlisis gravimtrico) o de un volumen de reactivo consumido (anlisis volumtrico). Si el componente a determinar, o un derivado suyo, se libera en forma gaseosa, se puede determinar su volumen (mtodos volumtricos de gases), o bien su peso (mtodos gravimtricos de gases).
Se denominan mtodos instrumentales al conjunto de procedimientos en los que la identificacin y/o medida se realiza sobre una variable de carcter fsico, despus de haber sometido, en muchos casos, la materia en estudio a una interaccin con un tipo de energa (mtodos pticos, electroqumicos, trmicos, etc.).
Los mtodos clsicos son ms exactos, con errores normalmente iguales o inferiores al 0.1% mientras que necesitan en general de una mayor cantidad de muestra para su realizacin (concentraciones mayores de 0.001 M).
Los mtodos instrumentales son menos exactos, con errores normalmente del orden del 1 al 5% pero se pueden alcanzar fcilmente concentraciones de 10-5 M e incluso, en algunos mtodos, inferiores.
GRAVIMETRAS: CLASIFICACIN, TIPOS, FACTOR GRAVIMTRICO.
La medida que caracteriza a los mtodos gravimtricos, es la de la masa, magnitud carente de toda selectividad, ya que la poseen todas las especies qumicas, lo que hace necesario efectuar separaciones lo ms perfectas posibles.
El anlisis gravimtrico consiste, pues, en separar y pesar, en el estado de mayor pureza, un elemento o compuesto de composicin conocida que se encuentra en una relacin estequiomtrica definida con la sustancia que se determina.
Segn el procedimiento empleado para la separacin, los mtodos gravimtricos se pueden clasificar en: Mtodos de precipitacin Mtodos de extraccin. Mtodos con otras separaciones especficas.
Estudiaremos en este curso los mtodos de precipitacin. Las fases de que consta el anlisis gravimtrico por precipitacin son: 1. Toma y preparacin de la muestra (disolucin). 2. Precipitacin 3. Filtrado y lavado del precipitado. 4. Secado y calcinacin. 5. Pesada y clculos.
1.Toma y preparacin de la muestra. La muestra no siempre consiste en una disolucin acuosa. En el caso de una muestra slida debemos tomar una parte que sea representativa del total de la muestra (en funcin de la estrategia de muestreo determinada) y posteriormente, disolverla mediante la tcnica ms adecuada de disgregacin o disolucin.
2. Precipitacin. Definiremos como forma precipitada el compuesto insoluble que se forma en la reaccin entre la sustancia de inters y la del reactivo precipitante, y como forma ponderable el compuesto que se pesa para obtener el resultado del anlisis. Estas dos formas pueden ser iguales o diferentes. Por ejemplo en la determinacin de calcio con oxalato, la forma precipitada ser el oxalato de calcio, CaC2O4.H2O, y la forma ponderable es el xido de calcio, CaO, que se puede obtener al calcinarlo. Sin embargo, en la precipitacin de bario con sulfato, se precipita y se pesa como sulfato de bario, BaSO4, sin experimentar cambios en su composicin. No todos los compuestos insolubles que puede formar un elemento pueden ser utilizados en anlisis gravimtrico. Slo es posible utilizar un compuesto insoluble, en la determinacin gravimtrica de un elemento, si cumple una serie de condiciones; estas condiciones son: 1. Solubilidad: El precipitado debe ser lo suficientemente insoluble para que la parte soluble no afecte al resultado del anlisis (0.0001 g/l). 2. Pureza: Las propiedades fsicas del precipitado deben ser tales que los contaminantes se puedan liberar por tratamientos sencillos, como puede ser el lavado. 3. Filtrabilidad: Debe ser posible aislar cuantitativamente el precipitado slido de la fase lquida por mtodos de filtracin sencillos y rpidos. Por eso son ms convenientes los precipitados de cristales grandes que no obturan los poros del filtro y adems adsorben menos sustancias de la disolucin, son menos contaminables puesto que su superficie especfica es menor.
Para la forma ponderable, se deben cumplir tambin una serie de condiciones:
1. Composicin qumica conocida: es totalmente necesario que la composicin del precipitado corresponda exactamente con su frmula qumica, si no, es imposible realizar los correspondientes clculos del anlisis. 2. Deben tener estabilidad qumica, es decir, no sea higroscpico, ni absorba CO2 atmosfrico, que no se oxide fcilmente al aire, etc. 3. Peso frmula elevado, es deseable que el contenido del elemento que se desea determinar en el precipitado sea lo menor posible, puesto que los errores de determinacin (errores de pesada, prdidas debidas a la solubilidad del precipitado o a la transferencia incompleta del precipitado al filtro) perturbarn menos sobre el resultado final del anlisis.
La precipitacin consiste en aadir a la disolucin que contiene el elemento a determinar, otra del reactivo precipitante, de manera que ste quede en exceso para desplazar el equilibrio hacia la formacin del compuesto insoluble. Se considera que la precipitacin es completa, si la cantidad del compuesto a determinar que permanece en la disolucin se halla fuera de los lmites de la precisin de la pesada, es decir, no supera los 0.0001 g.
3 Aislamiento del precipitado del resto de la disolucin. La filtracin y el lavado son operaciones sumamente importantes de las que depende la precisin del resultado. Hay dos tcnicas generales de filtracin: Con papel de filtro de peso de cenizas conocido, y Con placa filtrante.
La primera se utiliza cuando el precipitado se calcina, mientras que la segunda se utiliza cuando ste se seca. Despus de filtrar se lava el precipitado con objeto de eliminar las impurezas adsorbidas en la superficie del precipitado y la disolucin madre que lo impregna. Si el precipitado se va a calcinar el lquido del lavado debe contener nicamente sustancias voltiles. Si el precipitado se va a secar, deben utilizarse para el lavado, lquidos que se eliminen totalmente por secado. Solamente en el caso que se sepa que no puede haber prdidas por solubilidad, se usar agua como solucin de lavado, pero normalmente se utilizan disoluciones que contienen el reactivo precipitante, o reactivos que eviten la peptizacin o la solubilizacin del precipitado. La peptizacin har que el precipitado pase por el filtro muy fcilmente. 4
4. Secado y Calcinacin.
Se seca o deja secar el precipitado en el filtro y se transfiere filtro y precipitado a un crisol, que se ha llevado previamente a constancia de peso, y se calcina sobre un mechero y despus, si es necesario, en un horno elctrico o mufla. El calcinado se realiza para quemar el papel y eliminarlo y para que el compuesto pase a la forma ponderable (eliminacin del agua de cristalizacin, formacin de otro compuesto con diferente estequiometra, etc).
Si se filtra sobre placa filtrante, se seca esta en la trompa de vacio y luego en la estufa a 110-120C, para eliminar el agua adsorbida.
5. Pesada y clculos. Como normalmente no se pesa la sustancia a determinar si no un compuesto suyo, es necesario calcular a qu cantidad de sustancia que se determina corresponde la cantidad encontrada de precipitado. La relacin entre el peso frmula de la sustancia buscada y el peso frmula de la sustancia pesada es lo que se conoce como factor gravimtrico. Multiplicando este valor por los gramos de la sustancia pesada obtenemos el correspondiente valor en gramos de la sustancia buscada.
gsustancia buscada = gsustancia pesada * PF de sustancia buscada/PF sustancia pesada. Ejemplos de factores gravimtricos: Se busca el Fe3O4 y se pesa como Fe2O3: FG= 2PFFe3O4/3PFFe2O3 Se busca MgO y se pesa Mg2P2O7: FG=2MgO/ Mg2P2O7 Se busca P2O5 y se pesa Mg2P2O7: FG= P2O5/ Mg2P2O7
ANLISIS VOLUMTRICO.
En el anlisis volumtrico se mide el volumen de una disolucin de concentracin exactamente conocida que se necesita para reaccionar, de forma completa, con el analito (sustancia a analizar). Los mtodos volumtricos tienen la misma exactitud que los gravimtricos, pero tienen la ventaja de ser ms rpidos y 5
cmodos. Adems, la misma naturaleza de estos mtodos permite trabajar con muestras ms pequeas o con disoluciones ms diluidas.
Se entiende por disolucin estndar de reactivo a la disolucin de reactivo de concentracin conocida que se utilizara para realizar un anlisis volumtrico. Por valoracin entendemos el proceso por el cual se aade lentamente una disolucin estndar de reactivo, desde una bureta, a una disolucin de analito, hasta que la reaccin entre los dos sea completa. El volumen gastado para llevar a cabo la valoracin se determina por diferencia entre las lecturas final e inicial de la bureta.
Punto de equivalencia y punto final: El punto de equivalencia es el punto de la valoracin en el que la cantidad aadida de reactivo estndar (reactivo valorante) equivale exactamente a la de analito en la muestra.
El punto final es el punto de una valoracin en el que se produce un cambio fsico asociado a la condicin de equivalencia qumica. Normalmente este punto final se detecta aadiendo un indicador a la disolucin de analito, con el fin de obtener un cambio fsico observable (punto final). En la regin del punto de equivalencia ocurren grandes cambios de la concentracin relativa de analito y valorante, estos cambios de la concentracin hacen que el indicador cambie de aspecto. Cambios tpicos de indicador son un cambio de color, aparicin o desaparicin de un color y la aparicin o desaparicin de turbidez.
En los mtodos volumtricos el error absoluto de valoracin (Ev) viene dado por: Ev= Vpf - Vpe Siendo Vpf el volumen de reactivo en el punto final y Vpe el volumen terico de reactivo para alcanzar el punto de equivalencia. Tambin pueden utilizarse sistemas de medida instrumentales para detectar el punto final de una valoracin.
Condiciones que deben cumplirse en la reaccin qumica.
Las condiciones que debe reunir una reaccin qumica para poder ser utilizada como base en un mtodo volumtrico son: 1. Debe ser completa, es decir cuantitativa 2. Ser rpida 3. Ser estequiomtrica, es decir debe existir una reaccin bien definida y conocida entre el analito y el reactivo valorante. 4. Debe existir un procedimiento sencillo para poner de manifiesto el punto final de la valoracin.
Patrones primarios.
Un patrn o estndar primario, es un compuesto de elevada pureza, que sirve como material de referencia en todos los mtodos volumtricos. La exactitud de estos mtodos depende crticamente de las propiedades de este tipo de compuestos. Los requisitos de un estndar primario son: 1. Elevada pureza. Se toleran impurezas de 0.01 a 0.02 % si son conocidas exactamente. 2. Estabilidad al aire y a las temperaturas normales de secado. 3. Que no tenga molculas de hidratacin. 4. Que sea fcil de adquirir, y a coste moderado. 5. Que sea fcilmente soluble en el medio de valoracin. 6. Que tenga un peso frmula elevado, para que sean mnimos los errores de pesada.
El estndar primario debe ser secado antes de su pesada.
Disoluciones estndar: preparacin.
La disolucin estndar ideal para un mtodo volumtrico debe ser suficientemente estable de forma que solo se necesite determinar una vez su concentracin, que reaccione completa y rpidamente con el analito a valorar y que reaccione lo ms selectivamente posible con el analito de acuerdo con una ecuacin ajustada sencilla. 7
La exactitud de un mtodo volumtrico no puede ser mejor que la exactitud de la concentracin de la disolucin patrn utilizada en la valoracin. Son dos los mtodos ms utilizados para la preparacin de disoluciones estndar: Mtodo directo: se usa si se dispone de un compuesto estndar primario. Una vez seco el patrn, se pesa con exactitud una determinada cantidad del compuesto, se disuelve, se diluye y se enrasa cuidadosamente a un volumen exactamente conocido, en un matraz aforado. Mtodo indirecto: se usa cuando el compuesto qumico no es un patrn primario. Se prepara una disolucin de concentracin aproximada y se estandariza frente a un patrn primario. La estandarizacin es un proceso por el cual se determina la concentracin exacta de una disolucin, utilizando la disolucin para valorar una cantidad conocida de otro reactivo. La disolucin valorante obtenida de esta forma se denomina disolucin patrn o estndar secundario.
Clasificacin de los mtodos volumtricos.
Los mtodos volumtricos de anlisis, se clasifican principalmente en funcin del tipo de reaccin qumica utilizada, dividindose en cuatro clases principales: Valoraciones cido-base. Se efecta una reaccin de neutralizacin en la cual un cido reacciona con una cantidad equivalente de base. El valorante es siempre un cido o una base fuerte, siendo el analito una base o cido fuerte o dbil. Las curvas de valoracin se construyen representando el pH de la disolucin frente al volumen de reactivo aadido. Los indicadores utilizados suelen ser cidos o bases dbiles de intensos colores. Valoraciones de oxidacin-reduccin. En este tipo de valoraciones se produce una reaccin de transferencia de electrones entre el analito (sustancia a valorar) y el agente valorante. La reaccin que discurre entre ambos debe ser de cintica alta, puesto que de su velocidad depende la obtencin de buenos resultados. Por otra parte debe disponerse de un medio que permite observar el punto final de la valoracin. Estos indicadores pueden ser de muy diversos tipos, pero por lo general, son sustancias con caractersticas redox y cuya forma oxidada y reducida tienen diferente color. El valor del potencial normal del indicador tiene que estar entre los potenciales normales de los dos sistemas, para que viere cerca del punto de equivalencia de la valoracin. 8
Valoraciones de precipitacin. Estn basadas en reacciones en las que se forman compuestos de baja solubilidad. La mayora de los precipitados se forman lentamente lo que hace que se disponga de pocos agentes precipitantes para su aplicacin en valoraciones. El nitrato de plata es el reactivo precipitante ms importante y uno de los ms utilizados en la determinacin de halogenuros, SCN-, CN- y CNO-. Los mtodos volumtricos que utilizan el nitrato de plata como agente valorante reciben el nombre de argentomtricos.
Valoraciones de formacin de complejos. Los reactivos que forman complejos se utilizan ampliamente en la valoracin de cationes metlicos. Los ms empleados son compuestos orgnicos que tienen varios grupos donadores de electrones capaces de formar numerosos enlaces covalentes con iones metlicos. Como indicadores qumicos se utilizan colorantes orgnicos que forman quelatos coloreados con los iones metlicos. El negro de eriocromo T es de los ms utilizados, cuyos complejos con los iones metlicos son generalmente rojos, presentado un cambio de coloracin en funcin del pH del medio en el que se realice la valoracin puesto que la especie libre es roja/azul/naranja en funcin de que estemos a pH<6.3, 6.3<pH<11.6, y pH>11.6 respectivamente.
Clculos en anlisis volumtrico.
Una unidad de concentracin muy til en clculos volumtricos es la unidad en desuso denominada Normalidad, que emplea el concepto de equivalentes y peso equivalente. La concentracin normal depende de la reaccin en particular, y es necesario especificar dicha reaccin. Su principal ventaja frente a otras expresiones de concentracin radica en que para toda reaccin un equivalente de A reacciona con uno de B y adems si las disoluciones tienen la misma normalidad, un volumen de la sustancia A reacciona con el mismo volumen de la sustancia B.
Anlisis Gravimtrico
TRABAJO PRCTICO N 1: BALANZA ANALTICA
BALANZAS DE UN SOLO PLATILLO:
Constan de un platillo y un conjunto especial de pesas (generalmente de acero inoxidable de densidad 7,76 y composicin Fe-Cr-Ni con 25 % de Cr y 20 % de Ni) ubicados sobre un brazo, que son balanceados por un peso fijo en el otro. Los brazos no son iguales y slo se usan dos cuchillas. Una escala ptica permite hacer pesadas de 0,1 g con aproximacin de 0,1 mg.
Utilizan amortiguacin neumtica: este tipo de amortiguacin tiene unidos a la cruz unos grandes pistones que se mueven holgadamente dentro de cilindros fijos. As las oscilaciones se amortiguan tan completamente que si se sobrecarga levemente uno de los platillos, el fiel se mover hacia un lado al liberar los platillos y se detendr al final del recorrido. Al pesar, simplemente, se anota el punto de reposo.
La escala est graduada de modo que corresponda a miligramos y el punto en el que se detiene el fiel se lee con un microscopio interno. As pueden leerse directamente pesos menores de 100 mg con aproximacin de 0,1 mg.
Las ventajas de este tipo de balanzas frente a las de dos platillos son: velocidad, conveniencia y sensibilidad independiente de la carga (ya que sta es constante)
Las desventajas de estas balanzas monoplato es su sensibilidad a los cambios de temperatura en mayor medida que las de brazos iguales (como por ejemplo el calor producido por la lmpara de iluminacin de la escala) as como a leves flexiones de la mesa de la balanza.
REQUISITOS DE UNA BALANZA ANALTICA:
Debe ser exacta Debe ser estable Debe ser sensible El perodo de oscilacin de la balanza no debe ser muy largo
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
VARIACIONES EN EL PESO O CONDICIN, DE UNA SUSTANCIA O RECIPIENTE, DURANTE LA PESADA:
Adsorcin de humedad:
Los crisoles de porcelana calcinados y enfriados no adsorben agua en forma considerable en el tiempo que dura la pesada, los objetos grandes de vidrio pueden aumentar sensiblemente de peso.
La adsorcin de humedad de la sustancia que se pesa es ms seria que la del recipiente, es til emplear pesafiltros para pesar sustancias higroscpicas ya que pueden cerrarse hermticamente.
Electrificacin de recipientes:
Debido a la electricidad esttica, los recipientes de vidrio dan un peso errneo, sintiendo la superficie cargada una atraccin por las paredes o piso de la balanza, especialmente si la humedad relativa ambiente es baja (menor al 40 % RH). Exponiendo el recipiente a luz ultravioleta o a una descarga elctrica de alta frecuencia se puede disipar la carga.
Diferencias entre la temperatura del recipiente y la de la balanza:
El peso aparente de un objeto ms caliente que la balanza ser menor que el peso verdadero debido a las corrientes de conveccin ascendentes alrededor del objeto, que lo empujarn hacia arriba.
Por ejemplo, un crisol tapado de 25 ml cuya temperatura se encuentra 1C sobre la temperatura de la balanza, pesar 0,1 mg menos que el real.
Estos errores pueden surgir cuando los crisoles no se enfran suficientemente en un desecador luego de la calcinacin. Un crisol de porcelana debe enfriarse no menos de una hora en desecador, si primero se deja enfriar un minuto al aire luego de un calentamiento fuerte.
Cuando se pesa utilizando un pesafiltros, se recomienda tomar el mismo con una tira de papel de filtro doblado para evitar calentarlo con los dedos.
Anlisis Gravimtrico
REGLAS PARA EL USO DE LA BALANZA:
La balanza debe colocarse en un lugar adecuado, en un cuarto separado del laboratorio para protegerla de los vapores. No debe estar cerca de una ventana o calefactor. Debe colocarse sobre una base firme para protegerla de las vibraciones tanto como sea posible. No debe recibir luz solar directa ni corrientes de aire. La balanza debe estar a nivel Se debe mantener arrestada. No deben dejarse elementos sobre el platillo. Siempre se debe colocar el objeto a pesar con la balanza arrestada. El punto cero debe determinarse antes de cada pesada. Antes de quitar el objeto pesado, se debe arrestar nuevamente la balanza. Siempre que se pesa se debe tomar la aproximacin del peso con la llamada media pesada , luego que se carga el peso aproximado se pasa a la pesada completa para ajustar los miligramos exactamente. No se debe emplear la pesada completa cuando el platillo se encuentra cargado y la balanza indica 0,0000 g pues se sobrecargara pudiendo alterarse su delicado mecanismo. Todas las sustancias deben pesarse en algn recipiente para evitar el ataque de los platillos. Los recipientes adecuados son pesafiltros, vidrios de reloj, crisoles, y en casos especiales, pequeos erlenmeyers o vasitos de precipitados. Cuando se empleen lquidos corrosivos y slidos voltiles se deben pesar en recipientes hermticamente cerrados. Los objetos a pesar deben tener la temperatura de la balanza. La balanza no debe sobrecargarse nunca. La balanza debe mantenerse limpia, pero no se deben emplear lquidos para limpiar los platillos. Si pareciera haber alguna duda con la balanza o si se debe hacer algn ajuste, debe consultarse al Jefe de trabajos prcticos inmediatamente.
Anlisis Gravimtrico
TRABAJO PRCTICO N 2: DETERMINACIN DE NQUEL EN UNA SAL SOLUBLE DE NQUEL
CONSIDERACIONES TERICAS:
El ion Ni++ precipita cuantitativamente en forma de dimetilglioximato de nquel por adicin directa de una solucin alcohlica de dimetilglioxima a una solucin ligeramente cida y caliente de un compuesto de nquel, con el agregado posterior de un dbil exceso de amonaco (pH entre 5 y 9).
Tschugaeff sintetiz por primera vez la dimetilglioxima en 1905 siendo Brunck quien la emple en determinaciones de nquel en aceros en 1907.
La dimetilglioxima da un precipitado rojo voluminoso en presencia de nquel. OH ----O(-) CH3 - C = N N = C - CH3 Ni CH3 - C = N N = C - CH3 (-) O-----HO Dimetilglioximato de Nquel (rojo rosado)
Ni++ (ac) + 2
CH3 - C = N - OH CH3 - C = N - OH
Este precipitado es soluble en cidos minerales y, si bien, la reaccin se produce en un medio actico, se efecta la precipitacin en medio amoniacal o en solucin reguladora de cido actico-acetato de amonio.
Su frmula corresponde a un complejo interno cuya caracterstica es estar formado por una molcula orgnica que se une a un catin mediante un enlace heteropolar o salino y otro coordinado o dativo, formndose una molcula cclica. Se trata de un quelato y en el caso del nquel resulta un ciclo de 5 elementos. Es un compuesto fuertemente coloreado como consecuencia de la formacin de un anillo no saturado. Es insoluble en agua y soluble en disolventes orgnicos que tengan cierta afinidad con el ciclo formado.
La dimetilglioxima se puede considerar como un cido monoprtico, relativamente dbil en agua.
En la estructura del quelato puede designarse por Dmg a la parte que representa al ion dimetilglioximato que acta como ligando y H al protn que se ioniza. En consecuencia el cido progenitor, dimetilglioxima, ser HDmg. A valores de pH menores de 4 existen pocos iones
11
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
dimetilglioximatos libres en agua, debido a que el equilibrio cido-base favorece al cido no disociado.
La dimetilglioxima ( y otras dioximas ), constituyen un reactivo especial para el nquel, ya que aunque forma complejos enteramente estables con el cobre, cobalto, cinc y otros metales, estos son solubles en agua. La insolubilidad del Ni(Dmg)2 en agua tiene su origen en un factor estructural, la molcula tiene una configuracin plana, los grupos -OH y O- estn unidos por lazos internos (puentes hidrgeno intramoleculares) y no son fcilmente solvatados, por lo cual su solubilidad en agua es baja. Adems el nquel tiende a formar en el slido un dbil lazo metalmetal, lo que puede contribuir a la insolubilidad del Ni(Dmg)2 .
Los dimetilglioximatos de cobre (II) y cobalto (II) (el dimetro de estos cationes es mayor que el del Ni++) no tienen la estructura plana del complejo de nquel (II) y dado que el anillo del quelato no se encuentra en un mismo plano, los grupos -OH pueden enlazarse a molculas de agua y el enlace metal-metal se ve impedido de producirse.
INTERFERENCIAS:
Fe+++, Al+++, Bi+++ y Cr+++ : forman hidrxidos en medio amoniacal. Se evitan agregando un tartrato o citrato soluble Fe++ : da coloracin roja. Se evita oxidando con H2O2 persulfato antes de aadir amonaco Pd++ en medio clorhdrico o sulfrico: precipita Pd(Dmg)2 amarillo, de composicin similar al compuesto Ni(Dmg)2 Co++ y Cu++ : retrasan la precipitacin. El Co++ forma un complejo similar de color pardo rojizo, ms estable que el de Nquel, pudiendo llevar la concentracin de dimetilglioxima a valores que no satisfagan el producto de solubilidad de precipitacin del complejo de Nquel. El Cu++ forma un complejo soluble, color pardo, que obstaculiza la percepcin del precipitado rojo del Nquel, se elimina agregando una gota de sulfito cido y otra de tiocianato de potasio reduciendo al Cu++ a Cu2++ y formando Cu2(SCN)2. Al hervir la solucin con la solucin con el reactivo dimetilglioxima, el Au+++ se reduce a Au . El Ca++ y otros cationes metlicos que puedan estar presentes, forman complejos solubles, por lo cual ante su presencia deber utilizarse un exceso de reactivo.
o
REACTIVOS:
La dimetilglioxima es muy poco soluble en agua ( 0,4 g/l) pero soluble en alcohol y en lcalis como consecuencia de su carcter acdico, por lo que se la emplea en solucin alcohlica al 1% (en alcohol puro o absoluto)
12
Anlisis Gravimtrico
1 ml de esta solucin es suficiente para precipitar 0,0025 g de nquel.
La sal de sodio de la dimetilglioxima (NaDmg.9H2O) es soluble en agua y se emplea en solucin acuosa al 2-3 %
Un ligero exceso de reactivo no tiene accin sobre el precipitado pero debe evitarse un gran exceso porque: puede precipitar dimetilglioxima al ser poco soluble en agua el complejo Ni(Dmg)2 es ms soluble en una mezcla alcohol-agua (con ms del 50 % de alcohol) que en agua pura. Tambin se solubiliza en cidos minerales, amonaco concentrado y en agua caliente (alrededor de 0,6 mg/l)
Como ya se ha mencionado, el reactivo se agrega a una solucin caliente ligeramente acidificada, de una sal de nquel, y luego se alcaliniza ligeramente. Esta tcnica permite obtener un precipitado ms fcil de filtrar que por precipitacin directa en fro o de solucin amoniacal.
El Ni(Dmg)2 puede secarse a 110-130C sin sufrir alteraciones, para obtener una composicin definida y poder pesarlo adecuadamente.
En forma alternativa puede emplearse difurilglioxima, que en presencia de nquel da un precipitado rojo en solucin amoniacal. El complejo es menos soluble que la Ni(Dmg)2 y tiene menos Ni, obtenindose as un precipitado de mayor peso para la misma cantidad de nquel. Es decir, el factor gravimtrico es menor. La gran ventaja de la difurilglioxima es su solubilidad en agua, lo que evita la posible contaminacin con el reactivo en el precipitado del difurilglioximato de nquel. Corrientemente se emplea en solucin acuosa al 2 %. El principal inconveniente de este reactivo alternativo es su precio elevado.
| C C
O
HO
|| ||
N N
O
OH
Difurilglioxima
MATERIALES:
Vidrio de reloj Varilla de vidrio Vaso de precipitados Cuba hidroneumtica Pipetas Termmetro Crisol filtrante de Gooch Trompa de vaco Pinzas metlicas Kitasato Trpode Mechero Tela con centro de amianto Estufa Desecador Balanza
13
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
DROGAS:
Sulfato de nquel hexahidratado P.a cido clorhdrico (1:1) Hidrxido de amonio (1:10) Dimetilglioxima (1 % en etanol) Etanol (absoluto) Agua destilada
TCNICA OPERATORIA:
Calcular la cantidad de NiSO4.6H2O a pesar, sabiendo que 1 ml de dimetilglioxima al 1 % precipita 0,0025 g de Ni++, considerando que se desean consumir unos 30 ml de reactivo precipitante. 1 ml Dmg 0,0025 g Ni++ 30 ml Dmg x = 0,075 g Ni++ 58,71 g Ni++ 262,8588 g NiSO4.6H2O 0,075 g Ni++ x = 0,3358 g NiSO4.6H2O Pesar al 0,1 mg, cerca de 0,3 g de NiSO4.6H2O puro que contiene 0,075 g de Ni++. Pasar la muestra a un vaso de precipitados de 400 ml provistos de un vidrio de reloj y varilla de vidrio. Disolver con 50 ml de agua y agregar 5 ml de HCl diludo (1:1) para disolver totalmente la muestra, ya que sta no es completamente soluble en agua. Llevar a 200 ml con agua destilada. El medio HCl favorece la estabilizacin del catin Ni++, que es ligeramente cido. No puede emplearse cido sulfrico, pues por ion comn se reducira la solubilidad de la muestra. Calentar a 80C para llegar a la mxima solubilidad Agregar 30 ml de dimetilglioxima (al 1 % en etanol ) y despus, mientras se agita, aadir NH4OH diludo (1:10) hasta que se forma el precipitado. Dejar en bao mara hasta que el precipitado coagule (asegurarse que el lquido del bao supere o al menos alcance al nivel del lquido en el interior del vaso). En el lquido que sobrenada, comprobar con unos ml de dimetilglioxima si queda Ni++ en la solucin (en caso de dar negativo, verificar con unos ml de amonaco la ausencia de precipitacin). Dejar el precipitado en reposo, en fro, para asegurar la precipitacin completa, durante una hora (no agitar). Verificar presencia de Ni++ en el sobrenadante. Filtrar por crisol filtrante de Gooch de vidrio sinterizado, previamente calentado en estufa a 110C durante una hora, enfriado en desecador y pesado.
14
Anlisis Gravimtrico
Utilizar para el filtrado trompa de vaco, con succin muy suave. El filtrado debe ser claro, en caso que presente color verdoso indica pasaje de Ni++ a la solucin, por lo que debe repetirse la operacin de precipitacin con dimetilglioxima en el lquido del filtrado. Lavar el precipitado con agua fra para eliminar cloruros, y secar a 110-120C en estufa durante 1 hora. Dejar enfriar en desecador y pesar. Repetir hasta constancia de peso.
CLCULOS:
PESO DE LA MUESTRA: Peso vidrio de reloj Peso de la muestra Peso total 22,0983 g 0,3479 g 22,4462 g
PESO DEL PRECIPITADO: Peso crisol Peso crisol + precipitado Peso precipitado 48,6217 g 48,8911 g 0,2694 g
PORCENTAJE DE Ni++:
% Ni++ = (F * pp * 100 ) / Gm
donde: F = factor gravimtrico = Ni / Ni(Dmg)2 pp = peso del precipitado Gm = gramos muestra Peso molecular del Ni(Dmg)2 = 288,71 g/mol por lo tanto:
% Ni++ = 0,2033 * 0,2694 * 100 / 0,3479 = 15,7 %
RENDIMIENTO: 262,8588 g NiSO4.6H2O 288,71 g Ni(Dmg)2 0,3479 g NiSO4.6H2O x = 0,3821 g Ni(Dmg)2 VALOR TERICO 0,3821 g 0,2694 g VALOR EXPERIMENTAL 100 % x = 70,5 %
15
FACULTAD DE QUMICA E INGENIERA. Fr. Rogelio Bacon. U.C.A. CTEDRA DE QUMICA ANALTICA CUANTITATIVA
El rendimiento tambin puede calcularse mediante el uso del factor gravimtrico, empleando la sal completa en el numerador del factor, a saber: % NiSO4.6H2O = F * pp * 100 / Gm = (262,8588 / 288,71) * (0,2694 * 100) / 0,3479 = 70,5 %
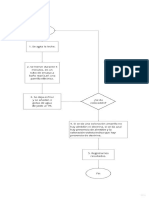
ESQUEMA:
50 ml agua 5 ml HCl (1:1)
Muestra verde
llevar a 200 ml calentar a 80C verde amarillento
30 ml Dmg
NH4OH hasta precipitar
llevar a bao mara 30 min
enfriar 45 min ir verificando con bao de agua fra en el sobrenadante
filtrar con vaco suave
reconocer Ni++ en el filtrado
lavar con agua a estufa, desecador y pesada hasta constancia de peso
16
Indice 1. Introduccion 2. Factores gravimtricos 3. Clculo de porcentajes 4. Clculo de pesos atmicos 5. Clculos en los que interviene una muestra en peso como factor 6. Clculos referidosa la muestra seca 7. Mtodos gravimtricosindirectos 8. Bibliografa 1. Introduccion El anlisis gravimtrico est basado en la Ley de las proporcionesdefinidas, que establece que, en cualquier compuesto puro, las proporciones enpeso de los elementos constituyentes siempre son las mismas, y en la Ley de laconsistencia de la composicin, que establece que las masas de los elementosque toman parte en un cambio qumico muestran una relacin definida einvariable entre s. El anlisis gravimtrico consiste en determinar la cantidad proporcionada deun elemento, radical o compuesto presente en una muestra, eliminando todas lassustancias que interfieren y convirtiendo el constituyente o componente deseadoen un compuesto de composicin definida, que sea susceptible de pesarse. Los clculos se realizan con base en los pesos atmicos y moleculares, y sefundamentan en una constancia en la composicin de sustancias puras y en lasrelaciones ponderales (estequiometra) de las reacciones qumicas. Un cloruro soluble, como el cloruro de sodio, tratado con una sal soluble deplata, da un precipitado de cloruro de plata, que puede ser filtrado, lavado,desecado y pesado. La reaccin qumica que se lleva a cabo se puederepresentar por la ecuacin molecular: NaCl AgNO3 NaNO3 AgCl (slido) (58,44) (169,87) (84,97) (143,32) que indica que 143,32 partes en peso de cloruro de plata se obtienen de 58,44partes en peso de cloruro de sodio, entonces, cualquier peso dado de cloruro deplata proviene de cloruro de sodio en la misma relacin. Ejemplo 1 Qu peso de NaCl dar lugar a 0,500 g de AgCl? Solucin:
g NaCl = 0,500 g AgCl x
= 0,2039 g NaCl
El factor gravimtrico, NaCl / AgCl , es la relacin del peso frmula dela sustancia original, NaCl, a la sustancia pesada, AgCl; utilizando dichofactor se convertir cualquier peso dado de AgCl en el peso de NaCl que loorigina. En trminos generales:
g de sust. buscada = g de sust. pesada x en donde a y b son los coeficientes necesarios para representar la estequiometra de las sustancias involucradas en la reaccin llevada a cabo. En el ejemplo 1, a = b = 1. Ejemplo 2 Calcular el peso de BaCl2 que da lugar a 0,500 g de AgCl.
Solucin: Cada mol de BaCl2 produce 2 moles de AgCl: BaCl2 2AgCl (208,25) (2 x 143,32) El factor gravimtrico en este caso es BaCl2 / 2AgCl ; de donde
g BaCl2 = 0,500 g AgCl x
= 0,3633 g BaCl2
2. Factores gravimtricos Un factor gravimtrico (o factor qumico) puede definirse como el peso deuna sustancia deseada equivalente al peso unitario de una sustancia dada. Losfactores gravimtricos se obtienen con base en las siguientes reglas: 1. El factor gravimtrico est representado siempre por el peso atmico o el peso frmula de la sustancia buscada por numerador y el peso de la sustancia pesada por denominador. 2. Aunque la conversin de la sustancia que se busca en la que se pesa se verifica mediante una serie de reacciones, solamente estas dos sustancias estn implicadas en el clculo del factor; no se tienen en cuenta las sustancias intermedias. 3. El nmero de veces que los pesos atmicos o formulares de las sustancias figuran en el numerador y en el denominador del factor, debe representar la estequiometra de la reaccin qumica que se lleva a cabo. En la secuencia de reacciones representada a continuacin: As2S3 2H3AsO4 2Ag3AsO46Ag 6AgCl (buscado) (pesado) el factor gravimtrico es As2S3 / 6AgCl . El numerador yel denominador no tienen ningn elemento en comn, pero el factor representala estequiometra de la reaccin que tiene lugar. Se prescinde de las etapasintermedias, y slo se tiene en cuenta la relacin estequiomtrica entre lassustancias inicial y final. Los factores gravimtricos son fundamentales para realizar los clculos,especialmente cuando se hacen anlisis repetidos de un determinadoconstituyente. Por ejemplo, el factor Cl / AgCl = 35,45 / 143,32 = 0,2473 es elmismo para todas las determinaciones de cloro pesado en forma de cloruro deplata, independientemente de la forma original del cloro que se determina. 3. Clculo de porcentajes Puesto que el factor gravimtrico representa el peso del elemento ocompuesto deseado equivalente a un peso unitario del elemento o compuestopesado, puede calcularse el peso de la especie deseada a partir de cualquierpeso de la especie pesada. El porcentaje de esa sustancia presente en la muestrapuede encontrarse dividiendo entre el peso de la muestra y multiplicando por100. Ejemplo 3 Una muestra de 0,400 g , que contiene cloruro, da un precipitado de cloruro deplata que pesa 0,250 g ; calcular el porcentaje de cloro en la muestra. Solucin: el peso de cloro en la muestra se calcula as
g Cl = g AgCl x Cl / AgCl = 0,250 x
= 0,06184 g Cl
Este peso de cloro est contenido en 0,400 g de muestra; el porcentaje de cloro ser entonces:
% Cl =
x 100 = 15,46 % Cl
En general, se puede utilizar la siguiente frmula para calcular porcentajes:
% de X en la muestra = en la que X es la sustancia buscada, Y es la sustancia pesada, a y b son los coeficientes de X y Y, respectivamente, necesarios para expresar la relacin estequiomtrica correcta entre ambas sustancias. Ejemplo 4 Una muestra de 0,500 g de magnetita impura (Fe3O4) se convierte por medio de reacciones qumicas en Fe2O3 , que pesa 0,4110 g. Cul es el porcentaje de Fe3O4 en la magnetita ? Solucin: el peso de Fe3O4 en la muestra se calcula as
g Fe3O4 = g Fe2O3 x 2Fe3O4 / 3Fe2O3 = 0,4110 g x y el porcentaje de Fe3O4 en la muestra es
= 0,397 g
% Fe3O4 =
x 100 = 79,4 % Fe3O4
4. Clculo de pesos atmicos El procedimiento experimental que normalmente se sigue para determinar valores de pesos atmicos es preparar, a partir del elemento, un compuesto con alto grado de pureza. Este compuesto se pesa y los porcentajes de sus constituyentes se determinan gravimtricamente. Los clculos matemticos que se realizan son exactamente similares a los de un anlisis gravimtrico, excepto que el peso atmico del elemento deseado es el nico factor desconocido. Ejemplo 5 2,56823 g de cloruro de sodio cuidadosamente purificado produjeron 6,2971 g de cloruro de plata. Suponiendo que los pesos atmicos del cloro y de la plata que se tomaron fueron de 35,457 y 107,880 respectivamente, calcule el peso atmico del sodio.
Solucin: Peso del NaCl = peso del AgCl x
2,56823 = 6,2971 x
2,56823 = 6,2971 x
Despejando Na: Despejando Na:
Na =
- 35,457 = 23,002
5. Clculos en los que interviene una muestra en peso como factor En trabajo industrial, en donde se analiza un gran nmero de muestras de materiales similares, a veces es deseable regular el peso de la muestra de manera que el peso del producto final obtenido, multiplicado por un factor simple, sea exactamente igual al porcentaje del constituyente deseado. Debido a esto, y sin mucha experiencia en pesar con exactitud, es posible tener la muestra pesada directamente contra una tara, y al mismo tiempo, eliminar tanto los tediosos clculos necesarios para cada anlisis, como la posibilidad de errores matemticos. El clculo del porcentaje de un constituyente deseado en un anlisis qumico que requiera una determinacin gravimtrica se realiza por medio de la frmula:
%=
gramos del producto X factor gravimtrico gramos de la muestra
x 100
Ejemplo 6 El factor gravimtrico de cierto anlisis es 0,3427. Se desea regular el peso de la muestra tomada de manera que (a) cada centigramo del precipitado obtenido represente el 1% del constituyente deseado, (b) el porcentaje sea el doble del nmero de centigramos del precipitado. Qu peso de muestra debe tomarse en cada caso? Solucin: a. La relacin entre el peso del precipitado y el porcentaje del constituyente es tal, que 0,01 g 1 %. Por tanto,
1=
0.01 x 0.3427 X
x 100 ;
X = 0,3427 g
2=
0.01 x 0.3427 X
x 100 ;
X = 0.1714 g
b.
Ejemplo 7 Qu peso de muestra debe tomarse en un tipo de anlisis para que 10,00 mg de cloruro de plata precipitado represente el 1,00 % de cloro en la muestra? Solucin: factor gravimtrico = Cl / AgCl = 0,2473
1,00 % Cl =
x 100
g muestra =
x 100 = 0,2473 g
6. Clculos referidos a la muestra seca Para las muestras que tienden a ganar o perder humedad con facilidad, los anlisisen distintos tiempos y en condiciones diferentes de almacenamiento no resultanconcordantes. Con estas muestras pueden seguirse dos procedimientos: (1) dejarsecar la muestra al aire hasta constancia de peso; (2) desecar la muestra en unaestufa a unos 110 C (procedimiento habitual). Los constituyentes se determinan con referencia a la muestra seca y despuspueden referirse a la muestra tal como se recibe, conocida la prdida de pesopor desecacin, que se determina aisladamente. Como en la desecacin seelimina un constituyente de la muestra (el agua), los dems constituyentesquedarn en la muestra seca en una proporcin superior a la que tenan en lamuestra original. Ejemplo 8 Una muestra de sal de Glauber comercial (Na2SO4 10H2Oimpuro) contiene el 20,0 % de SO3 . Una muestra exactamente de 1 g ,desecada en estufa, deja un residuo que pesa 0,52 g. (a) Calcular el porcentajede agua en la muestra . (b) Calcular el tanto por ciento de SO3 respectoa la muestra seca. Solucin: Para resolver este tipo de problemas debemos tener en cuenta las siguientes frmulas,las cuales nos servirn para calcular algunas cantidades:
% Y m.o. =
(1)
% Y m. d. =
(2)
en donde Y es el constituyente analizado y las abreviaturas m.o. y m.d. significan muestra original y muestra desecada, respectivamente. a. Para hallar el porcentaje de agua en la muestra, debemos tener en cuenta la cantidad de partida (1 g) y la cantidad obtenida por desecacin (0,52 g)
% de agua =
x 100 = 48,0 %
b. Para calcular el porcentaje de SO3 podemos utilizar la ecuacin (2) ya que se refiere a un componente de la muestra desecada.
% SO3 m. d. =
= 38,5 %
7. Mtodos gravimtricos indirectos Algunos pares de sustancias difciles de separar pueden determinarseindirectamente si cumplen con las siguientes condiciones: (1) Pueden obtenerseconjuntamente en forma pura para la pesada; (2) contienen un elemento (ion) comnque puede convertirse en otro producto
y ser pesado como tal, o pueden serconvertidas en una mezcla de otros compuestos puros, que se pesan conjuntamente.Por ejemplo, el sodio y el potasio pueden transformarse conjuntamente encloruros (NaCl y KCl) que se pesan. Disuelta esta mezcla de cloruros ytransformado el ion cloruro en cloruro de plata, se pesa de nuevo. Los clculospara estos mtodos, y especficamente para este ejemplo, son los siguientes: Sea Y = g de NaCl KCl y X = g de NaCl , entonces (Y X) = g de KCl Luego se escriben los factores gravimtricos correspondientes:
G AgCl procedentes de NaCl = X
G AgCl procedentes de KCl = (Y X)
G totales de AgCl = X
+ (Y X)
Ahora se sustituyen los factores gravimtricos por valores numricos
G totales de AgCl = X = 2,4524 X 1,9222 (Y X)
+ (Y X)
Al ser conocidos los pesos de AgCl y de la mezcla de cloruros, Y, se resuelvefcilmente la ecuacin para calcular X (gramos de NaCl en la muestra). Una vezcalculados los pesos de cloruro de sodio y cloruro de potasio, el resto de los clculosgravimtricos pueden efectuarse de la manera usual. Los mtodos indirectos no deben aplicarse a la determinacin de unconstituyente que est presente en cantidades muy pequeas, pues cualquiererror en la determinacin del otro constituyente, aunque sea pequeo, sereflejara como error importante de signo contrario en este constituyente. Ejemplo 9 En el anlisis de una muestra de feldespato que pesa 0,4150 g se obtiene unamezcla de KCl NaCl que pesa 0,0715 g. De estos cloruros se obtienen 0,1548 gde K2PtCl6 . Calcule el porcentaje de Na2O enel feldespato. Solucin: Sea x = peso del NaCl en los cloruros combinados Entonces, como los dos cloruros pesan 0,0715 g , 0,0715 x = peso del KCl Ahora se calculan los gramos de NaCl a partir del K2PtCl6 :
(0,0715 x) x
= 0,1548
Despejando x se tiene x = 0,0240 g de NaCl Luego se calcula el porcentaje de Na2O estableciendo el factor gravimtrico entre Na2O y NaCl ,
x 100 = 3,07 % de Na2O Ejemplo 10 En el anlisis de una muestra de feldespato de 0,5000 g se obtiene una mezcla de cloruros de sodio y de potasio que pesa 0,1180 g . Un tratamiento posterior con AgNO3 produce 0,2451 g de AgCl. Cul es el porcentaje de Na2O y de K2O en la muestra? Solucin: Sea x = peso de KCl y = peso de NaCl x + y = 0,1180 (1)
Gramos de AgCl que se obtienen de x g de KCl = x
= 1,922 x
Gramos de AgCl que se obtienen de y g de NaCl = y Entonces : 1,922 x 2,452 y = 0,2451 (2)
= 2,452
Ahora se resuelve el sistema de ecuaciones que forman (1) y (2),
(La resolucin de este sistema de ecuaciones queda como ejercicio para el lector) Resolviendo el sistema de ecuaciones se obtienen los valores: x = 0,0835 g de KCl y = 0,0345 g de NaCl Por ltimo se calculan los porcentajes pedidos:
% K2O =
x 100 = 10,5 % K2O
% Na2O = 8. Bibliografa
x 100 = 3,66 % Na2O
Ayres, G. (1970). Clculos en anlisis gravimtrico. En, G. Ayres, Anlisisqumico cuantitativo (pp. 209-215). Mxico: Editorial Harla. Hamilton, L. (1988). Clculos de anlisis gravimtricos. En, L. Hamilton, Clculosde qumica analtica (pp. 107-125). Mxico: McGraw Hill.
You might also like
- Determinación Gravimétrica Del Calcio Como Carbonato de CalcioDocument21 pagesDeterminación Gravimétrica Del Calcio Como Carbonato de CalcioJoan Torres100% (3)
- Ejercicios de Volumetria RedoxDocument7 pagesEjercicios de Volumetria RedoxjmattaNo ratings yet
- Q.A. - Clase 09 - Gravimetría Fundamentos PDFDocument29 pagesQ.A. - Clase 09 - Gravimetría Fundamentos PDFAngel CondoriNo ratings yet
- Estequiometria Con SolucionesDocument126 pagesEstequiometria Con Solucionescarlos lopezNo ratings yet
- Metodos GravimetricosDocument9 pagesMetodos GravimetricosMiguel Torres67% (3)
- Analisis GravimétricoDocument29 pagesAnalisis GravimétricoRosmeri Delinda QUISPE FLORESNo ratings yet
- Ejercicios Resueltos #05Document4 pagesEjercicios Resueltos #05RENATO JAIR COSTA MINGANo ratings yet
- Marcha Analítica Del Grupo I de Cationes Pb2+, Ag+ y Hg2 2+ PDFDocument2 pagesMarcha Analítica Del Grupo I de Cationes Pb2+, Ag+ y Hg2 2+ PDFAlejandra Patiño GarcíaNo ratings yet
- Cuestionario de Analitica (1) VolumetriaDocument27 pagesCuestionario de Analitica (1) VolumetriasegundoNo ratings yet
- Prac 3 Determinaciòn de Cloruros Por GravimetriaDocument3 pagesPrac 3 Determinaciòn de Cloruros Por Gravimetriar0a9f0a260% (5)
- Ejercicios GravimetriaDocument6 pagesEjercicios GravimetriaYenny Karin Perez Villar100% (1)
- Examen Parcial de Quimica AnaliticaDocument3 pagesExamen Parcial de Quimica Analiticaeltauro_123_44134405No ratings yet
- Ejercicios de PrecipitaciónDocument2 pagesEjercicios de PrecipitaciónLenin Gil GilNo ratings yet
- Ejercicios GravimetriaDocument2 pagesEjercicios GravimetriaJesus David Urbano TelloNo ratings yet
- Determinación Gravimétrica de Plomo en Forma de SulfatoDocument2 pagesDeterminación Gravimétrica de Plomo en Forma de SulfatoAnel GCNo ratings yet
- Ejercicios de GravimetríaDocument1 pageEjercicios de Gravimetríaernest0% (2)
- Introducción A La GravimetriaDocument10 pagesIntroducción A La GravimetriaAsdg SdfghfdNo ratings yet
- Ejercicios de Gravimetría IDocument5 pagesEjercicios de Gravimetría IJuan AguilarNo ratings yet
- Practica 2Document3 pagesPractica 2MARIA CRISTINA ELDA PEREDO LOPEZ50% (2)
- Tema4-Metodos Gravimetricos Ejercicios ResueltosDocument20 pagesTema4-Metodos Gravimetricos Ejercicios ResueltosConus GeographusNo ratings yet
- Clasificación de ValoracionesDocument2 pagesClasificación de ValoracionesItzel MirelesNo ratings yet
- Solución Estándar PDFDocument4 pagesSolución Estándar PDFFuerza M Duro de Roer100% (1)
- Química Analitica Unidad IiDocument56 pagesQuímica Analitica Unidad IiJaair Saalazar50% (6)
- Practica de Laboratorio No.2 - Análisis Volumétrico PDFDocument4 pagesPractica de Laboratorio No.2 - Análisis Volumétrico PDFnewtonNo ratings yet
- Tarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Document10 pagesTarea Sobre Análisis Gravimétrico Guia de Ejercicios 2Pamela Varela100% (1)
- Cuestionario Humedad Materia Seca y CenizasDocument1 pageCuestionario Humedad Materia Seca y CenizasJulio E Martinez HernandezNo ratings yet
- Problemario MC Equipo 6Document13 pagesProblemario MC Equipo 6Andrea Renteria GuzmanNo ratings yet
- Errores en Analisis QuimicosDocument3 pagesErrores en Analisis Quimicosstefy castillo50% (2)
- Problemas de Curva de Calibracion y Adicion EstandarDocument16 pagesProblemas de Curva de Calibracion y Adicion EstandarLeo0% (1)
- Taller 2323Document5 pagesTaller 2323Stiven ManriqueNo ratings yet
- Pesada de La MuestraDocument2 pagesPesada de La MuestraSof Romero100% (1)
- Unidad 5 Analisis Gravimetrico PDFDocument8 pagesUnidad 5 Analisis Gravimetrico PDFMarko Cardenas Alcantara100% (1)
- 2-4 Ejercicios HarveyDocument75 pages2-4 Ejercicios HarveyMaría Gabriela Quinga100% (1)
- El Zinc en Una Muestra de 0Document1 pageEl Zinc en Una Muestra de 0Carlos Madera Sarmiento100% (2)
- Presentación PrecipitometríaDocument22 pagesPresentación PrecipitometríaeleazarNo ratings yet
- Ejercicios - de Ceniza, Humedad y Kjeldad PDFDocument11 pagesEjercicios - de Ceniza, Humedad y Kjeldad PDFEvaMarie Chavarry100% (1)
- Peso Seco - BiomasaDocument5 pagesPeso Seco - BiomasaRojas Xicohtencatl David EduNo ratings yet
- Valoracion ChemlabDocument7 pagesValoracion ChemlababiNo ratings yet
- Inf CURVAS DE CALIBRACIÓN (1) - KarenDocument11 pagesInf CURVAS DE CALIBRACIÓN (1) - KarenTatiana GuashpaNo ratings yet
- Unidad 3.1. Clasificación de Las Técnicas InstrumentalesDocument36 pagesUnidad 3.1. Clasificación de Las Técnicas InstrumentalesFatima ColombianaNo ratings yet
- Ejercicios VolumetriaDocument5 pagesEjercicios VolumetriaAnonymous NxaUYUL100% (2)
- Unidad V Métodos VolumétricosDocument17 pagesUnidad V Métodos VolumétricosVivi Mar CSi25% (4)
- Aplicaciones de Los Métodos Gravimétricos en El Campo de Ingeniería QuímicaDocument2 pagesAplicaciones de Los Métodos Gravimétricos en El Campo de Ingeniería QuímicaAnaly RodriguezNo ratings yet
- Taller1 - Volumetría 2020Document3 pagesTaller1 - Volumetría 2020Valentina CalleNo ratings yet
- Determinación Gravimetrica de SulfatosDocument4 pagesDeterminación Gravimetrica de SulfatosDaimon Scrhondinger100% (1)
- GRAVIMETRIADocument8 pagesGRAVIMETRIALizeth Leon ChavezNo ratings yet
- El Método Fajans o Agronometría Es Utilizado en Química Analítica Descubierta Por El Físico y Químico Polaco Kasimir FajansDocument2 pagesEl Método Fajans o Agronometría Es Utilizado en Química Analítica Descubierta Por El Físico y Químico Polaco Kasimir FajansAngela Rodriguez AlmonacidNo ratings yet
- Resolucion de Problem As. Cinthia GallegosDocument53 pagesResolucion de Problem As. Cinthia GallegosCinthia Gallegos67% (3)
- Taller Acido Base AnaliticaDocument6 pagesTaller Acido Base AnaliticaValeria Marin Martinez0% (2)
- Cuestionarioinf5 OrgaDocument2 pagesCuestionarioinf5 Orgamela75% (4)
- Marcha Analitica PDFDocument9 pagesMarcha Analitica PDFCarloXs Xs MglNo ratings yet
- Paper Analitica Marcha Grupo 4Document2 pagesPaper Analitica Marcha Grupo 4Cristian PozoNo ratings yet
- Métodos GravimétricosDocument10 pagesMétodos GravimétricosHaydee LòpezNo ratings yet
- Anal It 1Document16 pagesAnal It 1Vanessa AguasNo ratings yet
- Determinación Gravimétrica Del NíquelDocument12 pagesDeterminación Gravimétrica Del Níqueljasmin fiorellaNo ratings yet
- Métodos GravimétricosDocument31 pagesMétodos GravimétricoshanscortesNo ratings yet
- Determinación Gravimétrica de AluminioDocument5 pagesDeterminación Gravimétrica de AluminioCynthia Liliana Roca Pelayo0% (1)
- GUIA Laboratorio Analítica Práctica 4 I - 2020Document12 pagesGUIA Laboratorio Analítica Práctica 4 I - 2020Nancy Tola FloresNo ratings yet
- 2T Análisis GravimétricoDocument12 pages2T Análisis GravimétricoHenry RodriguezNo ratings yet
- Práctica 2 Química AnalíticaDocument7 pagesPráctica 2 Química AnalíticaGenesis Fajardo IgotsevenNo ratings yet
- Ficha 01 Sesion N 01 Densidad y Peso EspecificoDocument2 pagesFicha 01 Sesion N 01 Densidad y Peso EspecificoJoel JoeNo ratings yet
- Tema 25 - Soldadura de Materiales DisimilesDocument22 pagesTema 25 - Soldadura de Materiales DisimilesVictorx A. QquenayaNo ratings yet
- CATALOGO X MAYOR BIOAQUA - COLOMBIA Oct 3Document196 pagesCATALOGO X MAYOR BIOAQUA - COLOMBIA Oct 3AdalinaVidalTovarNo ratings yet
- Voladura Secundaria5Document29 pagesVoladura Secundaria5ElvisArticaNo ratings yet
- MacronutrientesDocument62 pagesMacronutrientesjuan pabloNo ratings yet
- Practica 2 - DisolucionesDocument13 pagesPractica 2 - DisolucionesHxjNo ratings yet
- Eeym U1 A2 MiemDocument8 pagesEeym U1 A2 MiemMisael EslavaNo ratings yet
- Bradford Vs LowryDocument4 pagesBradford Vs LowryMinerva Resendiz Ballado100% (1)
- Cuestionario 3Document5 pagesCuestionario 3Christina SanchezNo ratings yet
- Taller de Estado SolidoDocument2 pagesTaller de Estado SolidodanielNo ratings yet
- T-2 Diagramas de Flujo de Pruebas de Plataforma en LecheDocument6 pagesT-2 Diagramas de Flujo de Pruebas de Plataforma en LecheOLAN BARBOSA JESUS ARTURONo ratings yet
- Tarea 4 Fluidos Del ReservorioDocument12 pagesTarea 4 Fluidos Del ReservorioGonzalo vargasNo ratings yet
- Activacion Superficial PDFDocument110 pagesActivacion Superficial PDFLuis AlarconNo ratings yet
- 02 Manual Equipo, Et Rodi 100GPDDocument9 pages02 Manual Equipo, Et Rodi 100GPDCHRISTIAN FIDEL VILCA OJEDANo ratings yet
- 10-2,3) Resumen TareaDocument2 pages10-2,3) Resumen TareacarolinaNo ratings yet
- Ficha Técnica PectinaDocument5 pagesFicha Técnica PectinaNatalia Rivera González0% (1)
- Practica 5 HeteroDocument8 pagesPractica 5 HeteroAmérica GómezNo ratings yet
- Centro Universitario de Ciencias de La Salud Licenciatura en Médico Cirujano y Partero Departamento de Fisiología Academia de FarmacologíaDocument48 pagesCentro Universitario de Ciencias de La Salud Licenciatura en Médico Cirujano y Partero Departamento de Fisiología Academia de FarmacologíaMarisol Vazquez GuerreroNo ratings yet
- 12 Principios de La Química VerdeDocument27 pages12 Principios de La Química VerdeRicardo Alfonso Trujillo SantillanaNo ratings yet
- Examen Recuperación Tecnologia C° - VacacionalDocument2 pagesExamen Recuperación Tecnologia C° - VacacionalEver CóndorNo ratings yet
- Wo 13235Document2 pagesWo 13235Ramses DelgadoNo ratings yet
- Manual-Química Farmaceutica 2Document32 pagesManual-Química Farmaceutica 2Martin LinoNo ratings yet
- KhsehbivkerDocument6 pagesKhsehbivkerMarco Fernández talledoNo ratings yet
- 5.1 Inv. Diferentes Tecnicas de Estudio de La CelulaDocument10 pages5.1 Inv. Diferentes Tecnicas de Estudio de La CelulazcanosalazarNo ratings yet
- Ord Números EnterosDocument2 pagesOrd Números Enterosjoas tapNo ratings yet
- Como Identificar El Material A SoldarDocument26 pagesComo Identificar El Material A SoldarNicolas Andres Araya VillalobosNo ratings yet
- Manual de Química Análitica EstDocument36 pagesManual de Química Análitica EstEduardo VegaNo ratings yet
- Alcaloides Totales y Actividad Antioxidante de Extractos Metanólicos de Hojas de Ipomoea Murucoides (Casahuate)Document78 pagesAlcaloides Totales y Actividad Antioxidante de Extractos Metanólicos de Hojas de Ipomoea Murucoides (Casahuate)Héctor Reyes TapiaNo ratings yet
- Acabados de Interiores y ExterioresDocument14 pagesAcabados de Interiores y ExterioresLilaloSegoviaAnguloNo ratings yet
- Laboratorio de Termofluidos PDFDocument78 pagesLaboratorio de Termofluidos PDFDavid A. GutierrezNo ratings yet