Professional Documents
Culture Documents
Obtencion Del Hidrogeno
Uploaded by
KarenRosioMoreiraCruzCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Obtencion Del Hidrogeno
Uploaded by
KarenRosioMoreiraCruzCopyright:
Available Formats
U.M.R.P.S.F.X.
CH
FACULTAD DE TECNOLOGIA
PRACTICA N1
OBTENCION DEL HIDROGENO
FECHA DE PRCTICA:07 /04/2014
FECHA DE ENTREGA: 14/04/2014
SIGLA: QMC 204
GRUPO: LUNES HORA: 18:00 a 20:00
INTEGRANTE DEL GRUPO:
CARRERA: ING. QUIMICA
SEMESTRE: SEGUNDO
NOTA:
NOMBRE DEL DOCENTE: ING. MARIO ALVAREZ GAMBARTE
PRACTICA N2
OBTENCION DE HIDROGENO
1. OBJETIVOS
Preparar hidrogeno en laboratorio por una de las reacciones estudiadas en teora y
posteriormente comprobar algunas propiedades fsicas y qumicas.
2. OBJETIVOS ESPECIFICOS
Obtener el gas hidrgeno por desplazamiento a partir de varios metales sobre
cidos.
Conseguir un buen conocimiento de la serie de actividad de los metales.
Aplicar la tcnica de recoleccin de gases sobre agua.
Estudiar algunas de las propiedades del Hidrgeno.
3. MARCO TEORICO
La separacin del hidrogeno en la capacidad que tienen los elementos reductores tales
como el zinc, aluminio, cobre y hierro, segn el potencial de electrodo que tiene cada
uno de estos elementos.
Tambin se puede obtener hidrogeno por efecto de la corriente elctrica que produce
la electrolisis de agua para separar hidrogeno de oxigeno cuando existe una solucin
acido o alcalina que permite conducir corriente.
4. MONTAJE EXPERIMENTAL
a)
Reduciendo
b)
Agua acidulada
5. MATERIALES, EQUIPOS Y REACTIVOS
Voltmetro de Hoffman con electrodos de platino.
Transformador de corriente.
Pinzas para tubos de ensayo.
Capilares de vidrio tapones de goma bihoradados
Mechero bunsen.
cido sulfrico.
Aluminio de lminas.
Zinc en granallas.
6. PROCEDIMIENTO
a) Armar el equipo para desprender el hidrogeno utilizando un Erlenmeyer con
tapn de goma bihoradado, que se utiliza uno de las horadaciones para cargar
el cido y el otro para desplegar hidrogeno y los dispositivos para recoger el
hidrogeno desplazado que consiste en tres tubos de ensayo invertidos llenos
de agua y sumergidos y sumergidos en una cubeta con agua.
Para iniciar la experimentacin se coloca Zinc o Aluminio en el Erlenmeyer se
cubre con agua y luego se carga el cido Sulfrico o Clorhdrico, se calienta si es
necesario para iniciar la reaccin. Una vez iniciada la reaccin se conduce por
medio de tubos capilares el gas Hidrogeno al fondo de los tubos de ensayo que
estn llenos de agua y que por la presin de gas se va desplazando al nivel de
agua.
b) Utilizando el voltmetro de Hoffman se realiza las siguientes operaciones:
Armar el equipo y suministrar de energa elctrica que debe ser de alta
intensidad y bajo voltaje.
Instalar los electrodos.
Cargar agua acidulada con cido sulfrico hasta llenar las dos
columnas.
Suministrar energa de corriente continua CC, observar que en la
electrolisis se produce el desprendimiento de gas por el
desdoblamiento de Hidrogeno y Oxigeno que se acumulan en la parte
superior de las columnas, observar que en una de las columnas se
acumulan los gases en una proporcin muy notable de 2:1 esta
contiene el Hidrogeno y el otro Oxigeno. Cuando una de las columnas
ha llenado o ha alcanzado la marca mayor se da por concluida la
prctica y se pasa a probar las propiedades del hidrogeno
especialmente frente a la llama y su capacidad de reduccin
especialmente frente al Permanganato de potasio (
o
tricloruro frrico (
.
7. OBSERVACIONES
En el experimento (a):
Se observa que el Zn va decolorando lentamente a medida que va
reaccionando as que para decolorar ms rpido se necesita ms hidrogeno.
Cuando empieza a salir el vapor de agua se observ que ya no produce ms
oxgeno.
En el casi del Zinc es oxidante y el hidrogeno est reduciendo
En el caso del Mn el hidrogeno termina siendo reductor.
En el experimento (b):
Se observa que el cido sulfrico hace que el agua sea conductora por que el
cido se disocia y aportara electrones al medio.
8. CONCLUSIONES
a. Para comprobar la existencia del hidrogeno comprobamos y le aadimos fuego
al tubo de ensayo y se pudo observar que se obtuvo una explosin mnima esto
nos confirma el xito de nuestro experimento por lo que concluimos que
obtuvimos el hidrogeno a partir del Zinc ms cido sulfrico exitosamente.
b. En la electrolisis se us un voltaje de 6 vol. Y se observ que va generando
hidrogeno pero no se pudo ver porque de los dos voltmetros escapa el
hidrogeno.
Tambin aprendimos nuevas cosas como son lo que es al cido sulfrico y su
gran utilidad; conocimos instrumentos nuevos para nosotros como son la
bureta, matraz, de los cuales aprendimos que utilidad le podemos dar en un
laboratorio de acuerdo a las distintas circunstancias.
De esta forma podemos definir de una forma sencilla y breve la electrolisis como
el proceso que Al pasar una corriente elctrica por el agua entre dos electrodos, el
agua se divide en sus dos componentes: hidrgeno y oxgeno.
9. BIBLIOGRAFIA
Enciclopedia Microsoft Encarta 2000. 1993-1999 Microsoft Corporation.
Reservados todos los derechos.
http://es.wikipedia.org/wiki/Electr%C3%B3lisis
http://www.quimicarecreativa.org/hidrogeno1.html
You might also like
- Informe 1Document10 pagesInforme 1JeanNo ratings yet
- Obtención de HidrogenoDocument5 pagesObtención de HidrogenoKevin Jorge VelardeNo ratings yet
- Informe 6Document19 pagesInforme 6Carol Alicia Gonzales SiñaniNo ratings yet
- Quimica 104 Práctica 3Document10 pagesQuimica 104 Práctica 3ShirleyNo ratings yet
- Práctica # 3 Cuestionario Funciones AlcoholesDocument2 pagesPráctica # 3 Cuestionario Funciones AlcoholesPaul Angel Soliz MamaniNo ratings yet
- Práctica # 3 Cuestionario Reconocimiento de Cationes Del Grupo I y IIDocument4 pagesPráctica # 3 Cuestionario Reconocimiento de Cationes Del Grupo I y IIDaniela Maturano100% (1)
- Practica #1Document7 pagesPractica #1Miguel Angel Sejas VillarroelNo ratings yet
- Universidad Nacional Del Callao Facultad de Ingeniería QuímicaDocument21 pagesUniversidad Nacional Del Callao Facultad de Ingeniería QuímicaNerit Paucarcaja BuitrónNo ratings yet
- PRACTICA N°5 Determinción de Aldehidos y Cetonas Copacalle RamosDocument11 pagesPRACTICA N°5 Determinción de Aldehidos y Cetonas Copacalle RamosNahum Agustin Copacalle Ramos ing alimentos100% (1)
- Informe EterDocument4 pagesInforme EterEric MaldonadoNo ratings yet
- Identificación de aniones IV en la Unidad DurangoDocument7 pagesIdentificación de aniones IV en la Unidad DurangoGrecia Hernandez ReyesNo ratings yet
- Práctica 04 - CarbonoDocument3 pagesPráctica 04 - CarbonosherajekiNo ratings yet
- Destilación A Presión ReducidaDocument6 pagesDestilación A Presión ReducidaalbertNo ratings yet
- Informe Nº1Document10 pagesInforme Nº1Jhonny IbañezNo ratings yet
- Reconomientos de CationesDocument8 pagesReconomientos de CationesJhonny IbañezNo ratings yet
- Informe Nº4 (Reconocimento de Cationes Del Grupo I y Ii)Document9 pagesInforme Nº4 (Reconocimento de Cationes Del Grupo I y Ii)Ronal CNo ratings yet
- Formación de SemicarbazonasDocument2 pagesFormación de SemicarbazonasDaniela GaonaNo ratings yet
- Practica N°6 Solubilidad Lab QuimicaDocument5 pagesPractica N°6 Solubilidad Lab QuimicaJesus E. Cabezudo Calderon100% (1)
- Practica 2 EtilenoDocument11 pagesPractica 2 EtilenoAlanRuizNo ratings yet
- Informe N°4 Del Laboratorio de Química GeneralDocument26 pagesInforme N°4 Del Laboratorio de Química GeneralCarlos Mario Conde RodríguezNo ratings yet
- Reconocimiento de cationes G1 y G2Document6 pagesReconocimiento de cationes G1 y G2Kévïn Hinojosa AlvisNo ratings yet
- Informe 7 Del Laboratorio de Química InorgánicaDocument18 pagesInforme 7 Del Laboratorio de Química InorgánicaisaacNo ratings yet
- InorganicaDocument17 pagesInorganicaRicardo A RoweNo ratings yet
- Informe N2 CorregidoDocument7 pagesInforme N2 CorregidoJhonny IbañezNo ratings yet
- Informe 1Document10 pagesInforme 1Viank Adri100% (3)
- TablasDocument3 pagesTablasjoseNo ratings yet
- Guía de laboratorio de química inorgánica sobre ensayos de oxidación y reducciónDocument4 pagesGuía de laboratorio de química inorgánica sobre ensayos de oxidación y reducciónJhonny IbañezNo ratings yet
- Informe N°5 Lab.q.inorganica - Grupo 1Document12 pagesInforme N°5 Lab.q.inorganica - Grupo 1CAICAY OTOYA LUIS EDUARDONo ratings yet
- Punto de Ebullicion CorregidoDocument11 pagesPunto de Ebullicion CorregidoSabrina PestanaNo ratings yet
- Analisis Elemental IIDocument23 pagesAnalisis Elemental IIIsmael Escobar AlvaNo ratings yet
- Informe 3 ElectroquimicaDocument9 pagesInforme 3 ElectroquimicaNelson DiazNo ratings yet
- Lab. Equilibrio Químico..Document8 pagesLab. Equilibrio Químico..Shadia Peña RojasNo ratings yet
- Practica Nº1Document9 pagesPractica Nº1Jhosep Parra ReyesNo ratings yet
- Ácidos Carboxilicos InformeDocument5 pagesÁcidos Carboxilicos InformeCesar Alfonso Rodriguez Maestre0% (1)
- Obtención y Propiedades de Hidrógeno y OxígenoDocument3 pagesObtención y Propiedades de Hidrógeno y OxígenoRosario Ruiz LeónNo ratings yet
- Informe Conductimetria-Daniel Arias 174681 PDFDocument5 pagesInforme Conductimetria-Daniel Arias 174681 PDFDaniel AriasNo ratings yet
- Obtención y propiedades de los halógenos cloro y bromoDocument10 pagesObtención y propiedades de los halógenos cloro y bromoMaria Del CarmenNo ratings yet
- Informe Calores de Neutralización y SoluciónDocument4 pagesInforme Calores de Neutralización y SoluciónPaula Ramirez100% (1)
- Informe Nº6 (Obtencion Del Peroxido de Hidrogno)Document6 pagesInforme Nº6 (Obtencion Del Peroxido de Hidrogno)Ronal CNo ratings yet
- Elementos Del Grupo 18Document56 pagesElementos Del Grupo 18Jelt Linares TrejoNo ratings yet
- Informe de Sintesis de AlquenosDocument10 pagesInforme de Sintesis de AlquenosRAUL ANDRES DIAZ CHACONNo ratings yet
- Analisis Elemental II Organica 1Document22 pagesAnalisis Elemental II Organica 1Meliza Rosi Bravo Castillo0% (1)
- Informe 12Document27 pagesInforme 12AnelizNo ratings yet
- Reaciones QuímicasDocument10 pagesReaciones QuímicasEmily SanchezNo ratings yet
- Halogenos PDFDocument19 pagesHalogenos PDFRoosevelt Villalobos Diaz100% (2)
- Balanza y VolumetríaDocument2 pagesBalanza y VolumetríaLizbeth CaizaNo ratings yet
- Propiedades de Los Alcoholes - InformeDocument11 pagesPropiedades de Los Alcoholes - InformeJavier Alfonso Perez NavarroNo ratings yet
- Agentes DesecantesDocument44 pagesAgentes DesecantesRossy Moral100% (1)
- Práctica # 2 Cuestionario de EstequiometriaDocument1 pagePráctica # 2 Cuestionario de EstequiometriaAbigail fernandezNo ratings yet
- Obtencion de EtenoDocument6 pagesObtencion de EtenoLuis Zamora0% (1)
- Practica2 172735Document10 pagesPractica2 172735luis marioNo ratings yet
- Reacción y Preparación de Complejos de NiDocument4 pagesReacción y Preparación de Complejos de Ni708170No ratings yet
- Máquina de Movimiento PerpetuoDocument8 pagesMáquina de Movimiento PerpetuoMimi MuñozNo ratings yet
- Informe de Laboratorio 5 Quimica Organica 132Document14 pagesInforme de Laboratorio 5 Quimica Organica 132Joseph Sulca MartinezNo ratings yet
- Informe de Lab de Ing QuimicaDocument4 pagesInforme de Lab de Ing QuimicaNelson Diaz100% (1)
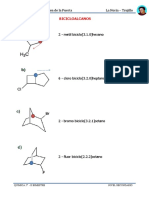
- BicicloalcanosDocument3 pagesBicicloalcanosGrecia NicolleNo ratings yet
- Informe de Inorganica (Oxigeno-Peroxido de Hidrogeno y Azufre)Document5 pagesInforme de Inorganica (Oxigeno-Peroxido de Hidrogeno y Azufre)Katy rcNo ratings yet
- Informe N°3Document7 pagesInforme N°3Antonio TelloNo ratings yet
- NombreDocument5 pagesNombreDiego Paúl Taipe100% (1)
- Obtención de Hidrógeno: Electrólisis y Reacciones ReductorasDocument4 pagesObtención de Hidrógeno: Electrólisis y Reacciones ReductorasKévïn Hinojosa Alvis100% (1)
- Proyecto de Grado de QuinuaDocument134 pagesProyecto de Grado de QuinuaKarenRosioMoreiraCruzNo ratings yet
- Control de Interpretacion 3Document8 pagesControl de Interpretacion 3KarenRosioMoreiraCruzNo ratings yet
- Poeselaboracion2015jmd 150614215013 Lva1 App6891 PDFDocument92 pagesPoeselaboracion2015jmd 150614215013 Lva1 App6891 PDFRojas Evert AlonsoNo ratings yet
- Cecaot HistoriaDocument2 pagesCecaot HistoriaKarenRosioMoreiraCruzNo ratings yet
- Proceso de moldeo de tubos PVCDocument20 pagesProceso de moldeo de tubos PVCKarenRosioMoreiraCruzNo ratings yet
- Reglamento de la Federación de Juntas Vecinales de UyuniDocument12 pagesReglamento de la Federación de Juntas Vecinales de UyuniKarenRosioMoreiraCruz100% (1)
- Proyecto de Grado PlanDocument1 pageProyecto de Grado PlanKarenRosioMoreiraCruzNo ratings yet
- Examen Modulo 2Document5 pagesExamen Modulo 2KarenRosioMoreiraCruzNo ratings yet
- Ejercicios Resueltos de Volumetria PDFDocument431 pagesEjercicios Resueltos de Volumetria PDFLaura Guarguati100% (5)
- 1413 - Granos Andinos Avances Logros y Experiencias Desarrolladas en Quinua Cañahua y Amaranto en BoliviaDocument191 pages1413 - Granos Andinos Avances Logros y Experiencias Desarrolladas en Quinua Cañahua y Amaranto en BoliviaNelson Andres UstarizNo ratings yet
- Reglamento Graduacion 2015Document26 pagesReglamento Graduacion 2015KarenRosioMoreiraCruzNo ratings yet
- Dieño Conceptual de Un ReactorDocument101 pagesDieño Conceptual de Un ReactoriancasvitNo ratings yet
- Metodos de Desaponificado de QuinuaDocument102 pagesMetodos de Desaponificado de QuinuaKarenRosioMoreiraCruzNo ratings yet
- Interpretacion de Los Requisitos para El Sistema de Gestion de Calidad Según NBDocument6 pagesInterpretacion de Los Requisitos para El Sistema de Gestion de Calidad Según NBKarenRosioMoreiraCruzNo ratings yet
- Mejora proceso quinua Centro ImbandinoDocument117 pagesMejora proceso quinua Centro ImbandinoKarenRosioMoreiraCruzNo ratings yet
- DianaMarcela FlorezCortes 2007Document101 pagesDianaMarcela FlorezCortes 2007KarenRosioMoreiraCruzNo ratings yet
- Refinaciamiento y CertificacionDocument6 pagesRefinaciamiento y CertificacionKarenRosioMoreiraCruzNo ratings yet
- Bases de La Educacion Boliviana 2019Document10 pagesBases de La Educacion Boliviana 2019KarenRosioMoreiraCruzNo ratings yet
- Diseño óptimo de ciclonesDocument18 pagesDiseño óptimo de ciclonesAPCANo ratings yet
- 03 EIA 417 TRABAJO D EGRADO Lecho Fluidizado TeoriaDocument109 pages03 EIA 417 TRABAJO D EGRADO Lecho Fluidizado TeoriaKarenRosioMoreiraCruzNo ratings yet
- Titulo de RelatiDocument5 pagesTitulo de RelatiKarenRosioMoreiraCruzNo ratings yet
- Impacto AmbientalDocument255 pagesImpacto AmbientalKarenRosioMoreiraCruzNo ratings yet
- Diseño de EquiposDocument7 pagesDiseño de EquiposKarenRosioMoreiraCruzNo ratings yet
- Competitivdad de La Cadena de Quinua Bolivia, Colombia PeruDocument17 pagesCompetitivdad de La Cadena de Quinua Bolivia, Colombia PerujeduardobravoNo ratings yet
- Investigacion de La Remosion de La Saponina y EnergiaDocument15 pagesInvestigacion de La Remosion de La Saponina y EnergiaKarenRosioMoreiraCruzNo ratings yet
- Escuela Superior Politécnica de Chimborazo: Escuela de Postgrado Facultad de Ciencias. Maestría en Protección AmbientalDocument137 pagesEscuela Superior Politécnica de Chimborazo: Escuela de Postgrado Facultad de Ciencias. Maestría en Protección AmbientalKarenRosioMoreiraCruzNo ratings yet
- Instrumentos de EvaluacionDocument5 pagesInstrumentos de EvaluacionKarenRosioMoreiraCruzNo ratings yet
- Instrumentos de EvaluacionDocument5 pagesInstrumentos de EvaluacionKarenRosioMoreiraCruzNo ratings yet
- Escuela Superior Politécnica de Chimborazo: Escuela de Postgrado Facultad de Ciencias. Maestría en Protección AmbientalDocument137 pagesEscuela Superior Politécnica de Chimborazo: Escuela de Postgrado Facultad de Ciencias. Maestría en Protección AmbientalKarenRosioMoreiraCruzNo ratings yet
- Solicitud PersonalesDocument10 pagesSolicitud PersonalesKarenRosioMoreiraCruzNo ratings yet
- Ecoindicador 99Document3 pagesEcoindicador 99Edgardo RamirezNo ratings yet
- Propiedades MecánicasDocument5 pagesPropiedades MecánicasJosue Acosta Espinoza100% (1)
- Curso de Partículas Magnéticas Nivel Ii Sena 2Document37 pagesCurso de Partículas Magnéticas Nivel Ii Sena 2Juankgx88% (8)
- Pichincha XIV CompletoDocument465 pagesPichincha XIV CompletoJosé YépezNo ratings yet
- Morir Por PemexDocument18 pagesMorir Por PemexTatiana Velásquez ArchiboldNo ratings yet
- Empresa y SustentabilidadDocument244 pagesEmpresa y SustentabilidadprofemariosalazaraltNo ratings yet
- Ing Bas Est Isla VIDocument22 pagesIng Bas Est Isla VIKenny de CornielesNo ratings yet
- Alta MFDocument134 pagesAlta MFkelrzNo ratings yet
- INFRA Catalogo Productos Accesorios SoldadorDocument12 pagesINFRA Catalogo Productos Accesorios Soldadorchente_bNo ratings yet
- Guía de Manejo y Buenas Prácticas de Aplicación de Enmiendas Orgánicas en AgriculturaDocument58 pagesGuía de Manejo y Buenas Prácticas de Aplicación de Enmiendas Orgánicas en AgriculturaFrancisco GuzmanNo ratings yet
- Heurísticas para La Síntesis de ProcesosDocument49 pagesHeurísticas para La Síntesis de ProcesosPedroTiconaNo ratings yet
- Informe de MetalografiaDocument19 pagesInforme de MetalografiaJoel S SanchezNo ratings yet
- Solar Combiner 2015Document20 pagesSolar Combiner 2015Liliana MartinezNo ratings yet
- Cizalla Manual Aslak Metalkraft Ftbs 1050 10 RefDocument16 pagesCizalla Manual Aslak Metalkraft Ftbs 1050 10 RefCarlos Andrés Medina Hernández50% (2)
- M-6v1 El Libro de Las PurificacionesDocument497 pagesM-6v1 El Libro de Las PurificacionesManuel Susarte RogelNo ratings yet
- Disfuncion AtmDocument9 pagesDisfuncion AtmcasillarodrigoNo ratings yet
- Informe de Quimica VerdeDocument17 pagesInforme de Quimica VerdeRomina VM50% (2)
- De Regulacion y Fiscalizacion en SaludDocument25 pagesDe Regulacion y Fiscalizacion en SaludRoberto Alexander Ventura ArribasplataNo ratings yet
- Proceso Ácido FosfóricoDocument17 pagesProceso Ácido Fosfóricoestrella gonzalesNo ratings yet
- TanquesAlmcHidrocarburosDocument6 pagesTanquesAlmcHidrocarburosOrlando Amusquivar EscuderoNo ratings yet
- Producción ácido nítricoDocument16 pagesProducción ácido nítricoJesus Adan LopezNo ratings yet
- Curticion Wet WhiteDocument19 pagesCurticion Wet WhiteMarta Herrero PinazoNo ratings yet
- Analisis y Diseño de Redes de Alcantarillado Sanitario Usando Civil ADSDocument28 pagesAnalisis y Diseño de Redes de Alcantarillado Sanitario Usando Civil ADScorneliortizNo ratings yet
- Practica 5 HexaaminocobaltoDocument4 pagesPractica 5 HexaaminocobaltoFercho Rojas RamosNo ratings yet
- Producción de CiclohexanonaDocument5 pagesProducción de CiclohexanonaOscar Gilberto ParraNo ratings yet
- Partida Def040Document3 pagesPartida Def040masterlemtarmaNo ratings yet
- SideroforosDocument13 pagesSideroforosNadis Cruz MoralesNo ratings yet
- Soluciones Alsina para estructuras de hormigónDocument32 pagesSoluciones Alsina para estructuras de hormigónEdgarNo ratings yet
- Bioseguridad en El Cultivo de Camarones Penaeidos, Una RevisiónDocument22 pagesBioseguridad en El Cultivo de Camarones Penaeidos, Una RevisiónArnaldo FigueredoNo ratings yet
- Chapa aluminio C250 5083 mecanizadaDocument1 pageChapa aluminio C250 5083 mecanizadaSalvador Tercero SalortNo ratings yet