Professional Documents
Culture Documents
Resumen de Avner
Uploaded by
Khristian VinicioCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Resumen de Avner
Uploaded by
Khristian VinicioCopyright:
Available Formats
INTRODUCCION
A LA
METALURGIA FSICA
TABLA DE MATERIAS
Captulo 1 Generalidades
Captulo 2 Estructura y cristalizacin de los metales
Captulo 3 Deformacin Plstica
Captulo 4 Recocido y trabajo en caliente
Captulo 5 Constitucin de las aleaciones
Captulo 6 Diagramas de equilibrio
Captulo 7 El diagrama de equilibrio hierro carbono
Captulo 8 el tratamiento trmico del acero
Captulo I
GENERALIDADES
1.1. Escalas de Temperatura.- La escala de temperatura ms utilizada es la
escala centgrada, sin embrago en plantas industriales norteamericanas se
utiliza la escala Fhrenhert. Para la transformacin de las siguientes escalas
utilizaremos las siguientes ecuaciones.
MEDIDA DE LA TEMPERATURA
La pirometria mide temperaturas elevadas, superiores a los 500c y los
instrumentos con los pirmetros.
La termometra mide temperaturas inferiores a los 500c y los
instrumentos utilizados son los termmetros.
1.2. Medicin de la temperatura mediante el color.- Se observa una relacin
entre la temperatura del metal y su color, pero es poco recomendable
porque una persona da una estimacin y puede variar en el color ya que no
sea uniforme, razn por la cual existen errores al determinar la
temperatura.
Tabla 1.1. Variacin del Calor con la Temperatura
Color Temp C
Rojo incipiente 520
Rojo sombra 620
Cereza naciente 635
Rojo cereza 700
Rojo cereza claro 800
Naranja sombra 900
Naranja 950
Amarillo 980
1.3. Termmetros metlicos que emplean aparatos de medida.- El bulbo se
coloca en el lugar de la temperatura que se desea medir, el tubo en espiral
acciona un sistema indicador al variar su forma.
El bulbo y el tubo en espiral estn unidos por un tubo capilar los cuales
estn llenos de una sustancia adecuada. Estas se clasifican en:
1. Termmetros de dilatacin de lquidos.
2. Termmetros de gas o vapor a presin.
El termmetro de dilatacin de lquidos est encargado con algn lquido
orgnico o mercurio. Al combinar la temperatura del bulbo, el lquido se
dilata cambiando la curvatura del tubo en espiral se necesita dotar al
termmetro algn sistema de compresin.
Mercurio -36 a + 510
Creosota -80 a + 204
Alcohol -80 a + 70
Pentano -200 a + 30
El termmetro de vapor a presin se encarga con un lquido voltil, en el
bulbo siempre debe haber lquido y vapor. Este produce una variacin de
presin que se transmite en el tubo espiral y seala la temperatura
correspondiente en funcin de la presin del vapor. Mide temperaturas
entre -50 y +250c. Los lquidos utilizados son el cloruro de metilo, el ter,
el alcohol etlico y el tolueno. El termmetro de gas a presin es similar al
del vapor, este utiliza nitrgeno en su interior y mide temperaturas entre -
268 a +650c.
1.4. Termmetros de resistencia elctrica.- se basa en el incremento que
experimenta la resistencia elctrica de un conductor metlico al aumentar
su temperatura. El conductor est constituido por un alambre metlico de
cobre, nquel o platino. El nquel y cobre miden temperatura entre 65 y
260c y platino entre -212 y +593c. Estos termmetros son muy frgiles.
1.5. Pirmetros termoelctricos.- Son utilizados en industrias metalrgicas
para la medida de temperaturas hasta ms 1700c.
Efecto Peltier.- Se cre una f.e.m., si se establece contacto elctrico entre dos
hilos de metales distintos
Efecto Thomson.- Si en dos extremos de un conductor homogneo hay
diferentes temperaturas, entre ellas se crea un F.e.m.
1.6. Constitucin de los termopares.- El temrinal positivo se une al material
citado en primer lugar
Chromel Alumel.- Formado por un hilo de Chromel (aleacin
compuesta por un 90% de nquel y un 10% de cromo) y otro de
Alumel (aleacin cuya composicin es 94% de nquel, 3% de
magnesio, 2% de aluminio y 1% de silicio). La temperatura de
medicin est comprendida entre 150 y 760.
Cobre Constantan.- Difiere ligeramente del anterior y puede
contener pequeas cantidades de hierro y de magnesio. La
temperatura de medicin est comprendida entre -250c y 300c.
Platino Platino con 10% de Radio.- Es de las llamadas metales
nobles y se utiliza en la medicin de temperaturas muy elevadas
comprendidas entre 0 y 1650c pero el comportamiento en
atmosferas reductoras es muy malo, ya que se deteriora
rpidamente.
1.7. Medida de la f.e.m..- La temperatura de la unin caliente se determina
midiendo la f.e.m. generada en el circuito. Se puede utilizar un voltmetro o
un potencio mtrico cuyas escalas pueden estar graduadas en mili voltios o
proporcionar directamente las temperaturas.
1.8. Pirmetros registradores y reguladores.- Al sustituir la aguja de un
aparato potencio mtrico por una pluma al resbalar sta sobre un diagrama
mvil, obtendremos una representacin grfica de las temperaturas.
Cuando se utilizan varios termopares puede utilizarse un solo aparato
registrado y regulador de la temperatura.
1.9. Pirmetros de radiacin.- Se basa en fenmenos de relacin que exige el
conocimiento de lo que se entiende por cuerpo negro. Tiene la propiedad
de absorber todas las radiaciones que recibe y emite ms energa que
ningn otro cuerpo a la misma temperatura.
W = Kr
4
W = energa emitida por el cuerpo negro
K = constante de proporcionalidad
T = temperatura absoluta del cuerpo
Si se mide la temperatura aparente de los cuerpos reales, el valor que se
obtiene es siempre inferior a la temperatura verdadera.
1.10. Pirmetros pticos.- constituyen el fundamento de los pirmetros de
radiacin. Se compara la intensidad luminosa del cuerpo cuya temperatura
se quiere medir con la emitida por una fuente luminosa de caractersticas
conocidas que se utiliza como referencia.
El ms utilizado en la industria es el de desaparicin del filamento, consta
de dos partes principales un anteojo y el sistema de alimentacin.
El cuerpo de aplciacion de estos pirmetros estn comprendidos entre 750
y unos 1300c.
No es recomendable sobrepasar la temperatura de 1300c ya que puede
destruir el filamento y una luz excesivamente brillante que puede afectar al
ojo.
Los pirmetros pticos y de radiacin ofrecen ciertas ventajas:
Medicin de altas temperaturas.
No requiere un contacto mutuo con el cuerpo
Mide temperaturas de cuerpos pequeos o en movimiento.
Ninguna parte est expuesta a los efectos destructivos del calor.
Los inconvenientes que producen:
Pueden introducirse errores en la medicin de temperaturas.
La presencia de gases y el humo entre el observador y el cuerpo,
puede dar errores en la medicin.
METALOGRAFA
1.11. Introduccin.- Se estudia mediante el microscopio las caractersticas de la
estructura de un metal o aleacin. Mediante el microscopio puede
determinarse el tamao de gramo y el de forma y distribucin de las
diversas fases e inclusiones, caractersticas relacionadas con las
propiedades mecnicas de los metales.
1.12. Obtencin de la muestra.- La muestra debe tomarse de una zona lo ms
prxima posible al punto en que se ha producido el fallo y compararla
posteriormente con otra obtendr en una seccin normal.
1.13. Desbaste.- El tamao de la muestra, siempre que se pueda, debe ser tal que
su manejo no encierre dificultad. Cuando el metal se blando, se utiliza una
lima mediante un movimiento de vaivn, sin hacer mucha presin. Cuando
se un metal duro o blando se puede utilizar lijas pero frecuentemente
enfrindola con agua para que no se caliente. El desbaste se encarga de que
no haya irregularidades en el material.
1.14. Muestras embutidas.- Consiste en montarla o embutirla en una pastilla, se
utiliza Baquelita o Lucite (resina) termoplstica, debe ser transparente para
observar la forma y estado de la muestra.
1.15. Pulido intermedio.- Pule el conjunto utilizando una serie de papeles de
esmeril de grano cada vez ms fino. El primero que se utiliza son los
nmeros 1/0 2/0 y finalmente 3/0. Algunas veces las muestras se pulen
con 4/0 Este pulido se efecta en seco o se utiliza cierto lubricante para
evitar el calentamiento.
1.16. Pulido fino (afino).- Se efecta sobre un plano horizontal giratorio
cubierto con un pao especial sobre el cual se pulveriza polvo de abrasivo,
tamizado, en suspensin de agua destilada; las abrasivas que se utilizan son
el polvo de diamante, el xido de magnesio, de xido de cromo y la alumina.
El pao suele ser de lana, fieltro y la lana. No deben existir rayas y se
considerara como el paso final.
1.17. Ataque.- El objeto es desarrollar la microestructura para poderlo observar
al microscopio. Se efecta por mtodos de reactivos qumicos y debe
hacerse uso del ms conveniente segn la naturaleza del metal o aleacin y
la estructura especfica que se desea observar (Fig. 9).
1.18. Microscopios metalogrficos.- La observacin no es posible efectuarla por
transparencia, debiendo efectuar por medio de la luz incidente, el hoz de
rayas precedente de una fuente luminosa llega a un vidrio plano el cual lo
refleja envindolo a travs de los lentes que constituyen el objetivo del
microscopio sobre la superficie de la muestra, como indica la figura 1.10.
La figura 11. Muestra un microscopio metalogrfico de mesa. El
microscopio de mesa puede utilizarse tambin para la obtencin de
metalografas, adaptndole una cmara fotogrfica en el ocular. Para esta
finalidad se emplean los bancos metalogrficos como se indica en la figura
11b.
1.19. Dureza.- La medicin de la dureza constituye uno de los medios ms
utilizados por su rapidez y sencillez, para la inspeccin y control de un
determinado material o procesos de fabricacin, hay que tener en cuenta
que los tratamientos trmicos y los trabajos en caliente modifican la dureza.
Los mtodos para medir la dureza:
1. Los que miden la dureza elstica.
2. Los que miden la resistencia que oponen los cuerpos, el corte o a la
abrasin.
1.20. Dureza elstica.- Se mide mediante el escleroscopio Fig. 13, permite medir
la altura de rebate de un pequeo martinete que lleva en la punta diamante,
al caer desde una altura determinada sobre la superficie que se va a
ensayar. Consta de un cuadrante indicador en el que automticamente
queda registrada la altura de rebote de martillo. En la posicin inicial del
martinete posee cierta energa potencial, al accionar el aparato, el martinete
cae y la energa potencial va transformndose en energa cintica hasta el
momento de medir sobre la superficie cuya dureza se va a medir.
1.21. Resistencia al corte o a la abrasin.- resistencia al rayado. Este ensayo
fue establecido por Friedrich Mohs, fij una escala de 10 minerales de
dureza creciente. El nmero 1 es el talco, el 2 el yeso hasta el 9 el zafiro o
corindn y el 10 diamante, la dureza est comprendida entre 5 y 6.
Ensayo de la lima. Este ensayo es comparativo y los resultados que se
obtienen dependen del tamao, forma y dureza de la lima.
1.22. Resistencia a la penetracin.- consiste en aplicar y comprimir
progresivamente sobre la probeta, bajo la accin de una carga esttica
conocida, un penetrador de forma determinada, la dureza se expresa de
acuerdo con el ensayo efectuado, mediante un nmero que es inversamente
proporcional a la profundidad de penetracin para unas condiciones de
carga medida que ha actuado sobre la superficie de penetracin.
Ensayo Brinell.- Consiste normalmente en una prensa hidrulica
vertical de accionamiento manual, cuyo objeto es efectuar una
presin determinada sobre la bola, aplicada sobre una superficie
plana y lisa del material a ensayar. El dimetro de la bola es 10mm
y la presin que ejerce de 3000ly para materiales frricos y 500ly
para los materiales no frreos.
BHN =
Ensayo Ropcicwell.- Se basa en la resistencia que oponen los
materiales a ser penetrados por un cuerpo ms duro.
Se coloca la pieza sobre el soporte de la mquina y se gira el tornillo
elevando la pieza y comprimindolo contra el penetrador hasta que
se haya aplicado el metal una carga fija poco elevada.
Existe dos clases de mquinas Rockwell, uno normal de la cual la
carga es pequea de 10Kg, y la rockwell superficial para un ensayo
de presas sumamente delgadas y que trabaja con una carga pequea
de 3Kg .
Ensayo Vicicers.- Se emplea como cuerpo penetrador un diamante
tallado en forma de pirmide cuadrangular de 136 entre caras y
normalmente se utilizan cargas variables de 1 a 120Kg, la distancia
entre ndices, se mide por medio de un tornillo micromtrico
graduado en milsimos de milmetro, conocida la longitud de la
diagonal, la dureza se obtiene directamente en una tabla aplicando la
frmula:
DPH=
L= carga aplicada en kilogramos
D= longitud de la digonal de la huella
1.23. Precauciones para hacer el ensayo
Estado del penetrador.- La esterilidad de la bala debe comprobarse
frecuentemente y desechar aquellas que presenten la ms mnima
deformacin.
Exactitud de la carga aplicada.- Si las cargas que se aplican no son mayores
que los indicados, los resultados que se obtengan, no ofrecen niguna
garanta de exactitud.
Aplicacin rpida de la carga.- Causa el deterioro de los penetradores de
diamante. Se recomienda utilizar amortiguadores de aceite que aseguren
funcionamiento suave.
Estado de la superficie de la probeta.- Esta superficie debe ser plana y
corresponder a una zona de material sano.
Espesor de la probeta.- esta superficie debe ser plana y corresponder a una
zona de material sano.
Forma de la probeta.- cuando la probeta sea larga, debe sujetarse de
manera adecuada para evitar que bascule. Cuando es cilndrico hay que
aplanar una de sus generatrices y asentarlo en un prisma en V. Tabla 15.
1.24. Ventajas e inconvenientes de los distintos tipos de ensayos.- El
procedimiento Brinell presenta el inconveniente de que el tamao siempre
grande de la huella limita su empleo a probetas grandes. El ensayo rockwell
es rpido y sencillo de realizar. El ensayo vicicers tiene la ventaja de que
pudiendo ser empleados con varios cargos puede, reducirse mucho la
penetracin de la huella.
1.25. Equivalencia entre las diversas cifras de dureza.- Son aplicables al acero
que se han obtenido tras numerosos ensayos de dureza realizados con
aceros de carbono y aleado, principalmente despus de haber estado
sometido a un tratamiento trmico.
1.26. Tensiones y deformaciones.- Se conoce como tensin total a la resistencia
interna total que ofrece una seccin del cuerpo, la determinacin o
alargamiento total en cualquier direccin es la venacin total que han
experimentado las dimensiones del cuerpo en dicha direccin.
1.27. Ensayo de traccin.- Es ms utilizado despus del ensayo de dureza, para
determinar algunas caractersticas mecnicas de los metales y aleaciones.
El ensayo se realiza mediante dispositivos mecnicos o hidrulicos que
permiten aplicar una carga axial sobre una probeta de forma y dimensiones,
colocada entre las mordazas de la mquina de traccin.
La relacin entre los valores de la tensin unitaria y del alargamiento
unitario diviendo este valor por la longitud inicial de la probeta,
representado en la figura 1.15 y 1.16.
1.28. Resultados del ensayo
Lmite de proporcionalidad.- En muchos casos ocurre que en la primera
zona del diagrama se obtiene una lnea sensiblemente recta como se
observa en la figura 1.15. En esta zona los alargamientos son
proporcionados a las tensiones de tal modo que ha incrementos tambin
iguales del alargamiento.
Lmite elstico.- Puede definirse como la tensin mxima, que al cesar de
actuar no produce deformaciones permanentes en el material. En mayor
parte de los materiales, el lmite elstico y el de proporcionalidad tienen
valores casi iguales.
Punto de fluencia.- Es la tensin, superior al lmite elstico, a partir de la
cual el alargamiento crece sin que se haya aumentado la carga, no se
presenta en todos los materiales sino solamente en algunos dctiles.
Lmite de fluencia o lmite prctica de elasticidad.- Se define como la tensin
para la cual las determinaciones permanentes son superiores a cierta
medida de longitud de la probeta. El valor que generalmente se fija a la
determinacin permanente se encuentra comprendido entre el 0,1 y el
0,2% de la longitud de la probeta
Carga mxima o resistencia a la traccin.- Es el valor mximo que suele
adquirir la tensin, considerando el arco de la seccin recta inicial.
Carga de rotura.- Se obtiene dividendo la carga que en dicho momento
acta sobre el material por el rea de la seccin recta original y tiene
siempre un valor inferior al de la carga mxima.
Ductilidad.- es la cantidad de deformacin que es capaz de sufrir antes de la
rotura.
Alargamiento.- se marcan sobre la probeta antes de comenzar el ensayo,
unos trazos a cierta distancia midindose despus del ensayo la distancia
alargada.
Alargamiento (por ciento)=
* 100
Li = Longitud final entre trazos
Lo = Longitud inicial entre trazos
Estriccin.- Se determina midindose el rea de la mnima seccin recta,
obtenido uniendo las dos mitades de la probeta y empleando la formula.
Estriccin por ciento =
* 100
Ao = rea de la seccin recta original
A1 = rea de la seccin recta final
Mdulo de elasticidad o mdulo de Young.- Se obtiene midiendo la
pendiente de la parte incial rectilinea del diagrama tensiones
alargamientos o la tangente del ngulo.
1.29. Curva de tensiones alargamientos verdaderos.- El valor real se
obtendra dividiendo la carga aplicada por el rea que tiene la seccin recta
en el momento de aplicacin de la carga y el alargamiento real sera el
cociente entre el incremento de longitud y la longitud de la probeta antes de
la aplicacin de la carga. Fig. 1.18. proporciona una valiosa informacin
sobre las deformaciones plsticas y fracturas de los metales.
1.30. Resiliencia y Tenacidad.- El rea encerrada bajo la curva en la zona delas
deformaciones elsticas nos mide la energa por unidad de volumen que
puede absorber el material sin que se produzcan deformaciones
permanentes. Este valor se denomina mdulo de resiliencia, la tenacidad se
define como la energa.
1.31. Ensayo de choque.- El ensayo de choques proporciona resultados que
constituyen un buen trmino de comparacin para juzgar acerca de su
tenacidad.
1.32. Ensayo de fatiga.- son de tipo dinmico y sirven para determinar el
comportamiento de los distintos materiales cuando estn sometidos a la
accin de esfuerzos repetitivos Fig. 120 muestra los grficos de fatiga de un
acero tratado trmicamente y de una aleacin de aluminio, los ensayos de
fatiga son utilizados para determinar la influencia que en la resistencia que
a la fatiga puede tener la corrosin, el grado de acabado superficial, la
temperatura, el tamao y la concentracin de tensiones.
1.33. Ensayos de fluencia lenta (LICEP).- Sirven para determinar el aumento de
deformacin de un material a elevada temperatura cundo est sometida a
una tensin inferior a l lmite de fluencia.
2. Capitulo 2
ENSAYOS NO DESTRUCTIVOS
2.1. Introduccin.- Son tiles en la localizacin de defectos en las piezas que
ueden dar lugar a posibles fallas en servicio, los ensayos de mayor
utilizacin son:
El examen radiogrfico
La inspeccin por medio de partculas magnticas
La inspeccin mediante lquidos penetrantes
La inspeccin por ultrasonidos
2.2. El examen radiogrfico.- Se puede utilizar los rayos X o los rayos gumma, la
radiacin gumma tiene una mayor penetracin que los rayos X, pero su
aplicacin est ms restringida al ser menor su sensibilidad. Los rayos X se
generan al chocar un chorro de electrones de gran velocidad contra un
obstculo. Una radiografa no es sino la fotografa obtenida por la
transparencia del objeto a reconocer, algunas zonas aparecen ennegrecidas
segn la intensidad segn la intensidad de rotacin que reiben.
2.3. La inspeccin por medio de partculas magnticas.- Se utiliza para la
deteccin de grietas, pliegues, hojas, costuras, inclusiones y defectos
similares e los materiales ferromagnticos, especialmente con el hierro y el
acero.
2.4. La inspeccin mediante lquidos penetrantes.- Se emplea la deteccin de
discontinuidades superficiales, de tamao muy pequeo, tales como grietas,
arrugas y poros en materiales no magnticos.
2.5. La inspeccin por ultrasonidos.- Las frecuencias ms utilizadas varan de 1
a 5 millones de ciclo por segundo. El detector supersnico llamado
reflectoscopio consta de un circuito elctrico, genera una corriente de
frecuencia muy elevada que se aplica a un cabezal explorador.
Se utilizan para detectar y localizar rechupes, roturas o grietas interiores
puras o inclusiones no metlicas de gran tamao. Observase las figuras
1.26. y 1.27.
Introduccin. La materia est compuesta de cuerpos simples, denominados
elementos qumicos, que son las partculas ms pequeas, diferenciadas entre s
por su actividad qumica y propiedades fsicas. A su vez los elementos constan
de partculas muy pequeas llamadas tomos, los cuales poseen una estructura
caracterstica, distinta en cada cuerpo simple.
Estructura del tomo. Los tomos de todos los cuerpos estn constituidos por
electrones, protones y neutrones, estando concentrada casi toda su masa en el
ncleo, el cual contiene los protones y los neutrones. El dimetro del ncleo es
del orden de
, magnitud muy pequea si se compara con el dimetro
del tomo, el cual es del orden de
. Por consiguiente, el tomo est
cargado positivamente por u n nmero de electrones que giran a su alrededor y
contrarrestan la carga nuclear, para que el tomo sea elctricamente neutro debe
contener el mismo nmero de protones que de electrones.
Los electrones estn distribuidos en capas u rbitas energticas, estando
animados simultneamente de un movimiento de rotacin alrededor de su eje.
Cada capa no puede contener ms que un nmero determinado de electrones, el
cual, como mximo, es de
, siendo n el nmero de orden de la capa.
De ellos, n es el nmero quntico principal que define el nivel energtico principal o
energa total del electrn en un estado particular. El segundo nmero quntico da la
medida del momento cintico del electrn. Los diversos valores de se
representan por las letras . El nmero quntico
determina el momento
magntico del electrn, toma un valor entre , incluido el cero. El nmero
cuntico
, que expresa el sentido de rotacin del electrn y puede tomar los valores
.
Sistema peridico de los elementos. La tabla peridica constituye una
referencia valiosa para el estudio de nuevas aleaciones que deban cumplir unas
condiciones especficas. Como los elementos pertenecientes al mismo grupo
tienen distribuciones electrnicas similares, muchas veces pueden remplazarse
algunos componentes de las aleaciones por otros elementos pertenecientes al
mismo grupo.
La cantidad de capas de un tomo depende de su nmero total de electrones como por
ejemplo el nmero mximo de electrones que puede contener la primera capa principal
es 2, la segunda capa tiene un nmero mximo de 8 electrones, la tercera capa con 18
electrones,etc. Los electrones situados en las capas no saturadas se denominan
electrones de valencia, y a ellos se debe en gran parte el comportamiento qumico
del elemento.
Estos elementos se denominan elemento de transicin y tienen todos valencia
variable, lo que implica que en estos elementos, las energas ce los electrones situados
en el nivel (son ligeramente superiores a la que poseen los que se encuentran
en el nivel .
Istopos. Los ncleos atmicos de algunos elementos presentan la particularidad de
contener un nmero de neutrones superior o inferior al normal, lo cual produce una
variacin del peso atmico, sin que el nmero atmico sufra ninguna modificacin. As por
ejemplo, el deuterio, un istopo del hidrgeno, contiene en su ncleo un neutrn y un protn,
por lo que su peso atmico es el doble del correspondiente al tomo de hidrgeno
normal, sin que su comportamiento qumico se altere. El deuterio es el material de partida
para la obtencin del agua pesada.
Clasificacin de los elementos. Una primera clasificacin de los elementos qumicos los
agrupa en metales, metaloides y no metales. Los elementos que integran el grupo de los
metales poseen ciertas propiedades especiales, que por ser peculiares de ellos han venido a
denominarse propiedades metlicas, y entre las que podemos citar:
1) Su existencia en el estado slido bajo forma cristalina.
2) Sus conductividades trmica y elctrica relativamente altas.
3) Su capacidad para deformarse plsticamente.
4) Una reflectividad de la luz relativamente elevada (brillo metlico).
Los metaloides participan de algunas propiedades de los metales y de otras de los no
metales. Generalmente poseen una conductividad pequea, si bien su plasticidad es nula o
muy pequea. Entre los metaloides, podemos citar, carbono, boro y silicio.
El resto de los elementos, los gases nobles, los cuerpos del Grupo V I I B, y N, O, P y S,
pertenecen al grupo de los no metales.
El enlace atmico. Los cuerpos pertenecientes al estado slido pueden agruparse en dos
categoras distintas:
*Los slidos verdaderos los cuales presentan una determinada ordenacin geomtrica
de sus tomos y molculas que confiere a sus estructuras el carcter de cristalinas-
*Los amorfos que no presentan una ordenacin regular de sus molculas, sino que la
distribucin de stas responde a las leyes del azar, tal como ocurre en el estado lquido.
Estos materiales no son propiamente slidos sino ms bien lquidos superenfriados.
Existen cuatro tipos posibles de enlace:
1. Enlace inico
2. Enlace covalente u homopolar
3. Enlace metlico
4. Enlace debido a fuerzas de Van der Waals.
1. Enlace inico. Los elementos a los que les sobra un electrn, tendern a
cederlo con objeto de contar con una rapa saturada, la cual, tras la cesin
de ese electrn, ser la ms exterior. Al ceder un electrn, el tomo
queda con ms protones que electrones, originndose un ion positivo.
2. Enlate covalente.- Los tomos de algunos elementos alcanzan una
configuracin electrnica estable, compartiendo uno o ms electrones de
su capa cortical con otros tomos contiguos. Esto da lugar a un fuerte
enlace entre los tomos, debido a la atraccin que ejercen los ncleos
positivos sobre los electrones compartidos. As, en el caso del diamante,
cada tomo de carbono aparece ligado a sus cuatro vecinos, con cada uno
de los cuales comparte dos electrones.
3. Enlace metlico.- Se caracteriza porque los electrones de valencia son
compartidos por ms de dos tomos. Este enlace puede realizarse porque
cada uno de los tomos del metal se desprende de sus electrones de
valencia, los cuales dan lugar a la formacin de una ''nube" de
electrones. En la estructura metlica, los tomos de un mismo metal no
pueden ser enlazados simplemente por enlaces inicos u homopolares, ya
que para que se verificara el primero tenan que existir iones con carga
opuesta, y para que se realizara el segundo, existir un nmero suficiente
de electrones de valencia.
El enlace metlico se puede considerar como un enlace covalente
extendido a gran nmero de tomos.
4. Fuerzas de Van der Waals.- Este tipo de enlace es caracterstico de los
tomos neutros, y as resulta la nica fuerza de enlace que rene entre s
los tomos de los gases nobles. Cuando los tomos se aproxi man, los
centros de las cargas positivas y negativas se separan, engendrndose
una dbil fuerza atractiva entre ellos.
Estas fuerzas se ponen de manifiesto nicamente a bajas temperaturas, ya
que solo entonces las fuerzas de atraccin, aunque dbiles, pueden
vencer la agitacin trmica de los tomos.
ESTRUCTURA DE LOS METALES
Dimetro atmico.- Cuando dos tomos metlicos se aproximan, la energa
interna vara bajo la accin de dos fuerzas opuestas, una de atraccin entre los
electrones y ambos ncleos positivos, y otra de repul sin entre los ncleos
positivos as como tambin entre los electrones. La primera tiende a disminuir
el valor de la energa interna, y la segunda a aumentarlo. Para un determinado
valor de la distancia interatmica, ambas fuerzas se equilibran, adquiriendo la
energa interna total
un valor mnimo correspondiente a la posicin de
equilibrio. La separacin de equilibrio
vara para cada elemento.
Estructura cristalina.- En el estado slido, los tomos acusan cierta
permanencia de posiciones que da lugar a la formacin de cristales.
Sin embargo, los tomos no permanecen fijos en sus posiciones sino que oscilan
alrededor de ellas, establecindose un equilibrio dinmico. Al agruparse los tomos
ordenadamente en el espacio, podemos considerar que determinan una red
tridimensional llamada red espacial, obtenida al unir todos los tomos entre s
mediante rectas imaginarias y que el cristal est constituido por una serie de clulas o
celdillas iguales, de simetra igual a la del cristal. La menor de estas clulas se
denomina celdilla unitaria o fundamental, la cual, en cada metal, viene definida
por los parmetros a, b, c, que indican la longitud de sus aristas y por los
ngulos (formado por b y c), (formado por a y c); y (formado por a y b).
Existen solamente 14 tipos de redes especiales pero las redes espaciales con que
normalmente nos encontramos son:
*La b.c.c. (cbica centrada en el cuerpo o de cuerpo centrado).
*La f.c.c. (cbica centrada en las caras).
*La c.p.h. (exagonal compacta).
Red cbica de cuerpo centrado.-Si tomos se representan por esferas, el
tomo central toca a los que ocupan los vrtices del cubo, pero stos no se
tocan entre s. Como los tomos de los vrtices son compartidos entre las ocho
celdillas vecinas, y el del centro pertenece por entero a la celdilla que estamos
considerando, el nmero de tomos que contiene la celdilla unitaria de la red
b.c.c. es:
8 tomos en los vrtices x 1/8 = 1 tomo
1 tomo en el centro =1 tomo
Total = 2 tomos
Red cbica de caras centradas. En esta configuracin los tomos pueden considerarse
como situados uno en cada vrtice del cubo y otro en cada cara, no existiendo ninguno en el
centro del cubo. Los tomos de cada cara son tangente a los situados en los vrtices de dicha
cara. Como los tomos de los vrtices pertenecen a los ocho cubos que existen alrededor de
cada vrtice, y los de las caras, a los dos cubos de la red que tengan esa cara comn, el
nmero real de tomos que contiene la celdilla fundamental es:
8 tomos en los vrtices x 1/8=1 tomo
6 tomos en el centro de las caras x 1/2 = 3 tomos
Total = 4 tomos
Agrupacin exagonal compacta. En este tipo de red los tomos se hallan distribuidos en
los vrtices de un prisma exagonal y en el centro de las bases del mismo, existiendo adems
otros tres aromos que se sitan en los centros de los prismas triangulares alternativos en
que puede descomponerse el prisma exagonal.
La repeticin paralela de este prisma exagonal no nos permite obtener el conjunto de la
red, ya que la verdadera celdilla fundamental de la red exagonal es solamente la
porcin representada por la lnea gruesa. Por tanto, el prisma exagonal contiene dos
celdillas fundamentales completas y dos medias celdillas.
Considerando nicamente la celdilla fundamental, es difcil llegar a comprender por
qu a este tipo de red se le denomina exagonal. Para ello hay que demostrar que si se
agrupan paralelamente cierto nmero de celdillas unitarias, de una manera similar a
como se encuentran dispuestas en la red espacial, se obtiene un prisma exagonal.
Tabla 2.7 Valores correspondientes a las propiedades fsicas de algunos elementos
Metal
Smb
olo
Densid
ad a 20
C
En
G por
cm3
Punt
o de
fusi
n
C
Punto de
Ebullici
n
C
Estructur
a
Cristalina
Parmetr
o de la
red
angstrom
s
Mnima
distancia
interatmic
a
angstroms
Aluminio Al 2,6994 660,2 2450 f.c.c. 4,0491 2,862
Antimoni
o
Sb 6,6169 630,5 1380 Rombodr
ica
4,5065 2,904
Berilio Be 1,8550 1277,
1
2771,1 C.p.h a=2,2858
c=3,5842
2,221
Bismuto Bi 9,8008 271,3 1,560 Rombodr
ica
4,7457 3,111
Cadmio Cd 8,6657 320,9 765 C.p.h. a=2,9787
c=5,617
2,972
Carbono
(grafito)
C 2,2426 3726,
7
4832,2 Hexagonal a=2,4614
c=6,7041
1,42
Cromo Cr 7,1984 1,875 2,665 b.c.c. 2,884 2,498
Cobre Cu 8,9703 1,083 2,595 f.c.c 3,6153 2,556
Oro Au 19,
3248
1,063 2971,1 f.c.c 4,078 2,882
Hierro( Fe 7,8626 1536,
5
2998,9 b.c.c 2,8664 2,4824
Plomo Pb 11,343
0
327,4 1,725 f.c.c. 4,9489 3,499
Magnesio Mg 1,7387 650 1,107 C.p.h a=3,2088
c=5,2095
3,196
Manganes Mn 7,4752 1,245 2148,9 Cubica(co 8,912 2,24
o mpleja)
Molibden
o
Mo 10,216
1
2.610 5,560 b.c.c 3,1468 2,725
Nquel Ni 8,9149 1452,
8
2731,2 f.c.c 3,5238 2,491
Platino Pt 21,456
6
1769,
4
4529,4 f.c.c 3,9310 2,775
Silicio Si 2,3256 1,410 2682,2 Cubica(Di
amantina)
5,428 2,351
Plata Ag 10,493
0
960,5 2,210 f.c.c. 4,086 2,888
Estao Sn 7,3008 231,9 2271,1 b.c.tetrago
nal
a=5,8314
c=3,1815
3,016
Titanio Ti 4,5405 1668,
3
3,260 C.p.h a=2,9503
c=4,683
2,91
Tungsten
o
W 19,297
1
3,410 5,930 b.c.c. 3,1585 2,734
Vanadio V 6,0910 1898,
9
3398,9 b.c.c. 3,039 2,632
Zinc Zn 7,1430 419,4 906,1 C.p.h. a=2,6649
c=4,9470
2,6648
2.16. Polimorfismo y alotropa. El polimorfismo es la propiedad que presentan
algunos materiales de existir en estado slido en distintas redes espaciales. Si estos
cambios de estructura son reversibles, la transformacin polimrfica se denomina
alotropa. Por lo menos quince metales presentan esta propiedad, y de ellos el ejemplo
ms conocido es el del hierro. Cuando el hierro cristaliza a 1537C lo hace segn una
red cubica centrada en el cuerpo, a 1400C la estructura de la red cambia a cubica
centrada en las caras, y a 910C, vuelve a cambiar adoptando nuevamente la estructura
cristalina centrada en el cuerpo.
2.17. Planos Cristalogrficos. Una red especial puede considerarse descompuesta por
infinitos nmeros de planos que pasan por los centros de todos los tomos de la red.
Estos sistemas de planos se denominan Planos atmicos o cristalogrficos. La relacin
de estos planos con los ejes de las celdillas fundamentales se indica mediante los ndices
de Miller.
En la Fig. 2.11. que representa la celdilla fundamental de la red cubica, el plano rayado
BCHG corta al eje Y a la distancia unidad del origen, y es paralelo a los ejes X y Z, o lo
que es lo mismo, los corta en el infinito. Por tanto:
X Y Z
Punto de interseccin 1
Valores Inversos
ndices de Miller 0 1 0
Los ndices de Miller del citado plano son, por tanto, (010). Cuando el plano corta
alguno de los ejes de referencia de la celdilla fundamental en sus prolongaciones, se
establece en la notacin un ndice negativo que expresa tal hecho, tal como (hkl). Por
ejemplo, los ndices de Miller del plano ADEF que pasa por el origen de coordenadas
(punto A), no pueden determinarse sin realizar previamente un cambio de origen. Esto
no encierra ninguna dificultad ya que cualquier vrtice del cubo puedo tomarse como
origen.
Si se tratara de determinar los ndices de Miller del plano BDH Fig: 2.11. La marcha a
seguir seria:
X Y Z
Punto de interseccin 1 1
Valores Inversos
ndices de Miller 1 1 2
Si los ndices de Miller que se obtienen son nmeros fraccionarios, se reducen estas
fracciones a comn denominador, tomndose como ndices de Miller los numeradores.
Fig. 2.11 Determinacin de los ndices de Miller. Los planos rayados son los (010)
y (112)
Todos los planos tienen los mismos ndices de Miller. Cuando tales ndices se
encuentran encerrados en un parntesis, significa que corresponden a un plano en
particular o a un sistema de plano paralelos; en cambio, los corchetes indican una
familia de planos de la misma Forma.
Fig. 2.12 Proyeccin de la red sobre un plano perpendicular al eje Z en la que se
indica el espacio entre los planos. Los crculos en negro se suponen que se
encuentran en el plano del dibujo
Los inversos no se utilizan para determinar los ndices de una direccin. Para tener una
idea aproximada de la densidad atmica de los distintos planos, sea de los nmeros de
tomos contenidos en cada plano, consideremos una celdilla fundamental de cada una
de las estructuras b.c.c. y f.c.c. suponiendo que los tomos ocupan los nudos de la red,
el nmero de tomos en los distintos planos serian:
Plano b.c.c. f.c.c.
(100) 4 5
(110) 5 6
(111) 3 6
(120) 2 3
(221) 1 1
Fig. 2.13. Espacio entre los planos del sistema (111) en una estructura (a) b.c.c. y
(b) f.c.c.
En una estructura cristalina se puede considerar un nmero infinito de plano, pero la
mayora de ellos son construcciones geomtricas y no tienen ninguna importancia
prctica. Dado que un sistema de planos paralelos debe contener la totalidad de los
tomos, los planos de mayor importancia son aquellos que tienen una densidad atmica
elevada y la mayor distancia interplanar.
Cristalizacin
2.18 Estados de la Materia. La materia puede presentarse en cualquiera de los
tres estados, perfectamente diferenciados, gaseoso, lquido y slido. El estado gaseoso
se caracteriza porque los tomos del metal ocupan un volumen considerable, debido a la
rapidez del movimiento de que estn animados. En este estado, los tomos se hallan
pues en continuo movimiento y describen trayectorias arbitrarias, durante las cuales
chocan entre s y con las paredes del recipiente que los contiene.
En el estado gaseoso, los tomos se mueven con completa independencia unos de otros,
por lo general, las distancias que los separan son muy grandes, por lo que las fuerzas de
atraccin entre ellos son despreciables. De todo ello se deduce que en un gas, los
tomos estn en completo desorden.
Conforme se enfra el gas, la energa cintica de los tomos disminuye hasta que llega
un momento en que las fuerzas de atraccin dejan sentir su accin y la mayora de los
tomos se agrupan dando lugar a la aparicin del Estado Lquido. No todos los tomos
pasan a formar parte de l. Algunos permanecen en el vapor situado sobre el lquido,
existiendo un intercambio continuo de tomos a travs de la interface liquido vapor.
Los gases pueden comprimirse fcilmente, reducindose notablemente el volumen que
ocupan, pero para comprimir un lquido se requieren presiones sumamente elevadas.
Fig. 2.14 Representacion esquemtica de una estructura (a) cristalina y (b) de un
liquido. El rea ABCDE presenta la misma ordenacin en el liquido y en el cristal.
Sin embargo, en el estado lquido la separacin de los tomos les permite todava una
amplia libertad de movimientos.
Conforme disminuye la temperatura de un lquido, la energa cintica de los tomos va
siendo cada vez menor y, por tanto, las fuerzas de atraccin originan el agrupamiento de
los tomos hasta que, finalmente, el lquido se solidifica. La mayora de los materiales
al solidificarse experimentan una concentracin de volumen, lo que indica una
separacin menor entre los tomos en el estado slido.
En este estado los tomos no permanecen en reposo sino que vibran alrededor de sus
posiciones de equilibrio, dando lugar a la disposicin ordenada de las estructuras
cristalinas explicadas anteriormente.
2.19. Mecanismo de la Cristalizacin. Se entiende por cristalizacin el paso del
estado lquido al estado slido, el cual se realiza en dos fases:
1. Formacin de los Ncleos.
2. Crecimiento de los Cristales.
Aunque en el estado lquido los tomos no tienen una distribucin ordenada definida,
puede ocurrir que, en un instante cualquiera, algunos de ellos se agrupan ocupando
posiciones muy similares a las que les corresponden en la red espacial que se forme al
solidificarse el lquido. Fig. 2.14
A medida que disminuye la temperatura del lquido, los tomos pierden libertad de
movimiento, lo que da lugar a un aumento de la vida del grupo, coexistiendo al mismo
tiempo un nmero mayor de ellos.
Fig. 2.15 Curva de enfriamiento de un metal puro. La curva ABDE corresponde al
enfriamiento ideal y la ABCDE a la real
En cualquier material los tomos poseen energa cintica y potencial. La primera es en
funcin de la velocidad con que se mueven los tomos y dependen solamente de la
temperatura. Al crecer esta aumenta la actividad de los tomos y, por consiguiente, su
energa cintica. En cambio la energa potencial depende de la separacin entre los
tomos. Cuanto mayor es la distancia media interatmica, mayor ser la energa
potencial que poseen los tomos.
La energa cintica de los tomos pertenecientes al estado lquido y la de los que se
encuentran en el estado slido tienen que ser la misma, pero no as las energas
potenciales que difieren notablemente debido a que en el estado slido, las distancias
interatmicas son menores que en el estado lquido, por lo que la solidificacin de los
lquidos va acompaada de un desprendimiento o cesin de energa.
La diferencia entre las energas potenciales de ambos estados se denomina calor
latente de fusin.
Cuando la temperatura del metal liquido disminuye lo suficiente por debajo del punto de
solidificacin, se forman espontneamente es distintos puntos del lquido, agrupaciones
o ncleos estables.
Fig. 2.16 Crecimiento de las dentrinas en el magnesio liquido
Estos ncleos, que son porciones de lquidos solidificadas, actan como grmenes de
cristalizacin. A medida que contina el enfriamiento, se solidifican ms tomos, los
cuales se agregan a los ncleos ya formados o constituyen nuevos ncleos de
cristalizacin.
Este proceso de solidificacin da origen a una estructura caracterstica de tipo
arborescente denominada detrtica, recibiendo estas arborescencias el nombre de
dendritas, (Fig. 2.16). Como los ncleos se crean de forma arbitraria, la orientacin de
los ejes cristalogrficos tambin presentara el mismo carcter, y las dentritas que en
ellos se formen tendrn direcciones diferentes en cada cristal.
Al interferirse el crecimiento de unos granos con los de otros, se crean unas zonas de
contacto entre ellos llamados Contorno de grano, caracterizados por su irregularidad.
Fig. 2.17 Representacin esquemtica del contorno de grano entre dos cristales.
Los tomos rayados son los que forman el material de unin entre los cristales.
2.20 . Imperfecciones en los Cristales. Resulta instructivo conocer cmo se realiza
el fenmeno del crecimiento de grano y las cifras que reflejan este crecimiento. A
ttulo de curiosidad, diremos que una velocidad de crecimiento pequea, por
ejemplo 1mm diario, implica la colocacin sobre la superficie de
aproximadamente, 100 capas de tomos por segundo.
Fig. 2.18 Representacin esquemtica del proceso de cristalizacin por nucleacin
y crecimiento dendrtico
Fig. 2.19 Defectos en los cristales, vacantes intersticiales.
Las imperfecciones ms importantes en los cristales son las vacantes, inserciones y
dislocaciones. Las vacantes son simplemente lugares que deban estar ocupados por
tomos y se encuentran vacos (Fig. 2.19) Termodinmicamente se demuestran que la
existencia de vacantes de la red constituye una caracterstica de los metales a
temperaturas superiores al cero absoluto. Al ser ocupada una vacante por un tomo, el
cual a su vez deja otra vacante, y as sucesivamente, resulta que la vacante se desplaza a
travs de la estructura cristalina, jugando por tanto un importante papel en el fenmeno
de la difusin.
En algunas estructuras cristalinas, principalmente en las de densidad atmica pequea,
puede ocurrir que los tomos se intercalen en los espacios interatmicos de dicha red o
posiciones intersticiales (Fig. 2.19).
La existencia de vacantes en la red permite a los tomos que la rodean aproximarse
entre s ligeramente, por lo que la separacin entre ellos es menor a la normal, mientras
que los tomos ubicados en posiciones intersticiales empujan a los tomos vecinos
separndolos. Las vacantes se producen no solo por consecuencia de la solidificacin
sino tambin al elevarse la temperatura del cristal, o al estar sometido este a la
irradiacin de partculas nucleares a gran velocidad.
La Dislocacin se puede definir como una irregularidad cristalina que se presenta entre
dos partes del cristal que individualmente pueden considerarse como perfectas. La (Fig.
2.20.) representa esquemticamente dos tipos sencillos de dislocaciones. La dislocacin
en arista se produce cuando en una red cristalina se origina un nuevo semiplano
atmico. La dislocacin en hlice o helicoidal recibe este nombre a causa de la
superficie espiral que forman los planos atmicos situados alrededor del frente de
dislocacin.
Fig. 2.20 Dislocaciones (a) en arista, (b) En elipse
Fig. 2.21 Limites de separacin entre dos granos de orientacin muy aproximada,
formados por ciento numero de dislocaciones en arista, representada por el
smbolo T.
2.21. Macro defectos en los productos moldeados. En el prrafo anterior hemos
estudiado los defectos que se producen en la solidificacin desde un punto de vista
atmico, pero hay otros muchos defectos que se presentan durante la solidificacin del
metal fundido, que por su tamao son observables a simple vista. Estos se conocen
como Macro defectos, y entre ellos los ms corrientes son las cavidades o embudos de
contraccin y la porosidad.
Los metales lquidos, salvo raras excepciones, al solidificarse experimentan una
concentracin de volumen que puede llegar a valer hasta un 6%. Lo primero que
solidifica es toda la corteza exterior, la reduccin de volumen que tiene lugar durante la
solidificacin del lquido contenido en el interior origina una gran cavidad de
contraccin en la zona central similar a la de la (Fig. 2.22). En los lingotes de acero
estas cavidades, conocidas por rechupes, se suelen presentar en la parte central superior
del lingote.
La solidificacin ideal del metal liquido seria aquella en que el enfriamiento comenzara
por la parte inferior del molde, progresando en direccin ascendente hasta alcanzar la
parte superior; sin embargo, el calor se elimina con mayor rapidez por la parte superior
del molde.
Si la pieza moldeada presenta secciones gruesas, es necesario disponer en puntos
adecuados del molde, de mazarotas o cmaras destinadas a contener metal lquido que
compense los efectos de contraccin.
Fig. 2.22 Cavidad o embudo de contraccin en un tocho de acero al columbio
Siempre que al solidificar el metal lquido queden retenidos gases en su interior, se
origina en la pieza moldeada poros o sopladuras. Por lo general estos defectos son ms
numerosos y de menos tamao que los embudos o cavidades de contraccin, y se
distinguen de estas ltimas por su forma esferoidal. Los gases son por lo general ms
solubles en los lquidos que en los slidos, durante la solidificacin los gases disueltos
pueden desprenderse. Los gases tambin pueden originarse como consecuencia de la
reaccin entre el metal lquido y las sustancias voltiles, tales como la humedad,
contenida en el molde. La porosidad se puede reducir en gran medida, aireando y
ventilando convenientemente los moldes.
Inmediatamente despus de solidificado el metal, se pueden originar en fuertes
tensiones por la contraccin, que pueden dar lugar a grietas de contraccin. Estas grietas
pueden ser debidas con mucha frecuencia al desmoronamiento o ruptura del molde de
arena, lo cual facilita la contraccin del metal.
El peligro de deformacin de estas grietas puede aminorarse mucho, utilizando moldes
correctamente concebidos y diseados.
Fig. 2.23 Porosidades en una funcin de hierro, ampliada X 3
2.22. Tamao de Grano. El tamao de grano de una pieza moldeada es funcin de la
reaccin existente entre la velocidad de crecimiento G y la nucleacin N. Cuando se
forman muchos ncleos, el metal que se obtiene poseer una estructura de grano fino y,
por el contrario, si el nmero de ncleos formados es pequeo, el metal tendr una
estructura basta o de grano grueso. Los factores que influyen en la velocidad de
nucleacin y, por tanto, en el tamao de grano, el ms importante es la velocidad de
enfriamiento. De aqu que un enfriamiento rpido (fundicin en coquilla) produzca la
formacin de una gran numero de ncleos de cristalizacin y estructuras de grano fino,
mientras que en los de enfriamiento lento (moldes de arena o lingotera caliente) solo se
forman unos pocos ncleos, los cuales posteriormente crecen, solidificando todo el
lquido antes de que pueda aumentar el nmero de ncleos.
Otros factores que contribuyen a aumentar la velocidad de nucleacin, facilitando la
obtencin de estructuras de grano fino son:
1. La presencia de impurezas insolubles, como el aluminio y el titanio, que dan
lugar a la formacin de xidos insolubles en el acero.
2. La agritacion del metal fundido durante la solidificacin, la cual hace que los
cristales se rompan antes de haber alcanzado un tamao excesivamente grande.
Fig. 2.24 (a) Fragilidad al choque de un metal con una estructura de grano gruesa;
(b) en la ruptura de un metal de estructura de grano fino, la fuerza sufre
frecuentes cambios de direccion
Cuando el lquido se mantiene exactamente a su temperatura de solidificacin, y se
coloca en su superficie un cristal minsculo (germen), este crecer extendindose por el
lquido. Eliminando cuidadosamente el germen puede conseguirse la formacin de un
monocristal.
Podemos decir que los materiales de estructura de grano fino presentan mayor tenacidad
o resistencia al choque, ms dureza y resistencia a la traccin que las estructuras de
grano grueso. (Fig. 2.24)
En el proceso practico de solidificacin, cuando se pone en contacto un lquido caliente
con la superficie inicialmente fra de un molde, se establece en el lquido un gradiente
de temperatura (diferencia de temperaturas). La superficie del lquido, en contacto con
las paredes del molde, se encuentra a una temperatura inferior a la del acero, lo que
provoca la formacin en esta zona exterior del lquido de muchos ncleos de
cristalizacin que empiezan a crecer en todas las direcciones.
Fig. 2.25 Fundicion de plomo de gran dureza. Aumento de X 2
Los granos que se forman presentan una forma de columnas alargadas, perpendiculares
a la superficie del molde, o estructura columnar, que corresponde a una fundicin de
plomo de gran pureza.
Los moldes no deben presentar aristas vivas, ya que esto puede dar lugar a la formacin
de planos de probable ruptura debido a que las impurezas slidas y gaseosas tienden a
concentrarse en ellos. Estos planos pueden ser causa de la aparicin de grietas internas
en el material durante su laminacin o forja, evitndose este riesgo redondeando las
aristas del molde
CAPITULO 5
CONSTITUCION DE LAS ALEACIONES
Introduccin
Una aleacin es una sustancia compuesta por dos o ms elementos qumicos. Si el
sistema est compuesto por dos elementos se denomina sistema de aleacin binario, si
es por tres ternario, etc. Dentro de cada sistema es posible, es posible gran nmero de
aleaciones distintas, y como con bastante frecuencia las aleaciones comerciales
contienen muchos elementos, y es por eso que existe un numero casi infinito de
aleaciones. Las aleaciones pueden clasificarse por su estructura.
Clasificacin de las aleaciones
Las aleaciones pueden ser homogneas o mezclas, al hablar de uniformidad en las
aleaciones no nos referimos a la uniformidad a escala atmica, sino a otra mucha mayor.
En la mayora de los elementos puros el termino fase es sinnimo de estado.
En el estado slido pueden presentarse tres fases distintas: metales puros, compuestos y
soluciones slidas.
Metales Puros
En estos metales para que se cumpla la condicin de equilibrio, el calentamiento y el
enfriamiento deber ser extraordinariamente lentos, es porque se necesita suficiente
tiempo para las transformaciones.
Fases de aleaciones intermedias o compuestos qumicos.
La mayor parte de los compuestos qumicos ordinarios estn formados por elementos de
valencia opuesta, entre ellos podemos citar al agua (H2O) y la sal comn (NaCl).
Cuando se forma un compuesto, los elementos pierden gran parte de sus propiedades
individuales, as como tambin su identidad.
Al combinarse los elementos componentes dejan de existir como elementos
individuales, dando origen a una combinacin qumica con caractersticas fsicas y
mecnicas propias y unas propiedades qumicas peculiares.
Con relacin a los diagramas de equilibrio, las fases de aleacin intermedia, presentan
una combinacin qumica distinta por general la de los metales. Las tres fases de
aleaciones intermedian ms corrientes son:
Los compuestos intermetalicos o de valencia. Estos compuestos estn formados por
metales qumicamente distintos y en su manera de combinarse obedecen las reglas de
valencia qumica. Entre los compuestos qumicos podemos indicar el CaSe, Mg2Sn y
Cu2Se.
Los compuestos intersticiales. La palabra intersticial significa entre los huecos o
espacios, y compuestos cuyos tomos tienen un dimetro relativamente pequeo ocupan
los intersticios de la red espacial del metal; los compuestos son: Ti, Ta, W, Fe y Sc.
Los compuestos electrnicos. En todo sistema se forma cierto nmero de fases
intermedias de anloga estructura cristalina y fue Hume Rothery quien primero indico
que la relacin entre el nmero de electrones de valencia al de tomos que forman su
molcula tiene un valor definido.
Soluciones Solidas
Toda solucin est formada por un soluto y un disolvente, y estas pueden ser cuerpos
slidos, lquidos o gaseosos.
Atendiendo la cantidad de soluto en un disolvente, las soluciones se pueden clasificarse
en: insaturadas y sobresaturadas. Toda solucin saturad se encuentra en una situacin
inestable, y por ello, si se le comunica una pequea cantidad de energa o dispone de
tiempo suficiente, tiende a convertirse en estable o saturada.
Las soluciones solidas son simplemente soluciones en estado slido y estn formadas
por tomos en una misma red espacial. En la mayora de las soluciones solidas la
solidificacin se lleva a cabo en un intervalo de temperatura.
Soluciones solidas por sustitucin
La sustitucin en la red espacial del disolvente de los tomos propios por tomos del
soluto, da origen a este tipo de soluciones.
Factor de estructura cristalina. Para que exista solubilidad total, es preciso que ambos
permanezcan a un mismo tipo de res espacial.
Factor de tamao relativo. El factor de tamao es favorable para formacin de
soluciones solidas cuando la diferencia en los radios atmicos de los constituyentes es
inferior a 15%. Si el factor de tamao es superior a 15% las soluciones solidas que se
formen presentan lmites muy restringidos de solubilidad.
Factor de afinidad qumica. Cuanto mayor es la afinidad qumica entre dos metales
ms restringidos se encuentra su solubilidad y se acenta la tendencia de formar
compuestos qumicos.
Factor de valencia relativa. Cuando el elemento de menor valencia es el metal
disolvente, la solubilidad en el de otros metales de mayor valencia es muy amplia, caso
contrario la solubilidad es muy restringida.
Soluciones solidas por insercin o intersticiales.
Este tipo de soluciones se obtiene cuando los tomos del soluto tienen un radio atmico
pequeo y se intercalan en los espacios interatmicos. Tambin cuando la cantidad de
soluto aadida al disolvente es pequea y la diferencia en los radios atmicos de los
constituyentes presenta un valor adecuado, pueden formarse soluciones intersticiales.
A diferencia de los compuestos intermetalicos e intersticiales, las solucione solidas son
por lo general ms fciles de separar, no poseen un punto de fusin definido
CAPITULO 6
DIAGRAMAS DE EQUILIBRIO
6.1.Introduccin.
Durante muchos aos ha sido objeto de estudio la aparicin o desaparicin de fases que
tienen lugar en el proceso de enfriamiento en un metal o de una aleacin, y la mejor
manera de realizar este estudio es mediante los diagramas de equilibrio.
Para que el estado en equilibrio quede completamente determinado es necesario conocer
los valores de tres variables independientes que son; la temperatura, la presin y la
composicin.
En esencia el diagrama no es sino la representacin grfica de un sistema de aleacin.
6.2.Coordenadas de los diagramas de fase.
Un diagrama de fase no es sino un sistema de coordenadas cartesianas, en el cual se
puede representar en ordenadas la temperatura en grados centgrados o Fahrenheit, y en
abscisas la composicin de la aleacin, expresadas por los porcentajes en peso de sus
constituyentes.
La transformacin de los porcentajes en peso a porcentajes en tomos puede llevarse a
cabo mediante las siguientes frmulas.
6.3. Mtodos experimentales.
Los datos necesarios para la construccin de los diagramas de equilibrio se determinan
experimentalmente por medio de una gran variedad de procedimientos, entre los cuales
los ms comunes son:
El anlisis trmico.
Procedimiento metalogrfico.
Difraccin de rayos X.
6.4. Tipo I-solubilidad total de dos metales en los estados slido y lquido.
Cuando dos metales son completamente solubles en estado slido el nico tipo de fase
slida que se forme ser una solucin slida por sustitucin.
Si tomamos diversas concentraciones del metal B en A y trazamos sus curvas de
enfriamiento empezando por la aleacin de 0% de B, o sea metal A puro, y terminando
por el 100% de B, o sea metal puro B, obtenemos la serie de curva representadas en la
figura 6.1.
A continuacin para trazar el diagrama de equilibrio real, basta con situar en los ejes
coordenados para los distintos valores de la composicin, las temperaturas
correspondientes a puntos caractersticos. Estos valores se obtienen de las distintas
curvas de enfriamiento obtenidas experimentalmente. Por ejemplo, en la fig. 6.2, como
el eje de la izquierda representa el metal puro A, se sita sobre el la temperatura TA.
Por la misma razn situamos TB sobre el eje de la derecha.
La lnea que resulta de unir los dos puntos correspondientes al comienzo de la
solidificacin se denomina lnea de lquidus, mientras que la que une los puntos finales
de la solidificacin se conoce como lnea de slidus.
6.5. Regla I composicin qumica de las fases.
Para determinar la composicin qumica de la fases de una aleacin, que consisten en
equilibrio a una temperatura cualquiera correspondiente a la regin bifsica, trazamos
por ella una recta horizontal llamada lnea de enlace, hasta que corta a las lneas que
delimitan dicha regin. Ejemplo:
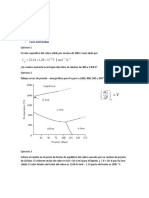
Fig. 6.3, la cual se encuentra a la temperatura T, la aleacin 80 A- 20 B.
6.6. Regla II cantidades relativas de cada fase.
Para determinar las cantidades relativas de cada fase, que a una temperatura dada,
coexisten en equilibrio en la regin bifsica. El punto de interseccin de ambas rectas
divide a la lnea horizontal en dos segmentos cuyas longitudes son inversamente
proporcionales a las cantidades de frases presentes. Esta regla se conoce tambin como
la regla de la palanca.
Considerando la fig. 6.3, vemos que la vertical correspondiente a la aleacin 80 A,
divide a la lnea de enlace horizontal mn y no.
Si suponemos que la longitud total de la lnea de enlace representa el peso total o 100%
de la dos fases presentes a la temperatura T, la regla de la palanca puede expresarse por:
Si representamos solamente la lnea de enlace e indicamos sobre ella los valores
compuestos, obtengo la fig. 6.4. Aplicando las ecuaciones anteriores, se halla
6.7. Enfriamiento en condiciones de equilibrio de una aleacin que forma una
solucin slida.
A continuacin vamos a estudiar el enfriamiento muy lento, en condiciones de
equilibrio, de una aleacin particular 70 A- 30 B, para observar las transformaciones de
fase que tienen lugar. Esta aleacin (fig. 6.5), a la temperatura To, constituye una
solucin
liquida monofsica homognea, permaneciendo en tal estado hasta que su temperatura
disminuye a T1. Al llegar a este punto se inicia la solidificacin formndose cristales de
solucin solida de composicin 1, su composicin es 95 A (regla I), la formacin del
lquido es correspondiente a L2. A esta misma temperatura, la nica solucin slida
que puede coexistir en equilibrio con L2 y, por tanto, la nica que puede formarse es 2.
Luego a medida que disminuye la temperatura, se enriquecen en B, no solo la
composicin del lquido, sino tambin la de solucin slida. Los cristales de 2 que se
forman a T2 rodean los ncleos de composicin 1, separando tambin dendritas de 2
(fig. 6.6).
Cuando esta aleacin se encuentra a T2, las cantidades relativas de solucin slida y
liquida presentes se determina utilizando la regla II.
A medida que disminuye la temperatura comienza el crecimiento de la solucin slida.
6.8. Enfriamiento en que no se cumplen las condiciones de equilibrio-origen de la
segregacin.
Como la difusin de estado slido se verifica a velocidades muy pequeas, cabe
suponer que con la velocidad de enfriamiento normal, se presentaran algunas
diferencias respecto a los resultados indicados en el diagrama de equilibrio.
Refirindonos nuevamente a la aleacin 70 A (fig. 6.7).
Puesto que la intensidad del ataque qumico, varia con la composicin, empleando los
reactivos adecuados, podremos ver al microscopio la estructura dendrtica (fig. 6.8). la
solucin solida final est constituida por una estructura segregada formada por una
parte central ms rica en metal de alto, punto de fusin, que es la que ha solidificado la
ltima. Este proceso se conoce como fenmeno de segregacin dendrtica.
6.9.Homogenizacin.
De lo expuesto en el prrafo anterior al tratar del origen de una estructura segregada se
deduce que la ltima porcin de lquido que solidifica a lo largo de los contornos de
grano y en los espacios interdendrticos es muy rica en metal de alto punto de fusin.
En la mayora de los metales la velocidad de difusin a la temperatura ambiente es muy
pequea.
La Fig. 6.9 representa el diagrama de equilibrio real del sistema cobre-nquel,
correspondiendo la lnea de trazos a la aleacin 85Cu-15Ni.
La Fig. 6.10 muestra Micrografas correspondientes a una aleacin 85Cu-15Ni. (1)
fundida en coquilla, (2) fundida en coquilla y calentada a 750C durante 3 horas, X50;
(3) fundida en coquilla y calentada durante 9 horas a 950C X50; (4) fundida en
lingotera caliente, X50; (5) fundida en lingotera caliente y calentada a 950C, durante
15 horas, X50.
6.10. Caractersticas de las aleaciones que presentan solubilidad total en estado
slido.
En general en los sistemas de aleacin que dan lugar a una serie continua de soluciones
slidas, la resistencia y la dureza presentaran cada una un mximo, aunque ambos no
tienen necesariamente que corresponder a una misma aleacin. Por el contrario, la
ductilidad y conductividad elctrica presentan un mnimo. La tabla 6.1 muestra la
influencia que ejerce la composicin sobre algunas propiedades fsicas y mecnicas de
las aleaciones del sistema cobre-nquel.
6.11. Casos que pueden presentarse en la solidificacin de las aleaciones de tipo I.
Todas las aleaciones incluidas dentro del tipo I funden a una temperatura comprendida
entre los puntos de fusin de A y de B. Sin embargo, en algunos sistemas, puede darse
el caso de que las lneas de lquidus y slidus pasen por un mximo y un mnimo (Fig.
6.12a, b).
6.12. Tipo II- caso de los metales totalmente solubles en estados lquidos y
totalmente insolubles en estados slidos.
Tcnicamente no existe ningn par de metales que sean totalmente insolubles, uno en
otro. Sin embargo en algunos casos la solubilidad es tan limitada que prcticamente
pueden considerarse como insolubles.
La Fig. 6.13 representa las curvas de enfriamiento de los metales puros y de algunas de
sus aleaciones.
Si sobre un grfico de temperaturas y composiciones llevamos los puntos singulares de
las curvas de enfriamiento, se obtiene un diagrama de equilibrio anlogo al de la Fig.
6.14.
Veamos como solidifica la aleacin 1 de la Fig. 6.15, cuya composicin es la eutctica,
40A-60B. Por encima del punto E, a la temperatura To, la aleacin se halla en estado
lquido formando una solucin homognea.
Por tanto a temperatura constante, solidifican alternativamente metal puro A y metal
puro B, obteniendo una mezcla extraordinariamente fina de estos metales, denominada
mezcla eutctica, que normalmente solo es visible al microscopio (Fig. 6.16).
La transformacin a temperatura constante de este lquido de composicin E en dos
slidos se conoce como reaccin eutctica, la cual puede escribirse en la forma
En la Fig. 6.17, se puede observar las fases del enfriamiento lento de una aleacin 80A-
20B.
La Fig. 6.18, muestra la relacin existente entre la composicin de la aleacin y las
cantidades relativas de los constituyentes.
6.13. Tipo III-sistema de dos metales totalmente solubles en el estado lquido, y
parcialmente solubles en el estado slido.
Este tipo podemos considerarlo como un caso intermedio entre los dos explicados
anteriormente, caracterizndose porque, en el estado slido, las soluciones de un metal
en otro que se forme tiene un lmite de saturacin.
El diagrama de equilibrio correspondiente al de este tipo es el representado en la Fig.
6.21.
La Fig. 6.19, representa el diagrama de fase simplificado aluminio-silicio, los nmeros
del fondo corresponden a las microfotografas de la Fig. 6.22.
La aleacin 1, situada a la izquierda de la Fig. 6.19, est formada por aluminio puro
cuya microestructura es la que aparece en la Fig. 6.20 a. la aleacin 2 (Fig. 6.20 b), la
cual contiene un 8% de silicio, est formada por dendritas de aluminio primario o
proeutctico rodeadas por una mezcla eutctica de aluminio y silicio. La aleacin 3 (Fig.
6.20 c) corresponde a la composicin eutctica, con un 12% de silicio, y su
microestructura est formada totalmente de una mezcla eutctica.
Conforme vamos avanzando hacia la derecha, la microestructura estar formada por
cantidades cada vez mayores de silicio primario (negro) como corresponde a contenidos
crecientes de silicio y por mezcla eutctica, como se observa en las micrografas de las
Figs. 6.20 d y e. Finalmente, la Fig. 6.20 f, muestra la microestructura del silicio puro.
La relacin eutctica que tiene lugar puede escribirse en la forma.
Esta relacin es igual a la que se verifica en el diagrama del Tipo II, con la diferencia de que, en
este caso, los constituyentes del eutctico no son metales puros sino soluciones slidas. La
cantidad de cada una de ellas, presente en la mezcla, puede determinarse aplicando la Regla II.
Debido al cambio de la solubilidad de Aen B (linea FH) y de A en B (linea GJ), habr un ligero
cambio en las cantidades relativas relativas de y cuando la aleacion se enfrie a temperatura
ambiente. Las cantidades relativas de y a temperatura ambiente son:
Consideremos ahora la solidificacion de la aleacion 3, de compocion 60A-40B. Alcanzar la
temperatura T
3
que pertenecen a la linea de liquidus, comienzan a formarse cristales primarios
o proeutectecticos, de soluion slida muy ricos en A. a medida que desciende la
temperatura, el liquido se enriquece cada vez ms en B. siendo su composicion la indica por la
linea del liquidus la cual recorre en sentido descendente y hacia la derecha hasta alcanzar el
punto E. cuando la temperatura alcanza una valor ligeramente superior al de solidificacion del
eutectico, las condiciones existentes son:
Fases
Composicin qumica
Cantidades relativas
Liquida
30A 70B
40%
primaria
80A 20B
60&
Esta solidificacin se lleva a cabo a temperatura constante, siendo la microestructura que
aparece una vez completada sta, la representacin en la Fig. 6.23
La Fig. 6.24 muestra el diagrama de equilibrio y las micrografas de varias aleaciones del
sistema plomo-antimonio. La micrografa de la aleacin 1 (Fig. 6.24b), con un contenido de
una 6.5% de antimonio, muestra una estructura pro eutctica tpica, formada por dendritas
primarias de solucin y por una mezcla eutctica los espacios interdendrticos. La aleacin 2
(Fig. 6.24c), que contiene un 11.5% de antimonio, est compuesta en su totalidad por una
mezcla eutctica de las soluciones slidas y . Las aleaciones cuya composicin se
encuentra en el diagrama a la derecha de eutctico estn constituidas por solucin solida
primaria rodeada de mezcla eutctica (Fig. 6.24d), diferencindose entre s solamente por las
cantidades relativas de las fases presentes, disminuyendo la cantidad de mezcla eutctica
conforme la composicin de la aleacin se separa de la eutctica.
6.14 envejecimiento. Los procedimientos de que actualmente se dispone para mejorar la
resistencia y la dureza de unas aleaciones dada, son dos principalmente: las deformaciones en
frio y el tratamiento trmico. De ellos el ms importante en el caso de las aleaciones no frreas
es el tratamiento trmico conocido como envejecimiento.
Par que produzca el fenmeno del envejecimiento, el tratamiento trmico debe constar por lo
general de dos fases: un calentamiento de la solucin y el envejecimiento propiamente dicho.
Calentamiento de la solucin. Si una vez en este estado de aleacin se enfra rpidamente, la
solucin solida sobresaturada o con exceso de soluto quedara retenida a la temperatura
ambiente.
Proceso de envejecimiento. La aleacin, en estado de temple, esta constituidas por una
solucin slida sobresaturada en condicin metastable, por lo que el exceso de soluto tendera
a precipitar. Las aleaciones en las que esta precipitacin tiene lugar espontneamente a la
temperatura ambiente, alcanzado el mximo de resistencia al cabo de cuatro o cinco das, se
denominan aleaciones de envejecimiento natural.
Nuevos estudios y teoras han llevado a un conocimiento ms completo del proceso de
envejecimiento. El aumento de resistencia que ocasiona en las aleaciones tratadas
trmicamente no es debido simplemente a la presencia de un precipitado, sino conjuntamente
a la distribucin uniforme de un precipitado submicroscpico finamente disperso y a la
distorsin que estas partculas ocasionan en las estructuras cristalinas antes de alcanzar un
tamao visible.
You might also like
- Expo Materiales FinalDocument28 pagesExpo Materiales FinalDanielNo ratings yet
- Técnicas de Valoración Con EDTA.Document1 pageTécnicas de Valoración Con EDTA.GARCIA GAMEZ JORGE ABRAHAMNo ratings yet
- QuimiDocument2 pagesQuimiAlcantaraSusyNo ratings yet
- Grupo 1 Del Viernes Laboratorio Analisis Mineral CuantitativoDocument13 pagesGrupo 1 Del Viernes Laboratorio Analisis Mineral CuantitativoEdison Guillermo Jairo Bazan ChavezNo ratings yet
- Practica 1 Microscopio MetalográficoDocument2 pagesPractica 1 Microscopio MetalográficoBernardo Ortiz100% (1)
- VERMICULAR Y GRAFITO COMPACTO: CARACTERÍSTICAS Y CAUSASDocument3 pagesVERMICULAR Y GRAFITO COMPACTO: CARACTERÍSTICAS Y CAUSASCamiloVinchiraNo ratings yet
- Esta Es La Celdilla de Un Hipotético MetalDocument1 pageEsta Es La Celdilla de Un Hipotético Metalcarlos bedonNo ratings yet
- Trabajo Union de Materiales HoyDocument4 pagesTrabajo Union de Materiales HoyJean Max IlachoqueNo ratings yet
- Informe Nro 3Document4 pagesInforme Nro 3RONALDNo ratings yet
- Actividad7 MatematicasAplicadasDocument17 pagesActividad7 MatematicasAplicadasVictor Fernando Chamba LeonNo ratings yet
- Aputes de SolidifaciónDocument37 pagesAputes de SolidifaciónCaballero RrzNo ratings yet
- Determinacion de Cobre Y Zinc en Cabello Por Espectrofotometria de Absorcion AtomicaDocument5 pagesDeterminacion de Cobre Y Zinc en Cabello Por Espectrofotometria de Absorcion Atomicadavic29No ratings yet
- Solidificacion LingotesDocument6 pagesSolidificacion LingotesenriqueNo ratings yet
- Análisis Metalográfico de MaterialesDocument8 pagesAnálisis Metalográfico de MaterialesandresfgonzalezpeNo ratings yet
- Capítulo 09 Intersección Plano Poliedro Problemas PDFDocument4 pagesCapítulo 09 Intersección Plano Poliedro Problemas PDFJose ZizoldNo ratings yet
- Guia de F1 EscalerasDocument5 pagesGuia de F1 EscalerasIsaac PortilloNo ratings yet
- Endurecimiento y soluciones sólidas en materialesDocument2 pagesEndurecimiento y soluciones sólidas en materialesPaola RadaNo ratings yet
- CPR Cticas t3Document3 pagesCPR Cticas t3Yojan Alejandro QuintalNo ratings yet
- Laboratorio Fisica 2 - Unmsm - Ciclo 2017-1 - Informe 4Document19 pagesLaboratorio Fisica 2 - Unmsm - Ciclo 2017-1 - Informe 4Axel 76No ratings yet
- Practica 1 - Termodinámica de FasesDocument1 pagePractica 1 - Termodinámica de FasesCarlos LlaequeNo ratings yet
- NMDocument2 pagesNMRoberto Pineda RamirezNo ratings yet
- Ejercicios Difusion 2013 - 14 CorregidoDocument3 pagesEjercicios Difusion 2013 - 14 CorregidoAndrea RamirezNo ratings yet
- Copias Introduccion A ThermodinamicaDocument22 pagesCopias Introduccion A ThermodinamicaCris0% (1)
- Corrosión ElectroquímicaDocument8 pagesCorrosión Electroquímicadaniel chirinosNo ratings yet
- Informe 1 de Metalurgia Fisica PDFDocument10 pagesInforme 1 de Metalurgia Fisica PDFjheysonNo ratings yet
- Segunda ley de Newton laboratorio físicaDocument23 pagesSegunda ley de Newton laboratorio físicaBruno MeloNo ratings yet
- Mar Practica 1 CorrosionDocument11 pagesMar Practica 1 CorrosionEmilio GalindoNo ratings yet
- HIDRO ED1 ROLDANAVILARMANDOCompletoDocument19 pagesHIDRO ED1 ROLDANAVILARMANDOCompletoArmando Roldan AvilaNo ratings yet
- Transferencia Conduccion 2egh - 2020-I PDFDocument4 pagesTransferencia Conduccion 2egh - 2020-I PDFValentino StradaNo ratings yet
- Solucionario de Ciencia e Ingenieria de Los MaterialesDocument470 pagesSolucionario de Ciencia e Ingenieria de Los MaterialesCurro Espadafor Fernandez AmigoNo ratings yet
- 1.7 - Polimeros Liquidos Cristalinos - 2018Document19 pages1.7 - Polimeros Liquidos Cristalinos - 2018Donovan AbrigoNo ratings yet
- Iron Ore Pelletizing Process An Overview - En.es PDFDocument21 pagesIron Ore Pelletizing Process An Overview - En.es PDFJazminNo ratings yet
- Informe Fisicoquimica 7Document14 pagesInforme Fisicoquimica 7SandraJustinoNo ratings yet
- Introduccion A Los Aceros A2 PDFDocument79 pagesIntroduccion A Los Aceros A2 PDFCarlos RodriguezNo ratings yet
- Difusión - PracticaDocument2 pagesDifusión - PracticaNIKOLEE LIZETH TORRES ZUÑIGANo ratings yet
- Aleantes Del Aluminio y Su InfluenciaDocument4 pagesAleantes Del Aluminio y Su InfluenciaJulieth MondragonNo ratings yet
- Ensayo de TracciónDocument18 pagesEnsayo de TracciónMARÍA JOSÉ CARRILLO SOLERNo ratings yet
- Practica 3 Sintesis de Polimeros EntrecruzadosDocument4 pagesPractica 3 Sintesis de Polimeros EntrecruzadosNoelia FloresNo ratings yet
- Practica 3 Endurecimiento Por Solucion SolidaDocument9 pagesPractica 3 Endurecimiento Por Solucion SolidaBelinda CruzNo ratings yet
- Análisis metalográfico de aceros aleados DF2Document17 pagesAnálisis metalográfico de aceros aleados DF2Gustavo PomaqueroNo ratings yet
- Cálculo de resistencia a fatiga y termofluencia de barras metálicasDocument9 pagesCálculo de resistencia a fatiga y termofluencia de barras metálicasFernanda GarmendiaNo ratings yet
- Solucion Examen Ii de Caracterización 2015Document3 pagesSolucion Examen Ii de Caracterización 2015Jhoel ChaucaNo ratings yet
- Ejercicio SchmidDocument1 pageEjercicio SchmidOscar SolisNo ratings yet
- Informe FisicoquimicaDocument87 pagesInforme FisicoquimicaxiasndkasxNo ratings yet
- Final MecanicaDocument22 pagesFinal MecanicaAnonymous W1mMU5ZNo ratings yet
- Tratamientos térmicos de aceros-ESIME Ticomán IPNDocument25 pagesTratamientos térmicos de aceros-ESIME Ticomán IPNJafet RodriguezNo ratings yet
- PerdidaCalorCajaTérmicaDocument5 pagesPerdidaCalorCajaTérmicaDaniel CarlosNo ratings yet
- Guía Tratamientos Térmicos 1Document4 pagesGuía Tratamientos Térmicos 1Jaime Alfonso Gonzalez VivasNo ratings yet
- Practica #4 Medidas de VariabilidadDocument7 pagesPractica #4 Medidas de VariabilidadRONY IVAN ALLHUIRCA LOPEZNo ratings yet
- Problemas Resueltos - II UnidadDocument8 pagesProblemas Resueltos - II Unidadronald milton anticona reyesNo ratings yet
- Termodinámica y diagramas de equilibrioDocument1 pageTermodinámica y diagramas de equilibrioMarcelo GuarachiNo ratings yet
- TAREA #3 - Química Teoríca (LEYES FUNDAMENTALES DE LA QUIMICA, TEORIA DE DALTON, ESTRUCTURA ATOMICA Y MOL)Document13 pagesTAREA #3 - Química Teoríca (LEYES FUNDAMENTALES DE LA QUIMICA, TEORIA DE DALTON, ESTRUCTURA ATOMICA Y MOL)Diana Jimenez MoralesNo ratings yet
- Materiales cerámicos: Pruebas mecánicasDocument6 pagesMateriales cerámicos: Pruebas mecánicasMaria Fernanda Vera DazaNo ratings yet
- Sesion 9 Ucv2012 IIDocument59 pagesSesion 9 Ucv2012 IIjgomez_65802250% (2)
- Termodinamica de La Tostacion ResumenDocument3 pagesTermodinamica de La Tostacion ResumenValentina M. CortésNo ratings yet
- Ejercicio Trabajo en Frio y Caliente .AskelandDocument1 pageEjercicio Trabajo en Frio y Caliente .AskelandEsliDavidMolerosIngunzaNo ratings yet
- Sistema de Maquinas Desarmables 62-005Document144 pagesSistema de Maquinas Desarmables 62-005Fabian Nina AguirreNo ratings yet
- 4.2. Instrumentos de TemperaturaDocument14 pages4.2. Instrumentos de TemperaturaRichard TamayoopNo ratings yet
- Piro Expo Tema 3Document31 pagesPiro Expo Tema 3andresmejia182No ratings yet
- PLANODocument1 pagePLANOKhristian VinicioNo ratings yet
- Tesis I. M. 439 - Lalaleo Tenelema Christian Vinicio PDFDocument127 pagesTesis I. M. 439 - Lalaleo Tenelema Christian Vinicio PDFKhristian VinicioNo ratings yet
- Dialnet METODODEDISENODEUNSISTEMAHIDRAULICODEPOTENCIAPARAL 4829342 PDFDocument6 pagesDialnet METODODEDISENODEUNSISTEMAHIDRAULICODEPOTENCIAPARAL 4829342 PDFKristel VilcaNo ratings yet
- Pelaez Piedra Santiago VicenteDocument503 pagesPelaez Piedra Santiago VicenteKhristian VinicioNo ratings yet
- 1Document31 pages1Khristian VinicioNo ratings yet
- 10 4Document3 pages10 4Khristian VinicioNo ratings yet
- Universidad Tècnica de CotopaxiDocument4 pagesUniversidad Tècnica de CotopaxiKhristian VinicioNo ratings yet
- Primero Agroindustrial Vespertino BDocument8 pagesPrimero Agroindustrial Vespertino BKhristian VinicioNo ratings yet
- Aga ManualDocument84 pagesAga Manualleni_sanchez7170883% (12)
- Boletin 4Document6 pagesBoletin 4Khristian VinicioNo ratings yet
- Particulas MagneticasDocument16 pagesParticulas MagneticasKhristian VinicioNo ratings yet
- Boletin 3Document3 pagesBoletin 3Khristian VinicioNo ratings yet
- Triptico San IsidroDocument2 pagesTriptico San IsidroKhristian VinicioNo ratings yet
- Clase 15 Jun 2016Document12 pagesClase 15 Jun 2016Khristian VinicioNo ratings yet
- Calculos+electricos+3 7Document88 pagesCalculos+electricos+3 7David MozoNo ratings yet
- " NOVENO Semestre "B": Universidad Técnica de AmbatoDocument2 pages" NOVENO Semestre "B": Universidad Técnica de AmbatoKhristian VinicioNo ratings yet
- Materiales MagnéticosDocument13 pagesMateriales MagnéticosAndres RomeroNo ratings yet
- ComputacionDocument2 pagesComputacionKhristian VinicioNo ratings yet
- Calculos para Instalacion ElectricaDocument13 pagesCalculos para Instalacion ElectricaVictorSNo ratings yet
- Reparticion Del TrabajoDocument1 pageReparticion Del TrabajoKhristian VinicioNo ratings yet
- Archivo Diseño II PDFDocument25 pagesArchivo Diseño II PDFKhristian VinicioNo ratings yet
- Auditoria EnergeticaDocument147 pagesAuditoria EnergeticajpmujpmuNo ratings yet
- Deber Ejercicio Rodamiento 30-11-2014Document6 pagesDeber Ejercicio Rodamiento 30-11-2014Khristian VinicioNo ratings yet
- Problema 1Document1 pageProblema 1Khristian VinicioNo ratings yet
- Contaminantes AmbientalesDocument15 pagesContaminantes AmbientalesKhristian VinicioNo ratings yet
- Reparticion Del TrabajoDocument1 pageReparticion Del TrabajoKhristian VinicioNo ratings yet
- NORMALIZACIÓNDocument10 pagesNORMALIZACIÓNValeria GarciaNo ratings yet
- Makinas ElectricasDocument4 pagesMakinas ElectricasKhristian VinicioNo ratings yet
- Medio Ambiente DVDocument4 pagesMedio Ambiente DVKhristian VinicioNo ratings yet
- Impregnación Al Vacío.Document10 pagesImpregnación Al Vacío.NICOLL DAYANNA TORRES NAVASNo ratings yet
- Preinforme Equilibrio - GualterosDocument4 pagesPreinforme Equilibrio - GualterosLaura Gualteros MatizNo ratings yet
- Agralco 2016Document48 pagesAgralco 2016Miguel Raya FeriaNo ratings yet
- Visita A Chancay S.A.C.Document8 pagesVisita A Chancay S.A.C.Luis Angel GutierrezNo ratings yet
- Muestreo de CarnicosDocument10 pagesMuestreo de CarnicosAlbert Bernal Mamani100% (1)
- Calor Especifico de Un MetalDocument24 pagesCalor Especifico de Un MetalJimmy JohnsNo ratings yet
- 008 - Fisica IIDocument16 pages008 - Fisica IIzeusgermNo ratings yet
- Informe 7 Quimica IIDocument22 pagesInforme 7 Quimica IIRafaelAlvaradoNùñezNo ratings yet
- Catalogo2020Marzo CapA Al CapGDocument175 pagesCatalogo2020Marzo CapA Al CapGJuan WilchesNo ratings yet
- Electroremediación de Suelos Contaminados Con Metales PesadosDocument19 pagesElectroremediación de Suelos Contaminados Con Metales PesadosMijael Antonio Celis RosasNo ratings yet
- Tarea - 2 Fundamentacion-FarmacologiaDocument8 pagesTarea - 2 Fundamentacion-FarmacologiaDayana MolinaNo ratings yet
- INFORME ANALITICA Lab 16 (Recuperado Automáticamente)Document11 pagesINFORME ANALITICA Lab 16 (Recuperado Automáticamente)Anonymous QSr25WOCNo ratings yet
- Normas y Codigos Vi Asme S 2 (202120)Document43 pagesNormas y Codigos Vi Asme S 2 (202120)jose.A ApazaNo ratings yet
- Manual Instalación y Manejo Ionizado miniMAXX CLJ PDFDocument20 pagesManual Instalación y Manejo Ionizado miniMAXX CLJ PDFjpmurizNo ratings yet
- Manejo Extintores MutualDocument39 pagesManejo Extintores MutualSergio Adán Vega QuiroaNo ratings yet
- Recubrimientos Anticorrosivos 1Document96 pagesRecubrimientos Anticorrosivos 1Adrián JerezNo ratings yet
- Informe de Tanque de Cocción para Profesora LuzDocument21 pagesInforme de Tanque de Cocción para Profesora LuzSTEVEN RESTREPO SALAZARNo ratings yet
- Guía Química11 Tema2Document20 pagesGuía Química11 Tema2Genesis Salgado0% (1)
- Isomeros EjerciciosDocument3 pagesIsomeros Ejerciciosledys100% (3)
- Infografia 2Document1 pageInfografia 2Medina Zeballos Jessica AlejandraNo ratings yet
- Disoluciones 2021-22Document2 pagesDisoluciones 2021-22bernardoNo ratings yet
- Extracción Con Solvente y SecadoDocument7 pagesExtracción Con Solvente y SecadolleisonNo ratings yet
- Interfase LíquidaDocument9 pagesInterfase LíquidaRai Coz OrtegaNo ratings yet
- Contenido de HumedadDocument10 pagesContenido de HumedadWalterFredyGutierrezCanazaNo ratings yet
- 3 Er. EXAMEN PARCIAL - Contaminacion y Tratamiento de Aguas ResidualesDocument2 pages3 Er. EXAMEN PARCIAL - Contaminacion y Tratamiento de Aguas ResidualesCeci Yanching Omonte BorrovicNo ratings yet
- Deshidratación Del Gas NaturalDocument100 pagesDeshidratación Del Gas NaturalJosé Miguel Carrero Pereira100% (1)
- El Enlace PeptídicoDocument3 pagesEl Enlace PeptídicoMeridasInterntNo ratings yet
- Informe #7. Cationes Del Grupo IV ADocument4 pagesInforme #7. Cationes Del Grupo IV AMaría Isabel Zorrilla CertucheNo ratings yet
- Deshidratacion Del PetroleoDocument15 pagesDeshidratacion Del PetroleoPaola MejiasNo ratings yet
- Hds Chesterton 723Document10 pagesHds Chesterton 723Auxiliar PromoquinNo ratings yet