Professional Documents
Culture Documents
Propiedades proteínas
Uploaded by
Joicy AlejandroOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Propiedades proteínas
Uploaded by
Joicy AlejandroCopyright:
Available Formats
PROPIEDADES DE LAS PROTENAS
1. Solubilidad:
Las protenas que tienen conformacin filamentosa son insolubles
mientras que las globulares son
solubles en agua. La solubilidad
se debe a los radicales libres de
los aminocidos que al ionizarse
establecen
enlaces
dbiles
(puentes de hidrgeno) con las
molculas de agua; as, cuando
una protena se solubiliza queda
recubierta de una capa de
molculas de agua (capa de
solvatacin) que impide que se
una a otras protenas lo cual provocara su precipitacin.
La adicin de un disolvente orgnico como acetona o alcohol a una
solucin de protena en agua disminuye la constante dielctrica del
disolvente, desplaza molculas de agua asociadas con la protena y
reduce la concentracin de agua presente en la disolucin. Estos
efectos tienden a disminuir la solubilidad de la protena y por ello se
utilizan para precipitar protenas de sus disoluciones. Si se agrega a
una solucin de protenas en agua una pequea cantidad de sal, la
solubilidad aumenta; este fenmeno llamado disolucin salina o
salting in se debe a las fuerzas de atraccin entre los iones de la
protena y los iones de la sal. Cuando se aumenta mucho la cantidad
de iones extraos (sal) las protenas se precipitan en un fenmeno
llamado salting out.
Esta propiedad es la que hace posible la hidratacin de los tejidos de
los seres vivos.
2. Capacidad amortiguadora:
Las protenas tienen un comportamiento anftero y esto las hace
capaces de neutralizar las variaciones de pH del medio, ya que
pueden comportarse como un cido o una base y por tanto liberar o
retirar protones (H+) del medio donde se encuentran.
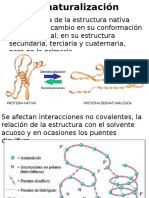
3. Desnaturalizacin y Renaturalizacin:
La desnaturalizacin de se refiere
a la ruptura de los enlaces que
mantienen
sus
estructuras
cuaternaria, terciaria y secundaria,
conservndose
solamente
la
primaria. En estos casos las
protenas
se
transforman
en
filamentos lineales y delgados que
se entrelazan hasta formar compuestos fibrosos e insolubles en agua.
Los agentes que pueden desnaturalizar a una protena pueden ser:
calor excesivo, sustancias que modifican el pH, alteraciones en la
concentracin, alta salinidad o agitacin molecular. La mayor parte
de las protenas experimentan desnaturalizaciones cuando se
calientan entre 50 y 60 C; otras se desnaturalizan tambin cuando
se enfran por debajo de los 10 a 15 C. La desnaturalizacin puede
ser reversible (renaturalizacin) pero en muchos casos es irreversible.
4.
Especificidad
Es una de las propiedades ms caractersticas de las protenas, se
refiere a que cada una de las especies de seres vivos es capaz de
fabricar sus propias protenas. La enorme diversidad proteica
interespecfica e intraespecfica es la consecuencia de las mltiples
combinaciones entre los aminocidos, lo cual est determinado por el
ADN de cada individuo. La especificidad de las protenas explica
algunos fenmenos biolgicos como la compatibilidad en los
trasplantes de rganos, injertos biolgicos, sueros sanguneos,
procesos alrgicos e incluso algunas infecciones. Esto no ocurre con
los glcidos y lpidos, que son comunes a todos los seres vivos.
La secuencia de aminocidos determina las posibles estructuras
secundarias, terciarias y cuaternarias que la protena puede adquirir y
estas determinaran la funcin de las protenas. Hay 2 tipos de
protenas cuyas funciones requieren una secuencia especfica de
aminocidos:
Enzimas: existe una enzima diferente para cada sustrato y para
cada reaccin qumica que experimenta dicho sustrato. De esta
especificidad depende la eficiencia de las enzimas como
catalizadores de las reacciones de los organismos.
Inmunoglobulinas: cada antgeno provoca en las
inmunitarias la elaboracin de un anticuerpo especfico.
clulas
La especificidad se muestra en diversos niveles:
Especificidad de funcin: reside en la posicin que ocupan
determinados aminocidos en su secuencia lineal. Esta secuencia
condiciona la estructura cuaternaria de la protena, responsable
de su funcin caracterstica.
Especificidad de especie: existen protenas que son exclusivas de
cada especie, pero las protenas que desempean funciones
similares en diferentes especies tienen una composicin y
estructura anloga; por ejemplo la insulina es exclusiva de los
vertebrados.
5. Isomera espacial y ptica:
El tomo de C central es asimtrico en todos los aminocidos,
excepto en la glicina, ya que poseen 4 radicales distintos. Este hecho
los hace pticamente activos, de modo que en disolucin desvan el
plano en que vibra un haz de luz polarizada. A su vez como los
enlaces de los tomos de C poseen una configuracin tetradrica,
sern posibles 2 configuraciones distintas para cada aminocido, que
sern imgenes especulares o estereoismeros.
Protenas (Wiki en Internet). St. Petersburg (FL): Wikimedia Foundation,
Inc.
2015.
[Consulta
14
abril
2015].
Disponible
en:
http://es.wikipedia.org/wiki/Prote
%C3%ADna#Propiedades_de_las_prote.C3.ADnas
Propiedades de las proteinas [en linea]. Murcia. [Consulta: 14 abril
2015]. Disponible en: http://www.um.es/molecula/prot06.htm
Protenas: caractersticas generales [en lnea]. Espaa: Maky Bermdez.
[Consulta:
14
abril
2015].
Disponible
en:
http://html.rincondelvago.com/proteinas_caracteristicas-generales.html
Propiedades de las protenas [en lnea]. [Consulta: 14 abril 2015].
Disponible
en:
http://www.asturnatura.com/articulos/proteinas/propiedades-de-lasproteinas.php
Garrido, Amando; Teijn, Jos; Blanco, Dolores; Villaverde, Carmen;
Mendoza, Carlos; Ramrez, Jess. Fundamentos de Bioqumica
Estructural. 2 ed. Madrid: Tbar, 2006.
You might also like
- Características Físicas y Químicas de La OrinaDocument5 pagesCaracterísticas Físicas y Químicas de La OrinaJoicy Alejandro76% (29)
- Características Físicas y Químicas de La OrinaDocument5 pagesCaracterísticas Físicas y Químicas de La OrinaJoicy Alejandro76% (29)
- Encuesta de Satisfaction EstudiantilDocument28 pagesEncuesta de Satisfaction EstudiantilmedallitaNo ratings yet
- Informe planimétrico inspección ocularDocument10 pagesInforme planimétrico inspección ocularangelar05No ratings yet
- Barras de Chocolate Con Miel de AbejaDocument19 pagesBarras de Chocolate Con Miel de AbejaJulio MorquechoNo ratings yet
- Desnaturalización de Las ProteínasDocument10 pagesDesnaturalización de Las ProteínasBrissiNo ratings yet
- Pensamiento crítico y definiciones de John E McPeckDocument3 pagesPensamiento crítico y definiciones de John E McPeckyulizurc86% (7)
- Funciones de Las ProteínasDocument5 pagesFunciones de Las ProteínasRuben Poveda100% (1)
- Propiedades Funcionale de Las Proteinas PDFDocument7 pagesPropiedades Funcionale de Las Proteinas PDFBrian Guillermo Bustamante86% (7)
- Propiedades Funcionales de Las ProteinasDocument14 pagesPropiedades Funcionales de Las ProteinasVictor Santa Cruz QuirozNo ratings yet
- Anti Nutrient EsDocument12 pagesAnti Nutrient Esdora yanetNo ratings yet
- Las proteínas: cadenas de aminoácidosDocument6 pagesLas proteínas: cadenas de aminoácidosNaky ChiNo ratings yet
- Para Imprimir, C. NaturalesDocument2 pagesPara Imprimir, C. Naturaleslinda sofia garcia marulandaNo ratings yet
- Laboratorio #11Document15 pagesLaboratorio #11Samuel Fernando Velasco Chacon75% (4)
- Taller D ProteinasDocument8 pagesTaller D ProteinasJorge SierraNo ratings yet
- Bromatología - ProteínasDocument15 pagesBromatología - Proteínasaidenalice4No ratings yet
- Propiedades de las proteínas: solubilidad, desnaturalización y especificidadDocument3 pagesPropiedades de las proteínas: solubilidad, desnaturalización y especificidadjusellyNo ratings yet
- Universidad Privada Franklin Roosevelt FinalDocument28 pagesUniversidad Privada Franklin Roosevelt FinalJuanCarlitos QMNo ratings yet
- Taller de Bioquimica ProteinaDocument7 pagesTaller de Bioquimica ProteinaRosman Ramos MartinezNo ratings yet
- DesnaturalizaciónDocument2 pagesDesnaturalizaciónMelaniie OrtiizNo ratings yet
- Desnaturalización de Proteínas Por Detergentes y Disolventes OrgánicosDocument7 pagesDesnaturalización de Proteínas Por Detergentes y Disolventes OrgánicosJosé Burgos100% (1)
- Proteínas EstructuraDocument8 pagesProteínas Estructuradylanr96No ratings yet
- Taller Quimica AplicadaDocument4 pagesTaller Quimica AplicadacristiandromerNo ratings yet
- Expo MañanaDocument3 pagesExpo MañanaSergio Mauricio Betancur HincapieNo ratings yet
- Cuestionarios 1er Parcial - Tema 5Document6 pagesCuestionarios 1er Parcial - Tema 5Sauceda ReyesNo ratings yet
- ProteinasDocument14 pagesProteinasHayda CalderonNo ratings yet
- DesnaturalizaciónDocument28 pagesDesnaturalizaciónErnesto GallegoNo ratings yet
- Precipitacion y DesnaturalizacionDocument9 pagesPrecipitacion y DesnaturalizacionMadeline CorderoNo ratings yet
- Proteínas Solubilidad y DesnaturalizaciónDocument17 pagesProteínas Solubilidad y DesnaturalizaciónAlex Romero SurcoNo ratings yet
- Resumen de Aminoacidos Proteinas y Enzimas 1Document5 pagesResumen de Aminoacidos Proteinas y Enzimas 1pablokapogNo ratings yet
- ProteínaDocument10 pagesProteínaCesar BlancoNo ratings yet
- Practica n3 Solubilidad de ProteinasDocument12 pagesPractica n3 Solubilidad de ProteinasgustavoNo ratings yet
- Sustentación de PreguntasDocument13 pagesSustentación de PreguntasLUIS ALEJANDRO PANTOJA VALLEJONo ratings yet
- TEMA 5. Alteraciones de Las ProteínasDocument16 pagesTEMA 5. Alteraciones de Las ProteínasNicole MastrogiorgioNo ratings yet
- Proteinas, Avalos Diaz Luisa TareaDocument24 pagesProteinas, Avalos Diaz Luisa TareaLuisa Avalos DíazNo ratings yet
- Casificacion de Las Proteinas BioquimicaDocument20 pagesCasificacion de Las Proteinas Bioquimicaisabel maren CondoriNo ratings yet
- Tema 3 Bioquimica ISTSLDocument32 pagesTema 3 Bioquimica ISTSLFîö Quenn's ShNo ratings yet
- Biomica Tema para ExponerDocument4 pagesBiomica Tema para ExponerFiorella MioNo ratings yet
- Desnaturalización (Bioquímica)Document17 pagesDesnaturalización (Bioquímica)Elizabeth Medina TorresNo ratings yet
- Importancia solubilidad proteínasDocument3 pagesImportancia solubilidad proteínasAndrea ChavezNo ratings yet
- Bioquímica - PROTEINASDocument58 pagesBioquímica - PROTEINASkaviNo ratings yet
- 1 ProteinasDocument10 pages1 ProteinasMartha Lia Castaño EcheverryNo ratings yet
- Desnaturalizacion de Las EnzimasDocument5 pagesDesnaturalizacion de Las EnzimasLeonel Carlos Rivero MamaniNo ratings yet
- Proteinas Sec Ter y Cuaternaria FuncionesDocument33 pagesProteinas Sec Ter y Cuaternaria FuncionesDavid FernandoNo ratings yet
- Proteínas: estructura, funciones y propiedadesDocument8 pagesProteínas: estructura, funciones y propiedadesAngela omaña50% (2)
- Que Es Desnaturalización en BromatologíaDocument2 pagesQue Es Desnaturalización en BromatologíaDeyvit GutierrezNo ratings yet
- Clase 4Document10 pagesClase 4Nikaury HidalgoNo ratings yet
- Conversion QuimicaDocument23 pagesConversion Quimicaisel galueNo ratings yet
- Propiedades funcionales proteínasDocument5 pagesPropiedades funcionales proteínasWendy Julieth LosadaNo ratings yet
- Bioquimica Reconocimiento de ProteinasDocument12 pagesBioquimica Reconocimiento de ProteinasJhovana Guevara FonsecaNo ratings yet
- Informe de Laboratorio N. 9Document16 pagesInforme de Laboratorio N. 9Miyey Gutierrez Orduz0% (1)
- Desnaturalización de proteínas por diferentes efectosDocument12 pagesDesnaturalización de proteínas por diferentes efectosKatherin BernalNo ratings yet
- U1L4 TD GRUPO 13-APROBADODocument9 pagesU1L4 TD GRUPO 13-APROBADOTiniHryshchenkoNo ratings yet
- Desnaturalizacion de ProteinasDocument4 pagesDesnaturalizacion de ProteinasLesly Caja TantaNo ratings yet
- Informe de DesnaturalizaciónDocument16 pagesInforme de DesnaturalizaciónDiana Sevillano AscateNo ratings yet
- Guia 5 LauraDocument2 pagesGuia 5 LauraNery Javier MartinezNo ratings yet
- Proteínas: estructura, propiedades y factores que afectan su solubilidadDocument11 pagesProteínas: estructura, propiedades y factores que afectan su solubilidadEmmanuel CasteloNo ratings yet
- Método Kjeldahl para determinar nitrógeno en sustancias orgánicasDocument3 pagesMétodo Kjeldahl para determinar nitrógeno en sustancias orgánicasIvan BobadillaNo ratings yet
- Desnaturalizacion BromatologiaDocument29 pagesDesnaturalizacion BromatologiaAxel Estrada SalazarNo ratings yet
- Macro NutrientesDocument52 pagesMacro NutrientesRodrigo Luis Rodriguez AlvinoNo ratings yet
- Desnaturalización de Las ProteínasDocument27 pagesDesnaturalización de Las ProteínasJonathan Acuña CordovaNo ratings yet
- DesnaturalizacionDocument4 pagesDesnaturalizacionAlexis VelaNo ratings yet
- Practica 01Document3 pagesPractica 01Andy Yosifer Chirinos GonzalesNo ratings yet
- Química de macrocomponentes de alimentosFrom EverandQuímica de macrocomponentes de alimentosNo ratings yet
- BioseguridadDocument5 pagesBioseguridadJoicy AlejandroNo ratings yet
- Intercambio aminoácidos órganosDocument2 pagesIntercambio aminoácidos órganosJoicy AlejandroNo ratings yet
- Intercambio aminoácidos órganosDocument2 pagesIntercambio aminoácidos órganosJoicy AlejandroNo ratings yet
- Fosas NasalesDocument2 pagesFosas NasalesJoicy AlejandroNo ratings yet
- Sistema EndocrinoDocument7 pagesSistema EndocrinoJoicy AlejandroNo ratings yet
- ParabolaDocument9 pagesParabolaJoicy AlejandroNo ratings yet
- Tejidos VegetalesDocument2 pagesTejidos VegetalesJoicy AlejandroNo ratings yet
- ParabolaDocument9 pagesParabolaJoicy AlejandroNo ratings yet
- Mod 2 ComunicaciónDocument68 pagesMod 2 ComunicaciónRosa Peña RosalesNo ratings yet
- Emocionesjesus PDFDocument31 pagesEmocionesjesus PDFVictor JimenezNo ratings yet
- Informe de Laboratorio 1 Fisica 3Document9 pagesInforme de Laboratorio 1 Fisica 3Mauricio MuñizNo ratings yet
- Jabon A Base de Maiz PDFDocument204 pagesJabon A Base de Maiz PDFDiego Muñoz Manrique0% (2)
- Jugo para Desinflamar VientreDocument4 pagesJugo para Desinflamar VientreHugo Martinez SandovalNo ratings yet
- Exmn ProbabilidadDocument6 pagesExmn ProbabilidadJessica SuastesNo ratings yet
- Niveles en La Constitución de Un Anuncio PublicitarioDocument2 pagesNiveles en La Constitución de Un Anuncio PublicitarioUbaldo Cardenas Guzman100% (1)
- Poemas LagerkvistDocument6 pagesPoemas LagerkvistDavid JaramilloNo ratings yet
- Teoría FundamentadaDocument20 pagesTeoría FundamentadajuliedetrejoNo ratings yet
- CuestionarioDocument11 pagesCuestionariodavid vergara0% (2)
- CIRCULAR 14 DE 2021. Reunión Comisiones, Entrega de Boletines Primer Periodo y Otras OrientacionesDocument2 pagesCIRCULAR 14 DE 2021. Reunión Comisiones, Entrega de Boletines Primer Periodo y Otras OrientacionesGUILLERMO AVENDAÑO ÁLVAREZNo ratings yet
- Ética - La Eva MitocondrialDocument3 pagesÉtica - La Eva MitocondrialAna Claudia TuctoNo ratings yet
- Relaciones Con Los Consumidores PDFDocument8 pagesRelaciones Con Los Consumidores PDFDan CruzNo ratings yet
- Guia10. Ecuación Diferencial de ClairautDocument2 pagesGuia10. Ecuación Diferencial de Clairaut?????100% (1)
- Guia Diseño de Plantas y Equipos de Ing AmbientalDocument12 pagesGuia Diseño de Plantas y Equipos de Ing AmbientalGARKNo ratings yet
- Primer Parcial Biociencias IIDocument4 pagesPrimer Parcial Biociencias IIJim MorrisonNo ratings yet
- Código Ética SimulacionDocument12 pagesCódigo Ética SimulacionDavid Sepulveda MirandaNo ratings yet
- El Arándano DiapositivasDocument11 pagesEl Arándano DiapositivasEdgar Garcia RosasNo ratings yet
- Unidades Funcionales PulmonaresDocument104 pagesUnidades Funcionales PulmonaresAndrea MartinezNo ratings yet
- Inhabilidades e Incompatibilidades Sept 2020Document42 pagesInhabilidades e Incompatibilidades Sept 2020oscar alberto bastidasNo ratings yet
- Síndrome de Deleción 5pDocument2 pagesSíndrome de Deleción 5pLuis AlfredoNo ratings yet
- El Cisne Negro en Las FinanzasDocument5 pagesEl Cisne Negro en Las FinanzasShantall Saldaña GonzalesNo ratings yet
- Conexión a Internet y protocolos TCP/IPDocument1 pageConexión a Internet y protocolos TCP/IPNINA.HZSKYNo ratings yet
- Curso SwatDocument2 pagesCurso SwatBraulio ValdiviaNo ratings yet
- Tipos evaluación por finalidad y momentoDocument8 pagesTipos evaluación por finalidad y momentoNancy ChojolanNo ratings yet
- Valoración y peritación inmobiliaria: conceptos, tipos y cálculosDocument93 pagesValoración y peritación inmobiliaria: conceptos, tipos y cálculosJuan Filgueiras PeñaNo ratings yet