Professional Documents
Culture Documents
Cara Pengambilan Swab Tenggorok
Uploaded by
Mutiara FerinaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cara Pengambilan Swab Tenggorok
Uploaded by
Mutiara FerinaCopyright:
Available Formats
Pewarnaan difteri
Corynebacterium diphtheriae merupakan makhluk anaerobik fakultatif dan gram positif,
ditandai dengan tidak berkapsul, tidak berspora, dan tak bergerak. Bakteri ini membentuk asam,
tetapi tidak membentuk gas pada beberapa karbohidrat. Corynebacterium diphtheriae terdapat
dalam saluran pernapasan, dalam luka-luka, pada kulit orang yang terinfeksi, atau orang normal
yang membawa bakteri. Bakteri disebarkan melalui droplet atau kontak dengan individu yang
peka. Bakteri kemudian tumbuh pada selaput mukosa atau kulit yang lecet, dan bakteri mulai
menghasilkan toksin
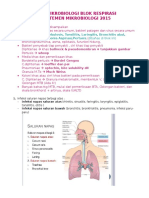
Cara Pengambilan swab tenggorok
Tekan lidah dengan spatula lidah, usap lidi kapas pada kedua tonsil dan faring
belakang, jangan menyentuh lidah & uvula
Pemeriksaan Difteri(pada tonsil, bakteri membentuk selaput, ketika di swap akan berdarah)
pseudomembran
Kuman Corynebacterium diphtheriae bila dipulas dengan Gram adalah : Gram positif
staf. Tetapi bila C. Diphtheriae diwarnai dengan pewarnaan yang spesifik yaitu NEISSER dan
ALBERT memperlihatkan bentuk yang istimewa seperti halter yang pada ujungnya kelihatan
pentolan yang disebut granula. Granula ini mula-mula dilihat oleh Babes Ernst dan dinamakan
granula Babes Erns.
I. Cara Neisser.
Pada pewarnaan ini diperlukan 3 macam larutan pulas yang masing-masing lazimnya disebut :
Neisser A, Neisser B dan Neisser C. Ketiga larutan pulas ini disimpan dalam botol yang
tersendiri.
Larutan Neisser A :
Susunan : Methylen biru
: 1 gram.
Alkohol 70%
: 20 ml.
Asam acetat glaciale : 50 ml.
Aquadest
: 95 ml.
Larutan Neisser B :
Susunan : Gentian violet : 1 gram.
1.
2.
3.
4.
5.
1.
2.
3.
4.
Alkohol absolut
: 10 ml.
Aquadest
: 300 ml.
Pemakaian : 2 bagian larutan Neisser A + 1 bagian larutan Neisser B. Campuran ini dibuat
mendadak dan disebut juga Neisser I.
Larutan Neisser C (Neisser II).
Susunan : Chrysoidin
: 1 gram
Alkohol panas
: 300 ml.
Atau
Bismark brown : 1 gram.
Aquadest panas : 500 ml.
Cara pewarnaan :
Sediaan yang direkatkan digenangi dengan larutan Neisser I selama kira-kira 20 detik.
Sediaan dicuci pada pancuran air kran pelan-pelan.
Bubuhi larutan Neisser II selama 30 detik.
Larutan pulas pada objek gelas dibuang tanpa dicuci dengan air, kemudian preparat dikeringkan
dengan kertas saring.
Periksa dengan mikroskop, hasil pewarnaan:
Badan bakteri (seperti batang) : cokelat-muda.
Granula pada kedua ujungnya : biru-hitam.
II. Cara Albert.
Diperlukan 2 macam larutan pulas.
Larutan I.
Susunan: Toluidin biru
: 0,15 gram.
Malachit hijau (Methyl hijau) : 0,20 gram.
Asam asetat glacial
: 1 ml.
Alkohol 95%
: 2 ml.
Aquadest
: 100 ml.
Zat warna dilarutkan dulu dalam alkohol, kemudian tambah air dan kemudian asam asetat
glacial. Biarkan 24 jam, saring dan baru dapat dipakai.
Larutan II.
Susunan: Jodium
: 2 gram.
Kalium Jodida : 3 gram.
Aquadest
: 300 ml.
(Pada modifikasi Jensen, larutan II ini diganti dengan susunan larutan sbb : Jod 1 gram + KJ 2
gram dan aquadest 100 ml). Simpan dalam botol yang sawo matang.
Cara pewarnaan :
Buat sediaan dan sesudah direkatkan, bubuhi dengan larutan I, biarkan kira-kira 3-5 menit.
Cuci dengan air kran, kemudian dibubuhi dengan larutan II, biarkan kira-kira 1 menit.
Larutan pulas pada objek gelas dibuang, keringkan dengan kertas saring.
Periksa dengan mikroskop dan hasil pewarnaan:
Bakteri (seperti batang) : hijau.
Granula atau kutubnya : hitam kebiru-biruan
Diagnosis pasti dengan isolasi C. diphtheriae dengan pembiakan pada media Loeffler dilanjutkan
dengan tes toksinogenitas secara in-vivo (marmut) dan in-vitro (tes Elek).
Kultur bakteriologik penting dilakukan untuk mengkonfirmasi diagnosis difteri.
Dilakukan pada seluruh pasien suspek difteria dan mereka yang beresiko untuk berkontak
dengan pasien difteria. Spesimen diambil dari hidung dan tenggorokan (swab nasofaring
dan faring).
Pengambilan spesimen untuk kultur sebaiknya secepatnya ketika difteria (pada lokasi
mana saja) telah dicurigai ada, walaupun antibiotik telah diberikan dalam dosis inisial.
Pengambilan spesimen dari membran memberikan hasil yang sama baiknya dari hidung
dan tenggorokan. Jika bisa, swab sebaiknya juga diambil dari balik membran.
Peringatkan laboratorium pada kecurigaan adanya difteria karena isolasi C. diphtheriae
membutuhkan media kultur khusus termasuk tellurite. C. diphtheria dapat tumbuh pada
berbagai selektif media, termasuk agar telurite atau khususnya media Loeffle, Hoyle,
Mueller, dan Tinsdale.
Isolasi C. diphtheriae pada orang yang cenderung berkontak dengan pasien difteri dapat
mengkonfirmasi diagnosis, walaupun jika hasil kulturnya negatif.
Setelah C. diphtheriae diisolasi, ditentukan juga biotipenya: gravis, mitis, atau
intermedius (substrain).
Tes toksigenisitas juga dilakukan.
Menggunakan tes Elek untuk menentukan C. diphtheriae yang diisolasi memproduksi
toksin.
Tes toksigenitas jarang tersedia di laboratorium mikrobiologi klini yang ada; bahan
dikirim ke laboratorium tertentu yang menyediakan tes tersebut dan mempunyai ahli
laboratorium yang dapat mengerjakan tes tersebut dengan baik.
Pengukuran kadar serum antibody pasien terhadap toksin difteria perlu dilakukan
sebelum pemberian antitoksin untuk menilai kemungkinan diagnosis difteria.
Jika kadar antibodinya rendah, diagnosis difteria tidak dapat ditegakkan, tapi jika
kadarnya tinggi, C. diphtheria kemungkinan telah menghasilkan toksin yang dapat
menyebabkan sakit yang berat.
You might also like
- DIFTERIDocument55 pagesDIFTERIAndy JoeyNo ratings yet
- BAKTERIOLOGIDocument19 pagesBAKTERIOLOGIAyu Puspita SariNo ratings yet
- Spo Pemeriksaan BtaDocument4 pagesSpo Pemeriksaan BtaRedhaRezianaNo ratings yet
- Perawatan MikroskopDocument29 pagesPerawatan MikroskopEva FebriyaniNo ratings yet
- Plasmodium FalciparumDocument7 pagesPlasmodium FalciparumVirga Aliefiansyah PradanaNo ratings yet
- Diagnosis Lab FilariasisDocument22 pagesDiagnosis Lab FilariasisInstalasi Laboratorium RSUD Kep. SeribuNo ratings yet
- Pemeriksaan Rapid Test HivDocument2 pagesPemeriksaan Rapid Test HivIchaMarisaWahyuNo ratings yet
- Mikosis SistemikDocument14 pagesMikosis SistemikAyu Purnama AsihNo ratings yet
- MakalahDocument16 pagesMakalahDwiputri Astuti FajriantiNo ratings yet
- Modul Virologi IiDocument27 pagesModul Virologi IiMus Rifa MunirNo ratings yet
- Penilaian Kualitas Sediaan DahakDocument13 pagesPenilaian Kualitas Sediaan Dahakdesyana fatmawatiNo ratings yet
- Klasifikasi Penyakit JamurDocument14 pagesKlasifikasi Penyakit JamurTiti Lasmini100% (3)
- PAPER Swab TelingaDocument6 pagesPAPER Swab TelingaEva NobNo ratings yet
- Pewarnaan BkateriologiDocument61 pagesPewarnaan BkateriologiAdimas GilangNo ratings yet
- Manajemen Laboratorium KesehatanDocument14 pagesManajemen Laboratorium KesehatanDarniusNo ratings yet
- MikologiDocument15 pagesMikologiPuskesmas Sambirejo BanyuwangiNo ratings yet
- Analisa Sperma Rev 2Document17 pagesAnalisa Sperma Rev 2Laura Angelica100% (1)
- Tugas Paper Manajemen Laboratorium JummiatiDocument11 pagesTugas Paper Manajemen Laboratorium JummiatiAliva AuliaNo ratings yet
- Aspergilus FumigatusDocument22 pagesAspergilus FumigatusKhairul LainiNo ratings yet
- Tugas Bu FitriDocument45 pagesTugas Bu Fitrisri rahayu puspita100% (1)
- Pemeriksaan Darah LengkapDocument18 pagesPemeriksaan Darah LengkaphaniNo ratings yet
- Laporan PPKM KombosDocument18 pagesLaporan PPKM KombosAndre Nitinegoro100% (1)
- Pemeriksaan TphaDocument9 pagesPemeriksaan Tphaahmadwaluyo0% (1)
- Sken 10 b15Document11 pagesSken 10 b15Chearin Dhea SNo ratings yet
- Mikroskop Olympus Cx-21Document2 pagesMikroskop Olympus Cx-21Heni MaikuriNo ratings yet
- SOP Penanganan Spesimen DahakDocument6 pagesSOP Penanganan Spesimen DahakJony TylerNo ratings yet
- TphaDocument10 pagesTphaDaffasyenaNo ratings yet
- Kelas - C - g70117178 - Christin Lumeling - Makalah Flora Normal Pada Tubuh ManusiaDocument19 pagesKelas - C - g70117178 - Christin Lumeling - Makalah Flora Normal Pada Tubuh Manusiachristin lumelingNo ratings yet
- Makalah MeningitidisDocument16 pagesMakalah MeningitidisRaden Febry Istyanto0% (1)
- Isolasi, Kultur Dan Identifikasi VirusDocument3 pagesIsolasi, Kultur Dan Identifikasi Viruselsmee100% (1)
- Metode TekanDocument2 pagesMetode TekanIkang JukiNo ratings yet
- SporotrikosisDocument16 pagesSporotrikosisniadestina20No ratings yet
- Sop Pemeriksaan DHF (Igg & Igm) Rapid TestDocument3 pagesSop Pemeriksaan DHF (Igg & Igm) Rapid TestELSANo ratings yet
- Hasil JadiDocument22 pagesHasil JadiAyu Putu Prima SeptianiNo ratings yet
- Identifikasi Plasmadium MalariaDocument32 pagesIdentifikasi Plasmadium MalariaAbdon DinongNo ratings yet
- SalmonellaDocument23 pagesSalmonellaRadiahTahirNo ratings yet
- Plasmodium FalciparumDocument4 pagesPlasmodium FalciparumFathur Rahman Mutiara HikmahNo ratings yet
- Surat Undangan DPWDocument4 pagesSurat Undangan DPWDwie Anjani SaiNo ratings yet
- Bakuan MutuDocument9 pagesBakuan MutuDwiza AndariNo ratings yet
- Logbook Identifikasi MalariaDocument7 pagesLogbook Identifikasi Malariamonika putriNo ratings yet
- Analisa SpermaDocument19 pagesAnalisa SpermaNosa Ika Cahyariza IINo ratings yet
- Loa LoaDocument7 pagesLoa Loanadia ekaNo ratings yet
- Pemeriksaan TPHADocument14 pagesPemeriksaan TPHAYana FaradilaNo ratings yet
- Angiostrongylus CantonensisDocument7 pagesAngiostrongylus CantonensisFaris MakkawaruNo ratings yet
- Basil Gram Positif Dan Gram NegatifDocument100 pagesBasil Gram Positif Dan Gram NegatifDevi Christina Damanik (Papua medical School)0% (1)
- Kimia Klinik TCO2 Ega SeptiDocument13 pagesKimia Klinik TCO2 Ega SeptiegaNo ratings yet
- Pap Smear PapanicolaouDocument12 pagesPap Smear Papanicolaouits meeeNo ratings yet
- Pengendalian MutuDocument7 pagesPengendalian MutuDaniel WilliamsNo ratings yet
- Tujuan Dan Prinsip String TestDocument1 pageTujuan Dan Prinsip String TestMiptaNo ratings yet
- Prosedur Pemeriksaan Glukosa Dengan FotometerDocument4 pagesProsedur Pemeriksaan Glukosa Dengan FotometerDyah Rahayu Sawitri100% (1)
- Plasmodium TugasDocument5 pagesPlasmodium TugasAlicia TjinNo ratings yet
- Teknik PewarnaanDocument6 pagesTeknik PewarnaanSulis TianingsihNo ratings yet
- Sumsum TulangDocument11 pagesSumsum TulangRiyen Astri VionitaNo ratings yet
- Pemantapan Mutu ImmunoserologiDocument6 pagesPemantapan Mutu ImmunoserologiIntan MasmudaNo ratings yet
- Cara Identifikasi Bakteri Vibrio Cholera Sampel TinjaDocument4 pagesCara Identifikasi Bakteri Vibrio Cholera Sampel TinjaAlifah HumairaNo ratings yet
- Laporan Pasca AnalitikDocument47 pagesLaporan Pasca AnalitikYaramadhaniNo ratings yet
- StreptococcusDocument22 pagesStreptococcusRadiahTahirNo ratings yet
- Corynebacterium DiphtheriaeDocument6 pagesCorynebacterium Diphtheriaecicin yuliantiNo ratings yet
- Laporan Bakteri 3 Difteri Jihan Nadhira S.Document8 pagesLaporan Bakteri 3 Difteri Jihan Nadhira S.jihan salsabilaNo ratings yet
- Bahan Mikrobiologi Blok RespirasiDocument8 pagesBahan Mikrobiologi Blok RespirasiNur Permata SariNo ratings yet