Professional Documents
Culture Documents
Calor de Combustion
Uploaded by
708170Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Calor de Combustion
Uploaded by
708170Copyright:
Available Formats
CALOR DE COMBUSTIN
1.- Objetivos:
Observar y comprender el fundamento de un calormetro.
Determinar la constante K,
Determinar la constante de combustin de acido benzoico.
Determinar el calor de combustin de azcar y de la leche.
2.- Marco Terico.Calorimetra.- Calormetro consiste en esencia de un recipiente aislado trmicamente y
lleno de agua en la cual se sumerge una cmara de reaccin en una reaccin exotrmica el
calor generado se trasmite al agua y la elevacin de temperatura resultante en esto se lee en
un termmetro sumergido en ella se trata una reaccin endotrmica hay que medir la
reduccin de la temperatura en vez de su incremento
Calor de combustin.- Es la cantidad de calor liberado por mol de una sustancia quemado
los calores de combustin se pueden emplear directamente para calcular calores de
formacin de compuestos orgnicos si estos compuestos solo carbono hidrgeno y oxigeno
se necesita la informacin complementaria o cerca del calor de formacin del dixido de
carbono y del agua liquido.
Calorimetra a volumen constante.- Para medir el calor de combustin se coloca una
masa conocida de un compuesto a un recipiente de aserr de no minado bomba calorimetra
volumen constante que se llena con oxigeno mas o menos a una 30atm de presin la bomba
serrado se sumerge en una cantidad conocida de agua la muestra se enciende elctricamente
y el calor producido por la reaccin de combustin se puede calcular con exactitud al
registrar el aumento de la temperatura del agua y el calor liberado por la muestra es
absorbido por el agua por el calorimtrica permite suponer que no hay perdida de calor o de
masa hacia el rededor durante el tiempo que se hace las mediciones como consecuencia se
puede decir que la bomba calorimtrica y el agua en que se sumerge constituyen un sistema
aislado debido a que no entra ni sale calor del sistema durante el proceso en la bomba
calorimtrica la reaccin ocurre bajo condiciones de volumen constante y no de la presin
constante.
3.- Parte Experimental.3.1.MATERIALES
Alambre de ignicin
Termmetro
Prensa
Vidrio de reloj
Mortero
Esptula
REACTIVOS
Acido benzoico
Naftaleno
Azcar
Leche
Agua
EQUIPO
Calormetro Parr
Balanza
Tubo de oxigeno
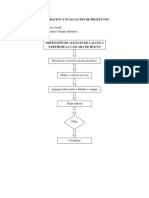
3.2.- Procedimiento.El calormetro consiste en un recipiente adiabtico que contiene una cubeta metlica con
una cantidad promedio de 2000g de agua, en cuyo interior se introduce la cmara de
reaccin, que es la bomba calorimtrica, dentro del cual se pone un peso determinado de la
sustancia que se desea determinar el calor de combustin, que es de un gramo, se introduce
oxigeno a una presin de 25 bar y por medio de electrodos y un alambre ignicin de una
longitud de 10 centmetros, se enciende el equipo y el calor producido por la reaccin eleva
la temperatura del agua, la cual se mantiene en agitacin a fin de uniformar la temperatura
en todos sus puntos.
Partiendo de esta elevacin de temperatura y conociendo la cantidad de calor requerido
para elevar la temperatura del calormetro en su contenido, se puede calcular el calor de
combustin por mol de sustancia quemada.
PROCEDIMIENTO DE PREPARACIN DE LA BOMBA CALORIMTRICA:
Pesar 1gr del slido que se va a utilizar.
Cortar 10cm del alambre de ignicin.
Con la prensa hacer la pastilla, utilizando el slido anteriormente pesado y el
alambre de ignicin.
Atar las puntas del alambre de la pastilla a los electrodos de la bomba de
combustin.
Cerrar la bomba.
Introducir oxigeno a la bomba abriendo con cuidado la vlvula de control a 25bar de
presin.
PREPARACIN DEL CALORMETRO:
En la cubeta metlica colocar agua (la cantidad no debe de sobre pasar a la bomba).
Poner dentro del equipo la bomba calorimtrica, observar que la bomba este en un
lugar adecuado.
Conectar a la bomba los cables que suministran corriente elctrica a los electrodos.
(La intensidad de corriente que pasa por el alambre de ignicin es de
aproximadamente de 4 amperios, con un voltaje de 18 voltios, suficiente para
encender la pastilla)
Colocar la tapa con el termmetro y el agitador en el orificio de la tapa, observando
que pueda leerse los cambios de temperatura del agua.
Oprimir el botn de encendido del equipo.
Se debe de leer la temperatura final hasta la cual alcanza la bomba.
Por ltimo se libera el oxigeno con cuidado, y ver si se quemo la pastilla de lo
contrario repetir el proceso.
3.3.- Clculos y Resultados.Tabla de valores:
T0
Tf
1 prueba (C)
12.5
14.4
2 prueba (C)
12.5
15.7
Azcar (C)
16.1
17.2
Leche (C)
16.9
18.5
Para el clculo de la constante:
H298K = -762.39cal/mol = -6.249cal/g
mH2O * CpH2O (T T0) + Kc (T T0) = - H298K
Kc = [- H298K (mH2O * CpH2O (T T0))] / (T T0)
Kc = [-6.249cal/g (100g * 1cal/gC (14.4 12.5)C) / (14.4 12.5)C
Kc = -103.289cal/gC
Para calcular el calor de combustin para el azcar:
- H = Kc (Tf T0)
H = -(-103.289cal/gC)(17.2 16.1)C
H = 113.618cal/g
Para el calor de combustin de la leche:
H = -(-103.289cal/gC)(18.5 16.9)C
H = 165.262cal/g
4.- Observaciones.
Se observa que al colocar la pastilla dentro de la bomba se debe de colocar bien
atada esta.
En el calormetro se debe de colocar agua, pero solo hasta no debe de sobrepasar a
la bomba.
Al dejar escapar el oxigeno luego de realizar un experimento con cualquier
sustancia, se debe de tener cuidado.
5.- Conclusiones.
Se concluye que al colocar la pastilla esta debe de estar bien atada a la bomba,
porque de lo contrario pueden ocurrir errores en el experimento y no se quemara la
pastilla al colocar la bomba en el equipo.
Sobre el agua, se concluye que esta no debe de sobre pasar a la bomba, ya que es en
la parte superior de la bomba donde se conectan los cables que suministran la
corriente elctrica.
Se concluye que se debe de tener cuidado al dejar escapar el oxigeno que est
dentro de la bomba, ya que como esta a una presin de 25bar, esta sale con una gran
fuerza, el oxigeno sale por la parte superior al abrir con una llave. Y tambin se
debe de tener el mismo cuidado al introducir el oxigeno.
6.- Bibliografa.Disponible en:
Internet entalpa monografa .com.
You might also like
- CS - Grupo 2Document257 pagesCS - Grupo 2Andres Felipe Chica Lopez100% (4)
- Adiabático e IsotérmicoDocument7 pagesAdiabático e Isotérmicojuan davidNo ratings yet
- Circuitos RC: Análisis de la carga y descarga de un capacitorDocument17 pagesCircuitos RC: Análisis de la carga y descarga de un capacitorAndrea Venegas cordobaNo ratings yet
- Fundicion de Precipitados de OroDocument15 pagesFundicion de Precipitados de OroCarlos Tolentino Tazo100% (3)
- Limpieza Canerias Industria PetroleoDocument6 pagesLimpieza Canerias Industria PetroleoLuu Chayle100% (1)
- Informe de Metodo de SpeedyDocument8 pagesInforme de Metodo de SpeedyRuffo Laguna100% (5)
- Actividad de Puntos Evaluables - Escenario 6 - Segundo Bloque-Ciencias Basicas - Fundamentos de Quimica - (Grupo b03)Document5 pagesActividad de Puntos Evaluables - Escenario 6 - Segundo Bloque-Ciencias Basicas - Fundamentos de Quimica - (Grupo b03)Estefania GonzalezNo ratings yet
- Exposicion RadianteDocument1 pageExposicion Radiantecarlos andresNo ratings yet
- Informe 5 - Enlaces Quimicos UnivalleDocument9 pagesInforme 5 - Enlaces Quimicos UnivalleDANIEL CASAS DAVALOSNo ratings yet
- Problemas de Química 2o BachilleratoDocument55 pagesProblemas de Química 2o Bachilleratoagurtzane.iturbeNo ratings yet
- EjerciciosDocument2 pagesEjerciciosJulio GonzalezNo ratings yet
- Coleccion EjerciciosDocument19 pagesColeccion EjerciciosJose Miguel0% (1)
- Puntaje 60/60: Cálculos de presión, volumen y temperatura para refrigerante 134aDocument3 pagesPuntaje 60/60: Cálculos de presión, volumen y temperatura para refrigerante 134anorbeiroNo ratings yet
- Determinación de propiedades termodinámicas en varios procesosDocument5 pagesDeterminación de propiedades termodinámicas en varios procesosYiya botia morenoNo ratings yet
- Presión vapor ecuaciones Clapeyron AntoineDocument6 pagesPresión vapor ecuaciones Clapeyron AntoineJosept Churqui CondoriNo ratings yet
- Transferencia de calor y primer principio de la termodinámicaDocument17 pagesTransferencia de calor y primer principio de la termodinámicaDavid herreraNo ratings yet
- Laboratorio 2 - Modelo de DesintegraciónDocument8 pagesLaboratorio 2 - Modelo de DesintegraciónJuän Krlos Muñoz AguilarNo ratings yet
- Exposicion Sensor Efecto CoriolisDocument14 pagesExposicion Sensor Efecto CoriolisLuis Enrique PariapazaNo ratings yet
- Ley de OhmDocument14 pagesLey de OhmJavier Palermo Maita NoelNo ratings yet
- Examen Quimica 40 de 50Document5 pagesExamen Quimica 40 de 50CORAZON POSADANo ratings yet
- Examen Final - Métodos Numéricos (MB536) 2020-2 - Revisión Del IntentoDocument18 pagesExamen Final - Métodos Numéricos (MB536) 2020-2 - Revisión Del IntentoRicardo VegaNo ratings yet
- Examen Final - Semana 8 EstadisticaDocument7 pagesExamen Final - Semana 8 EstadisticalorenaNo ratings yet
- Actividad de Puntos Evaluables - Escenario 6 - Primer Bloque-Ciencias Basicas - Fluidos y Termodinamica - (Grupo b02)Document5 pagesActividad de Puntos Evaluables - Escenario 6 - Primer Bloque-Ciencias Basicas - Fluidos y Termodinamica - (Grupo b02)Caterinn Caicedo MoraNo ratings yet
- Actividad 3 Control EstadísticoDocument4 pagesActividad 3 Control EstadísticoAndres RamirezNo ratings yet
- Problemario ResuletoDocument12 pagesProblemario Resuletobjazmin_gonzalez83% (6)
- Fluidos y TermodinamicaDocument4 pagesFluidos y TermodinamicaGloria Ines Echeverry GarciaNo ratings yet
- Pre Informe ConductividadDocument6 pagesPre Informe ConductividadDanny LetrasNo ratings yet
- 1ra y 2da Ley de La TermodinamicaDocument86 pages1ra y 2da Ley de La TermodinamicaCarlos Abdías Luis Villanueva100% (1)
- Parcial 1 Fisica IIIDocument5 pagesParcial 1 Fisica IIIRoloNo ratings yet
- Guia de Ejercicios Campo Electrico - Ley de GaussDocument4 pagesGuia de Ejercicios Campo Electrico - Ley de GaussLautaro Muratore100% (1)
- Excel - Examen Final Química Con ZincadoDocument16 pagesExcel - Examen Final Química Con ZincadoJersson RojasNo ratings yet
- Actividad de Puntos Evaluables - Escenario 6 - Primer Bloque-Ciencias Basicas - Fluidos y Termodinamica - (Grupo b02)Document5 pagesActividad de Puntos Evaluables - Escenario 6 - Primer Bloque-Ciencias Basicas - Fluidos y Termodinamica - (Grupo b02)Caterinn Caicedo MoraNo ratings yet
- Consolidado TermodinamicaDocument6 pagesConsolidado TermodinamicaAndrea IbañezNo ratings yet
- Fundamentos de Quimica Quiz 1 y 2 Parcial 1 y 2Document75 pagesFundamentos de Quimica Quiz 1 y 2 Parcial 1 y 2yeimy75% (4)
- Lab Calor Latente DefDocument41 pagesLab Calor Latente DefIVAN DANIEL CANCHALANo ratings yet
- Examen Final - Semana 8Document2 pagesExamen Final - Semana 8HhhhCaliNo ratings yet
- PROBLEMAS BASICOS EN EXCEL - TermodinamicaDocument26 pagesPROBLEMAS BASICOS EN EXCEL - TermodinamicaEdgarArrietaPaterninaNo ratings yet
- Cambio de temperatura en grados CelsiusDocument4 pagesCambio de temperatura en grados CelsiusPaolaNo ratings yet
- Determinacion Del Calor Específico Del EtanolDocument4 pagesDeterminacion Del Calor Específico Del EtanolMiguel Alva SevillaNo ratings yet
- LABORATORIO 2 Generación de Voltaje Por Medio Electroquímico (Limones y Cebolla)Document10 pagesLABORATORIO 2 Generación de Voltaje Por Medio Electroquímico (Limones y Cebolla)Richard CubillaNo ratings yet
- Serie de Ejercicios-Tema 3Document4 pagesSerie de Ejercicios-Tema 3Víctor Molina AlbaNo ratings yet
- Examen parcial procesos industrialesDocument12 pagesExamen parcial procesos industrialesmaritza prietoNo ratings yet
- AGROINDUSTRIA DE FRUTAS Y HORTALIZAS ParcialDocument5 pagesAGROINDUSTRIA DE FRUTAS Y HORTALIZAS ParcialCarlos andres bustosNo ratings yet
- Práctica 5. Observando El EquilibrioDocument5 pagesPráctica 5. Observando El EquilibrioBrayan GuttierrezNo ratings yet
- Actividad de Puntos Evaluables Esc 6 FLUIDOS Y TERMODINÁMICADocument5 pagesActividad de Puntos Evaluables Esc 6 FLUIDOS Y TERMODINÁMICAleonardo morenoNo ratings yet
- Gas IdealDocument1 pageGas IdealXavierRobalinoNo ratings yet
- PRACTICA 10 Fisicoquímica IDocument13 pagesPRACTICA 10 Fisicoquímica IYanided ValladolisNo ratings yet
- 100000NI22 Fisicoquimica PDFDocument6 pages100000NI22 Fisicoquimica PDFStephanie Paz ReateguiNo ratings yet
- Parcial 1 Fisica 1.3Document8 pagesParcial 1 Fisica 1.3Andrés GarzónNo ratings yet
- Capitulo 13Document8 pagesCapitulo 13Jorge EstupiñánNo ratings yet
- Regla del trapecio: integración numéricaDocument18 pagesRegla del trapecio: integración numéricaSergio MendozaNo ratings yet
- Ejercicios de ReologíaDocument7 pagesEjercicios de ReologíaValadez Juarez MaricarmenNo ratings yet
- Informe-Carga y Descarga CapacitorDocument9 pagesInforme-Carga y Descarga Capacitorandrea giraldoNo ratings yet
- Problemas de química para grado 11Document5 pagesProblemas de química para grado 11Luisa GarnicaNo ratings yet
- Desnaturalizacion de ProteinasDocument9 pagesDesnaturalizacion de ProteinasNatalia Torres100% (1)
- Unidad Didactica Físico-QuímicaDocument14 pagesUnidad Didactica Físico-QuímicaInti David Nacimba Guzmán100% (1)
- Evaluacion Quimica PDFDocument25 pagesEvaluacion Quimica PDFAnonymous w9C7cEkuy8No ratings yet
- Parametricas y Coordenadas PolaresDocument14 pagesParametricas y Coordenadas PolaresLuisNo ratings yet
- Calor de CombustionDocument11 pagesCalor de CombustionLorena Rafael TaipeNo ratings yet
- Calor CombustionDocument6 pagesCalor CombustionNaTalia BecerraNo ratings yet
- Informe 03 Quimica FisicaDocument7 pagesInforme 03 Quimica FisicaAnali SalirrosasNo ratings yet
- E5P4M24Document14 pagesE5P4M24Sandra RodriguezNo ratings yet
- Practica 5Document8 pagesPractica 5Joaquin Jose Abarca RodriguezNo ratings yet
- Calor Combustion PDFDocument7 pagesCalor Combustion PDFEdgar BenitezNo ratings yet
- Calor Especifico de LiquidosDocument8 pagesCalor Especifico de Liquidos708170No ratings yet
- ViscosidadDocument6 pagesViscosidad708170No ratings yet
- Obtencion Del Estaño Metalico A Partir Del Mineral CasiteritaDocument5 pagesObtencion Del Estaño Metalico A Partir Del Mineral Casiterita708170No ratings yet
- Refracción de La LuzDocument12 pagesRefracción de La Luz708170No ratings yet
- Calor de CombustionDocument5 pagesCalor de Combustion708170No ratings yet
- Estudio de La Cinética de Oxidación de Etanol Por Medio de Espectrofotometría VisibleDocument7 pagesEstudio de La Cinética de Oxidación de Etanol Por Medio de Espectrofotometría Visible708170No ratings yet
- Ley de BoyleDocument6 pagesLey de Boyle708170No ratings yet
- Constante de EquilibrioDocument5 pagesConstante de Equilibrio708170No ratings yet
- Calor EspecificoDocument7 pagesCalor Especifico708170No ratings yet
- Uso de Graficas en La Parte ExperimentalDocument2 pagesUso de Graficas en La Parte Experimental708170No ratings yet
- Simbologia y Manejo de InstrumentosDocument15 pagesSimbologia y Manejo de Instrumentos708170No ratings yet
- Propiedades Magnéticas de La MateriaDocument12 pagesPropiedades Magnéticas de La Materia708170No ratings yet
- Termodinámica de Las Pilas GalvánicasDocument8 pagesTermodinámica de Las Pilas Galvánicas708170No ratings yet
- Propiedades Quimicas de Hidrocarburos AromaticosDocument7 pagesPropiedades Quimicas de Hidrocarburos Aromaticos708170No ratings yet
- HNO de Moles ZN Moles HNO Moles ZN G ZN Mol ZN GDocument4 pagesHNO de Moles ZN Moles HNO Moles ZN G ZN Mol ZN G708170No ratings yet
- Documento CompletoDocument10 pagesDocumento Completo708170No ratings yet
- Electroquímica Conductividad de DisolucionesDocument8 pagesElectroquímica Conductividad de Disoluciones708170No ratings yet
- Sistema de Gestión de La CalidadDocument2 pagesSistema de Gestión de La Calidad708170No ratings yet
- Ejemplo de Manual de Calidad ISO-9001Document17 pagesEjemplo de Manual de Calidad ISO-9001708170No ratings yet
- AplicacionesDocument7 pagesAplicaciones708170No ratings yet
- Solicit UdDocument1 pageSolicit Ud708170No ratings yet
- Universidad Autónoma "Tomas Frias" Facultad de Ciencias Puras Carrera de QuímicaDocument9 pagesUniversidad Autónoma "Tomas Frias" Facultad de Ciencias Puras Carrera de Química708170No ratings yet
- OtrosDocument8 pagesOtros708170No ratings yet
- Método Potenciométricas DirectasDocument5 pagesMétodo Potenciométricas Directas708170No ratings yet
- Default IdDocument1 pageDefault IdHenry Franz Flores NicolásNo ratings yet
- Electroquímica Conductividad de DisolucionesDocument8 pagesElectroquímica Conductividad de Disoluciones708170No ratings yet
- Universidad Autónoma "Tomas Frias" Facultad de Ciencias Puras Carrera de QuímicaDocument15 pagesUniversidad Autónoma "Tomas Frias" Facultad de Ciencias Puras Carrera de Química708170No ratings yet
- Obtención de Acetato de AmonioDocument1 pageObtención de Acetato de Amonio708170No ratings yet
- Determinación de Na y KDocument10 pagesDeterminación de Na y K708170No ratings yet
- Qui MicaDocument4 pagesQui MicaArahi BarahonaNo ratings yet
- ACAIDocument1 pageACAICarlos AcostaNo ratings yet
- Determinación de Cationes CambiablesDocument4 pagesDeterminación de Cationes CambiablesFidelMendozaNo ratings yet
- Analisis Edificio CastelarDocument54 pagesAnalisis Edificio CastelarLuz Vargas100% (2)
- Diseño de Una Camara Frigorifica de Media Tonelada de Capacidad para La Congelacion de FresaDocument28 pagesDiseño de Una Camara Frigorifica de Media Tonelada de Capacidad para La Congelacion de FresaRicardo Rafael Rivera RamirezNo ratings yet
- 5.0 Notas de Clase 05Document16 pages5.0 Notas de Clase 05Domingo Alfonso Nuñez VieitesNo ratings yet
- Gases Ideales 010Document40 pagesGases Ideales 010Maria Del Pilar VELA FONTISNo ratings yet
- REPOSICIÓN RESET SISTEMA ADITIVO EOLYS FAPDocument3 pagesREPOSICIÓN RESET SISTEMA ADITIVO EOLYS FAPlada1119No ratings yet
- Desarrollo Farma Equipo 2 IncompatibilidadesDocument65 pagesDesarrollo Farma Equipo 2 IncompatibilidadesDenisse GoVeNo ratings yet
- Seminario de fisiología humana: Neurotransmisores y neuropéptidosDocument35 pagesSeminario de fisiología humana: Neurotransmisores y neuropéptidosBeatriz VillarrealNo ratings yet
- Proyecto Del Frijol Del Vaina MoradaDocument33 pagesProyecto Del Frijol Del Vaina MoradaBenjamin Santos SalinasNo ratings yet
- 1-Ejercicios-HPLC TAV Tema 2Document1 page1-Ejercicios-HPLC TAV Tema 2Leonardo ValdiviaNo ratings yet
- Agentes Del MetamorfismoDocument2 pagesAgentes Del MetamorfismoEngel Espinoza100% (1)
- Módulo - 1 - Repartido - 2 - Ejercicios de Tratamiento de DatosDocument3 pagesMódulo - 1 - Repartido - 2 - Ejercicios de Tratamiento de DatosAgustin LopezNo ratings yet
- Diseño de Mezclas de 1500psi.Document16 pagesDiseño de Mezclas de 1500psi.Jhoan Sebastian Peñuela GomezNo ratings yet
- Ácidos grasos: clasificación, propiedades y efectos en la saludDocument20 pagesÁcidos grasos: clasificación, propiedades y efectos en la saludFede RiosNo ratings yet
- Iglesia de Dios Unida - 01 Génesis Bajo El Lente de La Ciencia PDFDocument123 pagesIglesia de Dios Unida - 01 Génesis Bajo El Lente de La Ciencia PDFAlex AndinoNo ratings yet
- Celplast SADocument6 pagesCelplast SAabastecedorNo ratings yet
- Tincion de Gram SeminarioDocument13 pagesTincion de Gram Seminarioed_154862No ratings yet
- Manual Aire AcondicionadoDocument28 pagesManual Aire AcondicionadoManuel Flores100% (1)
- Presentación 1Document9 pagesPresentación 1Leydy Tatiana BenavidesNo ratings yet
- Tinción de Ziehl NeelsenDocument5 pagesTinción de Ziehl NeelsenXely Mercy BalmoryNo ratings yet
- Efecto de La Precipitación Efectiva en La TormentaDocument16 pagesEfecto de La Precipitación Efectiva en La TormentaCarlos Guarniz MuñozNo ratings yet
- Guia de Actividades y Rúbrica de Evaluación - Unidad 3 - Tarea 4 - Metales y MetalurgiaDocument13 pagesGuia de Actividades y Rúbrica de Evaluación - Unidad 3 - Tarea 4 - Metales y MetalurgiaEdwar Alejandro Rojas FlorezNo ratings yet
- Selección y pruebas de válvulas industrialesDocument109 pagesSelección y pruebas de válvulas industrialesalexloperNo ratings yet
- La Teoría Del Bing BangDocument4 pagesLa Teoría Del Bing BangElizabeth RaquelNo ratings yet