Professional Documents
Culture Documents
Cristalización, Crecimiento Cristalino y Caracterización de Cristales de Sulfato de Cobre Pentahidratado
Uploaded by
Orlando CastiblancoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cristalización, Crecimiento Cristalino y Caracterización de Cristales de Sulfato de Cobre Pentahidratado
Uploaded by
Orlando CastiblancoCopyright:
Available Formats
Cristalización, crecimiento cristalino y caracterización de
cristales de sulfato de cobre (II) pentahidratado
(CuSO4.5H2O)
Crystallization, crystalline growth and characterization of cupric sulfate
pentahydrate crystals (CuSO4.5H2O)
Orlando Castiblanco U., Ricardo Ceballos G., Johan Bocanegra C.
Departamento de Ciencias Naturales, Colegio Unidad Pedagógica, Bogotá, Colombia
Resumen Summary
Este artículo fue preparado para presentarse en el 3 er Intercambio This article was prepared to be presented in the 3er Exchange with
con la Enseñanza de la Ciencia 2010 (IEC 2010), Universidad de Los the Teaching of the Science 2010 (IEC 2010), University of The
Andes, Trujillo (Venezuela), en Junio de 2010. Andes, Trujillo (Venezuela), in June of 2010.
La cristalización es una operación de transferencia de materia en la The crystallization is an operation of mass transfer in which the
que se produce la formación de cristales a partir de una disolución. La formation of crystals takes place from a solution. The primary
nucleación primaria es la primera etapa en la cristalización. La nucleation is the first stage in the crystallization. The formation of the
formación del cristal se realizará a partir de la sobresaturación de la crystal is going to be made from the supersaturation of the solution, in
disolución, obteniéndose un núcleo, el cual posteriormente se order to obtain a nucleus, which later will be sow in a previously
sembrará en una disolución previamente preparada y filtrada, para un prepared and filtered solution, for a process of secondary nucleation
proceso de nucleación secundaria, en donde ocurre el crecimiento de where the growth of that first crystal occurs. Each substance
ese cristal primigenio. Cada sustancia cristaliza con una geometría crystallizes with a characteristic geometry; the cupric sulfate
característica; el sulfato de cobre (II) cristaliza en el sistema triclínico, crystallizes in the triclinic system, subject to the conditions that can
sujeto a las condiciones que pueden ocasionar cambios en el hábito cause changes in the crystalline habit and imperfections.
cristalino e imperfecciones.
This theoretical and experimental work was developed at the
Este trabajo teórico y experimental fue realizado en el Colegio Colegio Unidad Pedagógica of Bogotá, attended by teachers of
Unidad Pedagógica de Bogotá, participaron los maestros de Mathematics, Physics and Chemistry and its students. The work
Matemáticas, Física y Química y sus estudiantes. El trabajo related recounts how an option to bring students to topics of Natural
relacionado se vio cómo una opción para acercar a los estudiantes a Sciences, particularly the atomic hypothesis and the study of
tópicos de las Ciencias Naturales, particularmente la hipótesis atómica solutions.
y el estudio de disoluciones.
Key-Words: Saturated solution; Crystallization; Crystals; Crystalline
Palabras Clave: Disolución saturada; Cristalización; Cristales; Red net; Crystalline system.
cristalina; Sistema cristalino.
1. Introducción cual tiene color azul debido a la presencia del complejo
Cu(H2O)6+2. Se filtran las impurezas y los excesos de soluto, y
El trabajo en el colegio está fundamentado en cuatro pilares unas horas después aparecerán pequeños cristales, uno de los
básicos: la formación ética, la formación para el trabajo, la cuales se dispondrá para favorecer su crecimiento.
formación cognitiva y la formación para la participación.
Dentro del área de ciencias se resaltan las formas de trabajo del Los estudiantes de los últimos años de educación secundaria
colegio que posibilitan la exploración de los distintos realizaron el trabajo experimental varias veces en el laboratorio
fenómenos naturales que nos rodean, buscando una explicación del colegio, depurando el procedimiento, hasta obtener
y un por qué de los fenómenos: el camino no necesariamente cristales únicos que mostraran claramente su forma cristalina,
es lineal, y por supuesto busca una integración de las áreas del alcanzando una longitud de 2 cm para el mayor de los lados en
conocimiento para ampliar la visión de mundo de los la cara más grande del cristal.
estudiantes.
2. La disolución
El crecimiento de cristales es un fenómeno muy común en la
naturaleza, de ahí que sea relativamente fácil de observar. Para Una disolución es una mezcla homogénea de dos o más
obtener un cristal a partir de una disolución es necesario que componentes. La sustancia disuelta se denomina soluto y
esta disolución esté sobresaturada de la sustancia en cuestión, generalmente está presente en menor cantidad en comparación
esto es, que la concentración de la disolución sea mayor que la con la sustancia donde se disuelve denominada solvente. El
de equilibrio a cierta temperatura. Por tanto, se debe preparar agua es casi exclusivamente el solvente utilizado en la
una disolución saturada de CuSO4·5H2O en agua caliente, la
cristalización de sustancias inorgánicas. cuando los iones se hidratan. Cuanto mayor es la energía de
hidratación comparada con la energía necesaria para separar
Una disolución saturada es aquella que tiene la máxima los iones a partir del compuesto, será más probable que el
cantidad de soluto que puede disolverse en una cantidad sólido se disuelva en agua.
determinada de solvente puro a una temperatura específica. La
concentración de la disolución saturada se denomina CuSO4(s) Cu+2(g) + SO4-2(g) ΔH1>0 (energía de red) (1)
solubilidad del soluto en el solvente dado. La solubilidad varía Cu+2(g) H2 O
Cu+2(ac) ΔH2<0 (energía de hidratación) (2)
con la temperatura, y se denomina curva de solubilidad, a la SO4-2(g) H2 O
SO4-2(ac) ΔH3<0 (energía de hidratación) (3)
representación gráfica de la solubilidad en función de la
temperatura. En la mayoría de los casos la solubilidad de un CuSO4(s) Cu+2(ac) + SO4-2(ac) ΔHsol = ΔH1+ΔH2+ΔH3 (4)
soluto en un solvente se incrementa con la temperatura, pero ΔHsol = -2,86 Kcal/mol
hay algunas excepciones.
La hidratación de la sal anhidra CuSO4 es muy exotérmica,
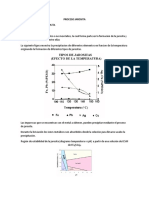
Tabla 1: Solubilidad del CuSO4 (Mullin), gramos de compuesto lo cual viene a corroborar la estabilidad de la sal hidratada.
anhidro por 100 gramos de agua Para realizarla basta con añadir unas gotas de agua a una
pequeña cantidad de CuSO4 de color blanco. Al cabo de unos
ºC 0 10 20 30 40 60 80 100 segundos la sal anhidra adquiere de nuevo la coloración azul de
g 14,3 17,4 20,7 25,0 28,5 40,0 55,0 75,4 la sal hidratada, desprendiéndose una gran cantidad de energía
en forma de calor.
Gráfica 1: Solubilidad del CuSO4
De hecho, es necesario tomar en consideración dos factores
para determinar si un proceso tendrá lugar espontáneamente.
La variación de entalpía es solamente uno de ellos. El otro
factor se denomina entropía, y se refiere a la tendencia natural
de las partículas submicroscópicas, átomos, iones o moléculas
a dispersarse en el espacio disponible. En resumen, si el
hipotético proceso de tres etapas para la formación de la
disolución es exotérmico se espera que tenga lugar la
disolución; pero también se espera que se forme una disolución
para un proceso de disolución endotérmico, siempre que ΔHsol
no sea demasiado grande.
Si al preparar una disolución se parte de menos soluto del
que estaría presente en una disolución saturada, el soluto se
disuelve completamente, y la disolución es no saturada. Por
En la formación de algunas disoluciones, se cede calor a los
otra parte, supongamos que se prepara una disolución saturada
alrededores y en muchos otros casos se absorbe calor; esto
a una temperatura y después cambiamos la temperatura hasta
hace referencia a la entalpía de disolución ΔHsol.
un valor para el que la solubilidad es menor (generalmente esto
significa una temperatura menor). Normalmente el exceso de
En una aproximación de tres etapas para ΔHsol. Primero las
soluto cristaliza desde la disolución, pero ocasionalmente todo
moléculas de disolvente deben separarse entre si para hacer
el soluto puede permanecer en la disolución. Como la cantidad
sitio a las moléculas de soluto. Esto consumirá alguna energía
de soluto es mayor que en una disolución saturada, se dice que
para vencer las fuerzas de atracción entre las moléculas de
es una disolución sobresaturada. Una disolución sobresaturada
disolvente. Como resultado, esta etapa debe ser endotérmica:
es inestable, y si se agregan unos pocos cristales de soluto para
ΔH>0. Segundo, las moléculas de soluto deben separarse
servir como partículas sobre las que puede tener lugar la
también entre sí. Esta etapa, asimismo, consume energía y debe
cristalización, el exceso de soluto cristaliza.
ser endotérmica. Finalmente, las moléculas separadas de soluto
y disolvente se atraerán entre sí. Estas atracciones llevarán a un
2. Cristalización
mayor acercamiento entre las moléculas y debe liberarse
energía. Esta es una etapa exotérmica: ΔH<0. La entalpía de
La cristalización es una operación de transferencia de
disolución es la suma de las tres variaciones de entalpía que se
materia en la que se produce la formación de un sólido (cristal
han descrito, y dependiendo de sus valores relativos, ΔHsol,
o precipitado) a partir de una fase homogénea (soluto en
será positivo (endotérmico) o negativo (exotérmico).
disolución o en un fundido). Uno de los tipos básicos de
cristalización a partir de disoluciones es la cristalización por
En la formación de disoluciones iónicas, los extremos
enfriamiento, en la que se alcanza la sobresaturación
negativos de los dipolos de agua apuntan hacia los iones
reduciendo la temperatura.
positivos y los extremos positivos de los dipolos de agua hacia
los iones negativos. Si estas fuerzas de atracción ión-dipolo son
La condición de sobresaturación por sí sola no es suficiente
suficientemente intensas para vencer las fuerzas de atracción
causa para que un sistema empiece a cristalizar. Antes de que
interiónicas en el compuesto, tendrá lugar la disolución. Por
los cristales puedan desarrollarse, deben existir en la disolución
otra parte, estas fuerzas ión-dipolo continúan actuando en la
una cantidad de pequeñas partículas sólidas, embriones o
disolución. Un ion rodeado por un agregado de moléculas de
núcleos, que serán los centros de la cristalización. La
agua se dice que está hidratado. La energía se desprende
formación de estos núcleos puede ocurrir espontáneamente o 3. Crecimiento cristalino
puede ser inducida por influencia de estímulos externos.
La nucleación secundaria ocurre en procesos con siembra de
La nucleación primaria es la primera etapa en la cristales, en donde se toma uno de los cristales producidos en
cristalización, no hay cristales de por medio y su formación se la etapa de nucleación primaria; se calienta de nuevo la
va realizar a partir de la sobresaturación de la disolución. Este disolución, añadiendo la cantidad de sulfato de cobre (II) que
tipo de primera formación cristalina en el medio líquido y en se ha “perdido” al formar el cristal, se filtra, se deja enfriar y
ausencia de cristales y de cualquier otra partícula se denomina luego se suspende el cristal escogido en la disolución, atado
nucleación homogénea. Los átomos o moléculas se combinan con un hilo delgado.
para producir agregados ordenados o embriones. Algunos de
ellos superan un tamaño crítico, convirtiéndose en núcleos; el Los cristales crecen en el seno de una disolución
resto se vuelven a disolver. sobresaturada a través de dos etapas en serie: 1) difusión en la
fase líquida de las unidades de soluto hasta alcanzar la
Hay que vencer una barrera energética para formar los superficie del cristal (teoría de difusión). 2) integración del
núcleos, por ello, se postula una ecuación tipo Arrhenius para soluto y organización dentro de la red (teoría de adsorción o
expresar la velocidad de nucleación: “reacción”).
(5) (8)
(6) (9)
(7) dm/dt: masa de sólido depositado en el tiempo
A: área superficial del cristal
Kd: coeficiente de transferencia de masa por difusión
J: velocidad de formación de núcleos Kr: razón constante para el proceso de integración
N: nº de núcleos (serán cristales)/volumen c: concentración de la disolución (sobresaturada)
A: factor preexponencial (del orden de 10 25) ci: concentración en la interfase del cristal y la disolución
ΔG: cambio de energía libre del sistema c*: concentración en el equilibrio de saturación
k: constante de Boltzmann (1,3805 · 10-23 J/ºK)
T: temperatura
: tensión de interfases
υ: volumen molar del cristal
S: grado de sobresaturación
Hay un valor de S crítico para el cual ΔG cambia de valores
positivos a negativos, momento en el que se produce
nucleación espontánea. Una vez lograda la sobresaturación Kg: coeficiente general de crecimiento cristalino
crítica, J aumenta muy rápidamente. Hace falta, por tanto, un g: orden del proceso de crecimiento del cristal (1,5 < g < 2 para
valor alto de S para que haya nucleación homogénea. Así, la muchas sales inorgánicas)
velocidad de nucleación primaria es altamente no lineal con la
sobresaturación de la disolución, siendo cercana a cero para 4. Cristales de sulfato de cobre (II)
bajos valores de S y aumentando rápidamente cuando se
alcanza la sobresaturación crítica. Por tanto, se espera un Un sólido cristalino se construye a partir de la repetición en
dominio de la nucleación primaria a elevadas el espacio de una estructura elemental denominada celda
sobresaturaciones. unitaria. En función de los parámetros de red, es decir, de las
longitudes de los lados o ejes del paralelepípedo elemental y de
La nucleación heterogénea es la cristalización producida los ángulos que forman, se distinguen siete sistemas
sobre las partículas de polvo o las paredes del recipiente. La cristalinos: cúbico, tetragonal, ortorrómbico, hexagonal,
razón de nucleación en una disolución puede verse afectada trigonal, monoclínico y triclínico.
considerablemente por la presencia de impurezas. Disoluciones
acuosas preparadas normalmente en el laboratorio pueden Cada sustancia tiene una única forma cristalina
contener más de 106 partículas sólidas por cm3 de tamaños correspondiente a alguno de los 7 sistemas cristalográficos. El
menores que 1 m. Es imposible lograr preparar una aspecto único de un compuesto es que los ángulos entre caras
disolución completamente libre de partículas extrañas, aunque adyacentes son constantes. Los ángulos no cambian (son
la utilización de agua destilada como solvente y una filtración característicos de cada sustancia), lo que puede cambiar es el
adecuada pueden reducir su número hasta menos de 103 por tamaño de las caras.
cm3.
El sulfato de cobre (II) cristaliza en la red triclínica, la
menos simétrica de las 14 redes de Bravais tridimensionales,
con parámetros de red: a = 6,12 Å, b = 10,7 Å, c = 5,97 Å, α =
82,27º, β = 107,43º y γ = 102,67º (Beevers y Lipson). disoluciones, y por supuesto, la hipótesis central de las
Ciencias Naturales: la existencia de un componente básico de
Gráfica 2: Red cristalina triclínica la materia, el átomo; su organización, enlaces y la relación con
los estados de la materia. Además ha permitido desarrollar
algunas actitudes propias del quehacer científico como la
curiosidad, la disciplina, el esfuerzo y la rigurosidad.
6. Referencias bibliográficas
BEEVERS, C. A. y LIPSON, H. Crystal Structure of
CuSO4·5H2O. Proceedings of the Royal Society. London.
1934.
Dado el tamaño de los cristales de sulfato de cobre (II),
resulta sorprendente comprobar como el orden microscópico CARRASQUILLA J. et Al. PPEI. Proyecto Pedagógico
del cristal puede contemplarse fácilmente a simple vista, Educativo Institucional. Colegio Unidad Pedagógica. 2009.
simplemente observando la forma de los cristales. Esto se debe
a que, a nivel microscópico, la celdilla unidad de sulfato de CUSSO F., LOPEZ C. y VILLAR R. Física de los Procesos
cobre (II) se repite del orden de un número de Avogadro de Biológicos. Primera edición. Ariel. Barcelona. 2004.
veces (~1023) para dar lugar a un cristal macroscópico.
DALESSANDRO O., CURIA M. et al. Cómo Integrar la
Con ángulos constantes y caras de diferente tamaño la forma Ciencia de los Materiales en los Tres Niveles Educativos a
de un cristal puede variar mucho. La modificación del hábito Través de la Preparación y Observación de Cristales
cristalino depende de numerosos factores ligados a las Macroscópicos. Formación Universitaria Vol.2(1). 2009.
condiciones en las que tiene lugar el crecimiento del cristal:
sobresaturación, enfriamiento brusco, siembra, agitación, HEWITT P. Física Conceptual. Novena edición. Pearson.
presencia de impurezas, tipo de disolvente, etc. México. 2004.
Las imperfecciones en el crecimiento cristalino son variadas MULLIN, J. W. Crystallization. Cuarta edición. Butterworth -
y frecuentes, no dejando discernir en la mayoría de los casos Heinemann. Londres. 2001.
cuál es el sistema cristalino en el cual ha sucedido la
cristalización. Por una rápida cristalización a partir de PAVPLOV, P. V. Física del Estado Sólido. Mir. Moscú. 1987.
disoluciones sobresaturadas se producen dendritas, además
pueden formarse también cristales compuestos (agregados). PETRUCCI R. H. Química General. Octava Edición. Madrid.
2003.
5. Resultados
ROPP R.C. Solid State Chemistry. Elsevier Science B.V.
Amsterdam. 2003.
En el laboratorio del colegio se ha venido desarrollando este
trabajo desde hace un año con varios grupos de estudiantes de
SANCHIS P., GRASES F et al. Uric Acid as Inducer of
los dos últimos grados de secundaria, pero durante este año un
Calcium Oxalate Cristal Development. Scandinavian Journal
grupo más pequeño de estudiantes de último grado, desarrolló
of Urology and Nephrology. 2007.
bajo nuestra guía el trabajo experimental durante varias
sesiones, depurando el procedimiento y dedicando horas de
SIERRA J. Y KATIME I. Cinética de Cristalización de
trabajo extracurricular. Con anterioridad se había logrado hacer
Copolímeros de Etileno/Ácido Acrílico. Revista
crecer colonias de cristales con múltiples núcleos (de
Iberoamericana de Polímeros. Febrero de 2006.
aproximadamente 3 mm) que con un examen detallado,
(preferiblemente utilizando un microscopio) mostraban formas
geométricas similares entre ellos.
Utilizando agua destilada y una filtración rigurosa, se ha
logrado conseguir algunos cristales únicos, de tamaño
considerable (2 a 3 cm) con sus caras muy bien definidas, que
demuestran la organización cristalina del sulfato de cobre (II)
en coherencia con los parámetros esperados (ángulos entre
caras), con un grado de transparencia muy uniforme que dejan
pasar principalmente luz de color azul.
El trabajo experimental ha permitido tratar con los
estudiantes bastantes tópicos entre los que destacamos, la
posibilidad de formación de cristales en el cuerpo humano
(cálculos renales), las geometrías tridimensionales, la búsqueda
de relaciones de dependencia, la solubilidad, la saturación de
You might also like
- Modelo - Demanda ArbitralDocument10 pagesModelo - Demanda ArbitralJuan Carlos Moreno Baquedano78% (36)
- Cristalizacion Del Sulfato de CobreDocument22 pagesCristalizacion Del Sulfato de CobreEdward Cuipa44% (9)
- Catálogo Mathiesen SACDocument10 pagesCatálogo Mathiesen SACreneossesNo ratings yet
- Mapa Conceptual Menas de UranioDocument3 pagesMapa Conceptual Menas de UranioNicolás Plata G.No ratings yet
- PREPARARDocument87 pagesPREPARARGega123No ratings yet
- Informe de Lab. n2 Purificacion de Sólidos Cristalización Ver.2Document22 pagesInforme de Lab. n2 Purificacion de Sólidos Cristalización Ver.2Renzo Miguel Alcántara67% (3)
- Sliding JigDocument8 pagesSliding JigMagu LaraNo ratings yet
- Oxalato Aluminio y PotasioDocument5 pagesOxalato Aluminio y PotasioDaniela BarcoNo ratings yet
- Informe Sulfato de CobreDocument10 pagesInforme Sulfato de CobreShary Alejandra Gómez100% (1)
- Informe Analisis de Hierro Por Gravimetria VictorDocument12 pagesInforme Analisis de Hierro Por Gravimetria Victorjhon esteban rodriguezNo ratings yet
- Velocidad de ReaccionDocument6 pagesVelocidad de ReaccionJesús GarcíaNo ratings yet
- Práctica #2 Flotacion Bulk Proces IiDocument16 pagesPráctica #2 Flotacion Bulk Proces IiAndy García LeónNo ratings yet
- Sulfato de Cobre PentahidratadoDocument22 pagesSulfato de Cobre PentahidratadoRonaldo Torres CasasNo ratings yet
- Obtecion de Sulfato de CobreDocument12 pagesObtecion de Sulfato de CobreLucina Cortes100% (1)
- Determinacion Volumetrica de HierroDocument0 pagesDeterminacion Volumetrica de HierroquimicaunsaNo ratings yet
- Proceso JarositaDocument2 pagesProceso JarositaalbertNo ratings yet
- 7 Guion Cromatografia AdsorcionDocument7 pages7 Guion Cromatografia AdsorcionZubii “Zubii”100% (1)
- Estudio de La Capa de NernstDocument12 pagesEstudio de La Capa de NernstPatrick JaneNo ratings yet
- Ciclo Del CobreDocument9 pagesCiclo Del CobreMaryin QuimbayaNo ratings yet
- Doble Capa ElectricaDocument26 pagesDoble Capa ElectricaEugenia ZentenoNo ratings yet
- Marcha Analitica Quimica InorganicaDocument5 pagesMarcha Analitica Quimica Inorganicasebastianzm7No ratings yet
- Clasificación de Los EspumantesDocument4 pagesClasificación de Los EspumantesFabrizio Ortiz Palza100% (1)
- P5 Cristalización y SublimaciónDocument12 pagesP5 Cristalización y Sublimaciónsofia quirarteNo ratings yet
- Preparacion y Valoracion de Una Solucion de Tiosulfato de SodioDocument3 pagesPreparacion y Valoracion de Una Solucion de Tiosulfato de SodioCami A IribarrenNo ratings yet
- Práctica #10 - LabAnalíticaDocument4 pagesPráctica #10 - LabAnalíticaDaniela IbarraNo ratings yet
- Lab 7 HidroDocument9 pagesLab 7 HidroJoseph ArgumeNo ratings yet
- FLOTACIONDocument216 pagesFLOTACIONFortunato PercaNo ratings yet
- YODOMETRIADocument3 pagesYODOMETRIAPatricio Arcos ShinNo ratings yet
- Practica #01 CURVA DE SOLUBILIDAD Y CRISTALIZACIÓN FRACCIONADDocument11 pagesPractica #01 CURVA DE SOLUBILIDAD Y CRISTALIZACIÓN FRACCIONADJuanAntonioSulcaSuca100% (1)
- Practica de MineralesDocument44 pagesPractica de MineralesVictor AlvarezNo ratings yet
- Laboratorio de Volumetria de Precipitacion 2Document19 pagesLaboratorio de Volumetria de Precipitacion 2Diego Peralta OchoaNo ratings yet
- Flotacion Espumantes BeneficiosDocument17 pagesFlotacion Espumantes BeneficiosYeiko OrtegaNo ratings yet
- Concentrador Centrifugo FalcónDocument3 pagesConcentrador Centrifugo FalcónMatute Nuñez50% (4)
- 03 Apuntes de FlotacionDocument70 pages03 Apuntes de FlotacionjinkuzamaNo ratings yet
- Efecto de Nitrato en SXDocument2 pagesEfecto de Nitrato en SXAnaDelPinoCalderonNo ratings yet
- Determinación Gravimetrica Del NíquelDocument5 pagesDeterminación Gravimetrica Del NíquelSamuel Fernando DelgadoNo ratings yet
- 381 400Document23 pages381 400Angeler BrennanNo ratings yet
- Trabajo 1 (Proceso de Transferencia de Masa)Document3 pagesTrabajo 1 (Proceso de Transferencia de Masa)JOAN RODOLFO PURIS CoNDORNo ratings yet
- Espejo SDocument7 pagesEspejo SSebaslu89100% (1)
- Deteminacion Volumetrica de Hierro en MineralesDocument2 pagesDeteminacion Volumetrica de Hierro en MineralessebastianNo ratings yet
- Crecimiento de Cristales en GelesDocument6 pagesCrecimiento de Cristales en GelesMadelyn Garrido VillarrealNo ratings yet
- Análisis de CementoDocument7 pagesAnálisis de CementoAlexa BedoyaNo ratings yet
- Crecimiento de Cristales Olga LuciaDocument7 pagesCrecimiento de Cristales Olga Luciadinobile10No ratings yet
- Informe 5Document7 pagesInforme 5Daniel FelipeNo ratings yet
- Propiedades Coligativas ElectrolitosDocument8 pagesPropiedades Coligativas ElectrolitosMariana HopeNo ratings yet
- Permanganometrà A, Dicromatometria, Yodimetria 22102020Document41 pagesPermanganometrà A, Dicromatometria, Yodimetria 22102020Stefany Mariela Pineda AyalaNo ratings yet
- Via HumedaDocument14 pagesVia HumedaMilton Mario Lazo YzagaNo ratings yet
- Caracterización de PulpasDocument7 pagesCaracterización de PulpasSilvio GomezNo ratings yet
- Práctica Vidrio de ColoresDocument7 pagesPráctica Vidrio de ColoresLizzie ZamNo ratings yet
- Informe Estado SolidoDocument5 pagesInforme Estado SolidodiegoNo ratings yet
- Manual PermanganometriaDocument10 pagesManual PermanganometriaKev Larico GomezNo ratings yet
- Determinación Del Work IndexDocument10 pagesDeterminación Del Work IndexPili Torres OrregoNo ratings yet
- LIXIVIACION DE MALAQUITA CuCO3Document27 pagesLIXIVIACION DE MALAQUITA CuCO3FRANKNo ratings yet
- Determinacion de Hierro (II) Con PermanganatoDocument34 pagesDeterminacion de Hierro (II) Con PermanganatoFernando Navarrete0% (1)
- Metodo de Rast 2Document6 pagesMetodo de Rast 2Mendoza EiraNo ratings yet
- Antep Roy EctoDocument6 pagesAntep Roy EctoruberthNo ratings yet
- Informe04 Josué Luna MeléndezDocument6 pagesInforme04 Josué Luna MeléndezMax Pérez GalindoNo ratings yet
- Cristalizacincrecimientocristalinoycaracterizacindecristalesdesulfatodecobrepentahidratado 1Document7 pagesCristalizacincrecimientocristalinoycaracterizacindecristalesdesulfatodecobrepentahidratado 1INGRID ANDRADE MORALESNo ratings yet
- Informe de CristalizacionDocument13 pagesInforme de Cristalizacioncarmen canturin cabreraNo ratings yet
- Cristalización Pract Lab 3Document19 pagesCristalización Pract Lab 3Daniel CasanovaNo ratings yet
- Marco-Teorico Feria de Ciencias 2022Document18 pagesMarco-Teorico Feria de Ciencias 2022Kathrina Fabiana Camacho ValverdeNo ratings yet
- Informe RecristalizaciónDocument7 pagesInforme RecristalizaciónCAROLINA TORRESNo ratings yet
- MR Cap5Document70 pagesMR Cap5cesarNo ratings yet
- Aprendizaje Por DescubrimientoDocument8 pagesAprendizaje Por DescubrimientoAILTON EDER HERRERA SOTONo ratings yet
- Constitucion Politica de Colombia 1991Document128 pagesConstitucion Politica de Colombia 1991IsabelNo ratings yet
- Implementación de Un Sitema de Gestiíon Ambiental para La Empresa Constructora Ahec SRL Basado en La Norma Iso 14001Document7 pagesImplementación de Un Sitema de Gestiíon Ambiental para La Empresa Constructora Ahec SRL Basado en La Norma Iso 14001MaryNo ratings yet
- CarneDocument101 pagesCarneOrlando HernandezNo ratings yet
- Mach 1 #3 (Año 1983)Document63 pagesMach 1 #3 (Año 1983)Lorenzo Borri100% (1)
- Ce - Gnfi - U2 - Dennis Sandoval ArriagaDocument6 pagesCe - Gnfi - U2 - Dennis Sandoval ArriagaMarisol QuintanarNo ratings yet
- TRIPTICO GadielDocument3 pagesTRIPTICO GadielDavid Gonzalez100% (1)
- Analisis Organizacional de Una Empresa MEDICARE IPS SASDocument13 pagesAnalisis Organizacional de Una Empresa MEDICARE IPS SASFreddy GonzalezNo ratings yet
- Cuadro Comparativo. (Act. 1)Document2 pagesCuadro Comparativo. (Act. 1)SPARTAN000080No ratings yet
- Programación Orientada A Objetos 3-4Document5 pagesProgramación Orientada A Objetos 3-4Edgar Andres Gonzalez BolañosNo ratings yet
- PDF Block TDocument1 pagePDF Block TAngela JaramilloNo ratings yet
- LEWKOWICZ Pensar Sin Estado SeleccionDocument41 pagesLEWKOWICZ Pensar Sin Estado SeleccionRafael Arce0% (1)
- Manual de Responsabilidad Social para PYMESDocument100 pagesManual de Responsabilidad Social para PYMESyosolinoNo ratings yet
- Guías de Proceso Dr. BalarezoDocument17 pagesGuías de Proceso Dr. BalarezojaviNo ratings yet
- Taller de Genetica CuantitativaDocument5 pagesTaller de Genetica CuantitativaJesusNo ratings yet
- Ciencias Sociales 5A, 5B y 5CDocument2 pagesCiencias Sociales 5A, 5B y 5CAntares HomeNo ratings yet
- DDHH en El Oriente Boliviano PDFDocument77 pagesDDHH en El Oriente Boliviano PDFJosé PazNo ratings yet
- LOZANO MANCHA JONATHAN ABISAI - Actividad 1Document11 pagesLOZANO MANCHA JONATHAN ABISAI - Actividad 1Lozano Mancha JonathanNo ratings yet
- Nota 4.0 - Auditoria y Aseguramiento II - Actividad 3Document8 pagesNota 4.0 - Auditoria y Aseguramiento II - Actividad 3ING. JAIRO ANDRES GOMEZ PEÑANo ratings yet
- Pigars 2017 Picota 1 PDFDocument98 pagesPigars 2017 Picota 1 PDFFIORELLA MARYCIELO CIPRIANO RAMOSNo ratings yet
- Instructivo Trail Making TestDocument8 pagesInstructivo Trail Making TestVerónica Guerra Guerra100% (11)
- De Su Hijo (A)Document1 pageDe Su Hijo (A)Maria BarajasNo ratings yet
- Publicación Del Libro Análisis Fundamental para La Valoración y La Toma de DecisionesDocument3 pagesPublicación Del Libro Análisis Fundamental para La Valoración y La Toma de Decisionesmsosasierra0% (1)
- 100 Usos de La Tabla Del 100 PDFDocument6 pages100 Usos de La Tabla Del 100 PDFJuan RumbaoNo ratings yet
- 5° Grado - Actividad Del de MarzoDocument37 pages5° Grado - Actividad Del de MarzoJorge Zambrano CarranzaNo ratings yet
- Asistencia de Estudiantes 30 Sep 2022Document51 pagesAsistencia de Estudiantes 30 Sep 2022duvvval34No ratings yet