Professional Documents
Culture Documents
Cristallochimie 2001
Uploaded by
Amine AminossOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cristallochimie 2001
Uploaded by
Amine AminossCopyright:
Available Formats
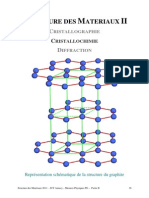
NOTIONS DE CRISTALLOCHIMIE
A- Gnralits
I- Introduction
La cristallochimie peut tre dfinie comme la
chimie de ltat solide. Autrement, la cristallochimie est
ltude des relations existant entre la composition
chimique, la structure et les proprits physico-
chimiques des solides cristallins.
Par ailleurs, les solides se prsentent dans la
nature sous deux tats amorphe et cristallin. Par
comparaison aux solides cristallins, les solides
amorphes, comme par exemple le verre et le caoutchouc,
sont isotropes (mmes proprits physiques dans toutes
les directions de lespace).
En gnral, les solides cristallins sont diviss en
quatre types
- Cristal molculaire: solide form de molcules lies par
des liaisons de Van der Waals.
Exemple : H
2
O (s) et CO
2
(s).
- Cristal covalent: il est constitu datomes lis par des
liaisons covalentes. Exemple : carbone diamant et
graphite,
-Cristal ionique: il correspond un assemblage dions de
signes opposs. La liaison tant ionique, elle est assure
par des forces lectrostatiques.
Exemple : NaCl et CaF
2
.
- Cristaux mtalliques : les particules concernes sont les
mtaux des colonnes 1 et 2, ainsi que les mtaux de
transition du bloc d.
Ltat mtallique est caractris par tout un ensemble de
proprits physiques parmi lesquelles une aptitude
particulire la conduction de la chaleur et du courant
lectrique, un clat particulier, une densit leve. On a un
rseau dions M
+
qui occupent des positions fixes et qui se
reproduisent priodiquement. Ces ions sont lis entre eux
par des liaisons covalentes localises. Les lectrons, environ
1 par atome mtallique, peuvent se dplacer facilement dans
les champ des ions positifs. Ces lectrons libres sont
appels lectrons de conduction. Ils sont responsables de la
conductivit lectrique.
La cohsion du systme provient de linteraction
lectrostatique entre les lectrons libres et les cations.
Lexprience montre que les cristaux mtalliques sont parmi
les plus compacts
II- Dfinitions
II.1- Rseau ponctuel
Le rseau ponctuel est un ensemble infini de points
(noeuds) disposs de faon priodique. Chaque noeud
(objet virtuel) du rseau a le mme environnement que ses
voisins. Ainsi, les noeuds du rseau peuvent se dduire
les uns des autres par des translations de type:
* * * * * * * *
Rseau monodimensionnel
Rseau bidimensionnel
a
b
a
Cristal idal = rptition priodique d'un motif lmentaire
Rseau : organisation spatiale & priodique de points, appels noeuds.
Motif : groupement d'atomes, d'ions ou de molcules, attach chaque
noeud du rseau
Cristal = rseau + motif
Rseau bidimensionnel
OM = n
1
a
1
+ n
2
a
2
Rseau tridimensionnel
OM = n
1
a
1
+ n
2
a
2
+ n
3
a
3
II.2- Rseau, nud
Le rseau est un ensemble infini de points ordonns
et rpartis rgulirement dans lespace. Les points du
rseau sont appels nuds. Le nud peut tre occup par
un objet (fleur dun papier peint, brique dun mur, carreau
dun carrelage, ) qui est rpt priodiquement qu'on
appelle motif.
II.3- Motif chimique
Le motif chimique est le plus petit groupement
structural despces chimiques (atomes, ions, molcules)
permettant de dcrire par translation tout le cristal. La
figure 1 montre un rseau cristallin, lequel est constitu de
motifs et dun rseau ponctuel.
Fig. 1: Schma dun rseau cristallin bidimensionnel.
N.B. : La relation entre le rseau ponctuel, le motif et la
structure cristalline se rsume :
Rseau ponctuel + Motif = Structure cristalline.
Sommaire
La priodicit : motif, maille,
rseau
Dernire mise jour : 8/02/05
Schma dun rseau cristallin tridimensionnel.
Fig 2. : Reprsentation dune maille tridimensionnelle
On appelle maille la structure gomtrique la plus simple
qui par translation dans les trois directions de lespace, permet
de gnrer le rseau cristallin dans son ensemble.
La maille est gnralement un paralllpipde, dfinie
par les trols longueurs a, b, c et par les trois angles , , . a, b
et c constituent les paramtres de la maille.
Paramtres de maille
Les paramtres de maille dsignent les dimensions de la
maille lmentaire. Dans le cas le plus complexe, le rseau
triclinique, on a 6 paramtres : trois dimensions a, b et c, et
trois angles alpha, bta et gamma. Dans le cas du rseau
cubique, on ne cite qu'un paramtre de maille, a (puisque a
= b = c, et que alpha = bta = gamma = 90), dans le cas
d'un orthorhombique, on n'en cite que trois, a, b et c
(puisque alpha = bta = gamma = 90) et dans le cas de
l'hexagonal, on en cite galement trois, a, c et gamma =
120 (puisque a = b, et que alpha = bta = 90).
II.5- Multiplicit
La multiplicit est le nombre de motifs que contient
une maille donne. Une maille primitive contient un seul
motif et par consquent sa multiplicit est gale 1. Dans
le cas contraire, la maille est dite multiple.
- Le choix de lorigine est arbitraire du fait qu'on a un rseau infini et
priodique.
En rsum, pour connatre la multiplicit dune maille,
il suffit de calculer son volume et le comparer celui de la
maille de base.
Exemple : considrons le rseau bidimensionnel donn dans la
figure 3.
Fig.3 : Rseau bidimensionnel (1: maille 1; 2 : maille 2).
N.B. : La multiplicit dune maille peut tre galement
dtermine en dnombrant les noeuds appartenant la
maille considre.
Exemple : Soient une maille tridimensionnelle simple et
une autre multiple.
- Dans le cas de la maille simple (primitive), les noeuds
existent uniquement aux sommets. Comme il y a 8
sommets pour une telle maille (4 dans le cas dune maille
bidimensionnelle) et que chacun des sommets appartient
8 mailles adjacentes, le nombre de noeuds / maille est
gal 8.1/8 = 1. Dans le cas dun rseau bidimensionnel,
il y a 4.1/4 = 1 nud/maille.
- Dans le cas de la maille multiple (qui devrait en
principe possder, en plus des noeuds aux sommets, des
noeuds sur les artes, les faces ou lintrieur), la
contribution de chaque noeud dans la maille concerne
est donne dans le tableau 1.
A ce sujet, il peut tre remarqu que la maille 2 du
rseau bidimensionnel de la figure 3 possde 4 noeuds
aux sommets (chacun des noeuds est partag par 4
mailles voisines) et un noeud lintrieur qui est compt
pour 1. Sa multiplicit est donc M
2
= (4.1/4) + 1 = 2.
Un exemple de range est montr dans la figure 4.
Remarque : Lensemble de ranges parallles constitue une famille.
Fig.4 : Reprsentation dans lespace de la range [u, v, w]. M(u,v,w)
est le premier noeud de la range.
Fig. 5 : Rseau bidimensionnel
Fig 6 : Rseau tridimensionnel
II.7- Plan rticulaire
Tout plan qui passe par au moins 3 noeuds non colinaires du
rseau est appel plan rticulaire. A ce propos, il peut tre not que
lensemble des noeuds dun rseau peut tre rparti en une infinit
de familles de plans rticulaires. Les plans de la mme famille sont
parallles et quidistants et la distance sparant les plans est appele
distance rticulaire, note d
hkl
.
Un plan rticulaire est repr par des indices de Miller, nots
(h k l) avec h, k, l des entiers premiers entre eux. Les indices de
Miller caractrisent la position du plan dans lespace et se
dfinissent par rapport au premier plan voisin de lorigine. La figure
5 montre la reprsentation spatiale du plan (h k l).
Fig.7 : Reprsentation dans lespace du plan rticulaire (h k l).
a
b
c
O
p
q
r
M
X
r z q y p x OM
r
l
c
OL
q
k
b
OK
p
h
a
OH
+ + =
=
=
=
L'quation de ce plan peut tre dduite en crivant que les trois vecteurs
) , , ( ; ) , 0 , ( ; ) 0 , , ( z y
h
a
x HM
l
c
h
a
HL
k
b
h
a
HK
qui appartiennent tous les trois au plan (h k l) sont lis. Leur dterminant est,
par consquent, nul. Soit:
0 ) (
0
0 = + + =
l
c
h
a
y
k
b
h
a
z
l
c
k
b
h
a
x
z
l
c
y
k
b
h
a
x
h
a
h
a
On en dduit l'quation analytique du plan (hkl):
1 = + +
c
lz
b
ky
a
hx
La distance qui spare deux plans conscutifs de la mme famille
est dite distance inter-rticulaire ou simplement distance
rticulaire. C'est une caractristique fondamentale de la famille
de plans.
Remarque
On doit bien faire la distinction entre les deux espaces dont
on a parl ici:
- l'espace physique constitu du cristal, motif, atomes,
ions
- et l'espace mathmatique constitu des points, nud,
vecteurs, angles qui permet de reprsenter l'espace
physique
EXEMPLE :
On voit que le plan le plus en avant sur la figure coupe les axes directs en
(2a,3b,6c). Ses indices h, k et l sont donc
h = n/2 k n/3 et l = n/6.
Le choix de n = 6 permet dobtenir trois entiers qui sont les indices de
Miller de cette famille de plans : (321)
Exemple : le plan rticulaire (1 1 0) montr dans la figure 6 est
parallle laxe Oz (c)
Fig. 6 : Reprsentation dans lespace du plan (1 1 0)
Fig. 9 : Reprsentation dans lespace de diffrents plans
rticulaires (100), (010) et (001)
Plans nodaux, vecteurs normaux et distance inter-
rticulaire
Exemples de plans nodaux dans un rseau triclinique
(quelconque)
Exemples de plans
nodaux dans un rseau
cubique
"Sous-plans" de type (002) dans une structure cubique centre
III- Systmes cristallins
Il a t tabli que le nombre de systmes
cristallins (formes cristallines) est limit 7 : cubique,
ttragonal (quadratique), orthorhombique, trigonal
(rhombodrique), hexagonal, monoclinique et
triclinique (voir tableau 2), et que le nombre maximal
de rseaux tridimensionnels diffrents est gal 14. Les
mailles des 14 rseaux, appeles rseaux de Bravais,
sont regroupes dans le tableau 2.
CUBIQUE
QUADRATIQUE
ORTHORHOMBIQUE
MONOCLINIQUE
TRICLINIQUE
RHOMBOEDRIQUE
4 Types de mailles
P : simple (primitive)
I : centre
C : bases centres
F : faces centres
Tableau 2 : Les sept systmes cristallins Les 14 rseaux de Bravais
Lgende:
Il existe 4 modes de rseau : P = primitif, I = Centr, F = toutes faces centres,
et C = 2 faces opposes centres.
P: prsence de noeuds uniquement aux sommets (maille
primitive).
C: prsence, en plus des noeuds aux sommets, de noeuds aux
centres de deux faces parallles (maille bases centres).
I: prsence, en plus des noeuds aux sommets, dun noeud au
centre de la maille (maille centre).
F: prsence, en plus des noeuds aux sommets, de noeuds aux
centres de chaque face (maille faces centres).
B- Structures mtalliques
I- Introduction
Les structures mtalliques peuvent tre considres comme
des empilements compacts ou partiellement compacts datomes
identiques, qui sont pris pour des sphres rigides.
L'un des modles qui permettent de comprendre la
liaison mtallique est celui qui considre les mtaux comme
des ions positifs baignant dans un nuage lectronique. Dans le
but d'tudier les diffrents types d'empilements d'atomes
mtalliques, ces derniers sont assimils des sphres rigides.
Ainsi, lorsquon juxtapose une srie de sphres semblables
pour en faire une couche uniforme, on peut partir sur deux
bases :
II- Empilements
Lune ralisant tout contact possible entre
les sphres
Lautre plus lche
Structure compacte : caractrise par
un maximum despace occup, Un
minimum de vide.
La succession de plans compacts
conduit deux types de structures :
CFC (cubique faces centres ) et HC
(hexagonal compact ).
Structure non compacte : La
succession de plans non
compacts conduit deux
types de structures :CS
(cubique simple ) et CC
(cubique centr ).
Fig. 10: Disposition des atomes
formant le premier plan (couche 1)
b
a
II-a. Empilements compacts entre sphres identiques
Les empilements compacts sont le rsultat dune succession de
plans (ou couches) atomiques compacts. De tels empilements
peuvent tre dcrits par des successions de couches atomiques
- Premire couche: les atomes sont placs tangentiellement de faon
ce que chacun deux soit entour de 6 atomes. Les centres des
atomes voisins forment donc un hexagone rgulier (voir figure 10
a).
On constate quentre trois atomes tangents se forme un creux,
o un atome dun autre plan pourrait bien se poser. Dans un
empilement compact, seulement la moiti des creux peuvent tre
occups.
figure 10 a
Couche B
Couche A
Pour placer une troisime couche au-dessus du plan B, deux
possibilits peuvent se prsenter:
i) Les atomes de la troisime couche sont placs la verticale des
atomes du plan A. Dans ce cas, la succession des plans est de type
ABA... et la structure est identifie un hexagonal compact (HC)
(Fig.11).
- Deuxime couche (plan B): les atomes de cette couche se placent
dans les creux du plan A. Ainsi, chaque atome du plan B repose sur
trois atomes du plan A. Comme il a t voqu auparavant, les
atomes du plan B noccuperont que la moiti des creux du plan A.
Fig. 11 : Empilement de plans donnant lieu une
structure hexagonale compacte (HC)
Fig. 12 : Maille hexagonale : Succession des plans
dans le HC
ii) Les atomes de la troisime couche sont mis la
verticale des creux inoccups du plan A. Dans ce cas, on
aura une succession de plans de type ABCA...
correspondant une structure cubique faces centres
(CFC) (Fig.13).
Couche B
Couche C
Couche A
Fig. 13 : Succession de plans compacts de type ABC.
Empilement compact de
sphres
rseau 3D
Cubique Faces Centres
Paramtre de maille = 14,17
Fig. 14 : Maille cubique faces centres : Succession des plans
dans le CFC
II- b. Empilements non compacts entre sphres identiques
Il sagit des deux empilements suivants :
Cubique Simple et Cubique Centr.
Fig.15: Maille cubique
simple
Fig. 16: Maille cubique
centr
III- Caractristiques cristallographiques
III.1- Coordonnes rduites
Elles reprsentent les coordonnes cartsiennes des atomes
dune maille, donnes en fraction du paramtre cristallographique
de la maille considre. Etant donn que le rseau cristallin est
priodique et que le choix de lorigine est arbitraire, la coordonne
un (1) est identique zro (0). Exemple : Dtermination des
coordonnes rduites des atomes de la maille reprsente dans la
figure 17.
Fig.17: Schma dune maille quelconque. Les positions 1, 2, ...
et 15 sont occupes par des atomes.
Les coordonnes rduites des atomes de la figure 16 sont donnes
dans le tableau 5.
Atome Coordonne cartsienne Coordonne rduite
1 (0, 0, 0) (0, 0, 0)
2 (1, 0, 0) (0, 0, 0)
3 (1, 1, 0) (0, 0, 0)
4 (0, 1, 0) (0, 0, 0)
5 (0, 0, 1) (0, 0, 0)
6 (1, 0, 1) (0, 0, 0)
7 (1, 1,1) (0, 0, 0)
8 (0, 1, 1) (0, 0, 0)
9 (1/2, 1/2, 0) (1/2, 1/2, 0)
10 (1/2, 1/2, 1) (1/2, 1/2, 0)
11 (0, 1/2, 1/2) (0, 1/2, 1/2)
12 (1, 1/2, 1/2) (0, 1/2, 1/2)
13 (1/2, 0, 1/2) (1/2, 0, 1/2)
14 (1/2, 1, 1/2) (1/2, 0, 1/2)
15 (1/2, 1/2, 1/2) (1/2, 1/2, 1/2)
Donc pour dcrire la maille ci-dessus, nous navons besoin que de cinq
coordonnes rduites :
Remarque : Le tableau suivant regroupe les coordonnes rduites des
diffrents modes ainsi que le nombre de motifs correspondant:
Mode P I C F
Nombre de
motifs par
maille
Coordonnes
rduites
1
(0, 0, 0)
2
(0, 0, 0)
(1/2, 1/2,
1/2)
2
(0, 0, 0)
(1/2, 1/2, 0)
4
(0, 0, 0),
(1/2, 1/2, 0),
(1/2, 0, 1/2),
(0, 1/2,
1/2)
Nombre de
motifs
1 2 2 4
Conclusion : il y a autant de coordonnes rduites que de motifs par maille
III.2. Indice de coordination ou coordinence(IC) :
Cest le nombre datomes les plus proches voisins
entourant un atome du rseau. Des exemples de
dtermination de IC seront donnes plus loin.
III. 3 Compacit ou taux de remplissage :
Elle est dfinie par le rapport:
Dans le cas des mtaux : t = (nv/V)x100
n : nombre de motifs par maille
v : volume de la particule considre sphrique (v= 4/3t r
3
; r :
rayon)
V : volume de la maille
Dune faon gnrale :
lorsquil y a
plusieurs types de particules.
III. 4. Masse volumique :
Elle est dfinie par le rapport : = m/V = nM/NV (en
g/cm
3
)
n : nombre de motifs/maille ; M : Masse molaire ; V : volume
de la maille; N : nombre dAvogadro = 6,02.10
23
III. 5. Densit
La densit est la masse volumique (), prcdemment dfinie,
rapporte la masse volumique de leau (
eau
).
d = /
eau
avec
eau
= 1 g/cm
3
T ambiante et P = 1 atm.
III.6. Sites
Cest la cavit dlimite par des particules sphriques
voisines. On distingue deux types de sites :
* Sites ttradriques [4] : Un site est dit ttradrique sil est
dlimit par un ttradre form par quatre atomes voisins.
Ttradrique [4]
ds qu'une sphre repose sur 3 sphres
* Sites octadriques [6] : Un site est dit octadrique sil est
dlimit par un octadre form par six atomes voisins.
Octadrique [6]
ds qu'un triangle de 3 sphres repose sur un autre triangle de 3
sphres tourn de 60 par rapport au premier
IV- Structures compactes
IV.1. Structure cubique faces centres
Cest une structure qui drive de lempilement compact
ABCABC Dans la maille dune structure CFC, les atomes
occupent les sommets et les centres des faces du cube. La
figure 18 donne une reprsentation de la maille en perspective
(dans lespace) ou en projection (sur un plan), le passage de
lune lautre tant rciproque.
a
b
Fig. 18 : Reprsentation en perspective (a) et en projection sur
le plan xoy (b) de la maille dune structure CFC.
Remarque:
Dans une projection, il est ncessaire de prciser la cote des
atomes, c'est--dire la coordonne selon le troisime axe, oz dans
ce cas. Les cotes 0 et 1 peuvent ne pas tre prcises.
a- Coordonnes rduites
Les coordonnes rduites des atomes de la maille sont :
(0,0,0) ; (1/2,1/2,0) ; (1/2,0,1/2) ; (0,1/2,1/2).
b- Nombre de motifs par maille :
Dans une maille CFC, il y a :
*8 motifs aux sommets et chaque motif contribue par 1/8 (car il est
commun 8 mailles voisines)
*6 aux centres des faces contribuant chacun par 1/2 (car la face
est commune 2 mailles adjacentes).
So n = 8.1/8 + 6.1/2 = 4. La maille CFC contient 4 motifs.
Remarque : En gnral, pour toute maille drivant du cube, le
nombre de motifs n est donn par la formule suivante :
n = n
s
/8 + n
a
/4 + n
f
/2 + n
i
.1
o n
s
, n
a
, n
f
et n
i
sont respectivement les nombres de motifs situs
aux sommets, sur les artes, sur les faces et lintrieur de la
maille.
C- Coordinence (IC)
La reprsentation graphique, donne dans la figure 19,
montre bien que lespce chimique du centre est entour de 12
espces places la mme distance (a2/2 ). Comme dans une
structure CFC toutes les positions atomiques sont quivalents, on
peut conclure que IC = 12
Fig. 19 : Reprsentation spatiale permettant de dterminer la coordinence dans
le cas dun systme CFC.
d- Compacit
Compacit :
On rappelle que la compacit (t) est donne par la
relation t = nv/V avec n = 4 ; v =(4/3) t r
3
; V = a
3
Or pour un CFC, les atomes sont tangents selon la diagonale de
la face.
a
2r
r
r
a
\2.a
Relation entre a et r
Fig.20 : Disposition des atomes dans une face dune maille CFC
En appliquant le thorme de Pythagore, on dduit : (4r)
2
=
a
2
+ a
2
2 4 a r =
% 74 100 .
) . 4 .( 3
2 2 . . . 4 . 4
3
3
= =
r
r t
t
Do la relation :
e- Masse volumique :
Lexpression de la masse volumique dune structure CFC
scrit : = m/V = nM/NV
Exemple : l'argent Ag a une structure CFC.
n = 4 ; a = 1,44 ; M = 107,87 ; N = 6,02.10
23
; 1 = 10
-8
cm.
Ce qui donne = 10,6 g/cm
3
.
f- Dnombrement des sites [4] et [6] :
*Sites ttradriques [4] :
La maille CFC peut tre divise en 8 petits cubes darte
a/2. Le centre de chaque petit cube constitue un site [4], ce qui
donne un total de 8 sites [4]/maille CFC.
a
b
Fig. 21 : Emplacement des sites ttradriques ([4]) (a) et
projection sur le plan xoy (b) dans une maille CFC
Remarques : - les 8 sites [4] forment un cube simple d'arte a/2.
- le nombre de sites [4] = 8 = 2n (= nombre de sommets).
* Positions ou coordonnes rduites des sites [4] :
Il y a autant de positions que de sites : 8 dont 4 z=1/4 et 4
z=3/4. Les coordonnes x et y sont dduites de la projection sur
le plan xoy :
(1/4, 1/4, 1/4) ; (1/4, 1/4, 3/4) ; (1/4, 3/4, 1/4) ; (1/4,3/4, 3/4) ; (3/4, 1/4,
1/4) ; (3/4, 1/4, 3/4) ; (3/4, 3/4, 1/4) ; (3/4, 3/4 , 3/4)
*Sites octadriques [6]
Ils se trouvent au centre de la maille et aux milieux des
artes : 1x1 + 12x1/4 = 4 sites [6]/maille CFC.
Fig. 22 :Positions des sites octadriques ([6]) dans une maille
CFC.
Remarque : - le nombre de sites [6] = 4 = n (nombre de
motifs).
Positions ou coordonnes rduites des sites [6] :
Il y a 4 coordonnes rduites : 1 (centre de la maille) et
3 (artes de la maille).
Centre de la maille : (1/2, 1/2, 1/2)
Artes de la maille : (1/2, 0, 0), (0, 1/2, 0) et (0, 0, 1/2).
Rayon du site ttradrique
Rayon du site octadrique
IV.2. Structure hexagonal compact (HC)
On rappelle que la structure HC est obtenue par
lempilement de plans ABAB selon la direction Oz. Cette
structure peut tre reprsente soit par une maille
hexagonale (= maille triple), soit par une pseudo - maille (=
1/3 de la maille hexagonale).
Fig. 23 : Reprsentation en perspective( maille triple et pseudo
maille) et en projection sur le plan xoy.
a- Coordonnes rduites :
La description du rseau, et en particulier la maille triple,
peut tre faite partir de la pseudo maille. Cette dernire contient
deux motifs, de ce fait le nombre de coordonnes rduites est de 2 :
(0, 0, 0) pour les sommets et (1/3, 2/3,1/2) pour les atomes du plan B
(z = c/2) ou (0,0,0) ; (2/3,1/3,1/2).
b- Nombre de motifs par maille
Considrons une maille hexagonale (3 pseudo - mailles), le
nombre de motifs est :
12 x 1/6 (sommets) + 2x1/2 (centre des bases) + 3x1(intrieur) =
6.
Remarque : Cas dune pseudo - maille (1/3 de maille) : 4x1/6 +
4x1/12 + 1 = 2, ou tout simplement : 8.1/8 + 1.1 = 2 en
considrant un rseau de pseudo mailles.
c- Coordinence (IC)
Considrons latome situ au milieu de
lhexagone du plan A de la figure 24. Cet atome est
tangent aux 6 atomes du mme plan ainsi quaux 3
atomes du plan B, c/2, et aux 3 atomes du plan B, -
c/2. Donc, latome considr est entour de 6 + 3 + 3 =
12 atomes, qui sont tous situs la mme distance.
Par ailleurs, comme dans une structure HC toutes les
positions atomiques sont quivalentes, la coordinence
est gale 12.
Fig.24 : Schma permettant de dterminer la
coordinence dans une structure HC
d- Compacit
Pour dterminer la compacit (t = nv/V), il est prfrable
de se rfrer la pseudo - maille. Dans ces conditions, on a:
n = 2 ; v = 4/3t r
3
Par ailleurs, en se referant au triangle IKJ, montr dans la figure 25,
on peut crire:
(IL)
2
+ (c/2)
2
= a
2
; c
2
/4 = a
2
IL
2
= a
2
(3a
2
)/9
c
2
= 4a
2
(1 1/3) = 8/3a
2
(c/a)
2
= 8/3 c/a =8/3 = 1,633.
Finalement, c/a =1,633 ; a =2r ; V = 11,29 r
3
; v = 4/3. tr
3
et n = 2.
On trouve t = 0,74
(C/2)
2
= a
2
- (IL)
2
et IL = 2/3 IH
Fig. 25 : Schma dun triangle IKJ de la maille dune structure HC
f- Dnombrement des sites [4] et [6] :
* Sites [4] :
Les sites [4] se trouvent sur les plans : 1/8, 3/8, 5/8 et 7/8
Fig. 26 : Positions des sites ttradriques dans une structure
HC
Le bilan des sites [4] est donc :
1/8 : (3x1) = 3
3/8 : (1+6x1/3) = 3
5/8 : (1+6x1/3) = 3
7/8 : (3x1) = 3
Soit un total de 12 sites
[4]/maille.
*Sites [6] :
Les sites [6] se trouvent sur les plans 1/4 et 3/4 de la maille
hexagonale.
Fig. 27: Emplacement des sites octadriques dans une structure
HC
Positions des sites [4] et [6] :
Il y a autant de sites que de positions :
Sites [4] : 4 sites par pseudo maille ce qui correspond 4
positions :
(2/3, 1/3, 1/8) ; (0, 0, 3/8) ; (0, 0, 5/8) ; (2/3, 1/3, 7/8).
Sites [6] : 2 sites par pseudo maille, donc 2 positions :
(1/3, 2/3, 1/4) ; (1/3, 2/3, 3/4).
Ces positions permettent de dcrire la maille hexagonale.
V- Structures non compactes
*Structure cubique centre
Dans cette structure qui drive dun assemblage non
compact, les atomes occupent les sommets et le centre de la
maille.
Fig. 28 : Reprsentation en perspective (a) et en projection sur le plan xoy
(b) de la maille dune structure CC.
a- Nombre de motifs par maille :
n = 2 : 8x(1/8) (sommets) + 1x1 (centre).
V.1- Caractristiques de la structure cubique centr (CC)
b- Compacit :
t = nv/V
Pour dterminer la valeur de t, il faut connatre la relation reliant
a et r.
a
a
\2.a 2r
r
r
Diagonale dune face :
2 2
1
2 d a a a = + =
Diagonale du cube :
( )
2
2
2
2 3 d a a a = + =
4r = (les atomes sont tangents selon la diagonale
principale du cube)
3 a
t = nv/V = (2.4/3. tr
3
)/a
3
= (8/3.tr
3
)/ (4r/3)
3
t = (24.3. tr
3
)/(192.r
3
) = 0,68
Il ressort que 68% du volume global de la maille sont occups
par des atomes et les 32% sont vides. Donc, lempilement
cubique centr est moins compact que celui de CFC et de HC.
c- Coordinence :
Considrant par exemple latome situ au centre de la
maille CC, Cet atome est entour de 8 atomes (environnement
cubique), et puisque toutes les positions atomiques sont
quivalentes, la coordinence est donc gale 8.
d- Sites :
La maille prsente des sites cristallographiques [4] et [6]
irrguliers.
La structure cubique I contient des sites intersticiels, mais
leur gomtrie est moins rgulire que dans la structure
cubique F. Ainsi, au centre de chaque face, se trouve un site
octadrique dform : il est distance a/2 des atomes
centraux des deux mailles qui partagent cette face, mais
distance des 4 atomes situs aux sommets de cette
face. Il sagit donc dun octadre aplati .
Il existe galement des sites ttradriques dforms
raison de 4 par face carre, soit 4x(6x1/2) = 12 par maille. Ils
se situent en (1/2, 0, 1/4), (1/4, 0, 1/2), (1/2, 0, 3/4), (3/4, 0,
1/2)etc
Un examen attentif rvle que des sites semblables se
trouvent aux milieux des artes, pour un total (6x1/2 +
12x1/4) = 6 sites octadriques dforms par maille.
V-2 Caractristiques de la structure cubique simple(CS)
Il sagit de la maille la plus simple o seuls les sommets
sont occups.
a- Nombre de motifs par maille :
Comme seuls les sommets de la maille sont occups par
des atomes, il en dcoule que le nombre de motifs/ maille est gal
1 (8.1/8)
b- Compacit (t)
t = nv/V = (4tr
3
)/3a
3
Dans une maille cubique simple, les atomes sont tangents
suivant les artes, et par consquent a dpend de r selon la
relation: a = 2r. Finalement, on obtient : t = (4t)/24 = 0,52.
a
r
a
a
c- Coordinence
En considrant un bloc constitu de mailles
cubiques simples (Fig.29), on constate que chaque
atome au sommet est entour de 6 atomes, situs
chacun la distance a (paramtre cristallographique).
Les autres atomes voisins latome considr sont
situs, plus loin, la distance a2. Ainsi, la
coordinence est gale 6.
Fig. 29 : Bloc de mailles cubiques simples
Remarque : Certains mtaux sont polymorphes et
ralisent des assemblages datomes qui peuvent
diffrer selon les conditions physiques. Par exemple,
le fer admet diffrentes structures parmi lesquelles
on peut citer celles du fer qui est cubique centr et
du fer qui est cubique faces centres. De mme, le
cobalt admet deux structures hexagonale
compacte et cubique faces centres. , et sont
dites varits allotropiques.
STRUCTURES IONIQUES
Introduction
Les solides ioniques sont forms de l'association de deux
ou plusieurs ions de charges opposes. La cohsion de
leurs structures est alors assure par des forces de nature
lectrostatique : Forces attractives et rpulsives.De ce fait,
ldifice ionique est le rsultat dun compromis entre ces
forces et lquilibre aura lieu pour une distance inter
ionique d
0
et une nergie appele nergie rticulaire.Si on
considre une molcule diatomique AB, dont la liaison est
purement ionique, l'nergie potentielle d'interaction est de
la forme :
U
T
= U
1
+ U
2
ans un cristal et pour une mole dions, U
1
et U
2
scrivent :
U
1
= - NAe
2
/4
0
d et U
2
= B/d
n
Lnergie totale est donc :
U
T
= - NAe
2
/4
0
d + B/d
n
Le cristal se forme pour une nergie totale U
T
minimum et
pour une distance d =d
0
. Cette nergie U
T
correspond
lnergie rticulaire qui est de la forme :
)
1
1 (
2
n d
NA e z z
E U
o
r T
= =
+
N : Nombre dAvogadro ;
A : Constante de Madelung = Constante gomtrique qui est la mme
pour toutes les structures de mme type.
n : Constante qui tient compte des couches lectroniques de A
+
et B
-
.
z
+
et z
-
: Nombres de charge du cation et de l'anion.
Remarque : E
r
nest pas directement mesurable, car elle
impliquerait la dtermination de la chaleur de raction :
A
+
(g) + B
-
(g) --> AB(s)
qui est dtermine par le cycle de Born- Haber.
Les composs ioniques peuvent tre classs par indice de
coordination et leurs structures vont tre apparentes des
composs chimiques types.
La description des structures ioniques sera faite en les
considrant :
Soit comme une imbrication des rseaux anioniques et
cationiques, appels sous rseaux.
Soit comme un rseau anionique dans lequel les cations
occupent les sites car en gnral
r
anion
> r
cation
On se limitera ltude des composs de type AB et AB
2
. (voir
TD)
Les solides que nous allons considrer comportent au
moins deux types datomes diffrents. Leur formule la plus
simple est donc M
. La diffrence dlectrongativit entre
les atomes va crer des interactions lectrostatiques qui
seront dautant plus importantes que
cette diffrence entre les deux lments sera plus
grande. Une structure cristalline peut alors tre dfinie par :
Les solides ioniques de type MX
1- Un rseau principal constitu par les atomes les plus gros,
en occurrence les anions
X de rayons r
-
. Ce rseau aussi appel rseau anionique
formera :
- soit une structure non compacte
- soit une structure compacte de type hc ou cfc
2- Les ions de plus petite taille, en gnrale les cations de
rayons r
+
, occuperont les sites interstitiels Octa ou Ttra du
rseau anionique, comme prsent sur la figure suivante :
Les deux types de sites interstitiels
Cependant, les vides interatomiques du rseau ne peuvent
pas tre occups par des atomes de nimporte quelle taille.
Si lon considre un ensemble form par quatre atomes
tangents, il nest pas possible dy insrer un atome trop
petit, lensemble formant un systme
thermodynamiquement instable. Le systme idal est constitu dun
atome interstitiel tangent aux quatre sphres du rseau, elles-mmes
tangentes entre elles. De mme, il est possible dy insrer un cation de
taille plus leve, de manire carter les atomes du rseau qui ne sont
alors plus tangents entre eux. Ces trois cas sont reprsents sur la figure
suivante .
Les possibilits dinsertion stables dun cation dans un site
interstitiel anionique, avec la condition r
c
(r
c
)min. Un
cation trop petit conduit un arrangement instable.
On peut alors montrer par des considrations gomtriques
simples, que le rapport des rayons ioniques = r
+
/r
-
doit
avoir une valeur minimum. Les sites interstitiels occups
doivent respecter un domaine de stabilit caractris par les
valeurs de r suivantes( voir Tableau) :
Composs de type AB
Structure de type CsCl
Description :
Les ions Cl
-
forment un rseau cubique simple et les ions Cs
+
occupent les sites [8]. Autrement dit deux sous - rseaux cubiques
simples dcals de
Reprsentation :
2
3
a
Reprsentation des deux mailles lmentaires possibles
Coordonnes rduites :
Cl
-
(0, 0, 0) ; Cs
+
(, , )
Nombre de motifs par maille :
Cl
-
: 8x1/8 = 1 et Cs
+
:1x1 = 1
soit 1 motif CsCl /maille
Coordinence : 8 : 8 (cubique).
Condition gomtrique de stabilit de la structure :
Soient r
+
et r
-
les rayons ioniques du cation et de lanion. La
condition gomtrique de stabilit tient compte de la
tangence entre les ions. Ainsi, les ions de signes opposs
sont tangents entre eux et les ions de mme signe sont la
limite tangents entre eux.
La tangence des ions de signes opposs a lieu selon la
diagonale du cube et se traduit par la relation :
+
+ = r r a
2
3
(1)
Celle des ions de mme signe, gnralement les anions, peut avoir
lieu selon larte : (2)
a r s
2
D'autre part,
1 (
+
r
r
(3)
En combinant les relations (1), (2) et (3) on obtient :
1 732 , 0 ( s
+
r
r
Cest la condition gomtrique pour avoir une structure o
la coordinence = 8.
-Exemples de structures de type CsCl :
Compos CsCl CsBr CsI TlCl TlBr
r+/r- 0,93 0,87 0,78 0,83 0,77
Structure de type NaCl
Description :
les ions Cl
-
sont aux sommets du cube et au centre des faces (forment un
CFC). Les ions Na
+
occupent tous les sites [6]. Autrement dit, deux sous -
rseaux CFC dcals de a/2 selon larte.
Reprsentation :
Coordonnes rduites :
Cl
-
: (0,0,0) ; (, , 0) ; (, 0, ) (0, , )
Na
+
: (, 0 0) ; (0, 0) ; (0, 0, ) , (,,)
Nacl
Nombre de motifs par maille :
Cl
-
: 8x1/8 + 6x1/2 =4 et Na
+
: 12x1/4 + 1 = 4
soit 4 motifs NaCl/maille
Coordinence : 6 : 6 (octadrique).
Condition gomtrique de stabilit de la structure :
Les ions de signes opposs sont tangents selon larte,
d'o : (1)
Dautres part, les anions peuvent la limite se toucher
selon la diagonale dune face :
a r r = +
+
) ( 2
2 4 a r s
(2)
La combinaison des relations (1) et ( 2) conduit : En
tenant compte du domaine de stabilit de la structure
type NaCl, on aboutit la condition gomtrique
suivante :
s 1 2
+
r
r
1 3 (
-Exemples de structures de type NaCl :
Compos LiF NaF NaCl NaBr NaI KCl
r
+
/r
-
0,44 0,70 0,52 0,49 0,44 0,73
Il existe aussi des oxydes tels que CaO, BaO, MgO,
FeO ainsi que des sulfures MnS et PbS etc .
Structure de type ZnS
Introduction :
Selon la temprature, le sulfure de zinc ZnS peut avoir deux
types de structures : la blende cristallisant dans le systme
cubique, basse temprature et la wrtzite dans le systme
hexagonal, haute temprature. Dans les deux cas, le cation
Zn
2+
occupe un site [4] sur deux dune structure compacte de
S
2-
(CFC ou HC).
Structure de type ZnS Blende
Description :
Les ions S
2-
forment un rseau cubique faces centres
(CFC) dont la moiti des sites [4] est occupe par les ions
Zn
2+
, la distance Zn-Zn tant maximale.
Autrement dit, deux sous - rseaux CFC de S
2-
et Zn
2+
dcals de a(3)/4 suivant la diagonale du cube.
Reprsentation :
Structure cristallographique de la Blende de Zinc : les atomes A et B sont
disposs sur deux rseaux CFC dcals d'un quart de la diagonale du
cube. Chaque atome A (B) est au centre d'un ttradre rgulier form
par 4 atomes B (A).
La blende Zns
Coordonnes rduites :
S
2-
: (0,0,0) ; (, , 0) ; (, 0, ) (0, , )
Zn
2+
: (3/4 , , ) ; (, 3/4, 1/4) ; (,1/4, 3/4) , (3/4, 3/4,3/4)
Coordinence : 4 : 4 (ttradrique).
Nombre de motifs par maille :
S
2-
: 8x1/8 + 6x1/2 =4 et Zn
2+
: 4x 1 = 4
soit 4 motifs ZnS/maille
Condition gomtrique de Stabilit :
Considrons un cube darte a = a/2 :
La tangence suivant la diagonale du cube permet d'crire :
4 / 3 2 / 3 ' a r r a = + =
+
(1)
Les anions peuvent la limite se toucher selon la face du
cube :
2 2 a r s
(2)
Les relations (1) et (2) conduisent :
1 2 / 3 >
+
r
r
La limite suprieure tant celle de la coordinence 6, la
condition de stabilit pour la coordinence 4 - 4 :
414 , 0 225 , 0 ( s
+
r
r
-Exemples de structures type ZnS blende :
Sulfures Tellures Slniures Hydrures oxydes
BeS BeTe BeSe TiH ZnO
MnS ZnTe MnSe ZrH
ZnS CdTe ZnSe
CdS HgTe HgSe
HgS
Chlorures Bromures Iodures Carbures Arsniures Phosphures
CuCl CuBr CuI SiC AlAs AlP
AgI
Structure de type ZnS Wrtzite
Description :
Les ions S
2-
forment un rseau hexagonal compact (HC)
dont la moiti des sites [4] est occupe par les ions Zn
2+
, la
distance Zn-Zn tant maximale. Autrement dit, deux sous -
rseaux HC de S
2-
et Zn
2+
dcals de 3c/8.
Reprsentation :
Coordonnes rduites :
S
2-
: (0, 0, 0) ; (2/3, 1/3, )
Zn
2+
: (2/3, 1/3, 1/8) ; (0, 0, 5/8)
-Coordinence : 4 : 4 (ttradrique).
Nombre de motifs par maille :
S
2-
: 12x1/6 +2x1/2 +3 = 6 et Zn
2+
: 3x1 + 6x1/3 +1 = 6
6 motifs ZnS/maille Donc 2 motifs ZnS/pseudo-maille.
Condition gomtrique de Stabilit: Elle est la mme que
celle de ZnS blende.
Structure cristallographique de la structure Wurzite : les atomes A et
B sont disposs sur deuxrseaux hexagonaux dcals de peu prs
3/8 de la hauteur. l'instar de la structure Blende de Zinc, les atomes
d'un lment sont au centre d'un ttradre form par 4 atomes de
l'autre lment.
Structure Wrtzite
Structure de type NiAs
Description :
Les atomes dArsenic (As) forment un HC dans lequel
les atomes de nickel (Ni) occupent tous les sites [6].
Les atomes sont cette fois-ci lis entre eux par des
liaisons mtalliques (et non ioniques comme
prcdemment ). Cette structure est tout de mme
importante car on la retrouve dans de nombreux
composs.
Reprsentation :
Coordonnes rduites :
As : (0, 0, 0) ; (1/3, 2/3, )
Ni : (2/3, 1/3, 1/4) ; (2/3, 1/3, 3/4)
Coordinence : 6 : 6
Les polydres de coordination ne sont pas les mmes. C'est
un octadre pour Ni et un prisme bases triangulaires pour
As.
Nombre de motifs par maille :
As : 12x1/6 +2x1/2 +3 = 6 et Ni : 6x1 =6
6 motifs NiAs /maille
Donc 2 motifs NiAs/pseudo-maille.
Rsum des structures AB
Composs de type AB2
Structure de type Fluorine CaF
2
Description :
Les ions Ca
2+
forment un rseau CFC dans lequel les ions
F
-
occupent tous les sites [4].
Une autre description consiste considrer la structure
comme tant un rseau cubique simple de F
-
dans lequel
les ions Ca
2+
occupent un site [8] sur deux.
Reprsentation :
Coordinence 8 : 4 : Ions F
-
: 4 voisins Ca
2+
a3 /4 ; Ions Ca
2+
: 8 voisins
F
-
a3 /4
Ca
2+
: 8, cubique et F
-
: 4, ttradrique.
Nombre de motifs :
Ca
2+
: 8x1/8 + 6x1/2 = 4 et F
-
: 8x1 = 8 4 motifs CaF
2
/maille
Paramtre de la maille a:
Contact cation/anion: sur la grande diagonale: r
+
+ r
-
= a 3 /4
Contact anion/anion: sur la diagonale dune face: a 2 > 4 r
-
Masse volumique :
Compacit
Remarque :
Dans certains composs de formule AB
2
, le rseau CFC est form par
les anions et les cations occupent les sites [4], on parle de structure
antifluorine (Li
2
O, K
2
O ).
Antifluorine Na
2
O, coordinence
Antifluorine Na
2
O:
Les ions O
2-
forment un rseau CFC dans lequel les ions Na
+
occupent tous les sites [4].
Atomes par maille : 4 Na
2
O
lCoordinence : 4/8
Gomtrie : Ttradrique / Cubique
Antifluorine Li
2
O, coordinence 4/8
Structure de type Rutile TiO
2
TiO
2
existe sous trois formes allotropiques : la
brookite, l'anatase et le rutile. Le rutile est la seule forme
stable dans les conditions standards. On utilise le rutile
dans la peinture blanche,pour remplacer le plomb
toxique.
Description :
Les ions Ti
4+
forment un rseau quadratique centr (avec
c<a et b= 1,5 a) et les ions O
2-
forment un octadre dform
autour des ions Ti
4+
.
Reprsentation :
Coordonnes rduites :
Ti
4+
: (0, 0, 0) ; (, , ).
O
2-
: (u, u ,0) ; (- u,- u, 0) ; ( + u, - u, ) ; ( - u, + u, )
avec u = 0,29
Nombre de motifs par maille :
Ti
4+
: 8x1/8 + 1 = 2 et O
2-
: 4x + 2 = 4 2 motifs TiO
2
/maille.
Exemples: oxydes: MO2 (e.g. Ti, Nb, Cr, Mo, Ge, Pb, Sn)
Coordinence : 6 : 3
Ti
4+
: 6, octadre dform et O
2-
: 3,triangle presque quilatral.
STRUCTURES COVALENTES
Carbone diamant
Description :
Les cristaux covalents correspondent des difices datomes lis par
des liaisons fortes et diriges (covalentes). Ce type de cristaux est bien
illustr par le carbone diamant. Il sagit dun rseau CFC de carbone
dans lequel un site [4] sur deux est occup par les atomes de carbone.
On peut aussi le considrer comme 2 rseaux CFC de carbone dcals
de (a3/4) suivant la diagonale principale.
Reprsentation :
Le diamant est un cristal monoatomique de carbone. Sa formule est
donc C. Tous les atomes de carbone sont lis chimiquement par une
liaison covalente leurs voisins. C'est un cristal covalent. La
cohsion de ce type de cristal est extrmement forte, ce qui explique
sa trs grande duret.
Carbone diamant
Coordinence :
4 avec dc-c = 1,54 et une hybridation sp
3
.
Remarque : Contrairement au graphite, le diamant est un isolant (pas
dlectrons dlocaliss). Il est trs dur do labsence de clivage.
Exemple : Si, Ge, Sn (gris).
Carbone diamant
La structure graphite
Le graphite est la varit hexagonale du carbone ; Son
domaine de stabilit est trs tendu, les atome de carbone
tant en (0,0,1/4), (1/3,2/3,1/4).
1) Chaque atome de carbone est associ 3 voisins
coplanaires (angle C-C-C de 120,hybridation sp
2
). Les
liaisons dans le plan sont trs fortes.
2) Les liaisons C-C entre plans sont de type Van der Waals :
* possibilit de clivage et utilisation comme lubrifiant.
* Certains lments ou molcules de type base de Lewis
peuvent se fixer entre les couches pourformer ainsi des
composs dinsertion.
Reprsentation
Caractristiques de la maille :
La maille est un prisme droit base losange :
a = 2,463 et c = 6,714
Coordinence
STRUCTURES MOLECULAIRES
Glace hexagonale
Description :
Les oxygnes forment un hexagonal compact et occupent la moiti
des sites [4]. Chaque oxygne est entour de 4 autres situs aux
sommets dun ttradre.
Donc chaque atome doxygne est entour de 4 atomes dhydrogne :
2 appartenant une molcule deau.
2 appartenant aux autres molcules.
La cohsion de ldifice est assure par des liaisons hydrogne.
Reprsentation :
Remarque : Leau solide (glace) peut exister sous plusieurs formes
cristallines (varits allotropiques) cette varit est la plus stable
et sappelle la tridymite.
Dioxyde de carbone
Description :
Le dioxyde de carbone CO
2
se solidifie 78C (carboglace) et cristallise
dans une structure CFC. Les 8 molcules occupant les sommets sont
parallles entre elles, celles des centres des faces sont parallles entre
elles. La cohsion du cristal est due des interactions de type Van der
Waals.
Reprsentation :
Le dioxyde de carbone CO
2
cristallise sous la forme prsente ci-contre.
Le groupement formulaire est une molcule. Les molcules de CO
2
se
positionnent au sommets de la maille et au centre des faces. C'est un
cristal molculaire. Les liaisons covalentes sont internes au groupements.
La cohsion du cristal est assure par des forces intermolculaires faibles.
Cristal molculaire de
CO
2
STRUCTURES EN COUCHES
Introduction
Ce sont des structures constitues par la succession de feuillets
(couches) de telle faon que la distance inter-feuillets soit beaucoup
plus importante que celle entre les atomes dun mme feuillet.
Ainsi, une structure est dite en couches (ou lamellaire) si :
La distance inter-feuillets est denviron 3 4 ,
La distance inter-atomique dun mme feuillet est de lordre de 2.
Il sensuit donc deux types de liaisons :
Dans un mme feuillet, les liaisons sont fortes (ioniques,
covalentes ou mtalliques).
Entre deux feuillets, les liaisons sont faibles (hydrogne ou Van der
Waals) donc le clivage est facile dans certaines directions.
Structures types
Structure de type
CdI
2
Description :
Les ions I
-
forment un empilement hexagonal compact et les ions Cd
2+
occupent les sites [6] dun plan sur deux (z = 1/4 ou 3/4).
Reprsentation :
Nombre de motifs par maille :
1 motif CdI
2
/pseudo maille
Coordinence : 3 : 6. Coordination: Cd: 6 (octadrique) I: 3 (pyramide
triangulaire)
3 pour I
-
et 6 pour Cd
2+
Exemples : MI
2
; MBr
2
; M(OH)
2
avec M = Cd, Ca, Fe, Co .
Cette structure est dite lamellaire. En effet,
on observe que les atomes forment des
couches lies entre elles par des liaisons
de Van der Waals ( liaison faible ) tandis
qu' l'intrieur d'une mme couche les
liaisons sont ioniques.
Composs de type CdI
2
Iodures des cations modremment polarisants ;
bromures et chlorures de cations fortement
polarisants;
e.g. PbI
2
, FeBr
2
, VCl
2
Hydroxydes de nombreux cations divalents
e.g. (Mg,Ni)(OH)
2
Di-chalcognures de nombreux cations ttravalents
e.g. TiS
2
, ZrSe
2
, CoTe
2
Structure de type CdCl
2
Description :
Les ions Cl
-
forment un empilement cubique faces centres et les
ions Cd
2+
occupent les sites [6] dun plan sur deux.
Atomes par maille : 2 CdI2
l Coordinence : 6/3
l Gomtrie : Octadrique / Pyramide trigonale
Sa structure est aussi lamellaire
-Reprsentation :
Remarque :
A cause de labsence dun plan cationique sur deux, il apparat des
forces rpulsives entre les plans anioniques proches voisins, il en rsulte
une dformation rhombodrique selon laxe C
3
.
Nombre de motifs par maille :
1 motif CdCl
2
/maille
Coordinence : 3 : 6.
3 pour Cl
-
et 6 pour Cd
2+
Exemples : MCl
2
(M = Fe, Co, Ni, Mg, Mn)
Caractres structuraux de solides plus complexes
Les composs de type MO
3
Les oxydes CrO
3
, MoO
3
, WO
3
, et ReO
3
adoptent le type structural ReO
3
.
Les ions O
2-
occupent-les des positions du rseau cfc (milieu des
artes de la maille cubique) les cations M
6+
occupent les sommets de la
maille (1/4 des sites octadriques occups). Les octadres MO
6
partagent les sommets.
Exemple : Nitrure de Bore BN mais avec alternance des plans B et N avec la
distance B N gale 1,45 et la distance inter-feuillets gale 3,45 .
Rseau: Cubique P, 1 ReO
3
par maille
Motif:
1 Re (0, 0, 0); 3 O (1/2, 0, 0), (0, 1/2, 0), (0, 0, 1/2)
cordinence : Re: 6 (octadrique) ; O: 2 (linaire)
les octadres ReO6 partagent seulement les sommets
Peut tre regard comme un oxyde ccp avec 1/4 des sites vacants (au
centre de la maille)
Exemples:
WO
3
, AlF
3
, ScF
3
, FeF
3
, CoF
3
, Sc(OH)
3
(distordu )
Les composs de structure type provskite CaTiO
3
Lorsque les cations A et M ont des tailles diffrentes (RA > RM), loxyde
AMO3 adopte la structure provskite. Pour CaTiO
3
, par exemple, elle peut
tre considre comme drive de la structure ReO
3
dans laquelle les ions
Ti
4+
occupent les sites octadriques et les ions Ca
2+
, en
coordinence 12 occupent le centre des mailles comme sur la figure suivante:
Structure provskite
Ti
4+
: aux sommets de la maille cubique
O
2-
: au milieu des artes, Ca
2+
: au centre
Rseau: Cubique P (structure idalise),
1 CaTiO
3
par maille
Motif:
Ti (0, 0, 0);
Ca (1/2, 1/2, 1/2);
3 O (1/2, 0, 0), (0, 1/2, 0), (0, 0, 1/2)
Coordinence
Ca 12 par O (cuboctadre)
Ti 6 par O (octadre) O octadre distordu (4xCa + 2xTi)
Polydres
Octadres TiO
6
lis par sommet
Cubocatdres CaO
12
lis par les faces
Ca occupe les sites ccp vacants du motif ReO
3
, formant un arrangement
ccp avec 1/4 des sites octadriques (ceux dfinis par 6xO) remplis par Ti
Exemples: NaNbO
3
, BaTiO3 , CaZrO
3
, YAlO3 , KMgF
3
, Nombreuses
distorsions faibles : e.g. BaTiO3 est ferrolectrique
La structure provskite est compltement prvue par la 2
me
rgle de
Pauling
La structure provskite idale est forme si les cations sont tangents aux
anions ce qui impose la condition gomtrique: RA+RO= 2(RM +RO).
Cest en fait une condition trs stricte et Goldschmidt a introduit un facteur
de tolrance t permettent dexpliquer lexistence dune telle structure pour
une large gamme de rayons ioniques:
RA+RO=t 2(RM +RO)
Le diamant est un cristal monoatomique de carbone. Sa formule est donc
C. Tous les atomes de carbone sont lis chimiquement par une liaison
covalente leurs voisins. C'est un cristal covalent. La cohsion de ce
type de cristal est extrmement forte, ce qui explique sa trs grande duret.
le diamant
Le dioxyde de carbone CO
2
cristallise sous la forme prsente ci-
contre. Le groupement formulaire est une molcule. Les molcules de
CO
2
se positionnent au sommets de la maille et au centre des faces.
C'est un cristal molculaire. Les liaisons covalentes sont internes au
groupements. La cohsion du cristal est assure par des forces
intermolculaires faibles.
cristal molculaire de CO
2
un plan rticulaire dans un rseau cubique
On montre ci-contre une famille de plans rticulaires dans un rseau cubique
faces centres. C'est une famille de plans faciaux. La distance entre chaque
plan vaut :
Cette autre famille de plans rticulaires est de type oblique. La distance entre
chaque plan vaut :
Pour la famille de plans rticulaires
prsente ci-contre, la distance entre
chaque plan vaut :
Le chlorure de sodium NaCl est galement un compos de type
ionique. Il cristallise dans le systme cubique faces centres. Le
chlore occupe les sommets et les centres des faces. Le sodium est
situ au milieu des artes et au centre du cube. Il constitue un autre
rseau cubique face centre dcal de a/2 par rapport celui du
chlore.
Dans le fluorure de calcium CaF2, les ions fluor (reprsents ci-
contre en bleu) occupent les sommets, les centres des faces, les
milieux des artes et le centre de la maille. Les ions calcium (en
gris) occupent la moiti des sites cubiques. Ils ont donc une
coordinence 8. Chaque fluor est entour par quatre atomes de
calcium qui forment un ttradre (coordinence 4). La maille
contient quatre groupements CaF2. La structure ci-contre est
appele fluorine.
On peut reprsenter alternativement cette structure en plaant les ions
calcium dans un rseau cfc et les ions fluors au centre de tous les sites
ttradriques, comme illustr ci-contre. Cette reprsentation met en
vidence la symtrie cubique faces centres mais illustre mal la compacit
du rseau des ions fluor ; elle est par contre plus adapte la description
de composs tels que Li
2
O. On l'appelle structure antifluorine
La blende
Les valeurs numriques portes dans ce tableau correspondent des structures
"idales" dans lesquelles tous les ions sont tangents.
Dans une structure de type NaCl par exemple, dans laquelle les ions sont en
environnement octadrique (coordinence 6), le rapport des rayons ioniques est tel
que les ions sont tous tangents sur une face.
Le gaz parfait (idal)
Le gaz parfait
Le gaz parfait est un gaz idal :
il correspond un gaz dilu c..d un gaz pression rduite
c'est un ensemble de N atomes ou molcules identiques sans
interaction entre eux et soumis une agitation perptuelle et
alatoire (dite agitation molculaire ou thermique)
Modle du gaz parfait
- les molcules se dplacent dans
toutes les directions
- l'nergie cintique d'une molcule
est 1/2 mv
i
2
Hypothses du gaz parfait (Thorie cintique des gaz)
- les atomes ou molcules du gaz sont assimils des masses ponctuelles
-les molcules sont sans interaction entre elles (nergie potentielle Ep = 0)
- la pression est due aux nombreux chocs des molcules sur les parois de
l'enceinte
Dune manire gnrale, la volume dun gaz dpend de plusieurs
paramtres au nombre desquels on peut identifier la quantit quon
traduira par le nombre de mole n, la temprature T et la pression P.
Historiquement, le baromtre mercure a t invent par Evangelista
TORRICELLI en 1643. Il remarqut que la pression atmosphrique
variait de quelques centimtres dun jour lautre. On sait maintenant
que dans des conditions dites standards qui seront prcises
ultrieurement, 1 atmosphre est gal 101 325 N/m2. On utilise
aussi le bar qui est gal 105 N/m2, donc un tout petit moins quun
atmosphre. basse pression on utilise souvent le mm de Hg qui est
aussi appel le torr en lhonneur de TORRICELLI. Il vaut 1/760e
dune atmosphre.
1.1. La loi de BOYLE-MARIOTTE
1. Quelques lois macroscopiques
En 1660, Boyle publia le rsultats de ses observations. Il avait construit
une pompe vide. Notons au passage quen ces moments o la notion
de vide faisait son apparition, certains philosophes prtendaient
dmontrer que le vide ne pouvait exister : Le vide est rien et ce qui est
rien ne peut exister . En modifiant quelque peu son approche
exprimentale, en 1662, BOYLE en arrivait dmontrer que le produit
Pression Volume est constant : le volume dun chantillon gazeux est
inversement proportionnel sa pression. En termes mathmatiques, P
1 / V, ce quexprime la figure 2.1 :
PV = Constante
Figure 2.1. Relation pression volume pour un
gaz parfait. n
1
et n
2
sont des quantits
diffrentes de gaz.
T R
V P
total
.
- n
tot
=
= 0,2 mol
- m
N2
= M(N2) n
total
_
N2
= 4,2 g ; m
O2
= M(O2) n
total
_
O2
=
0,64 g ; m
CO2
= M(CO2) n
total
_
CO2
= 1,32 g
You might also like
- Chimie TDDocument47 pagesChimie TDMOUSTAPHA ISSAKHA HAMAT100% (3)
- Exercices d'intégrales et d'équations intégro-différentiellesFrom EverandExercices d'intégrales et d'équations intégro-différentiellesNo ratings yet
- Exercices d'intégrales de lignes, de surfaces et de volumesFrom EverandExercices d'intégrales de lignes, de surfaces et de volumesNo ratings yet
- Stéréochimie organique: Les Grands Articles d'UniversalisFrom EverandStéréochimie organique: Les Grands Articles d'UniversalisNo ratings yet
- Pile À CombustibleDocument7 pagesPile À CombustibleAhmed Sayyaf AhmedNo ratings yet
- Analyse de SolsDocument8 pagesAnalyse de SolsBelkacem Elouafi100% (2)
- Atomistique CoursDocument18 pagesAtomistique Courssoumara100% (1)
- Géométrie maxwellienne augmentée de l'espaceFrom EverandGéométrie maxwellienne augmentée de l'espaceRating: 5 out of 5 stars5/5 (4)
- COURS S4 Cristtallo SMPC 2019 - 1Document35 pagesCOURS S4 Cristtallo SMPC 2019 - 1strcomNo ratings yet
- Corriges Des ExercicesDocument94 pagesCorriges Des ExercicesWilliam Keller100% (1)
- Examens Corriges CM CG IiDocument59 pagesExamens Corriges CM CG IiAbdoulaye Diallo87% (23)
- Construction Des Fours TubulaireDocument26 pagesConstruction Des Fours TubulairerezokaNo ratings yet
- Diffraction-RayonsX Nimes 2013 PDFDocument119 pagesDiffraction-RayonsX Nimes 2013 PDFKahlouche HichemNo ratings yet
- Cours Complet Geotechnique PDFDocument79 pagesCours Complet Geotechnique PDFAfaf SarrijNo ratings yet
- ÉlectrochimieDocument5 pagesÉlectrochimieOussama El BouadiNo ratings yet
- Cours 10 Notion de Potentiel D'oxydoréductionDocument3 pagesCours 10 Notion de Potentiel D'oxydoréductionBeatrice Florin100% (3)
- 01 Structure CristallineDocument24 pages01 Structure CristallineMariam Rosa100% (4)
- ArchitecturedelamatiereChap 3TDDocument2 pagesArchitecturedelamatiereChap 3TDbadreNo ratings yet
- SMC-4 - COURS Cristallo - CHTOUNDocument49 pagesSMC-4 - COURS Cristallo - CHTOUNhéma tologie100% (1)
- Chapitre 3 Les Fluides FrigorigenesDocument22 pagesChapitre 3 Les Fluides FrigorigenesPa Aliou DialloNo ratings yet
- ChapM1 Chimie GénéraleDocument99 pagesChapM1 Chimie GénéraleHakim Bil100% (2)
- Structure Des Materiaux II CristallochimieDocument25 pagesStructure Des Materiaux II CristallochimieOmar DaaliNo ratings yet
- 5 Cours Cristal Chapitreiii s4Document25 pages5 Cours Cristal Chapitreiii s4RAFIK BENONo ratings yet
- CristallographieDocument14 pagesCristallographieالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- CristallographieDocument131 pagesCristallographieKurosaki BilyNo ratings yet
- Cristallographie 1 PDFDocument148 pagesCristallographie 1 PDFAnonymous bxsB9ENo ratings yet
- Cours Electrochimie SMC5 20182019Document218 pagesCours Electrochimie SMC5 20182019Regele ZăpeziiNo ratings yet
- ENSPG 2A Physique Du Solide COURS 2004Document223 pagesENSPG 2A Physique Du Solide COURS 2004amenzou80% (5)
- Cours Cristallo s4 2018Document69 pagesCours Cristallo s4 2018héma tologie100% (1)
- Cristallographie 20202021Document105 pagesCristallographie 20202021AIT TAHAR NeilaNo ratings yet
- Chapitre II Structure Cristalline Des Solides PDFDocument11 pagesChapitre II Structure Cristalline Des Solides PDFmohamed amine AtiaNo ratings yet
- ChmTheo S5 Chapitre 7Document32 pagesChmTheo S5 Chapitre 7Abdelhakim BailalNo ratings yet
- Huckel 1Document4 pagesHuckel 1Khalid ZegNo ratings yet
- Exam 1 CristalloDocument2 pagesExam 1 Cristalloabdomarin100% (1)
- Cours de Cristallochimie 2015 INTRODUCTIONDocument59 pagesCours de Cristallochimie 2015 INTRODUCTIONOussam Ouadidi75% (4)
- Cristallographie BOUABDALLAHDocument81 pagesCristallographie BOUABDALLAHbakkali ikram100% (4)
- METALLURGIE20 Converti PDFDocument33 pagesMETALLURGIE20 Converti PDFMohamed mellahNo ratings yet
- Chap2 SciencedesMatériauxDocument50 pagesChap2 SciencedesMatériauxأشرف عبودNo ratings yet
- Cristallochimie - I - DOC4Document26 pagesCristallochimie - I - DOC4azzamNo ratings yet
- MEB ExoDocument1 pageMEB ExoZahra l زهرةNo ratings yet
- DiffractionDocument9 pagesDiffractionAdil ELNo ratings yet
- SMC4 Cristallographie Correction Normale 2016Document4 pagesSMC4 Cristallographie Correction Normale 2016mad100% (2)
- Solution TD N3 2021Document3 pagesSolution TD N3 2021Rhm GamingNo ratings yet
- Cours Séance 1 DDSDocument14 pagesCours Séance 1 DDSMohammed REMAIDINo ratings yet
- Corrige TD2 CDSDocument2 pagesCorrige TD2 CDSrahma rahmaNo ratings yet
- Chapitre IDocument44 pagesChapitre IZakaria SahirNo ratings yet
- CH - Coord SMC6 2021 - 2022 AamiliDocument42 pagesCH - Coord SMC6 2021 - 2022 AamiliNabil mifdalNo ratings yet
- Chap1 Structure CristallineDocument13 pagesChap1 Structure CristallineHachi AbdelazizNo ratings yet
- C25 - Courbes Intensite Potentiel PDFDocument8 pagesC25 - Courbes Intensite Potentiel PDFAbdelhakim BailalNo ratings yet
- coursSM1 PDFDocument21 pagescoursSM1 PDFSamah SamahNo ratings yet
- Cour Cristallochimie IIDocument204 pagesCour Cristallochimie IIRyad Khelouf100% (2)
- Chapitre 7 Non StoechiométrieDocument23 pagesChapitre 7 Non StoechiométrieAli Zouaoui100% (1)
- Mécatronique en Partant de RienDocument18 pagesMécatronique en Partant de RienAbdirachid Ali100% (1)
- Projet CristallographieDocument28 pagesProjet CristallographieMedini SouhaibNo ratings yet
- Corrigé TD2 - Chimie ThéoriqueDocument3 pagesCorrigé TD2 - Chimie Théoriqueayoub dahbiNo ratings yet
- Ato ExercicesDocument11 pagesAto ExerciceshhedfiNo ratings yet
- 0 Programme PDFDocument5 pages0 Programme PDFKarimBenA0% (1)
- Analyse Des Eaux UséesDocument8 pagesAnalyse Des Eaux UséesNINA RAISSONNo ratings yet
- CB1 2021-2022 SujetDocument7 pagesCB1 2021-2022 SujetOmar BennourNo ratings yet
- Module 1Document5 pagesModule 1Aruto YvannNo ratings yet
- TD Chromatographie en Phase Gazeuse L3 Chimie Physique: Exercice 1Document7 pagesTD Chromatographie en Phase Gazeuse L3 Chimie Physique: Exercice 1nour100% (2)
- Entropie (Thermodynamique) - WikipédiaDocument23 pagesEntropie (Thermodynamique) - WikipédiaJimmy ANDRIATSIMIALINANo ratings yet
- SMPC S2 Exam 2016Document4 pagesSMPC S2 Exam 2016Abdelhakim BailalNo ratings yet
- Edmond Becquerel - La LumièreDocument448 pagesEdmond Becquerel - La Lumièreshinkazama359No ratings yet
- Chapitre 12 Vitesse Et Variation PDFDocument7 pagesChapitre 12 Vitesse Et Variation PDFCHAMONTNo ratings yet
- CONTROLE DES PERFORMANCES DES - Bouziani M'barek - 605Document32 pagesCONTROLE DES PERFORMANCES DES - Bouziani M'barek - 605Anaibar TarikNo ratings yet
- Amerique Physique Chimie Specialite 2019Document11 pagesAmerique Physique Chimie Specialite 2019LETUDIANT100% (4)
- Resolution d'1 Probleme de MCPDocument12 pagesResolution d'1 Probleme de MCPhitmannoirNo ratings yet
- Formulaire de Physique ElectrocinetiqueDocument3 pagesFormulaire de Physique Electrocinetiqueibnou kadyNo ratings yet
- La FlammeDocument8 pagesLa FlammeKOUMNo ratings yet
- Trafi SerieDocument2 pagesTrafi SeriesamarNo ratings yet
- PolycopieTP Chimie Orag - S4-2016Document16 pagesPolycopieTP Chimie Orag - S4-2016blaksitoNo ratings yet
- Act Tintin Et La GravitationDocument3 pagesAct Tintin Et La GravitationMedios RadnNo ratings yet
- Alcool IsoDocument1 pageAlcool IsoValentinNo ratings yet
- Système de Stérilisation STERRAD 100NXDocument152 pagesSystème de Stérilisation STERRAD 100NXEric LebeauNo ratings yet
- Chap6 - Outillages Pour Moulage Sous Pression 2017 PDFDocument64 pagesChap6 - Outillages Pour Moulage Sous Pression 2017 PDFjarray abdesslemNo ratings yet
- Chimie AluminiumDocument2 pagesChimie AluminiumbilalbbkNo ratings yet
- Projet HydrauliqueDocument7 pagesProjet HydrauliqueTelesphore MoffoNo ratings yet
- Memoire: ThèmeDocument60 pagesMemoire: ThèmeytrNo ratings yet
- Mesure de La Tension Interfaciale À L'aide de La Méthode de La Goutte Montante Ou PendanteDocument4 pagesMesure de La Tension Interfaciale À L'aide de La Méthode de La Goutte Montante Ou PendanteAbde TamNo ratings yet