Professional Documents
Culture Documents
TP Chimie N°7 Dosage Oxydoreduction
Uploaded by
Serge.Omisos3677Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
TP Chimie N°7 Dosage Oxydoreduction
Uploaded by
Serge.Omisos3677Copyright:
Available Formats
LC7 Réactions d’oxydoréduction
TP Chimie n°7 Dosage d’oxydoréduction
Objectif :
- Déterminer la concentration d’une solution aqueuse de diiode
I- Etude préliminaire :
1- La réaction d’oxydo réduction
Le dosage en question fait intervenir une réaction d’oxydoréduction, qui est une réaction entre un oxydant
et un réducteur. On fait réagir une solution de diiode avec une solution de thiosulfate de sodium (2Na +(aq) +
S2O3 2-(aq)). On obtient l’ion tétrathionate S4O6 2- et l’ion iodure I-
2− 2−
L’équation chimique de cette réaction est la suivante : I2 + 2S2 O3 → S4 O6 + 2I
−
2- L’empois d’amidon
Dans un tube à essais verser 2 mL d’une solution de diiode puis ajouter quelques gouttes d’empois d’amidon.
Noter vos observations.
Comment utiliser la propriété mise en évidence pour repérer l’équivalence lors du dosage. Expliquer.
II- Dosage d’une solution aqueuse de diiode par le thiosulfate de sodium
On veut doser un volume V= 10 mL d'une solution de diiode, à laide d'une solution de thiosulfate de
sodium à la concentration C0= 0,1 mol.L-1.
Le volume V de solution à doser sera placé dans le bécher. Une pièce de papier sera placée sous le
bécher afin de mieux repérer la zone de virage.
La solution titrante de thiosulfate placée dans la burette sera versée mL par mL dans V. La solution
sera agitée pendant tout le dosage.
Après avoir réalisé le montage, effectuer un premier dosage rapide. Lorsque la solution du bécher
prend une coloration jaune paille, verser quelques gouttes d’empois d’amidon. Continuer à verser la
solution de thiosulfate jusqu’à l’équivalence.
Effectuer un nouveau dosage plus précis.
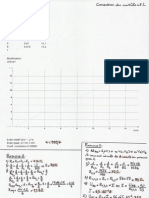
1- Schématiser le dispositif expérimental.
2- Donner la valeur du volume à l'équivalence Ve.
3- Après avoir rappelé ce qu’est l’équivalence, indiquer comment vous l’avez repérée.
4- En déduire la concentration molaire C de la solution de diiode. Les deux méthodes (celle avec et celle
sans tableau) sont demandées.
5- Etude de la réaction du dosage
a- Ecrire une demi équation permettant de rendre compte de la transformation subit par le diiode.
I2 + …….. 2I-
b- Ecrire une demi équation permettant de rendre compte de la transformation subit par le
thiosulfate 2 S2O3 2- S4O6 2- + ……….
c- En déduire quelle est la particule qui a été échangée lors de la réaction du dosage.
d- Une espèce chimique qui est capable de gagner une telle particule est un oxydant. Une espèce
chimique qui est capable de céder une telle particule est un réducteur. Quels sont l’oxydant et le
réducteur de la réaction chimique du dosage.
You might also like
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- TP - Dosage D'une Solution de Diiode Par Une Solution de Thiosulfate de SodiumDocument1 pageTP - Dosage D'une Solution de Diiode Par Une Solution de Thiosulfate de SodiumKonan Richard Kouassi100% (3)
- PS CMM b1 TP Dosage Du Diiode Dans La Betadine Version Sans DilutionDocument7 pagesPS CMM b1 TP Dosage Du Diiode Dans La Betadine Version Sans DilutionmranonimosNo ratings yet
- C03 Cinetique ReactionDocument2 pagesC03 Cinetique ReactionmohNo ratings yet
- TP Dosage Redox Diiode CorrectionDocument3 pagesTP Dosage Redox Diiode CorrectionSk CisseNo ratings yet
- Cinetique ConductimetrieDocument10 pagesCinetique ConductimetrieMouad Arrad100% (1)
- TP ConductimetrieDocument5 pagesTP ConductimetriePedro Assassi100% (1)
- Chim SolDocument4 pagesChim SolÆm Inē100% (2)
- TP Chimie Des SolutionsDocument11 pagesTP Chimie Des SolutionsFatima Yahia100% (1)
- TP N°°°05 ManganimétrieDocument6 pagesTP N°°°05 Manganimétrieroumaissa bhNo ratings yet
- 2003 Asie Sujet Exo1 Savon 4ptsDocument2 pages2003 Asie Sujet Exo1 Savon 4ptstrenteastonNo ratings yet
- TPDosage Vinaigre CorDocument3 pagesTPDosage Vinaigre CorCamille LegaveNo ratings yet
- TP N°2 ChimieDocument5 pagesTP N°2 ChimieDenilson Josemir100% (1)
- Corrige TPC8 PDFDocument4 pagesCorrige TPC8 PDFSaraa Papillon100% (1)
- TP 4 Dosage Des Ions ChlorureDocument6 pagesTP 4 Dosage Des Ions ChlorureSali0% (2)
- TP Dosage de L Acidite D Un VinaigreDocument3 pagesTP Dosage de L Acidite D Un VinaigreDjahid Jo75% (4)
- TP Benamara WDocument3 pagesTP Benamara Wabir ben100% (1)
- tp17 Synthese Savon PDFDocument5 pagestp17 Synthese Savon PDFDelano TseffNo ratings yet
- C71 - TP 2 Chimie Minerale Reactions de Complexation: RougeDocument7 pagesC71 - TP 2 Chimie Minerale Reactions de Complexation: RougeMarck CadiilNo ratings yet
- Imp PDFDocument13 pagesImp PDFChimiste ChimisteNo ratings yet
- 6 Identification Des Fonctions Organiques 2 CopieDocument6 pages6 Identification Des Fonctions Organiques 2 CopieKreirate Sid Ahmed100% (1)
- Compte Rendu TP Chimie Ii TP N°3: Determination Experimentale de L'Ordre D'Une ReactionDocument4 pagesCompte Rendu TP Chimie Ii TP N°3: Determination Experimentale de L'Ordre D'Une ReactionAyoub KabecheNo ratings yet
- TP Cinetique ChimiqueDocument3 pagesTP Cinetique ChimiqueNouara Amokrane100% (1)
- Dosage Par ManganimetrieDocument4 pagesDosage Par ManganimetrieLouve MystiqueNo ratings yet
- TP MiniralDocument11 pagesTP MiniralAymene Salah Bendrihem100% (2)
- TP Cine TiqueDocument4 pagesTP Cine Tiquejaywalk100% (1)
- TP Cinétique Chimique reaction-1-ORDRE-1Document10 pagesTP Cinétique Chimique reaction-1-ORDRE-1kiritosunny30No ratings yet
- 9 Chloration D Un Alcool TertiareDocument4 pages9 Chloration D Un Alcool TertiareBouaouina Kenza100% (1)
- Etude Cinetique D'Une Reaction Du 2 Ordre TP N°1Document2 pagesEtude Cinetique D'Une Reaction Du 2 Ordre TP N°1Ikram GrNo ratings yet
- TP Chimie Des Solutions (Préparation Des Solutions (Acides - Basique - Tampons) )Document4 pagesTP Chimie Des Solutions (Préparation Des Solutions (Acides - Basique - Tampons) )Roudaina Benzeguir67% (3)
- TP Formulation Et Dosage de L AspirineDocument2 pagesTP Formulation Et Dosage de L AspirineNassima100% (2)
- 4 Preparation Du SavonDocument7 pages4 Preparation Du SavonChouYa OsNo ratings yet
- FICHE DE TP Eau de JavelDocument3 pagesFICHE DE TP Eau de JavelAbdelhamid ABDENNOURINo ratings yet
- Correction Dosage Javel PDFDocument1 pageCorrection Dosage Javel PDFanon_115085036100% (2)
- Alcalimetrie TP N°4Document4 pagesAlcalimetrie TP N°4Diallo100% (1)
- TP1 Durete EauDocument3 pagesTP1 Durete Eauayoub dahbiNo ratings yet
- Tp4: Modeles Moleculaires: ObjectifsDocument2 pagesTp4: Modeles Moleculaires: Objectifssoufiane souf100% (1)
- Décomposition Du Thiosulfate de SodiumDocument2 pagesDécomposition Du Thiosulfate de SodiumDana Capbun67% (3)
- Des Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide OxaliqueDocument3 pagesDes Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide Oxaliquesidi mohamed el amine nekkalNo ratings yet
- TITRAGEDocument3 pagesTITRAGETahar YahiaouiNo ratings yet
- Compte Rendu TP Chimie en Solution - Copie 2Document11 pagesCompte Rendu TP Chimie en Solution - Copie 2Ennakhla SalmaNo ratings yet
- Chapitre IIIDocument11 pagesChapitre IIIHåmēd Bën MåkhtārįNo ratings yet
- TP 4 Chimie 1Document3 pagesTP 4 Chimie 1joher100% (1)
- Thermodynamique TP n2 Solution Diluees CryometriesDocument11 pagesThermodynamique TP n2 Solution Diluees CryometriesKIAS DjahidNo ratings yet
- Solution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaDocument8 pagesSolution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaKhalil Oukebdane100% (1)
- TP PH Metre ATHIR - New1Document8 pagesTP PH Metre ATHIR - New1samibenhabileNo ratings yet
- Solubilité & Produit de SolubilitéDocument14 pagesSolubilité & Produit de Solubilitésafemind0% (1)
- TP Dosage PH MétriqueDocument2 pagesTP Dosage PH MétriqueAbidine CHAHIR100% (2)
- Conductim PDFDocument4 pagesConductim PDFMokhtarBensaidNo ratings yet
- Esprit de Sel DeboucheurDocument5 pagesEsprit de Sel Deboucheurmeriem elinaNo ratings yet
- TP 6 Conensation AldoliqueDocument8 pagesTP 6 Conensation AldoliqueMaurice ABOURIDANo ratings yet
- Correction To CinetiqueDocument5 pagesCorrection To CinetiquejaywalkNo ratings yet
- TP N4Document4 pagesTP N4abdrahman toubalNo ratings yet
- Compte Rendu TP ChimieDocument6 pagesCompte Rendu TP ChimieLoukmen Biad100% (1)
- TP Chimie 02Document6 pagesTP Chimie 02Rayane BEKKOUCHENo ratings yet
- TP 4 PolarimetrieDocument2 pagesTP 4 PolarimetrieAmina Ben100% (1)
- Applications de la spectrophotomérie en phytochimie: sciencesFrom EverandApplications de la spectrophotomérie en phytochimie: sciencesNo ratings yet
- Chapitre 6 Activité Avancement D'une Réaction Chimique CorrectionDocument3 pagesChapitre 6 Activité Avancement D'une Réaction Chimique Correctionjean06No ratings yet
- 02 TP Cinetique DosagesDocument3 pages02 TP Cinetique Dosagesssg100% (1)
- SUIVI TEMPOREL de L'avancementDocument2 pagesSUIVI TEMPOREL de L'avancementSahbi Mabrouki YamenNo ratings yet
- Plannings TP Des 2nd Jusqu'Aux Grandes VacancesDocument6 pagesPlannings TP Des 2nd Jusqu'Aux Grandes VacancesSerge.Omisos3677No ratings yet
- Histoire de L'informatiqueDocument7 pagesHistoire de L'informatiqueSerge.Omisos3677No ratings yet
- Histoire de L'informatiqueDocument7 pagesHistoire de L'informatiqueSerge.Omisos3677No ratings yet
- Correction Des Exercices Sur Les Réactions Acidos Basiques p83 84Document2 pagesCorrection Des Exercices Sur Les Réactions Acidos Basiques p83 84Serge.Omisos3677No ratings yet
- Correction Des Exercices Sur La 2ème Loi de Newton p137 138Document3 pagesCorrection Des Exercices Sur La 2ème Loi de Newton p137 138Serge.Omisos3677No ratings yet
- TP Mouvement Et ForcesDocument3 pagesTP Mouvement Et ForcesSerge.Omisos3677No ratings yet
- Représentation de Lewis de MoléculesDocument1 pageReprésentation de Lewis de MoléculesSerge.Omisos3677No ratings yet
- 2nd Correction Du Contrôle N°3Document2 pages2nd Correction Du Contrôle N°3Serge.Omisos3677No ratings yet
- Représentation de Lewis de MoléculesDocument1 pageReprésentation de Lewis de MoléculesSerge.Omisos3677No ratings yet
- 1S2 Correction Contrôle N°3Document3 pages1S2 Correction Contrôle N°3Serge.Omisos3677No ratings yet
- MPI Contrôlen°2 CorrectionDocument1 pageMPI Contrôlen°2 CorrectionSerge.Omisos3677No ratings yet
- 05 Lubrification SNRDocument14 pages05 Lubrification SNRAnonymous LfeGI2hM100% (1)
- TP Génie de ProcedésDocument22 pagesTP Génie de ProcedéskaltoumNo ratings yet
- HABITAT 3 Guide Equipt Segpa 2 MAJDocument8 pagesHABITAT 3 Guide Equipt Segpa 2 MAJedysoneNo ratings yet
- 1S TP N 17 Separation D Un Melange Eau AlcoolDocument3 pages1S TP N 17 Separation D Un Melange Eau Alcoolsaber mimiNo ratings yet
- Lme 604Document87 pagesLme 604Seraphin BibaNo ratings yet
- 1 PBDocument30 pages1 PBfreshmendocsNo ratings yet
- Pommade A L'oxyde de ZincDocument2 pagesPommade A L'oxyde de ZincDabi YannNo ratings yet
- Chapitre 01 Securite EnvironnementDocument7 pagesChapitre 01 Securite EnvironnementMAYA OURABAHNo ratings yet
- CXS C04fDocument3 pagesCXS C04fمولاي أمحمد عكرميNo ratings yet
- Liste Des Analyses D'eau PiscineDocument3 pagesListe Des Analyses D'eau PiscinemouradNo ratings yet
- Technique de Maintenance Des Postes THTDocument95 pagesTechnique de Maintenance Des Postes THTKamel NaitNo ratings yet
- La Société CancérigèneDocument17 pagesLa Société CancérigènealfahadjiNo ratings yet
- SALMIM - MERBAHS.AMIRY.1 Céréales PDFDocument87 pagesSALMIM - MERBAHS.AMIRY.1 Céréales PDFVaio SonyNo ratings yet
- Project Microbiologie IreDocument22 pagesProject Microbiologie IreDaniela Gologan100% (2)
- TP Chimie S1Document58 pagesTP Chimie S1François Adolphe50% (2)
- Les EmpreintesDocument56 pagesLes EmpreintesLina Ray Ben100% (7)
- Cat Electronic Technician 2017B v1.0 État: Paramètre ValeurDocument2 pagesCat Electronic Technician 2017B v1.0 État: Paramètre ValeursemahNo ratings yet
- Laisson Chimiques SMPC S2Document37 pagesLaisson Chimiques SMPC S2Saidi AbdelghaniNo ratings yet
- Synth Simple MDADocument2 pagesSynth Simple MDAwillyp31eNo ratings yet
- Proprietes Des MateriauxDocument14 pagesProprietes Des Materiauxlamia temmoucheNo ratings yet
- Coours D'hydralique ESMGDocument17 pagesCoours D'hydralique ESMGGedehon KOUADIONo ratings yet
- Chimie PharmaceutiqueDocument65 pagesChimie PharmaceutiqueLoïc GarveyNo ratings yet
- 18chi3e E2Document4 pages18chi3e E2Fouad MihoubNo ratings yet
- 4) Mesures D'épaisseur À ChaudDocument12 pages4) Mesures D'épaisseur À Chaudmody kamissokoNo ratings yet
- MP FP END 0024 UT Travaux Dirigés 2009 PDFDocument39 pagesMP FP END 0024 UT Travaux Dirigés 2009 PDFgueridiNo ratings yet
- Transformateur de PuissanceDocument25 pagesTransformateur de PuissanceSidiNo ratings yet
- Chap 3 2020Document24 pagesChap 3 2020JakeNo ratings yet
- Chapitre 10 Structure Et Polarité d' Une MoléculeDocument2 pagesChapitre 10 Structure Et Polarité d' Une MoléculeElouan Berthome LavignotteNo ratings yet
- PhonochirurgieDocument24 pagesPhonochirurgieLuc DucrouxNo ratings yet
- Ecologie, Agronomie Et TerritoiresDocument11 pagesEcologie, Agronomie Et TerritoiresLe MondeNo ratings yet