Professional Documents
Culture Documents
ManualElectro2a PDF
Uploaded by
Carlos Huitron RiosOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
ManualElectro2a PDF
Uploaded by
Carlos Huitron RiosCopyright:
Available Formats
INSTITUTO POLITCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGA
MANUAL PARA LABORATORIO DE
ELECTROQUMICA II
AUTOR:
M. en C. Juan Ramrez Balderas
CONTENIDO
Prctica 1 2
Nombre SOLUCIONES REGULADORAS OXIDORREDUCCIN Y ACIDEZ. DIAGRAMA EI EN FUNCIN DEL pH. OXIDORREDUCCIN Y PRECIPITACIN. DETERMINACIN DE Cu(II). OBTENCIN DE I2 POR ELECTRLISIS DE KI VALORACIONES CONDUCTIMTRICAS VALORACIONES POTENCIOMTRICAS POLAROGRAFA I. DOMINIO DE ELECTROACTIVIDAD POLAROGRAFA II. INFLUENCIA DE LA CONCENTRACIN EN LA CORRIENTE LMITE
Pg. 1 5
11
4 5 6 7 8
16 20 27 31 35
Manual de Prcticas de Electroqumica II
PRCTICA No. 1
SOLUCIONES REGULADORAS
1. OBJETIVOS. Determinar que el potencial de una disolucin que contiene al par conjugado Fe3+/Fe2+ permanece prcticamente constante con la adicin de un oxidante enrgico como es el Ce4+.
2. FUNDAMENTOS. La relacin entre el potencial de oxidorreduccin (E) de algn par dado y las concentraciones correspondientes a las formas oxidada (Ox) y reducida (Red) se expresa por la ecuacin de Nernst: E = E0 + donde: E es el potencial normal del par dado. R es la constante universal de los gases. T es la temperatura a condiciones normales. F es la constante de Faraday. n es el nmero de electrones que intervienen en la reaccin de oxidorreduccin. Sustituyendo los valores numricos de las constantes y pasando de logaritmos naturales a logaritmos decimales, obtenemos: E = E0 + 0.06 [Ox ] log n [Re d] (2) RT [Ox ] ln nF [Re d] (1)
As, el potencial de oxidorreduccin de una disolucin que contiene al oxidante y al reductor conjugados esta dado por la ecuacin (2). Una solucin de este tipo, que contiene a la vez al oxidante y al reductor conjugados, se llama solucin reguladora ( solucin tampn). La adicin a esta disolucin reguladora de un oxidante o de un reductor que de lugar a una variacin relativamente grande de la [Ox ] relacin hace cambiar poco el potencial oxidorreductor. Se dice entonces [Re d] que la disolucin est tamponada ( regulada) en lo que se refiere al potencial.
Manual de Prcticas de Electroqumica II
Estas disoluciones, que contienen al mismo tiempo al oxidante y al reductor conjugados, permiten fijar prcticamente el potencial de oxidorreduccin en un valor determinado.
3. CUESTIONARIO Y EJERCICIOS PREVIOS. 3.1 Realizar los clculos para preparar las siguientes disoluciones. a) 100 mL de H2SO4 1 M (pureza 97.7%, densidad 1.84 g/mL). b) 25 mL de una mezcla de Fe(NH4)2(SO4)2.6H2O (sulfato ferroso amoniacal) y Fe2(SO4)3. en concentracin 0.1 M cada uno en cido sulfrico 1 M. c) 50 mL de (NH4)4Ce(SO4)4.2H2O (sulfato de cerio amoniacal) 0.1 M en cido sulfrico 1 M. 3.2 Investigar como se clasifican los indicadores utilizados en las valoraciones de oxidorreduccin. 3.3 La o-fenantrolina ferrosa es un indicador redox cuyo equilibrio de transferencia electrnica se puede representar por la siguiente reaccin: InOx + 1edonde: InOx es la forma oxidada indicador (ofenantrolina frrica) InRed es la forma reducida del indicador (ofenantrolina ferrosa) a) Investigar el potencial de vire del indicador. b) Cul es el color del complejo de la ofenantrolina ferrosa y cul es el color del complejo de la ofenantrolina frrica? 3.4 Se tiene una solucin que contiene una sal frrica y una sal ferrosa, ambas en concentracin 1 M. a) Se adiciona Cr2+ (reductor) en cantidad tal que la concentracin total de ste reductor es 10-1 M. Cul es la reaccin que se lleva acabo? Cul es el potencial de la disolucin despus de que se verific la reaccin? b) A la solucin original se le adiciona Ce4+ (oxidante) en cantidad tal que la concentracin total de ste oxidante es 10-1 M. Cul es la reaccin que se lleva a cabo? Cul es el potencial de la disolucin despus que se verific la reaccin? 3.5 Elaborar un diagrama de flujo donde se indique la secuencia experimental. InRed
qe
Manual de Prcticas de Electroqumica II
4. DESARROLLO EXPERIMENTAL.
4.1 Material y Equipo. 4 Matraces erlenmayer de 125 mL 2 Pipetas volumtricas de 10.00 mL 1 Matraz volumtrico de 50.00 mL 1 Matraz volumtrico de 25.00 mL 1 Matraz volumtrico de 100.00 mL 1 Probeta de 25 mL 1 Bureta de 25.00 mL 1 Soporte universal 1 Pinzas para bureta 1 Piceta
4.2 Reactivos. Disolucin de cido sulfrico 1 M. Disolucin de sulfato de cerio amoniacal 0.1M en cido sulfrico 1 M. Mezcla de Fe2(SO4)3 y de sulfato ferroso amoniacal en cido sulfrico 1 M. Disolucin de o-fenantrolina ferrosa. Agua destilada.
4.3 Secuencia Experimental. 4.3.1 Valoracin de la solucin no regulada. a) Llenar la bureta de 25.00 mL con la solucin de sulfato de cerio amoniacal y ajustarla a 0.00 mL. b) Tomar una alcuota de 10.00 mL de H2SO4 1 M y transferirla a un matraz erlenmayer de 125 mL. c) Adicionar 20 mL de agua destilada y una o dos gotas de o-fenantrolina ferrosa. d) A la solucin resultante agregar gota a gota sulfato de cerio amoniacal hasta el cambio de color. Anotar el volumen en el punto de equivalencia. (cambio de tonalidad del indicador). e) Repetir dos veces ms la secuencia experimental. 4.3.2 Valoracin de la solucin regulada. a) Tomar una alcuota de 10.00 mL de la mezcla de sulfato ferroso amoniacal y sulfato frrico y transferirla a un matraz erlenmayer de 125 mL. b) Adicionar 20 mL de agua destilada y una o dos gotas de o-fenantrolina ferrosa.
3
Manual de Prcticas de Electroqumica II
c) A la solucin resultante agregar gota a gota sulfato de cerio amoniacal hasta el cambio de color. Anotar el volumen en el punto de equivalencia. (cambio de tonalidad del indicador). d) Repetir dos veces ms la secuencia anterior.
5. Resultados Experimentales. 5.1 Cul fue el volumen gastado de sulfato de cerio amoniacal en la solucin no regulada y en la solucin regulada?. 5.2 Por qu el indicador redox (o-fenantrolina ferrosa) cambi de su forma reducida a su forma oxidada?. 5.3 Cul es el potencial que se requiere para que el indicador redox (ofenantrolina ferrosa) cambie de su forma reducida a su forma oxidada?. 5.4 Cul es la reaccin que se verifica cuando se adiciona el sulfato de cerio amoniacal a la solucin reguladora?. 5.5 Cul es la reaccin que experimenta la o-fenantrolina ferrosa cuando se alcanza el punto de equivalencia en la solucin no regulada y la solucin regulada?. 5.6 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA. 6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Harris D.C., Anlisis Qumico Cuantitativo, 3 edicin, Editorial Iberoamrica S. A. de C.V., 1992, Mxico, D.F., 886 pginas. 6.4 Skoog D.A., West D.M., Holler F.J., Qumica Analtica, 6 edicin, Editorial McGraw-Hill/Interamericana de Mxico, 1995, Mxico, D.F., 612 pginas.
Manual de Prcticas de Electroqumica II
PRCTICA No. 2
DIAGRAMA DE POTENCIAL ESTNDAR CONDICIONAL EN FUNCIN DEL pH DEL SISTEMA OXIDORREDUCTOR QUINONA/HIDROQUINONA OXIDORREDUCCIN Y ACIDEZ
1. OBJETIVOS. Trazar la curva experimental de potencial estndar condicional (E0 )en funcin del pH para el sistema oxidorreductor quinona/hidroquinona (Q/Q2-).
2. FUNDAMENTOS. Los sistemas redox que se establecen durante el proceso de transferencia electrnica donde intervienen especies orgnicas e inorgnicas tienen un potencial caracterstico en condiciones estndar. Este parmetro fisicoqumico, con un valor nico se denomina potencial estndar termodinmico (E). Los protones del medio pueden participar antes, durante y despus del proceso de transferencia electrnica protonando el sustrato, al intermediario o al producto, respectivamente. En cada uno de estos sistemas, el potencial es una funcin de la actividad qumica de los iones hidrnio en el medio, que a su vez se relaciona con un valor numrico de pH. El potencial recibe el nombre de potencial normal condicional E0 y su valor depende de las condiciones que prevalecen en el medio. En el proceso de transferencia electrnica intervienen especies electroactivas que son capaces de participar en dichos procesos obtenindose los reductores o los oxidantes conjugados, esta transferencia electrnica se puede realizar en forma qumica, electroqumica o biolgica. Existen en gran nmero de sustratos electroactivos con importancia biotecnolgica, tales como los antioxidantes, vitaminas, quinonas y especies metlicas. Las quinonas son compuestos sintticos o naturales con gran versatilidad qumica, electroqumica y/o biolgica. Generalmente, las quinonas pueden comportarse como antioxidantes por lo que la reduccin de las mismas se puede realizar utilizando mtodos qumicos, electroqumicos o biolgicos, si se considera como ejemplo especfico a la quinona, esta se puede reducir totalmente para producir la hidroquinona de acuerdo al siguiente equilibrio:
Manual de Prcticas de Electroqumica II
:O : OH +2e _ +2H +
:O : Q uinona (Q )
OH Hidroquinona (H2Q )
que simplificaremos por: Q + 2H+ + 2e- qe H2Q (1)
Por lo que el potencial del sistema esta dado por la ecuacin de Nernst de acuerdo a la siguiente relacin: 0.06 [Q][H + ] 2 E=E + log n [H 2 Q]
0
(2)
donde: E es el potencial del sistema oxidorreductor quinona/hidroquinona E es el potencial estndar del sistema oxidorreductor quinona/hidroquinona n es el nmero de electrones transferidos. La reduccin total de la quinona tiene lugar en medios prticos y polares obtenindose la hidroquinona, que es el reductor conjugado de la quinona.
3. PREGUNTAS Y EJERCICIOS PREVIOS. 3.1 Investigar las constantes de acidez del cido oxlico, cido ctrico, cido brico, cido fosfrico y cido carbnico. 3.2 Realizar los clculos para preparar las siguientes disoluciones: a) 50 mL de cido oxlico 0.1 M b) 100 mL de cido ctrico 0.1 M c) 50 mL de cido brico 0.1 M d) 200 mL de NaH2PO4H2O 0.1 M e) 100 mL de NaHCO3 0.1 M f) 250 mL de HCl 0.3 M
Manual de Prcticas de Electroqumica II
g) 250 mL de NaOH 0.3 M h) 25 mL de quinidrona (mezcla equimolar de quinona e hidroquinona) 10-1 molar. 3.3 Trazar el diagrama de potencial estndar condicional (E0 )en funcin del pH para el sistema oxidorreductor quinona/hidroquinona (E0 = 0.06 V, pKa1 = 10, pKa2 = 11.5). 3.4 Calcular el pH de las siguientes disoluciones: a) cido oxlico 0.1 M b) cido ctrico 0.1 M c) cido brico 0.1 M d) NaH2PO4H2O 0.1 M e) NaHCO3 0.1 M 3.5 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL. 4.1 Material y Equipo. 4 Matraces volumtricos de 25.00 mL 2 Matraces volumtricos de 50.00 mL 2 Matraces volumtricos de 100.00 mL 2 Matraces volumtricos de 200.00 mL 2 Matraces volumtricos de 250.00 mL 14 Vasos de precipitados de 50 mL 1 Pipeta volumtrica de 1.00 mL 1 Electrodo combinado para medir pH 1 Electrodo de referencia (Ag/AgCl) 1 Electrodo indicador (Pt) 1 Potencimetro 4.2 Reactivos. Disolucin de cido oxlico 0.1 M Disolucin de cido ctrico 0.1 M Disolucin de cido brico 0.1 M Disolucin de NaH2PO4H2O 0.1 M Disolucin de NaHCO3 0.1 M Disolucin de HCl 0.3 M Disolucin de NaOH 0.3 M Disolucin de quinidrona 10-1 M Disolucin reguladora de pH 7 y pH 4.
Manual de Prcticas de Electroqumica II
4.3 Secuencia Experimental.
Preparacin de las soluciones reguladores de pH 1 y 2. a) Tomar 25 mL de cido oxlico 0.1 M y colocarlos en un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota HCl 0.3 M hasta que el pH de la solucin sea igual a 1. b) Tomar 25 mL de cido oxlico a 0.1 M y colocarlos en un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 2. Prepracin de las soluciones reguladoras de pH 3, 4, 5 y 6. c) Tomar 25 mL de cido ctrico 0.1 M y colocarlos en un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 3. d) Repetir el inciso c) para obtener soluciones de pH 4, 5 y 6. Preparacin de las soluciones reguladoras de pH 7 y 8. e) Tomar 25 mL de NaH2PO4 0.1 M y transferirlos a un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 7. f) Repetir el inciso e) para obtener una solucin de pH 8. Preparacin de las soluciones reguladoras de pH 9 y 10. g) Tomar 25 mL de cido brico 0.1 M y transferirlos a un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 9. h) Repetir el inciso g) para una solucin de pH 10. Preparacin de las soluciones reguladoras de pH 10.2, 10.4, 10.6 y 10.8. i) Tomar 25 mL de NaHCO3 0.1 M y transferirlos a un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 10.2. j) Repetir el inciso i) para obtener soluciones de pH 10.4, 10.6 y 10.8. Preparacin de las soluciones reguladoras de pH 11, 11.2 y 11.4.
Manual de Prcticas de Electroqumica II
k) Tomar 25 mL de NaH2PO4 0.1 M y transferirlos a un vaso de precipitados de 50 mL, introducir el electrodo combinado y medir el pH de la solucin. Adicionar gota a gota NaOH 0.3 M hasta que el pH de la solucin sea igual a 11. l) Repetir el inciso k) para obtener soluciones de pH 11.2 y 11.4. Determinacin del potencial de las soluciones de quinhidrona a diferentes valores de pH. m) Tomar una alcuota de 1.00 ml de quinhidrona y transferirla a un matraz volumtrico de 25.00 mL. Adicionar hasta la marca la solucin reguladora de pH igual 1. Introducir los electrodos de platino y Ag/AgCl para leer el potencial de la solucin y registrar su valor. n) Repetir el inciso m) para soluciones reguladoras de pH 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 10.2, 10.4, 10.6, 10.8, 11, 11.2 y 11.4.
5. RESULTADOS EXPERIMENTALES. 5.1 Llenar la siguiente tabla de acuerdo a los datos obtenidos en los incisos 4.3 m) y 4.3 n). pH 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 E (mV) pH 10.00 10.20 10.40 10.60 10.80 11.00 11.20 11.40 E (mV)
5.2 En una hoja de papel milimtrico representar grficamente la curva de potencial estndar condicional en funcin del pH. 5.3 Determinar la pendiente de la parte lineal de la curva. 5.4 Determinar el valor experimental del potencial estndar del sistema quinona/hidroquinona. 5.5 Determinar el nmero de protones que participan en el equilibrio. 5.6 Obtener las conclusiones pertinentes.
Manual de Prcticas de Electroqumica II
6. BIBLIOGRAFA. 6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Snchez-Batanero P. Qumica Electroanaltica Fundamentos y Aplicaciones, 1 edicin, Editorial Alhambra, S.A., 1981, Madrid, Espaa, 345 pginas.
10
Manual de Prcticas de Electroqumica II
PRCTICA No. 3
DETERMINACIN DE Cu2+ OXIDORREDUCCIN Y PRECIPITACIN
1. OBJETIVOS. 1.1 Determinar que un equilibrio de precipitacin modifica el potencial de un par oxidorreductor. 1.2 Observar que la determinacin volumtrica de Cu2+ se basa en la modificacin del potencial redox del par Cu2+/Cu+ debido a la precipitacin de CuI(s).
2. FUNDAMENTOS. La modificacin de las propiedades oxidorreductoras debido a la formacin de compuestos poco solubles es un fenmeno que se presenta cuando se ponen en juego la oxidorreduccin y la precipitacin. La precipitacin del oxidante o del reductor al estado de sal, da lugar a su desaparicin de la disolucin y a que las propiedades reductoras u oxidantes de la especie conjugada se vean reforzadas. De esta manera, para el equilibrio oxidorreductor (1) el potencial del sistema esta dado por la ecuacin de Nernst de acuerdo a la relacin (2). Ox + ne- qe Red
0 E = E Ox / Re d +
(1) (2)
0.06 [Ox ] log n [Re d]
Si el reductor forma compuestos poco solubles con el agente precipitante X, de acuerdo al equilibrio (3), el potencial del sistema oxidorreductor aumentar, provocando que las propiedades oxidantes de la especie Ox se vean reforzadas (Fig. 1). Red + X RedX(S) donde: X es el agente precipitante RedX(S) es el precipitado La constante del producto de solubilidad queda definida por:
11
(3)
Manual de Prcticas de Electroqumica II
Ks = [Red] [X] donde: Ks [Red] [X] es la constante del producto de solubilidad es la concentracin del agente reductor es la concentracin del agente precipitante
(4)
Ox Red Ox RedX(s)
E0(V) E (V)
0
Posicin inicial del par redox
Posicin final del par redox
E0Ox/RedX(s) > E0Ox/Red
Figura 1. Modificacin del potencial del sistema Ox/Red cuando el reductor forma compuestos poco solubles.
El equilibrio resultante de transferencia de electrones esta dado por la reaccin (5) y el potencial del sistema queda representado por la ecuacin (6). Ox + X + ne- RedX(S)
0 E = E Ox / Re dX( S ) +
(5)
0.06 log[Ox ][ X] n
(6)
La magnitud del potencial estndar del par Ox/RedX(S) depende del potencial estndar del par Ox/Red y del valor del producto de solubilidad y esta dado por la ecuacin (7) que resulta de la combinacin de las ecuaciones (2) (4) y (6).
0 0 E Ox / Re dX( S ) = E Ox / Re d +
0.06 pKs n
(7)
3. CUESTIONARIO Y EJERCICIOS PREVIOS.
3.1 Realizar los clculos para preparar las siguientes disoluciones: a)100 mL de Na2S2O35H2O 0.05 M. b) 25 mL de CuSO4 0.05 M.
12
Manual de Prcticas de Electroqumica II
c) 10 mL de almidn al 0.1% en peso. d) 25 mL de KI al 30% en peso. e) 10 mL de H2SO4 1 M. 3.2 Investigar el mtodo para estandarizar una solucin de tiosulfato de sodio. 3.3 Investigar los potenciales estndar de los siguientes pares oxidorreductores: Cu2+/Cu+ y I2/I-. 3.4 Tomando en cuenta las magnitudes de los potenciales estndar de los pares Cu2+/Cu+ y I2/I-. Cul es la reaccin espontnea entre estas especies?. Determinar su constante de equilibrio. 3.5 Investigar el valor del producto de solubilidad de CuI(S). 3.6 Deducir la ecuacin 7. 3.7 Se cuenta con una disolucin que contiene al oxidante Cu2+ y se adiciona KI en exceso. Determinar el potencial estndar del par Cu2+/CuI(S) 3.8 Considerando las magnitudes de los potenciales estndar de los pares Cu2+/CuI(S) y I2/I-. Cul es la reaccin espontnea entre estas especies?. Determinar su constante de equilibrio. 3.9 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL. 4.1 Material y Equipo.
3 Matraces erlenmeyer de 125 mL 1 Pipeta volumtrica de 5.00 mL 1 Pipeta graduada de 1 mL 1 Pipeta graduada de 10 mL 1 Matraz volumtrico de 100.00 mL 2 Matraces volumtricos de 25.00 mL 1 Matraz volumtrico de 10.00 mL 3 Vasos de precipitados de 50 mL 1 Bureta de 25.00 mL 1 Soporte universal 1 Pinzas para bureta 1 Piceta 1 Esptula 1 Perilla de succin Papel aluminio
13
Manual de Prcticas de Electroqumica II
4.2 Reactivos.
Disolucin de tiosulfato de sodio 0.05 M. Disolucin de CuSO4 0.05 M. Disolucin de KI al 30% en peso. Disolucin de almidn al 0.1% en peso (indicador). Disolucin de H2SO4 1 M.
4.3 Secuencia Experimental. a) Llenar la bureta de 25.00 mL con la solucin de tiosulfato de sodio y ajustarla a 0.00 mL. b) Tomar una alcuota de 5.00 mL de sulfato de cobre a un matraz erlenmeyer de 125 mL y agregar 10 mL de agua destilada. c) Adicionar 1 mL de H2SO4 1 M y 5 mL de KI al 30% en peso. d) Cubrir el matraz completamente con papel alumnio y colocarlo en la oscuridad derante 5 minutos. e) A continuacin se titula la disolucin resultante con Na2S2O3. La adicin de tiosulfato de sodio se realiza gota a gota hasta que la solucin adquiera un color amarillo claro. f) Adicionar 2 mL del indicador de almidn y continuar con la adicin de tiosulfato de sodio hasta el cambio de color (de azul a incoloro). Anotar el volumen gastado. g) Repetir dos veces ms el procedimiento anterior.
5. RESULTADOS EXPERIMENTALES.
5.1 Escribir la reaccin que se verifica cuando se adiciona la solucin de KI a la solucin de Cu2+. 5.2 Escribir la reaccin que se verifica cuando se adiciona Na2S2O3 a la solucin resultante de la mezcla anterior. 5.3 Escribir en forma de tabla el volumen gastado de Na2S2O3 en la valoracin. 5.4 Determinar las moles de Na2S2O3 necesarias para alcanzar el punto de equivalencia. 5.5 Determinar las moles de Cu2+ presentes en la alcuota de 5.00 mL. 5.6 Determinar la concentracin de la disolucin de Cu2+. 5.7 Obtener las conclusiones pertinentes.
14
Manual de Prcticas de Electroqumica II
6. BIBLIOGRAFA.
6.1 Alexiev V.N., Anlisis Cuantitativo, 1 edicin, Editorial Mir Mosc, URSS, 519 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.3 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.4 Harris D.C., Anlisis Qumico Cuantitativo, 3 edicin, Editorial Iberoamerica S. A. de C.V., 1992, Mxico, D.F., 886 pginas. 6.5 Skoog D.A., West D.M., Holler F.J., Qumica Analtica, 6 edicin, Editorial McGraw-Hill/Interamericana de Mxico, 1995, Mxico, D.F., 612 pginas.
15
Manual de Prcticas de Electroqumica II
PRCTICA No. 4
OBTENCIN DE I2 POR ELECTROLISIS DE KI
1. OBJETIVOS.
1.1 Obtener I2 por medio de la electrlisis de una solucin de KI. 1.2 Determinar la cantidad de KI electrolizada y la cantidad de I2 obtenida aplicando las leyes de Faraday.
2. FUNDAMENTOS
La reacciones de oxidorreduccin implican la transferencia de electrones desde un tomo o grupo de tomos a otro tomo o grupos de tomos. Esta transferencia puede lograrse por medio de un agente externo, es decir, un agente que sea capaz de suministrar electrones. Este agente externo puede ser un dispositivo que proporcione corriente continua (pila seca, batera de automvil, etc.). Las reacciones de transferencia de electrones que se llevan a cabo por medio de un agente que proporciona corriente continua se conocen con el nombre de reacciones electroqumicas. Las reacciones electroqumicas se producen siempre asociadas a un proceso llamado electrlisis, para lo cual se necesita un montaje con los siguientes elementos: a) Una celda de electrlisis con la solucin a electrolizar. b) Los electrodos (nodo y ctodo) deben ser qumicamente inertes (como el platino, el carbono, etc). c) Un generador elctrico, que constituye la fuente de corriente o de voltaje necesaria para la realizacin de la electrlisis. Para conocer la cantidad de electricidad que se requiere para que se verifique una reaccin electroqumica se utilizan las conocidas Leyes de Faraday, las que establecen que, cuando tiene lugar una reaccin electroqumica, de reduccin, por ejemplo, tal como: Ox + ne- Red (1)
siendo Ox un catin metlico en solucin, debe cumplirse que el nmero de moles de ese catin que ha sido reducido es proporcional a la cantidad de electricidad que se ha puesto en juego e inversamente proporcional al nmero de electrones intercambiados por el in metlico y a una magnitud constante llamada constante de Faraday y simbolizada por F.
16
Manual de Prcticas de Electroqumica II
N= Donde:
Q nF
(2)
N es el nmero de moles que reaccionan. Q es la cantidad de electricidad puesta en juego, en Coulombios. n es el nmero de electrones. F es el Faraday 96500 Coulombios/mol. Puesto que la cantidad de electricidad (Q) esta dada por el producto de la corriente (en amperes) y el tiempo (en segundos) se puede escribir: N= Que reacomodando queda: Q = It = NnF (4) It nF (3)
3. CUESTIONARIOS Y EJERCICIOS PREVIOS.
3.1 Investigar el potencial estndar del par oxidorreductor I2/I-. 3.2 Realizar los clculos necesarios para preparar las siguientes disoluciones: a) 100 mL de KI al 0.6 M. b) 250 mL de tiosulfato de sodio 0.01 M. c) 25 mL de almidn al 0.1% en peso. 3.3 De acuerdo con las leyes de Faraday determinar las moles de KI que se electrolizan cuando se usa una pila seca de 1.5 V y 3 miliamperes para un tiempo de electrlisis de: 5, 10, 15, 20, 25 y 30 minutos. 3.4 Determinar los moles de I2 que se obtendrn cuando se usa una pila seca de 1.5 V y 3 miliamperes en la electrolisis de KI para un tiempo de: 5, 10, 15, 20, 25 y 30 minutos. 3.5 Determinar el potencial que se debe imponer a una solucin de KI de concentracin inicial 0.6 M para electrolizar el 99.9% del KI y quede sin electrolizar el 0.1% de KI. 3.6 Para la realizacin de esta prctica los alumnos traern 2 pilas secas por equipo. 3.7 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
17
Manual de Prcticas de Electroqumica II
4. PARTE EXPERIMENTAL. 4.1 Material y equipo.
2 vasos de precipitados de 150 mL 2 matraces erlenmeyer de 250 mL 1 matraz volumtrico de 100 mL 1 bureta de 25 mL 1 probeta de 25 mL 1 pipeta graduada de 1 mL 1 vaso de precipitados de 50 mL 1 pinzas para bureta 1 soporte universal 1 parrilla de agitacin 2 pilas secas (las traern los alumnos) 1 agitador magntico 2 electrodos de grafito 2 trozos de alambre de cobre
4.2 Reactivos.
Disolucin de KI 0.6 M Disolucin de tiosulfado de sodio 0.01 M. Disolucin de almidn al 0.1% (Indicador).
4.3 Secuencia experimental.
a) Medir 100 mL de KI 0.6 M y colocarlos en un vaso de precipitados de 150 mL adicionar la barra magntica y colocar la placa de agitacin. b) Introducir los electrodos de carbono (los cuales deben hacer contacto elctrico con la pila seca por medio de un alambre de cobre) a la solucin de KI para permitir el proceso de electrlisis durante 5 minutos. El tiempo se registra desde que los electrodos son introducidos a la solucin. c) Llenar la bureta con la solucin de tiosulfato de sodio. d) Una vez transcurrido el tiempo de electrlisis valorar la solucin adicionando gota a gota la solucin de tiosulfato de sodio, hasta que la coloracin pase de un color caf a un color amarillo claro. e) Adicionar un ml del indicador de almidn y continuar con la valoracin hasta el cambio de color de azul a incoloro. f) Registrar el valor del volumen gastado del tiosulfato de sodio en el punto de equivalencia.
18
Manual de Prcticas de Electroqumica II
g) Repetir el procedimiento anterior para los siguientes tiempos de electrlisis 10, 15, 20, 25 y 30 minutos.
5. RESULTADOS EXPERIMENTALES.
5.1 Registrar el volumen de tiosulfato de sodio gastado en cada uno de los tiempos de electrlisis de acuerdo a la siguiente tabla Tiempo (min.) 5 10 15 20 25 30 5.2 Determinar la cantidad de electricidad aplicada a la solucin en cada tiempo de electrlisis (considere que la pila seca proporciona una corriente de 3 mA). 5.3 Determinar moles de I2 producidos para cada tiempo de electrlisis. 5.4 Determinar moles de KI electrolizados para cada tiempo de electrlisis. 5.5 Trazar la grfica Q en funcin de los moles de I- electrolizados. 5.6 Determinar el nmero de electrones que se transfieren en la reaccin de electrlisis. 5.7 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA.
mL de Na2S2O3 gastados
Moles de I2 producidos
Moles de KI electrolizados
Q aplicada (coulomb)
6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Snchez-Batanero P. Qumica Electroanaltica Fundamentos y Aplicaciones, 1 edicin, Editorial Alhambra, S.A., 1981, Madrid, Espaa, 345 pginas. 6.4 Vassos B.H., Ewing G. W., Electroqumica Analtica, 1 edicin, Editorial Limusa, S. A. de C.V., 1987, Mxico, D. F., 303 pginas.
19
Manual de Prcticas de Electroqumica II
PRCTICA No. 5
VALORACIONES CONDUCTIMTRICAS
1. OBJETIVOS.
1.1 Determinar las curvas de valoracin conductimtricas de un cido fuerte con una base fuerte y de una mezcla de dos cidos (fuerte y dbil) con una base fuerte. 1.2 Determinar con precisin el punto final de una valoracin conductimtrica de un cido fuerte con una base fuerte y de una mezcla de dos cidos (fuerte y dbil) con una base fuerte.
2. FUNDAMENTOS.
La conductancia electroltica es una medida de la amplitud de una solucin para permitir el paso de corriente elctrica. Las soluciones de electrolitos conducen la corriente elctrica por la migracin de los iones bajo la influencia de un gradiente de potencial. Al igual que un conductor metlico las soluciones de electrolitos obedecen la ley de Ohm, por lo tanto, el recproco de la resistencia electroltica se denomina conductancia y se expresa en mhos o siemens. L= 1 R (1)
donde: L es la conductancia expresada en mhos o siemens. R es la resistencia de la solucin electroltica en Ohms. La conductancia observada de una disolucin que se encuentra entre dos electrodos de lminas de platino paralelos uno a otro, depende inversamente de la distancia entre electrodos y directamente de su rea.
A L = k d (2)
donde: d es la distancia entre electrodos en cm. A es el rea de los electrodos en cm2. k es la conductancia especfica denominada conductividad. Se define como el recproco de la resistividad en mhoscm-1.
20
Manual de Prcticas de Electroqumica II
Para una celda conductimtrica dada con electrodos fijos, la relacin d/A es una constante llamada constante de celda y se representa por . La ecuacin (2) queda entonces: L= k (3)
En conductimetra, las aplicaciones analticas dependen de la relacin entre la conductividad y la concentracin de los diversos iones presentes en la solucin, resultando como consecuencia la conductividad equivalente: = donde: k N (4)
es la conductividad equivalente en mhosLcm-1eq-1 N es la concentracin en eq/L.
La conductividad equivalente tambin se puede expresar segn:
=
1000 k N
(5)
donde: k es la conductividad en mhoscm-1. N es la concentracin de los iones en solucin en eq/L. es la conductividad equivalente en mhoscm2eq-1. A dilucin infinita los iones tericamente son independientes entre s y cada in contribuye a la conductividad equivalente total; por lo tanto:
= 0+ + 0
(6)
donde:
es la conductividad equivalente a dilucin infinita.
y 0 son las conductividades equivalentes inicas de cationes y aniones a dilucin infinita, respectivamente.
0 +
Si experimentalmente trabajamos a concentraciones diluidas entonces:
= (0+ + 0 )
(7)
sustituyendo (3) y (7) en (5) y reordenando se tiene finalmente:
21
Manual de Prcticas de Electroqumica II
N (0+ + 0 ) 1000
(8)
Las valoraciones.
La medicin de la conductividad de una disolucin en el transcurso de una valoracin permite determinar el punto final de la valoracin. En particular la determinacin del punto final por medicin conductimtrica es usado en disoluciones muy diluidas. Por ejemplo las valoraciones de cidos y bases cuya deteccin es difcil por medicin potenciomtrica del pH pueden efectuarse por el mtodo conductimtrico. Las valoraciones de formacin de complejos solubles e insolubles pueden efectuarse conductimtricamente y as evitar el uso de electrodos selectivos de iones los cuales requieren condiciones de operacin ms estrictas. En general el punto final de las valoraciones de oxido-reduccin no se puede determinar por conductimetra ya que los medios de reaccin necesarios para asegurar una buena cuantitatividad requieren que la reaccin se lleve acabo en presencia de medios cidos concentrados. En stos casos la alta concentracin y la movilidad del in H+, no permite diferenciar los cambios en la conductividad de los iones de inters durante la valoracin.
3. CUESTIONARIO Y EJERCICIOS PREVIOS.
3.1 Realizar los clculos para preparar las siguientes disoluciones: a) 100 mL de HCl 0.1 M (Pureza 36%, densidad = 1.21 g/mL). b) 100 mL de una mezcla de HCl y CH3COOH, ambos en concentracin 0.1M (densidad del cido actico = 1.05 g/mL, pureza = 99%). c) 500 mL de NaOH 0.1M. 3.2 Investigar las conductividades equivalentes inicas a dilucin infinita de las siguientes especies H+, Na+, OH- y CH3COO-. 3.3 Esquematizar la forma de la curva de valoracin conductimtrica de un cido fuerte con una base fuerte. 3.4 Escribir la reaccin que se verifica para los siguientes casos: a) El cido clorhdrico y el hidrxido de sodio. b) El cido actico y el hidrxido de sodio. 3.5 Establecer el cuadro de variacin de concentraciones para la valoracin de: a) HCl con NaOH. b) Una mezcla de HCl y CH3COOH con NaOH.
22
Manual de Prcticas de Electroqumica II
3.6 Describir el principio de funcionamiento de una celda conductimtrica. 3.7 Investigar que tipo de valoraciones cido-base son difciles de realizar por medicin del pH 3.8 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL.
4.1 Material y equipo. 1 probeta de 50 mL 1 probeta de 25 mL 1 pipeta volumtrica de 10 mL 1 bureta de 25 mL 1 agitador magntico 1 placa de agitacin 1 pinza para bureta 1 celda conductimtrica 1 conductmetro papel absorbente para secar la celda. 1 jeringa 1 soporte universal 1 piceta
4.2 Reactivos. Solucin de HCl de concentracin 0.1 M Mezcla de cidos en solucin (HCl y CH3COOH en concentracin 0.1 M c/u). Solucin estandarizada de NaOH 0.1M
23
Manual de Prcticas de Electroqumica II
4.3 Secuencia experimental. Valoracin de un cido fuerte con una base fuerte.
Bureta con NaOH
celda
Conductmetro
probeta
Placa de agitacin Fig. 1 Sistema para medir conductancia.
a) Montar el dispositivo de la figura 1. b) Tomar una alcuota de 10.00 mL de disolucin de HCl de concentracin desconocida y transferirla a una probeta de 50 mL. c) Adicionar 10 mL de agua desionizada. d) Conectar el conductmetro e) Introducir a la probeta, el agitador magntico y la celda conductimtrica. Tomar la lectura de conductancia al inicio de la valoracin (0.0 mL de reactivo titulante agregado). f) Llenar una bureta de 25.00 mL con la solucin estndar de NaOH 0.1 M y ajustar la marca a 0.00 mL. g) Valorar la disolucin de HCl con adiciones de alcuota de 1.00 mL. h) Registrar el volumen agregado de titulante y la conductancia en cada punto.
24
Manual de Prcticas de Electroqumica II
i) Conforme transcurra la valoracin graficar la conductancia en funcin del volumen agregado de titulante.
Valoracin de una mezcla de cidos con una base fuerte.
j) Montar el dispositivo de la fig. 1. k) Tomar una alcuota de 10.00 mL de la mezcla de cidos y transferirla a una probeta de 50 mL. l) Repetir los pasos c) a i)
5. Resultados experimentales.
5.1 Reportar los resultados obtenidos en una tabla que contenga la siguiente informacin. Valoracin conductimtrica de HCl con NaOH 0.1M. mL de NaOH Conductancia mL de NaOH
Conductancia
Valoracin conductimtrica de una mezcla de cidos (HCl y CH3COOH) con NaOH 0.1 M.
mL de NaOH Conductancia mL de NaOH Conductancia mL de NaOH Conductancia
25
Manual de Prcticas de Electroqumica II
5.2 Construir las grficas de conductancia en funcin del volumen agregado de titulante. 5.3 Cuntas pendientes existen en la grfica correspondiente a la valoracin de HCl con NaOH? 5.4 Cuntas pendientes existen en la grfica correspondiente a la valoracin de la mezcla de cidos con NaOH? 5.5 Localizar con ayuda del diagrama conductimtrico los puntos finales de cada valoracin. 5.6. Con los puntos finales de la valoracin calcular la concentracin del HCl, la concentracin de la mezcla de cidos y la concentracin de cada uno de los componentes de la mezcla de cidos. 5.7 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA.
6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Meloan C.E y Kiser R.M., Problemas y Experimentos en Anlisis Instrumental, 1 edicin, Editorial Revert Mexicana, 1973, Mxico, D.F., 560 pginas. 6.4 Skoog D.A. y Leary J.J., Anlisis Instrumental, 4 edicin, Editorial Mc Graw Hill/Interamarcana de Espaa, 1994, Madrid Espaa, 935 pginas. 6.5 Vassos B.H., Ewing G. W., Electroqumica Analtica, 1 edicin, Editorial Limusa, S. A. de C.V., 1987, Mxico, D. F., 303 pginas. 6.6 Willard H.H., Merrit L.L., Dean J.A. y Settle F.A., Mtodos Instrumentales de Anlisis, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1991, Mxico, D.F., 884 pginas.
26
Manual de Prcticas de Electroqumica II
PRCTICA No. 6
MTODOS POTENCIOMTRICOS. VALORACIONES POTENCIOMTRICAS. DETERMINACIN DE CROMATO DE POTASIO Y/O DICROMATO DE POTASIO.
1. OBJETIVOS. a) Determinar la curva de valoracin potenciomtrica de una disolucin que
contiene dicromato de potasio y/o cromato de potasio. b) Determinar con precisin el punto final en una valoracin potenciomtrica. c) Determinar la concentracin de dicromato de potasio y/o de cromato de potasio de una disolucin problema.
2. FUNDAMENTOS. Valoraciones potenciomtricas.
Las valoraciones potenciomtricas consisten en la medicin de la diferencia de potencial entre un electrodo indicador y un electrodo de referencia durante el transcurso de una titulacin. El objetivo de la medicin potenciomtrica es obtener informacin acerca de la composicin de una solucin mediante el potencial que aparece entre los dos electrodos. El potencial de la solucin en el recipiente de valoracin se detecta por medio del electrodo indicador. El potencial de la solucin vara a medida que se agrega el reactivo titulante. El problema ms crtico de una valoracin es el reconocimiento del punto en el cual las cantidades de las especies reaccionantes estan presentes en cantidades equivalentes (el punto final). La curva de valoracin puede seguirse punto por punto, localizando como ordenadas de una grfica a los valores del potencial de la celda y como abscisas a los valores de volumen de titulante.
3. CUESTIONARIO Y EJERCICIOS PREVIOS.
27
Manual de Prcticas de Electroqumica II
3.1 Cul es el principio de funcionamiento del electrodo para medir pH. 3.2 Realiza un diagrama que muestre el montaje de una valoracin potencimetrica de pH con todos sus elementos. 3.3 Realiza un diagrama de bloques de la parte experimental que llevars a cabo. 3.4 Realizar los clculos para preparar las siguientes disoluciones: a) 100 mL de dicromato de potisio 0.1 M. b) 100 mL de cromato de potasio 0.1 M. c) 100 mL de una mezcla de cromato de potasio y dicromato de potasio 0.1 M cada uno. d) 100 mL de cido clorhdrico 0.1 M. e) 100 mL de NaOH 0.1 M. 3.5 Investigar las caractersticas que debe reunir un electrodo indicador. 3.6 Investigar las caractersticas que debe reunir un electrodo de referencia. 3.7 Investigar el principio de funcionamiento de los siguientes electrodos de + referencia Ag /AgCl y E.C.S. 3.8 Investigar como se estandariza una disolucin de HCl y una disolucin de NaOH. 3.9 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL. 4.1 Material y Equipo.
1 vaso de precipitados de 150 mL 1 pipeta volumtrica de 10 mL 1 bureta de 25.00 mL 1 probeta de 50 mL 1 agitador magntico 1 placa de agitacin 1 pinza para bureta 1 soporte universal 1 piceta 1 jeringa
28
Manual de Prcticas de Electroqumica II
1 potenciometro + 1 electrodo de referencia (Ag /AgCl) 1 electrodo indicador
4.2 Reactivos. Disolucin de dicromato de potasio 0.1 M Disolucin de cromato de potasio de 0.1 M Disolucin de una mezcla de cromato de potasio y dicromato de potasio 0.1 M cada uno Disolucin de Hidrxido de sodio 0.1 N Disolucin de cido clorhdrico 0.1 N Agua destilada 4.3 Secuencia Experimental.
a) Llenar la bureta con hidrxido de sodio estandarizado (0.1N) y ajustar a 0.00 mL. b) En un vaso de precipitados de 100 mL adicionar 5.00 mL de la muestra problema, 15 mL de HCl 0.1 N y 35 mL de agua destilada. c) Introducir el electrodo para medir pH. d) Valorar la disolucin que contiene la muestra problema con adiciones de 0.2 mL en 0.2 mL de hidrxido de sodio estandarizado y medir en cada adicin el valor de pH. e) Mantener una agitacin constante durante toda la titulacin.
5. RESULTADOS EXPERIMENTALES.
5.1 Construir una tabla que contenga la siguiente informacin: mL de titulante pH mL de titulante pH
29
Manual de Prcticas de Electroqumica II
5.2 Trazar la grfica de pH en funcin del volumen agregado de NaOH. 5.3 Cules son las especies presentes en la disolucin problema? 5.4 Cul es la concentracin de cada especie de tu disolucin problema? 5.5 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA.
6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Meloan C.E y Kiser R.M., Problemas y Experimentos en Anlisis Instrumental, 1 edicin, Editorial Revert Mexicana, 1973, Mxico, D.F., 560 pginas. 6.4 Skoog D.A. y Leary J.J., Anlisis Instrumental, 4 edicin, Editorial Mc Graw Hill/Interamarcana de Espaa, 1994, Madrid Espaa, 935 pginas. 6.5 Vassos B.H., Ewing G. W., Electroqumica Analtica, 1 edicin, Editorial Limusa, S. A. de C.V., 1987, Mxico, D. F., 303 pginas. 6.6 Willard H.H., Merrit L.L., Dean J.A. y Settle F.A., Mtodos Instrumentales de Anlisis, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1991, Mxico, D.F., 884 pginas.
30
Manual de Prcticas de Electroqumica II
PRCTICA No. 7
POLAROGRAFA I DOMINIO DE ELECTROACTIVIDAD
1. OBJETIVOS.
1.1 Determinar las ondas de reduccin del oxgeno empleando el electrodo de gotas de mercurio. 1.2 Determinar el dominio de electroactividad de una disolucin acuosa de NaNO3 empleando el electrodo de gotas de mercurio.
2. FUNDAMENTOS. Dominio de electroactividad.
Una especie electroactiva es aquella que se oxida o se reduce en el dominio de electroactividad. El dominio de electroactividad es un intervalo de potenciales que depende del disolvente, del electrolito indiferente y de la naturaleza del material del que est constituido el electrodo de trabajo. Los lmites de ste intervalo, conocidos como barreras del dominio de electroactividad, estn provocados por las elevadas intensidades de corriente que se desarrollan, debido generalmente, a la oxidacin y reduccin del disolvente. Para soluciones acuosas el lmite de potencial positivo est dado por la oxidacin del agua para dar oxgeno molecular, siempre y cuando no ocurra primero la oxidacin del electrodo de trabajo, y el lmite de potencial negativo es debido a la reduccin del agua dando como producto hidrgeno molecular. Las reacciones que se verifican en ambos lmites estn dadas por las siguientes ecuaciones: Lmite positivo. Reaccin de oxidacin del agua: 2H2O 4e- qe O2(g) + 4H+ Lmite negativo. Reaccin de reduccin del agua: 2H2O + 2e- qe H2(g) + 2OH(2) (1)
31
Manual de Prcticas de Electroqumica II
Reduccin del oxgeno disuelto.
El oxgeno disuelto se reduce fcilmente en el electrodo de mercurio. La disolucin acuosa saturada de aire suministra dos ondas de reduccin atribuibles a este elemento, una correspondiente a la semirreaccin de O(0) O(-) y otra correspondiente a la semirreaccin O(-) O(-). La primera corresponde a la reduccin de oxgeno a perxido de hidrgeno segn la ecuacin (3). O2(g) + 2H + 2e H2O2
+ -
(3)
Y la segunda corresponde a la reduccin de perxido de hidrgeno a agua segn la ecuacin (4). H2O2 + 2H + 2e 2H2O
+ -
(4)
La presencia de oxgeno a menudo interfiere en la determinacin precisa de otras especies. As, la eliminacin de oxgeno es la primera etapa en los procedimientos voltamperomtricos. El burbujeo de un gas inerte a la disolucin durante varios minutos permite esta eliminacin, y para prevenir la reabsorcin del oxgeno se hace pasar sobre la disolucin una corriente del mismo gas inerte durante el tiempo que tarde el anlisis polarogrfico.
3. CUESTIONARIO Y EJERCICIOS PREVIOS.
3.1 Realizar los clculos para preparar 100 mL de nitrato de sodio 0.1 M. 3.2 Investigar cmo funciona un electrodo de gotas de mercurio. 3.3 Investigar el potencial estndar al cual se oxida el mercurio. electrodo de gotas de
3.4 Cul es la reaccin de oxidacin que se lleva a cabo en el electrodo de gotas de mercurio? 3.5 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL. 4.1 Material y Equipo.
1 pipeta volumtrica de 20.00 mL. 1 piceta. 1 celda polarogrfica. 1 polargrafo metrohm con microprocesador 693 VA processor.
32
Manual de Prcticas de Electroqumica II
1 sistema de tres electrodos 694 VA Stand. 1 electrodo de referencia (Ag/AgCl). 1 electrodo indicador (Hg). 1 electrodo auxliar (Pt).
4.2 Reactivos.
Disolucin de nitrato de sodio 0.1 M. Nitrgeno gaseoso. Agua desionizada.
4.3 Secuencia Experimental.
a) Tomar una alcuota de 20.00 mL de disolucin de nitrato de sodio 0.1 M y transferirla a una celda polarogrfica. b) Verificar que los electrodos de referencia, de trabajo y auxiliar estn conectados a las terminales adecuadas del sistema de tres electrodos. c) Colocar la celda en el polargrafo y registrar el polarograma. Iniciar el barrido de potencial en 2000 mV y terminar el barrido en +700 mV. d) Burbujear nitrgeno a la disolucin durante 5 minutos y registrar el polarograma en las mismas condiciones del inciso c).
5. RESULTADOS EXPERIMENTALES.
5.1 Obtener el polarograma debido a las reducciones del oxgeno. 5.2 Indicar en el polarograma anterior las reacciones de reduccin del oxgeno. 5.3 A qu potencial ocurre la reduccin de oxgeno a agua oxigenada? 5.4 Cul es el potencial de reduccin de agua oxigenada a agua? 5.5 Obtener el polarograma del dominio de electroactividad. 5.6 Atribuir al polarograma anterior los potenciales (positivo y negativo) debidos a los lmites del dominio de electroactividad. 5.7 Atribuir al lmite negativo del polarograma la correspondiente reaccin de reduccin.
33
Manual de Prcticas de Electroqumica II
5.8 Atribuir al lmite positivo del polarograma la correspondiente reaccin de oxidacin. 5.9 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA.
6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Harris D.C., Anlisis Qumico Cuantitativo, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1992, Mxico, D.F., 886 pginas. 6.4 Meloan C.E y Kiser R.M., Problemas y Experimentos en Anlisis Instrumental, 1 edicin, Editorial Revert Mexicana, 1973, Mxico, D.F., 560 pginas. 6.5 Snchez-Batanero P. Qumica Electroanaltica Fundamentos y Aplicaciones, 1 edicin, Editorial Alhambra, S.A., 1981, Madrid, Espaa, 345 pginas. 6.6 Skoog D.A. y Leary J.J., Anlisis Instrumental, 4 edicin, Editorial Mc Graw Hill/Interamarcana de Espaa, 1994, Madrid Espaa, 935 pginas. 6.7 Vassos B.H., Ewing G. W., Electroqumica Analtica, 1 edicin, Editorial Limusa, S. A. de C.V., 1987, Mxico, D. F., 303 pginas. 6.8 Willard H.H., Merrit L.L., Dean J.A. y Settle F.A., Mtodos Instrumentales de Anlisis, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1991, Mxico, D.F., 884 pginas.
34
Manual de Prcticas de Electroqumica II
PRCTICA No. 8
POLAROGRAFA II INFLUENCIA DE LA CONCENTRACIN EN LA CORRIENTE LMITE
1. OBJETIVO.
Determinar la relacin que guarda la concentracin de una especie electroactiva con la corriente lmite de difusin (altura de la curva de intensidad-potencial).
2. FUNDAMENTOS.
Cuando se obtiene la curva de intensidad-potencial (i-E) de una disolucin en reposo que contiene solamente al disolvente y al electrolito soporte, se observa que circula por el sistema electroltico una pequea corriente de electrlisis conocida como corriente residual (figura 1). Si se adiciona una especie electroactiva y se traza la curva i-E, se observar un incremento brusco de corriente originado por la electrlisis de la sustancia agregada; a esta corriente se le conoce con el nombre de corriente de difusin, id (figura 1), y se denomina as porque despus del incremento brusco de corriente se produce en el sistema una polarizacin de concentracin y el rgimen de transferencia electrnica empieza a ser limitado por la velocidad con que la especie electroactiva puede ser transportada por difusin desde el seno de la disolucin hasta la superficie del electrodo. La magnitud de la corriente de difusin es proporcional al gradiente de concentracin de la especie electroactiva. Llamando Cs a la concentracin de la especie electroactiva en el seno de la disolucin y Cel a la concentracin en la superficie del electrodo la corriente de difusin ser: id = n k (Cs-Cel) (1)
El signo corresponde a las convenciones adoptadas: +, para las corrientes de oxidacin y -, para las corrientes de reduccin; k es un coeficiente de proporcionalidad que depende del coeficiente de difusin de la especie electroactiva y n es el nmero de electrones transferidos. En un proceso electroltico a rgimen estacionario la corriente de difusin tiende a un valor lmite cuando Cel=0, en este caso la corriente recibe el nombre corriente lmite de difusin y corresponde al valor ms elevado del gradiente de concentracin. En este caso, la corriente es proporcional a la concentracin de la sustancia que, estando en disolucin, da lugar a la curva de intensidad-potencial. ilm = n k (Cs) (2)
La ecuacin (2) constituye la magnitud analtico-cuantititiva de los mtodos electroqumicos. La medida de esta magnitud sirve para conocer la concentracin
35
Manual de Prcticas de Electroqumica II
de la especie electroactiva presente en la disolucin, interpolando la intensidad medida, en una recta de calibrado llevada a cabo en las mismas condiciones experimentales.
Figura 1. Curvas de i-E obtenidas por polarografa clsica de: 1) electrolito indiferente y disolvente; 2) misma que la anterior pero agregando una especie electroactiva.
3. CUESTIONARIO Y EJERCICIOS PREVIOS.
3.1 Realizar los clculos para preparar las siguientes disoluciones: a) 100 mL de nitrato de sodio 0.1 M. b) 100 mL de nitrato de plomo 1000 ppm. c) 100 mL de tritn X-100 al 1% en volumen. 3.2 Cul es el potencial estndar del par redox Pb 2+ /Pb(s)?. 3.3 Qu es un mximo polarogrfico?. 3.4 Qu es un supresor de mximos polarogrficos?. 3.5 Elaborar un diagrama de flujo donde se indique la secuencia experimental.
4. DESARROLLO EXPERIMENTAL. 4.1 Material y reactivos.
36
Manual de Prcticas de Electroqumica II
1 pipeta volumtrica de 20.00 mL. 1 pipeta graduada de 1.00 mL. 1 piceta. 1 celda polarogrfica. 1 polargrafo Metrohm con microprocesador 693 VA Processor. 1 sistema de tres electrodos 694 VA Stand. 1 electrodo de referencia (Ag/AgCl). 1 electrodo indicador (Hg). 1 electrodo auxiliar (Pt).
4.2 Reactivos.
Disolucin de nitrato de sodio 0.1 M. Disolucin de nitrato de plomo 1000 ppm. Disolucin de tritn X-100 al 1% en volumen. Nitrgeno gaseoso. Agua desionizada.
4.3 Secuencia experimental.
a) Tomar una alcuota de 20.00 mL de disolucin de nitrato de sodio 0.1 M y transferirla a una celda polarogrfica. b) Adicionar a la celda una gota de tritn X-100 al 1% y verificar que los electrodos de referencia, de trabajo y auxiliar estn conectados a las terminales adecuadas del sistema de tres electrodos. c) Colocar la celda en el polargrafo, agitar la solucin por un minuto y burbujear nitrgeno durante 5 minutos. d) Registrar el polarograma iniciando el barrido de potencial en -200 mV y terminandolo en -500 mV. e) Adicionar 0.10 mL de nitrato de plomo 1000 ppm, agitar la solucin durante un minuto y burbujear nitrgeno durante 3 minutos. f) Registrar el polarograma iniciando el barrido de potencial en -200 mV y terminandolo en -500 mV. g) Repetir los incisos e) y f) para cuatro adiciones ms de 0.10 mL de nitrato de plomo 1000 ppm.
5. RESULTADOS EXPERIMENTALES.
37
Manual de Prcticas de Electroqumica II
5.1 Obtener las grficas de intensidad de corriente en funcin del potencial (curvas de intensidad-potencial polarogramas). 5.2 Medir la altura de las curvas y determinar la corriente lmite de difusin para cada una de ellas. 5.3 Graficar la corriente lmite de difusin en funcin de la concentracin de Pb 2+ . 5.4 Determinar la pendiente, la ordenada al origen y el coeficiente de correlacin de la curva de calibrado. 5.5 Qu relacin guarda la corriente lmite de difusin con respecto a la concentracin de Pb 2+ ?. 5.6 Se cumplieron los objetivos de la prctica?. 5.7 Obtener las conclusiones pertinentes.
6. BIBLIOGRAFA.
6.1 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo I, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 282 pginas. 6.2 Charlot G., Curso de Qumica Analtica General, 1 edicin, Tomo II, Editorial Toray-Masson, S.A., 1977, Barcelona, Espaa, 200 pginas. 6.3 Harris D.C., Anlisis Qumico Cuantitativo, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1992, Mxico, D.F., 886 pginas. 6.4 Meloan C.E y Kiser R.M., Problemas y Experimentos en Anlisis Instrumental, 1 edicin, Editorial Revert Mexicana, 1973, Mxico, D.F., 560 pginas. 6.5 Snchez-Batanero P. Qumica Electroanaltica Fundamentos y Aplicaciones, 1 edicin, Editorial Alhambra, S.A., 1981, Madrid, Espaa, 345 pginas. 6.6 Skoog D.A. y Leary J.J., Anlisis Instrumental, 4 edicin, Editorial Mc Graw Hill/Interamarcana de Espaa, 1994, Madrid Espaa, 935 pginas. 6.7 Vassos B.H., Ewing G. W., Electroqumica Analtica, 1 edicin, Editorial Limusa, S. A. de C.V., 1987, Mxico, D. F., 303 pginas. 6.8 Willard H.H., Merrit L.L., Dean J.A. y Settle F.A., Mtodos Instrumentales de Anlisis, 1 edicin, Editorial Iberoamrica S.A. de C.V., 1991, Mxico, D.F., 884 pginas.
38
You might also like
- Conductv UnmsmDocument24 pagesConductv UnmsmBrenda wen :PNo ratings yet
- Conductv UnmsmDocument24 pagesConductv UnmsmBrenda wen :PNo ratings yet
- Práctica 4Document4 pagesPráctica 4Rosangeles LopezNo ratings yet
- Informe de Quimica Analitica UptDocument7 pagesInforme de Quimica Analitica UptMariela Alejandra Cutipa VargasNo ratings yet
- Determinación de la constante de ionización del ácido acéticoDocument25 pagesDeterminación de la constante de ionización del ácido acéticoElizabeth SandovalNo ratings yet
- Equilibrio de solubilidad de hidróxido de cobreDocument15 pagesEquilibrio de solubilidad de hidróxido de cobreMelanny Rejas0% (1)
- Lab 7Document23 pagesLab 7delacruztifanny2No ratings yet
- Guia Lab. Analisis Instrumental I 2022-2 PARTE 2 E.E.DDocument14 pagesGuia Lab. Analisis Instrumental I 2022-2 PARTE 2 E.E.DAaron Quispe100% (1)
- GUIA de LAB #7 EQUILIB QUÍM BQU01Document12 pagesGUIA de LAB #7 EQUILIB QUÍM BQU01Sebastian MQNo ratings yet
- Informe de Laboratorio N°6Document28 pagesInforme de Laboratorio N°6Cristian Suarez0% (1)
- Bqu01 Lab #7 (Equilib Químico)Document11 pagesBqu01 Lab #7 (Equilib Químico)Brayan Rivera ArgumedoNo ratings yet
- Verificación de La Ecuación de Nernst.: Objetivo. Objetivo DidácticoDocument6 pagesVerificación de La Ecuación de Nernst.: Objetivo. Objetivo Didácticojuan castelazzi100% (1)
- Manual de Practicas Lab - Qa2 Iq 2022Document28 pagesManual de Practicas Lab - Qa2 Iq 2022GERAEMILNo ratings yet
- Oxidación de Etano Con Cromo.Document3 pagesOxidación de Etano Con Cromo.Juan V RamirezNo ratings yet
- Practica PotenciometriaDocument8 pagesPractica PotenciometriamelanieNo ratings yet
- 9,10. Práctica ConductimetriaDocument2 pages9,10. Práctica ConductimetriaXuxek MartinezNo ratings yet
- Titulación ácido-base: Determinación de concentración de HClDocument32 pagesTitulación ácido-base: Determinación de concentración de HClMireya LuctualaNo ratings yet
- Reacciones químicas de óxido reducciónDocument4 pagesReacciones químicas de óxido reducciónAna GuerreroNo ratings yet
- Guia Ejercicios QUI230Document56 pagesGuia Ejercicios QUI230Manuel Curitol Piutrin0% (1)
- 7 Reporte Reacciones Químicas IDocument16 pages7 Reporte Reacciones Químicas IMYSA SACSINo ratings yet
- PRACTICA 4 DE REACCION (Reparado)Document20 pagesPRACTICA 4 DE REACCION (Reparado)Fernanda JaldinNo ratings yet
- Serie de Ejercicios de Conductimetria 2073Document14 pagesSerie de Ejercicios de Conductimetria 20731MAX1100% (1)
- Guia de Laboratorio de Quimica Analitica 2017-IDocument21 pagesGuia de Laboratorio de Quimica Analitica 2017-Ili100% (1)
- GUIA No. 7 REACCIONES EN SOLUCIONES (Editada)Document5 pagesGUIA No. 7 REACCIONES EN SOLUCIONES (Editada)Domenica SaritamaNo ratings yet
- Practica11.Preparación de Una Crema para ManosDocument4 pagesPractica11.Preparación de Una Crema para Manosaxl62No ratings yet
- Determinación de La Constante de Equilibrio de Un IndicadorDocument5 pagesDeterminación de La Constante de Equilibrio de Un IndicadorMaryjoseLeónNo ratings yet
- Práctica de titulación redox entre permanganato de potasio y ácido oxálicoDocument3 pagesPráctica de titulación redox entre permanganato de potasio y ácido oxálicojanetteNo ratings yet
- Práctica de Laboratorio #06. Equilibrio Químico y Principio de Le ChatelierDocument4 pagesPráctica de Laboratorio #06. Equilibrio Químico y Principio de Le ChatelierVALEERY ANSHERLY CUTIPA AVALOSNo ratings yet
- INFORME LABORATORIO - PRACTICA de HoyDocument10 pagesINFORME LABORATORIO - PRACTICA de HoyAndrea Montoya SantivañezNo ratings yet
- G8 - Cinética QuímicaDocument9 pagesG8 - Cinética QuímicaNeeiVidarteEspinoNo ratings yet
- Modulo 6 - 2020Document18 pagesModulo 6 - 2020Gisex Von LouzerNo ratings yet
- Guía de reacciones redoxDocument7 pagesGuía de reacciones redoxHicker RieraNo ratings yet
- Informe 4. Acido Cítrico - Documentos de GoogleDocument29 pagesInforme 4. Acido Cítrico - Documentos de GoogleHannya CruzNo ratings yet
- Factores que afectan la acidez de cationes metálicosDocument8 pagesFactores que afectan la acidez de cationes metálicosdianaNo ratings yet
- Guia de Quimica de Soluciones Acuosas Andina I Sem 20171Document4 pagesGuia de Quimica de Soluciones Acuosas Andina I Sem 20171ana maria escobarNo ratings yet
- Informe Practica No 7 y 8Document30 pagesInforme Practica No 7 y 8AndersonLeòn100% (1)
- Titulaciones Redoz y Electrodos SelectivosDocument18 pagesTitulaciones Redoz y Electrodos SelectivosJANE BARAJASNo ratings yet
- Preparación de Patrones Ácido-Base PDFDocument3 pagesPreparación de Patrones Ácido-Base PDFAlejandra Patiño GarcíaNo ratings yet
- Informe 13-Conductividad-LfqaiiDocument10 pagesInforme 13-Conductividad-LfqaiiÁlvaro Olórtegui IglesiasNo ratings yet
- BQG - 2023-II Practica No. 3 Reacciones de CarbohidratosDocument6 pagesBQG - 2023-II Practica No. 3 Reacciones de CarbohidratosPato VmNo ratings yet
- EXPERIMENTO N° 7 - REACCIONES REDOXDocument7 pagesEXPERIMENTO N° 7 - REACCIONES REDOXJesus AndradesNo ratings yet
- LAboratoDocument6 pagesLAboratoMILTON DAVID JIMENEZ SALASNo ratings yet
- Informe de Practica de Laboratorio n6 Valoracion Redox y Estequiometria Grupo n1 - CompressDocument7 pagesInforme de Practica de Laboratorio n6 Valoracion Redox y Estequiometria Grupo n1 - CompressMamjeet AlessandraNo ratings yet
- Previo 4Document7 pagesPrevio 4Marco GonzalezNo ratings yet
- Antología de QuímicaDocument63 pagesAntología de QuímicaArturo ChavezNo ratings yet
- Determinación de conductividades iónicasDocument8 pagesDeterminación de conductividades iónicasLuis MopositaNo ratings yet
- Prac 2 Electro Qui MicaDocument9 pagesPrac 2 Electro Qui MicaArturo Gnz0% (1)
- Ejercicios de Examen Electrometricos Marzo 10 2015Document8 pagesEjercicios de Examen Electrometricos Marzo 10 2015Kar LunAsNo ratings yet
- InformeDocument12 pagesInformeDiego Medrano HidalgoNo ratings yet
- Guia 4 - 5Document5 pagesGuia 4 - 5MARIA JOSE TRIANA RANGELNo ratings yet
- Practica de Laboratorio N°5 ENLACE QUIMICODocument17 pagesPractica de Laboratorio N°5 ENLACE QUIMICOOlmedo Aedo Huyhua AcevedoNo ratings yet
- Manual de Analitica Experimental 2Document19 pagesManual de Analitica Experimental 2MarcosEduardoMtzNo ratings yet
- Informe N°9 Conductimetría II (Grupo 6)Document12 pagesInforme N°9 Conductimetría II (Grupo 6)Nicole SalvatierraNo ratings yet
- Apuntes de Electroquimica II UPIBIDocument74 pagesApuntes de Electroquimica II UPIBILeoNo ratings yet
- Practica PotenciometriaDocument25 pagesPractica PotenciometriaMaximus Tellez LopezNo ratings yet
- Practica2 DescargDocument3 pagesPractica2 DescargSandra PatriciaNo ratings yet
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Allura FC MovilDocument1 pageAllura FC MovilCarlos Huitron RiosNo ratings yet
- Rayos X y MicroondasDocument52 pagesRayos X y MicroondasCarlos Huitron RiosNo ratings yet
- Ondas Parte1 2012Document21 pagesOndas Parte1 2012Carlos Huitron RiosNo ratings yet
- ECG FundamentacionDocument4 pagesECG FundamentacionCarlos Huitron RiosNo ratings yet
- Fuente8 ManualOrganizacionDocument30 pagesFuente8 ManualOrganizacionCarlos Huitron RiosNo ratings yet
- Rayos X y MicroondasDocument52 pagesRayos X y MicroondasCarlos Huitron RiosNo ratings yet
- Resumen de Mantenimiento A CalderasDocument2 pagesResumen de Mantenimiento A CalderasCarlos Huitron RiosNo ratings yet
- Horario de 3° SemestreDocument1 pageHorario de 3° SemestreCarlos Huitron RiosNo ratings yet
- En Cabeza DooDocument1 pageEn Cabeza DooCarlos Huitron RiosNo ratings yet
- Guia - OMS - Mantenimiento de Equipos MedicosDocument96 pagesGuia - OMS - Mantenimiento de Equipos MedicosCarlos Terré100% (1)
- 7importancia MantenimientoDocument20 pages7importancia MantenimientoAlan Nuñez DalletoNo ratings yet
- Protocolo para Un Concierto-1Document6 pagesProtocolo para Un Concierto-1Carlos Huitron RiosNo ratings yet
- Autos HibridosDocument36 pagesAutos HibridosRoberto Vazquez100% (4)
- Observacion Y Analisis de La Practica Escolar: Licenciatura en Educación Primaria Segundo SemestreDocument7 pagesObservacion Y Analisis de La Practica Escolar: Licenciatura en Educación Primaria Segundo SemestreJazive Arlette Santiago BolañosNo ratings yet
- Unidad 1 - Tarea 2Document10 pagesUnidad 1 - Tarea 2arelis ruizNo ratings yet
- Cap 11Document9 pagesCap 11Adriana VelazquezNo ratings yet
- Informe Investigacion Millennials AD PDFDocument26 pagesInforme Investigacion Millennials AD PDFMarcela BastidasNo ratings yet
- CV Sheyla Porras Huaman 2023Document18 pagesCV Sheyla Porras Huaman 2023Alonso Cubas GuzmánNo ratings yet
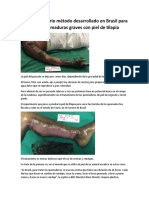
- Método Desarrollado en Brasil para Tratar Quemaduras Graves Con Piel de TilapiaDocument3 pagesMétodo Desarrollado en Brasil para Tratar Quemaduras Graves Con Piel de TilapiaJose Maria VargasNo ratings yet
- Sistemas Multiples de Grados de Libertad 27 NOV 2018 Analisis Estructural 2Document24 pagesSistemas Multiples de Grados de Libertad 27 NOV 2018 Analisis Estructural 2Leinad ScNo ratings yet
- Plan Estratégico Empresa Maxpellets S.A: Líneas de Productos y ServiciosDocument2 pagesPlan Estratégico Empresa Maxpellets S.A: Líneas de Productos y ServiciosKATHERINE - GARZON CABRERANo ratings yet
- Patologías de La VozDocument4 pagesPatologías de La VozAndreaNo ratings yet
- Preinforme 4Document5 pagesPreinforme 4Ariana Chanta Rodas100% (1)
- Aplicaciones Clinicas de Las EnzimasDocument5 pagesAplicaciones Clinicas de Las EnzimasElias Charcape OtinianoNo ratings yet
- Monografias 2010Document8 pagesMonografias 2010bibliofceaNo ratings yet
- CONJUNTIVITISDocument15 pagesCONJUNTIVITISGaby Moya ArcanaNo ratings yet
- 4 - CCSS-S08Document2 pages4 - CCSS-S08Franklin Gilvonio YarangaNo ratings yet
- Requisitos MinimosDocument3 pagesRequisitos MinimosSandra BarralNo ratings yet
- Practica FinalDocument4 pagesPractica FinalYafreisy Peguero G.No ratings yet
- Laboratorios MRUVDocument6 pagesLaboratorios MRUVOscar Javier Hernandez GomezNo ratings yet
- PorcelanatoDocument15 pagesPorcelanatoCarlos EspNo ratings yet
- Correo Miguel Angel Yaguilla Solucion Bridge ConferenciaDocument7 pagesCorreo Miguel Angel Yaguilla Solucion Bridge ConferenciaRafael TrujilloNo ratings yet
- Manual Quimica AnaliticaDocument73 pagesManual Quimica Analiticarosabetancourt100% (1)
- Fotointerpretación: Plan de vuelo fotogramétricoDocument16 pagesFotointerpretación: Plan de vuelo fotogramétricorononti2634No ratings yet
- PeyronieDocument20 pagesPeyronieFernando HerreraNo ratings yet
- Capacitación Prevención de Uso y Consumo de DrogasDocument2 pagesCapacitación Prevención de Uso y Consumo de DrogasValeria CastilloNo ratings yet
- Mantequilla Power PDFDocument39 pagesMantequilla Power PDFANA LUZ MAMANI QUISPENo ratings yet
- Cap II. Importancia de La FlexibilidadDocument54 pagesCap II. Importancia de La Flexibilidadivancattoni98No ratings yet
- Oferta ComercialDocument7 pagesOferta ComercialDiego M Camargo ANo ratings yet
- Unidad 2 Actividad 2Document4 pagesUnidad 2 Actividad 2Luis Alfredo Espino M.100% (1)
- Sesion LOS ECOSISTEMAS DEL PERÚDocument4 pagesSesion LOS ECOSISTEMAS DEL PERÚVilma Gladis Rios HilarioNo ratings yet
- Inyeccion Directa GasolinaDocument49 pagesInyeccion Directa GasolinaBoris MuñozNo ratings yet
- LimpiaparabrisasDocument1 pageLimpiaparabrisasRamirez Ruiz GabrielNo ratings yet