Professional Documents
Culture Documents
Electrodos de Referencia
Uploaded by
totumasCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Electrodos de Referencia
Uploaded by
totumasCopyright:
Available Formats
ELECTRODOS DE REFERENCIA
PRESENTADO POR: CARLOS ANDRS GALN FABIO ALEXANDER RODRIGUEZ
LABORATORIO DE CORROSIN
PRESENTADO A: ZAIDA ISADORA TORRES VERA ING. METALRGICO UIS
GRUPO: C2
UNIVERSIDAD INDUSTRIAL DE SANTANDER FACULTAD DE INGENIERIAS FISICOQUMICAS ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES LABORATORIO DE CORROSION BUCARAMANGA
ELECTRODO ESTNDAR DE HIDROGENO ESH Dentro de los electrodos de referencia el electrodo estndar de hidrogeno ESH es el que se utiliza como referencia para las mediciones del potencial de electrodo, tericamente siendo el electrodo ms importa. El electrodo de hidrogeno reversible en una solucin de iones de hidrogeno con actividad igual a 1 presenta un potencial que se supone es cero en todas las temperaturas. En la tabla 1 al igual que en la figura 3 Equivalencia aproximada entre las escalas de potencial relativas a los electrodos de referencia El electrodo se compone de un alambre de platino sumergido en una solucin (Fig. 1) que contiene iones de hidrgeno y saturado con gas hidrgeno. El platino se sumerge completamente en arsnico acuoso libre de cido clorhdrico, y gas hidrgeno libre de oxgeno y monxido de carbono es burbujeado a la superficie de platino. Lentamente, el aire se desplaza por el hidrgeno y el potencial reversible se logra. Desafortunadamente, este electrodo tiene algunos inconvenientes. En primer lugar, la reversibilidad del electrodo de hidrgeno no se puede mantener en medios oxidantes. En segundo lugar, si una corriente se retira del electrodo, el electrodo acta como nodo, debido a la ionizacin de las molculas de gas. Adems, el electrodo es frgil y delicado de manejar.
Fig 1. Electrodo estndar de hidrogeno ESH
ELECTRODO DE REFERENCIA DE CALOMELANOS.
Este electrodo est formado por mercurio cubierto por una capa de cloruro insoluble (calomelanos), Hg2Cl2 en equilibrio con una disolucin de cloruro potsico, KCl, que puede ser 0.1 N, 1 N o saturada. El contacto elctrico con el mercurio se realiza por medio de un hilo de platino. Un esquema de este electrodo se presenta en la figura 2. Ha sido desde hace tiempo el electrodo de referencia normal para uso en el laboratorio. Se compone de mercurio en equilibrio con Hg 2++ ,estando determinada su actividad por la solubilidad del Cl 2 Hg2 (cloruro mercurioso o calomelanos). La reaccin de la semipila es: Hg2Cl2+2e- 2Hg+2ClMercurio puro cubre un alambre de platino que atraviesa el fondo de un tubo de vidrio. El mercurio esta cuberito con cloruro mercurioso solido que es solo un poco soluble en la solucin de cloruro potsico que llena la pila, la actividad de Hg 2++ depende de la concentracin de KCl puesto que el producto de solubilidad (Hg 2++) (Cl-)2 es una constante, lo potencial en la escala de hidrogeno normal para diferentes concentracin de KCl se observan en la tabla 1.
Figura 2. Electrodo de referencia de calomelanos[4] SEMIPILA PLATA-CLORURO DE PLATA (Ag/AgCl). Est formado por un hilo de Ag sobre el cual se deposita AgCl, generalmente por va electroqumica, en una solucin de NaCl o KCl, en la cual el hilo de Ag acta como nodo, como se observa en la figura 4.
Figura 4. Plata /cloruro de plata, Ag/AgCl [5] La reaccin electrdica es la siguiente: AgCl + eY su potencial de equilibrio a 25C es: E = 0.2224 - 0.059 log [Cl-]. En agua de mar, el valor del potencial es aproximadamente de + 0.25 V respecto al electrodo normal de hidrgeno (ENH) a 25C. El potencial del electrodo depende muy especialmente de la salinidad de la solucin en la cual el electrodo est sumergido. ELECTRODO DE COBRE/SULFATO DE COBRE (CU/CUSO4). Est formado por una barra cilndrica de Cu sumergida en una solucin de CuSO4 saturada. El contacto electroltico con la solucin o suelo se realiza mediante un puente salino constituido (formado) por un tapn de madera de balsa. En la figura 5 se ilustra este tipo de electrodo. Ag + Cl-,
Reaccin de electrodo es la siguiente: Cu Cu2+ + 2e-;
Su potencial de equilibrio a 25C viene dado por: E = 0.340 + 0.0295 log [Cu2+] V vs. ENH.
Figura 5. Cobre/ sulfato de cobre, Cu/CuSO4 Con la solucin saturada de CuSO4, se tiene E = + 0.318 V vs. ENH, pero para uso prctico se considera un valor de 0.30 V. Este tipo de electrodo puede utilizarse en cualquier ambiente, sea en el suelo o agua de mar, aguas dulces o saladas. Entre otras ventajas, presenta la sencillez de su preparacin y su gran estabilidad. Cuando se utiliza en agua de mar, puede contaminarse con cloruros, por lo cual es aconsejable ms bien en el suelo, en aguas dulces y en salmueras.
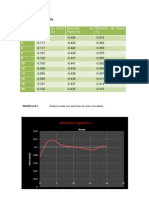
Tabla 1. Potenciales estndar de los electrodos de referencia [1][2][3]
Tabla 2: Potenciales estndar de los electrodos de referencia [5]
Figura 3. Equivalencia aproximada entre las escalas de potencial relativas a los electrodos de referencia utilizados en proteccin catdica, con indicacin de los intervalos de corrosin, proteccin y sobreproteccin para acero al carbono [5].
BIBLIOAGRAFIA [1] D.J.G. Ives & G.J. Janz, "Reference Electrodes, Theory and Practice", Academic Press, NY (1961). Es la referencia de las referencias, citado por todos los anteriores [2]A.J. Bard & L.R. Faulkner, "Electrochemical Methods", Wiley, NY (1980),. [3] D.T. Sawyer, A. Sobkowiak, J.L. Roberts, Jr,"Electrochemistry for Chemists", 2nd Ed, Wiley, NY (1995) p.192. [4] electrodo de calomelanos, disponible en http://es.wikipedia.org/wiki/Electrodo_de_calomelanos la pgina web
[5] JAVIER VILA, JOAN GENESC. ms all de la herrumbre. Mexico. 1996
You might also like
- Lixiviación DiagnosticooDocument12 pagesLixiviación DiagnosticoototumasNo ratings yet
- La Moraleja Del Puerco Espin.Document5 pagesLa Moraleja Del Puerco Espin.totumasNo ratings yet
- Cubilote de Revestmiento Descargarr 2 WorkDocument7 pagesCubilote de Revestmiento Descargarr 2 WorktotumasNo ratings yet
- Precios de Minerales Octubre 04 Al 08 2010Document3 pagesPrecios de Minerales Octubre 04 Al 08 2010totumasNo ratings yet
- Sant BlastingDocument2 pagesSant BlastingtotumasNo ratings yet
- Constantes Fisicas y QuimicasDocument4 pagesConstantes Fisicas y Quimicasjose davidNo ratings yet
- Tema 9 Fe C AcerosDocument27 pagesTema 9 Fe C AcerosJordan Alexnnader GarzonNo ratings yet
- Constantes Fisicas y QuimicasDocument4 pagesConstantes Fisicas y Quimicasjose davidNo ratings yet
- Constantes Fisicas y QuimicasDocument4 pagesConstantes Fisicas y Quimicasjose davidNo ratings yet
- Soldadura en Tanques y Recipienbtes A Presion Segun Codigo ASMEDocument62 pagesSoldadura en Tanques y Recipienbtes A Presion Segun Codigo ASMEtotumas100% (1)
- Rentabilidad RiesgoDocument16 pagesRentabilidad RiesgototumasNo ratings yet
- Corrosión en la industria petrolera: causas, tipos y prevenciónDocument69 pagesCorrosión en la industria petrolera: causas, tipos y prevencióntotumasNo ratings yet
- Informe de Serie Galvanica y Los EfectosDocument3 pagesInforme de Serie Galvanica y Los EfectostotumasNo ratings yet
- Estudio de La Fatiga Térmica Según La Norma API 571 RP, CARLOS ANDRÉS GALÁNDocument8 pagesEstudio de La Fatiga Térmica Según La Norma API 571 RP, CARLOS ANDRÉS GALÁNCarlos Andrés GalánNo ratings yet
- ISE04-005-R0 Mantenimiento Preventivo ServomotorDocument6 pagesISE04-005-R0 Mantenimiento Preventivo ServomotorManuel FernándezNo ratings yet
- Foro Seman 5 Proceso ExtractivoDocument3 pagesForo Seman 5 Proceso Extractivomivega88100% (1)
- An Alisis Estructural Y Electr Onico de La Perovskita Doble Compleja de Labife ODocument152 pagesAn Alisis Estructural Y Electr Onico de La Perovskita Doble Compleja de Labife Ojk gfNo ratings yet
- Anexos EAM Desagregacion VariablesDocument1,754 pagesAnexos EAM Desagregacion VariablesJay BanmNo ratings yet
- Procesos de conformado mecánico: embutición, repujado, doblado y másDocument13 pagesProcesos de conformado mecánico: embutición, repujado, doblado y másKevin Morejon RualesNo ratings yet
- MatrizDocument27 pagesMatrizbernardoNo ratings yet
- S12.s1 - Material VIIDocument46 pagesS12.s1 - Material VIIAngelica M. TatajeNo ratings yet
- EDAR OperadorDocument75 pagesEDAR OperadorCarlos Cruz LópezNo ratings yet
- Plano Gas-Isometrico-IsometricosDocument1 pagePlano Gas-Isometrico-IsometricosNicolas PalacinNo ratings yet
- MSDS Hidro PlastificanteDocument4 pagesMSDS Hidro PlastificantebahiamultimediaNo ratings yet
- Contaminación atmosférica: causas y efectosDocument182 pagesContaminación atmosférica: causas y efectosMercedes MendozaNo ratings yet
- Formulacion y Evaluacion y Control de PR, Germán Arboleda Vélez, 4a EdiciónDocument17 pagesFormulacion y Evaluacion y Control de PR, Germán Arboleda Vélez, 4a EdiciónJuan Camilo GonzalezNo ratings yet
- Analisis de Grados BrixDocument3 pagesAnalisis de Grados BrixAislin FloresNo ratings yet
- Pruebas de Caracterización de Derivados Halogenados.Document7 pagesPruebas de Caracterización de Derivados Halogenados.Melissa CuellarNo ratings yet
- PatoDocument23 pagesPatohugoNo ratings yet
- PPT-PRSSO212-Introducción A Los Procesos Industriales y Mineros-S3 RECDocument35 pagesPPT-PRSSO212-Introducción A Los Procesos Industriales y Mineros-S3 RECOmar Padilla GarciaNo ratings yet
- Calculo de AgregadosDocument15 pagesCalculo de Agregadosmichelk rivasplataNo ratings yet
- 3.4 Seleccion de Electrodos - 1Document14 pages3.4 Seleccion de Electrodos - 1Deyvid MelendezNo ratings yet
- MC 04Document28 pagesMC 04M. A. T. J.No ratings yet
- Examen 1Document5 pagesExamen 1luis sarcoNo ratings yet
- Fichas-Tecnicas-Cableado Estructurado - Norman.Document4 pagesFichas-Tecnicas-Cableado Estructurado - Norman.Alexis FloresNo ratings yet
- Enlace CovalenteDocument3 pagesEnlace CovalenteFERNANDO GARCIA AQUIJENo ratings yet
- ACI 318-XXI-1999 Cap 21 Disposiciones Especiales para El DiDocument19 pagesACI 318-XXI-1999 Cap 21 Disposiciones Especiales para El DiGeorgiosLupusMogueidaNo ratings yet
- Recubrimiento Especial A Base de Resina Acrílica Siliconizada Con Pigmento de Aluminio Pemex Re - 30 Tipo A ModificadoDocument2 pagesRecubrimiento Especial A Base de Resina Acrílica Siliconizada Con Pigmento de Aluminio Pemex Re - 30 Tipo A ModificadoDemetri M. ScytheNo ratings yet
- Ejemplos de ViscosidadDocument2 pagesEjemplos de ViscosidadOmar Baez RomeroNo ratings yet
- Obtención de SemiconductoresDocument9 pagesObtención de SemiconductoresCamilo Casas100% (1)
- Geometria MolecularDocument2 pagesGeometria MolecularHéctor A. SaldivarNo ratings yet
- Modelos de PortadasDocument3 pagesModelos de PortadasRaul LacaveNo ratings yet
- Reductores de FriccionDocument2 pagesReductores de Friccionvictor hugo capchaNo ratings yet
- Ferro Magnetism oDocument8 pagesFerro Magnetism oSandy Davis BathoryNo ratings yet