Professional Documents
Culture Documents
EQUILIBRIO QUIMICO Exercicios
Uploaded by
Vagner EbreOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
EQUILIBRIO QUIMICO Exercicios
Uploaded by
Vagner EbreCopyright:
Available Formats
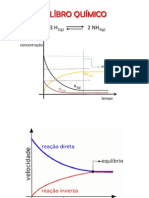
EQUILBRIO QUMICO
01. Trs mols de gs amonaco (NH3) so colocados num recipiente. Com aquecimento conveniente, estabelece o seguinte equilbrio gasoso: 2NH3 N2 + 3H2. Calcular o grau de dissociao (em %) do NH3, sabendo que no equilbrio existem 2,7 mols desse gs.
02. Um mol de gs hidrognio, 0,5 mol de gs oxignio e 2 mols de H2O(g) encontram-se em equilbrio num recipiente de 0,5L de capacidade, a certa temperatura. Determine o valor da constante de equilbrio para o equilbrio: H2O H2 + O2 R: 0,25M
03. Calcule a constante de equilbrio, em termos de concentrao, para a reao representada pela equao qumica SO2 + O2 SO3, sabendo que nas condies de temperatura e presso em que se encontra o sistema existem as seguintes concentraes dos compostos presentes no equilbrio: [SO3]= 0,1M; [O2]= 1,5M e [SO2]= 1,0M. R: 0,0066 M-1
04. Cinco mols de gs amonaco (NH3) so colocados num recipiente. Com aquecimento conveniente, estabelece o seguinte equilbrio gasoso: NH3 N2 + H2. Calcular o grau de dissociao (em %) do NH3, sabendo que no equilbrio existem 4,0 mols desse gs. R: 20%
05. Em um sistema em equilbrio, a 25O C, as concentraes de NOCl(g), NO(g) e Cl2(g) so, respectivamente, 5M, 5x10-5M e 2M. Calcule o Kc a 25O C para a reao NOCl NO + Cl2. R= 2x10-10M
06. Num recipiente de 2 L de capacidade encontra-se o seguinte sistema gasoso em equilbrio: N2 + H2 NH3 . Calcular o valor da constante de equilbrio, sabendo que no equilbrio existem 2 mols de N2, 4 mols de H2 e 1 mol de NH3. R=0,03125 M-2
07. O pentacloreto de fsforo um reagente muito importante em Qumica orgnica . Ele preparado em fase gasosa atravs da reao: PCl3 + Cl2 PCl5. Um frasco de 3 L contm as seguintes quantidades de equilbrio, a 200O C: 0,12 mol de PCl5; 0,600 mol de PCl3 e 0,0120 mol de Cl2. Calcule o valor da constante de equilbrio qumico, a essa temperatura. R= 50 M-1
08. So misturados 2 mols de gs hidrognio (H2) com 3 mols de gs cloro (Cl2) num recipiente fechado de V litros de capacidade, a certa temperatura. Calcular o valor da constante de equilbrio para a formao do gs HCl, sabendo que 80% do gs hidrognio reagiu. R 18,3
09. Efetuando, num recipiente fechado, a certa temperatura, a reao entre dixido de enxofre gasoso (SO2) e gs oxignio (O2), verificou-se que, aps estabelecido o equilbrio, existiam 2 mols de SO2, 1,5 mols de O2 e 4 mols de SO3(g). Sabendo que a capacidade do recipiente de 0,5L, determinar o valor da constante de equilbrio para a reao SO2 + O2 SO3. R:1,33M-1
10. Num recipiente de 2 L de capacidade so colocados 3,6g de H2O(g). Com aquecimento, estabelece-se o equilbrio gasoso: H2O H2 + O2. Sabendo que o grau de dissociao da gua de 5%, calcular a constante de equilbrio qumico. 2H2O 2H2 + 1O2 Inicial 0,2 mol - -
Dissociao 0,2x5% - Reag/Form. 0,01mol 0,01mol 0,005 Equilbrio 0,19mol 0,01mol 0,005
[ ]=
=0,095M
=0,005M
=0,0025M
11. Num recipiente de um litro de capacidade misturam-se 2 mols de CO(g) e 2 mols de O2(g) . A certa temperatura estabelece-se o equilbrio gasoso: CO + O2 CO2 . Calcule o valor da constante Kc para esse equilbrio, sabendo que 90% de CO reagiram. R: 73,6 M-1
12. Dois mols de gs hidrognio so misturados com um mol de gs oxignio num recipiente de 500 mL de capacidade. Determinar o valor da constante de equilbrio para a formao de H2O(g), sabendo que 80% do gs hidrognio reagiram. R: 40 M
13. Um mol de H2O(g) colocado num recipiente de 2 L de capacidade. A determinada temperatura 60% do H2O(g) sofrem decomposio. Determine o valor do Kc para o equilbrio estabelecido. R: 0,34 M
14. Num recipiente fechado encontram-se, a determinada temperatura, 1,8 mols de HCl(g) em equilbrio com H2(g) e Cl2(g). Determine o grau de dissociao do HCl(g) nessa temperatura, sabendo que inicialmente foram colocados 2 mols de HCl(g) no recipiente. R: 10%
15. Foram colocados x mols de HCl(g) num recipiente e, a seguir, aquecidos a uma temperatura t. Atingida a temperatura t, estabelece-se o equilbrio: HCl(g) H2(g) + Cl2(g). Sabendo que no equilbrio existem 1,2 mols de HCl e que o seu grau de dissociao de 30%, calcule o valor de x. R=1,71 mol
16. So colocados 22g de CO2(g) num recipiente de 1,5L de capacidade. A certa temperatura estabelece-se o equilbrio: CO2(g) CO(g) + O2(g) . Determine a constante Kc desse equilbrio, sabendo que o grau de dissociao do dixido de carbono de 10% nessa temperatura. R=2,04x10-4 M
17. No equilbrio gasoso HI H2 + I2 , encontramos as seguintes concentraes molares 10M de H2 e 0,01M de I2. Qual a concentrao molar do HI, sabendo que, nas condies de experincia, Kc vale 10-3. R=10
18. Um mol de gs hidrognio e um mol de I2(g) so misturados a 500O C. As substncias reagem e, aps certo tempo, chega-se a um equilbrio, onde se constata a presena de 0,22 mol de hidrognio residual. Qual a constante de equilbrio Kc, nessas condies para a reao H2 + I2 HI? R=50,28
19. Considere o seguinte sistema em equilbrio: H2(g) + Cl2(g) HCl(g) , Verifica-se que, para esse equilbrio, a certa temperatura, as presses parciais dos componentes so: pH2 = 0,5 atm; pCl2 = 0,4 atm e pHCl = 0,6 atm. Determinar o valor da constante de equilbrio em termos de presses parciais (Kp).
20. Calcule o valor do Kp do sistema gasoso em equilbrio: N2 + H2 NH3 sabendo que, nesse equilbrio, a determinada temperatura, as presses parciais dos componentes so pN2 = 0,5 atm; pH2 =1,5 atm e pNH3 = 2 atm. R= 2,37 atm-2
21. A certa temperatura as presses parciais dos componentes, no equilbrio gasoso: H2 + O2 H2O so pH2 =0,6 atm; pO2 =0,2 atm e pH2O = 0,8 atm. Determine o valor do Kp. R= 8,9 atm1
22. Num recipiente de 2 L de capacidade encontram-se 1,8g de H2O(g), 2,0g de H2(g) e 1,6g de O2(g) em equilbrio, a 427OC. Calcule o valor da constante de equilbrio em termos de presses parciais (Kp) para o equilbrio gasoso: H2O H2 + O2 .
23. O equilbrio gasoso H2 + Cl2 HCl se estabelece, a 27O C, com 4,0g de H2 , 35,5g de Cl2 e 73,0g de HCl num recipiente de 1 L de capacidade. Calcule o valor da constante Kp. R= 4
24. A 27O C, a constante Kc do equilbrio gasoso H2 + Cl2 HCl vale 20. Calcule o valor da constante Kp. R= 20
25. Num recipiente fechado so introduzidos 20 mols de HI(g). Aquecendo esse recipiente a 450O C, verifica-se que o equilbrio se estabelece com a decomposio de 25% do HI. Calcule o valor de Kc e Kp para o equilbrio gasoso HI H2 + I2. R= 0,028 e 0,028
26. Calcule o valor da constante de equilbrio em termos de presses parciais, a 127O C, para o equilbrio gasoso SO2 + O2 SO3 , sabendo que a constante de equilbrio qumico vale 40 M-1. R= 1,22 atm-1
27. Um recipiente fechado contm, a 450O C, 13g de gs hidrognio, 508g de I2(g) e 1920g de HI(g) em equilbrio, segundo a equao H2 + I2 HI. Calcule o valor de Kc e Kp. R= 17,3 e 17,3
28. A constante Kp do equilbrio gasoso NO + O2 NO2 igual a 0,04 atm-1, a 147O C. Descubra o valor da constante Kc. R= 1,38 M-1
29. So aquecidos, a 527O C, 5,1g de NH3(g) num recipiente de 800 mL de capacidade. Calcule o valor de Kc e Kp para o equilbrio gasoso NH3 N2 + H2 , sabendo que 5% do NH3 se dissociam. R= 1,63x10-6M2; 7,0x10-3 atm2
30. No equilbrio gasoso CO + O2 CO2 , o Kc vale 2,24x1022, a 727O C. Qual o valor de Kp na mesma temperatura? R= 2,73x1020 atm-1
31. Num recipiente fechado mantido a temperatura constante foram introduzidos monxido de carbono e vapor de gua em quantidades tais que suas presses parciais eram iguais e valiam 0,856 atm cada uma. Aps certo tempo, estabeleceu-se o equilbrio gasoso CO + H2O CO2 + H2. Medindo-se ento a presso parcial de CO, obteve-se 0,580 atm. Qual o valor da constante de equilbrio Kp? CO + H2O CO2 + H2 Inicial 0,856 atm 0,856 atm - -
Reag/Form. 0,276 atm 0,276 atm 0,276 atm 0,276atm Equilbrio 0,580 atm 0,276 atm 0,276 atm 0,276atm
32. Calcule o valor do Kc, a 47O C, do equilbrio gasoso ClO2 Cl2 + O2 , sabendo que nessa temperatura a constante Kp igual a 0,8 atm. R= 0,03M
33. A presso de um sistema gasoso constitudo por CO2, O2 e CO, em equilbrio, de 2 atm, a dada temperatura. Tendo em conta que no sistema em questo existem 30% de CO2 e 20% de O2, em volume, calcule: a) a presso parcial de CO; b) a constante de equilbrio do sistema CO2 O2 + CO em termos de presso; c) a constante de equilbrio em termos de presso para a reao inversa. % de CO = 100 (% de CO2 + % de O2) % de CO = 100 (20+30) % de CO = 50% PCO = % de CO x PTotal PCO = 0,5 x 2 atm PCO = 1,0 atm (1 resposta) PCO2 = % de CO2 x PTotal PCO2 = 0,3 x 2 atm PCO2 = 0,6 atm PO2 = % de O2 x PTotal PO2 = 0,2 x 2 atm PO2 = 0,4 atm
b)
c)
34. Calcule a constante de equilbrio em termos de presso parcial para a reao CO + H2O CO2 + H2 em fase gasosa, sabendo que num recipiente de 20 L de capacidade, mantido a 1727O C, esto em equilbrio 0,855 mol de CO, 0,855 mol de H2O, 1,145 mol de CO2 e 0,145 mol de H2. R=0,227 (Kp=Kc)
35. Num recipiente fechado, indeformvel e a uma dada temperatura, aquece-se 0,4 mol de NH3. Estabelecido o equilbrio NH3 N2 + H2 verifica-se que h 0,30 mol de hidrognio no sistema. Calcule o grau de dissociao trmica do NH3, quela temperatura. R= 50%
36. Em um recipiente de 500 mL, encontram-se, em condies de equilbrio, 0,48g de NO2 e 2g de N2O4. Calcule a constante de equilbrio, em termos de concentrao, para a reao NO2 N2O4. R=100,31M-1
37. temperatura de 25O C temos: H+ + OH- H2O velocidade da reao: v1= 1011 [H+][OH-] e H2O H+ + OH- velocidade da reao: v2= 2x10-5 [H2O] Qual deve ser, a 25O C, o valor da constante de equilbrio da reao representada por H+ + OH H2O?
38. Calcular o Kc da reao gasosa H2 + S2 H2S, a 750OC, sabendo que num recipiente de 90L de capacidade esto em equilbrio, 13,7g de H2, 9,2x10-3g de enxofre e 285,6g de
sulfidreto. Calcular tambm o Kc da reao inversa na mesma temperatura. R=9,4x105 M-1 e 1,06x10-6M
39. Num recipiente de 10L, esto em equilbrio, a 727O C e sob presso total de 224 atm, 3,74L de N2, 5,89L de H2 e 0,37L de NH3. Calcular o Kc do equilbrio N2 + H2 NH3, nas condies da experincia.
You might also like
- Resolução Ficha Formativa Quantidade Química TEDocument3 pagesResolução Ficha Formativa Quantidade Química TEMiguel Angélico GonçalvesNo ratings yet
- Teste 1 10 - VIDocument9 pagesTeste 1 10 - VICatarina MatosNo ratings yet
- Areal Editores Exame 10anoDocument5 pagesAreal Editores Exame 10anoNuno SantosNo ratings yet
- Aval Global e Prep Exame1 Dominio 1 PDFDocument26 pagesAval Global e Prep Exame1 Dominio 1 PDFMaria FilipeNo ratings yet
- F-Trabalho 6 - Energia - Fenomenos Termicos e Radiaà à oDocument4 pagesF-Trabalho 6 - Energia - Fenomenos Termicos e Radiaà à ocatarina fariaNo ratings yet
- 1-Simulação Q 11 RápidasDocument4 pages1-Simulação Q 11 RápidasSérgio MarquesNo ratings yet
- BG10 TesteBioGeo Temas4 5abio 2013 PDFDocument4 pagesBG10 TesteBioGeo Temas4 5abio 2013 PDFBeatriz AndradeNo ratings yet
- Acerto Redox-RegrasDocument7 pagesAcerto Redox-RegrasRosa Maria PaisNo ratings yet
- Ficha Gases e DispersoesDocument7 pagesFicha Gases e DispersoesSusana Maria Cunha TeixeiraNo ratings yet
- 9 - Digestao Intracelular Importancia Do Sistema Endomembranar - CCDocument3 pages9 - Digestao Intracelular Importancia Do Sistema Endomembranar - CCKim SunheeNo ratings yet
- 00 Redox ExercíciosDocument5 pages00 Redox Exercíciosapi-27441481100% (1)
- 11 - Ficha - 6 Produto EscalarDocument2 pages11 - Ficha - 6 Produto EscalarMaria JoãoNo ratings yet
- Ficha Nº 14 - Concentração de SoluçõesDocument5 pagesFicha Nº 14 - Concentração de Soluçõesc2mfNo ratings yet
- Teste 1 (2017-2018)Document5 pagesTeste 1 (2017-2018).No ratings yet
- Ciencias 9ºDocument5 pagesCiencias 9ºfranquimico0% (1)
- Exercicios Geometria Molecular e PolaridadeDocument3 pagesExercicios Geometria Molecular e PolaridadeAdriano Jaime AdryNo ratings yet
- Ficha de Trabalho - Parte 2 - 11º CT1 - SE1Document5 pagesFicha de Trabalho - Parte 2 - 11º CT1 - SE1Manuel HliveNo ratings yet
- Ficha Acido BaseDocument4 pagesFicha Acido Basejoao sequeiraNo ratings yet
- Ficha Biologia 10Document2 pagesFicha Biologia 10Filimone ThumboNo ratings yet
- Lista de Exercícios Química Orgânica - UNESP Prof. BeatrizDocument4 pagesLista de Exercícios Química Orgânica - UNESP Prof. BeatrizAlexandra RuizNo ratings yet
- Polaridade Moleculas Exerc ResolvidosDocument6 pagesPolaridade Moleculas Exerc ResolvidosIara Daher100% (1)
- Docsity Ficha FQ 10o Ano HidrocarbonetosDocument6 pagesDocsity Ficha FQ 10o Ano HidrocarbonetosMariana PereiraNo ratings yet
- Novo 10Q Teste3)Document7 pagesNovo 10Q Teste3)Tomás SilveiraNo ratings yet
- FQ 7 AnoDocument4 pagesFQ 7 AnoMaria FigueiredoNo ratings yet
- Relatório Solução TampãoDocument11 pagesRelatório Solução TampãoVanessa NovaisNo ratings yet
- Ficha de Filosofia PDFDocument2 pagesFicha de Filosofia PDFcarolina Lopes0% (1)
- Ficha Formativa 1 - Cálculos Estequiométricos - Reagente LimitanteDocument4 pagesFicha Formativa 1 - Cálculos Estequiométricos - Reagente LimitanteLara FerreiraNo ratings yet
- Ficha Formativa Q1.2 N.º 1 - 10FQADocument5 pagesFicha Formativa Q1.2 N.º 1 - 10FQAAlexandre PereiraNo ratings yet
- 1o Teste q12 2Document4 pages1o Teste q12 2Madalena DuqueNo ratings yet
- Ficha EstequiometriaDocument7 pagesFicha EstequiometriaPaulo Santos100% (1)
- 1º Teste 12º Ano 2017-2018Document4 pages1º Teste 12º Ano 2017-2018Luis ColaçoNo ratings yet
- FICHA INFORMATIVA - Fotossíntese e QuimiossínteseDocument6 pagesFICHA INFORMATIVA - Fotossíntese e QuimiossínteseMerabi DaganidzeNo ratings yet
- Ficha Hereditariedade 9 AnoDocument4 pagesFicha Hereditariedade 9 Anocarla miguelNo ratings yet
- Quimica Geral Exercicios Resolvidos Ligacoes Quimicas PDFDocument16 pagesQuimica Geral Exercicios Resolvidos Ligacoes Quimicas PDFamydylanNo ratings yet
- Relatório Laboratorial - Acido Forte - Base ForteDocument12 pagesRelatório Laboratorial - Acido Forte - Base ForteSofiaPinheiro100% (2)
- Microsoft Word - Q11 AL23 Titulação PDFDocument12 pagesMicrosoft Word - Q11 AL23 Titulação PDFTiago PiresNo ratings yet
- Funcionamento de Uma Solução-TampãoDocument12 pagesFuncionamento de Uma Solução-TampãocubigrafNo ratings yet
- Santillana M11 Ficha Avaliacao Dominio-3Document4 pagesSantillana M11 Ficha Avaliacao Dominio-3Ricardo Silva100% (1)
- Ficha Formativa Quantidade Química TEDocument3 pagesFicha Formativa Quantidade Química TEMiguel Angélico Gonçalves100% (1)
- Lista1 Exercicios ADocument4 pagesLista1 Exercicios ALucas TestaNo ratings yet
- AL 3.2 Capacidade Térmica MássicaDocument2 pagesAL 3.2 Capacidade Térmica Mássicajessica100% (1)
- Questoes BiologiaDocument7 pagesQuestoes BiologiamarcusvquimicoNo ratings yet
- Exe EquilibrioDocument48 pagesExe Equilibrioruannamsb4596100% (2)
- Ficha Diagnóstica 8º Ano CNDocument10 pagesFicha Diagnóstica 8º Ano CNJoana CunhaNo ratings yet
- Questoes Globalizantes Quimica PDFDocument24 pagesQuestoes Globalizantes Quimica PDFGogo111111No ratings yet
- Gabarito Ae2 Biologia 1º AnoDocument8 pagesGabarito Ae2 Biologia 1º AnoAntonio CorreiaNo ratings yet
- Teste Q2Document2 pagesTeste Q2leonor1306No ratings yet
- Principio de LechatelierDocument34 pagesPrincipio de LechatelierjparatyNo ratings yet
- Hidrocarbonetos Ramificado. Lista de ExercíciosDocument10 pagesHidrocarbonetos Ramificado. Lista de ExercíciosDenis Claudio Silva BarrosNo ratings yet
- Amor - Perdicao - Resumo de ConteúdosDocument18 pagesAmor - Perdicao - Resumo de ConteúdosDavidNo ratings yet
- Equilíbrio QuímicoDocument8 pagesEquilíbrio Químicoprofmarkao0% (1)
- Lista de Exercícios Equlíbrio QuímicoDocument2 pagesLista de Exercícios Equlíbrio QuímicoBrandie ThompsonNo ratings yet
- Exerc EquilibrioDocument4 pagesExerc EquilibrioJr FantinellNo ratings yet
- Equilíbrio QuímicoDocument2 pagesEquilíbrio QuímicoGerson SilvaNo ratings yet
- 1 Lista de Atividades de Equilíbrio QuímicoDocument4 pages1 Lista de Atividades de Equilíbrio QuímicoDavid RonaldNo ratings yet
- Lista Equilibrio QuimicoDocument3 pagesLista Equilibrio QuimicoAline MirandaNo ratings yet
- 135Document4 pages135mailas33No ratings yet
- Equi Lib Rio CompletoDocument50 pagesEqui Lib Rio CompletoLeonardo JunglesNo ratings yet
- Lista Equilibrio Quimico 2012Document12 pagesLista Equilibrio Quimico 2012Luelc SouzaNo ratings yet
- AP1 AntigaDocument3 pagesAP1 AntigaVagner EbreNo ratings yet
- Matriz - Matem Tica 20171 7owmhz1e6yvsvgc06012017Document2 pagesMatriz - Matem Tica 20171 7owmhz1e6yvsvgc06012017Vagner EbreNo ratings yet
- Resumo FísicaDocument1 pageResumo FísicaVagner EbreNo ratings yet
- Poesias Adrianne OgedaDocument11 pagesPoesias Adrianne OgedaVagner EbreNo ratings yet
- 18Document2 pages18jhorge3No ratings yet
- Crase Regras AugustoDocument2 pagesCrase Regras AugustoVagner EbreNo ratings yet
- Impulso ResumoDocument1 pageImpulso ResumoVagner EbreNo ratings yet
- Avaliação e EducaçãoDocument3 pagesAvaliação e EducaçãoVagner EbreNo ratings yet
- Guia Estagio 3Document10 pagesGuia Estagio 3Vagner EbreNo ratings yet
- ÁreasDocument3 pagesÁreasLuiz Gustavo da SilvaNo ratings yet
- Ísica: Esolução Das Atividades ComplementaresDocument45 pagesÍsica: Esolução Das Atividades ComplementaresSavio Phelipe50% (2)
- Resumo FísicaDocument4 pagesResumo Físicajoaogml100% (2)
- TC de Revisao Gabaritado 3etapaDocument4 pagesTC de Revisao Gabaritado 3etapaRômulo RodriguesNo ratings yet
- RESUMO TEXTOS AvaliaçãoDocument33 pagesRESUMO TEXTOS AvaliaçãoVagner EbreNo ratings yet
- Tópicos ResumoDocument18 pagesTópicos ResumoVagner EbreNo ratings yet
- Guia Estagio 3Document10 pagesGuia Estagio 3Vagner EbreNo ratings yet
- C1 Curso e Tarefa FisicaDocument12 pagesC1 Curso e Tarefa FisicaVinicius BorgesNo ratings yet
- Ciências 2 ResumoDocument11 pagesCiências 2 ResumoVagner EbreNo ratings yet
- Quimica Lista de Exercicios para Recuperacao 1 SemDocument6 pagesQuimica Lista de Exercicios para Recuperacao 1 SemVagner EbreNo ratings yet
- ResoluçõesDocument3 pagesResoluçõesVagner EbreNo ratings yet
- Alfa 2 ResumoDocument12 pagesAlfa 2 ResumoVagner EbreNo ratings yet
- Alfa 2 ResumoDocument12 pagesAlfa 2 ResumoVagner EbreNo ratings yet
- RESUMO TEXTOS AvaliaçãoDocument33 pagesRESUMO TEXTOS AvaliaçãoVagner EbreNo ratings yet
- Exe Mat 8a 02Document2 pagesExe Mat 8a 02Vagner EbreNo ratings yet
- Funcoes InorganicasDocument48 pagesFuncoes InorganicasVagner EbreNo ratings yet
- Resumo Geo 2 - Ap2Document23 pagesResumo Geo 2 - Ap2Vagner EbreNo ratings yet
- Movimentos - ResumoDocument27 pagesMovimentos - ResumoVagner EbreNo ratings yet
- Geo 2 - ResumoDocument19 pagesGeo 2 - ResumoVagner EbreNo ratings yet
- Resumo CN1Document34 pagesResumo CN1Vagner EbreNo ratings yet
- ParÂmetros Curriculares NacionaisDocument90 pagesParÂmetros Curriculares NacionaisAlfonso Gómez PaivaNo ratings yet
- N 0115Document125 pagesN 0115sabrunoNo ratings yet
- Exercício - Química Analítica Qualitativa - Prof. Fernanda Gomes - 20200416042838Document5 pagesExercício - Química Analítica Qualitativa - Prof. Fernanda Gomes - 20200416042838PROF. ALANO PITOMBEIRANo ratings yet
- Data Sheet Loctite 620Document3 pagesData Sheet Loctite 620Reginaldo AlvesNo ratings yet
- Manual Caldera Ariston Genus One UsuarioDocument28 pagesManual Caldera Ariston Genus One UsuarioJosu ENo ratings yet
- 8800 - Estrutura de AçoDocument10 pages8800 - Estrutura de AçoCipriano NetoNo ratings yet
- Prova Quím 1c MatDocument2 pagesProva Quím 1c MatjuscilaineNo ratings yet
- Resmat 1Document26 pagesResmat 1jose salgueiro100% (2)
- Enzimas e BioenergeticaDocument49 pagesEnzimas e BioenergeticaRones Dias100% (1)
- NBR 14643-2001-Corrosao-Atmosferica-Classificacaodacorrosividadedeatmosferas PDFDocument12 pagesNBR 14643-2001-Corrosao-Atmosferica-Classificacaodacorrosividadedeatmosferas PDFAna Cristina dos Santos CarvalhoNo ratings yet
- Componentes Gerais de Uma Bomba CentrífugaDocument8 pagesComponentes Gerais de Uma Bomba CentrífugaJean MendesNo ratings yet
- Motor Acionador, Remoção MCBDocument5 pagesMotor Acionador, Remoção MCBAlexandreNo ratings yet
- MODULO 1 - Introducao Ao Comportamento Das EstruturasDocument28 pagesMODULO 1 - Introducao Ao Comportamento Das EstruturasInacio Mauricio TomasNo ratings yet
- Apostila Mecanica Dos Solos IIDocument122 pagesApostila Mecanica Dos Solos IIRaiane100% (1)
- Física Quântica e EspiritualidadeDocument12 pagesFísica Quântica e EspiritualidadeRoberto Brandão Vargas JúniorNo ratings yet
- Mod 06 Materiais e Equiapamentos FísicosDocument357 pagesMod 06 Materiais e Equiapamentos FísicosDaniel MotaNo ratings yet
- EAOEARDocument2 pagesEAOEARFigueredo ConcurseiroNo ratings yet
- Magnetismo TerceiroDocument3 pagesMagnetismo TerceiroÉder MartinsNo ratings yet
- Exercícios de Fixação - OP IIDocument11 pagesExercícios de Fixação - OP IIGabriela OliverNo ratings yet
- Perguntas e Respostas Sobre Refrigeração e ClimatizaçãoDocument37 pagesPerguntas e Respostas Sobre Refrigeração e Climatizaçãogilbertofb87% (15)
- Tratores John DereDocument4 pagesTratores John DereVITOR GABRIEL100% (1)
- Saint Gobain - ComportaDocument2 pagesSaint Gobain - ComportaBruceMoraisNo ratings yet
- Abnt CB 02 NBR 14323 PDFDocument75 pagesAbnt CB 02 NBR 14323 PDFWilliamNo ratings yet
- 03 - Lista - 1 - (Estudo - Dos - Gases - 2° - Ano)Document2 pages03 - Lista - 1 - (Estudo - Dos - Gases - 2° - Ano)yasmim SOARESNo ratings yet
- Prova UNICAMP 2020 Física ComentadaDocument23 pagesProva UNICAMP 2020 Física ComentadaMarceleNo ratings yet
- Curso 12168 Aula 10 v1Document80 pagesCurso 12168 Aula 10 v1Gerson GersonNo ratings yet
- Ficha 2 - Extensão Das ReaçõesDocument3 pagesFicha 2 - Extensão Das ReaçõesRafael TeixeiraNo ratings yet
- Física Geral e Experimental: MecânicaDocument12 pagesFísica Geral e Experimental: MecânicaRodrigo_Miguel_CENo ratings yet
- C - Corte PuroDocument8 pagesC - Corte PuroReginaldo G SoaresNo ratings yet
- Física Quântica e Espiritualidade - Aula 1Document11 pagesFísica Quântica e Espiritualidade - Aula 1Roberto Brandão Vargas Júnior100% (1)