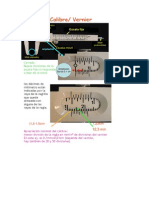
Professional Documents
Culture Documents
Investigacion Maquinas Termicas
Uploaded by
Deivis Rojas HerreraCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Investigacion Maquinas Termicas
Uploaded by
Deivis Rojas HerreraCopyright:
Available Formats
Un gas ideal es un gas terico compuesto de un conjunto de partculas puntuales con desplazamiento aleatorio que no interactan entre s.
El concepto de gas ideal es til porque el mismo se comporta segn la ley de los gases ideales, una ecuacin de estado simplificada, y que puede ser analizada mediante la mecnica estadstica. En condiciones normales tales como condiciones normales de presin y temperatura, la mayora de los gases reales se comporta en forma cualitativa como un gas ideal. Muchos gases tales como el aire, nitrgeno, oxgeno, hidrgeno, gases nobles, y algunos gases pesados tales como el dixido de carbono pueden ser tratados como gases ideales dentro de una tolerancia razonable.1 Generalmente, el apartamiento de las condiciones de gas ideal tiende a ser menor a mayores temperaturas y a menor densidad (o sea a menor presin),1 ya que el trabajo realizado por las fuerzas intermoleculares es menos importante comparado con energa cintica de las partculas, y el tamao de las molculas es menos importante comparado con el espacio vaco entre ellas. El modelo de gas ideal tiende a fallar a temperaturas menores o a presiones elevadas, cuando las fuerzas intermoleculares y el tamao intermolecular es importante. Tambin por lo general, el modelo de gas ideal no es apropiado para la mayora de los gases pesados, tales como vapor de agua o muchos fluidos refrigerantes.1 A ciertas temperaturas bajas y a alta presin, los gases reales sufren una transicin de fase, tales como a un lquido o a un slido. El modelo de un gas ideal, sin embargo, no describe o permite las transiciones de fase. Estos fenmenos deben ser modelados por ecuaciones de estado ms complejas. El ciclo de Carnot se produce cuando un equipo que trabaja absorbiendo una cantidad de calor Q1 de la fuente de alta temperatura y cede un calor Q2 a la de baja temperatura produciendo un trabajo sobre el exterior. El rendimiento viene definido por
y, como se ver adelante, es mayor que cualquier mquina que funcione cclicamente entre las mismas fuentes de temperatura. Una mquina trmica que realiza este ciclo se denomina mquina de Carnot. Como todos los procesos que tienen lugar en el ciclo ideal son reversibles, el ciclo puede invertirse. Entonces la mquina absorbe calor de la fuente fra y cede calor a la fuente caliente, teniendo que suministrar trabajo a la mquina. Si el objetivo de esta mquina es extraer calor de la fuente fra se denomina mquina frigorfica, y si es ceder calor a la fuente caliente, bomba de calor.
El ciclo de Carnot consta de cuatro etapas: dos procesos isotermos (a temperatura constante) y dos adiabticos (aislados trmicamente). Las aplicaciones del Primer principio de la termodinmica estn escritos acorde con el Criterio de signos termodinmico. Expansin isoterma: (proceso 1 2 en el diagrama) Se parte de una situacin en que el gas se encuentra al mnimo volumen del ciclo y a temperatura T 1 de la fuente caliente. En este estado se transfiere calor al cilindro desde la fuente de temperatura T 1, haciendo que el gas se expanda. Al
expandirse, el gas tiende a enfriarse, pero absorbe calor de T 1 y mantiene su temperatura constante. Al tratarse de un gas ideal, al no cambiar la temperatura tampoco lo hace su energa interna, y despreciando los cambios en la energa potencial y lacintica, a partir de la 1 ley de la termodinmica vemos que todo el calor transferido es convertido en trabajo:
Desde el punto de vista de la entropa, sta aumenta en este proceso: por definicin, una variacin de entropa viene dada por el cociente entre el calor transferido y la temperatura de la fuente en un
proceso reversible:
. Como el proceso es efectivamente reversible, la entropa
aumentar Expansin adiabtica: (2 3) La expansin isoterma termina en un punto tal que el resto de la expansin pueda realizarse sin intercambio de calor. A partir de aqu el sistema se asla trmicamente, con lo que no hay transferencia de calor con el exterior. Esta expansin adiabtica hace que el gas se enfre hasta alcanzar exactamente la temperatura T2 en el momento en que el gas alcanza su volumen mximo. Al enfriarse disminuye su energa interna, con lo que utilizando un razonamiento anlogo al anterior proceso:
Esta vez, al no haber transferencia de calor, la entropa se mantiene constante: Compresin isoterma: (3 4) Se pone en contacto con el sistema la fuente de calor de temperatura T2 y el gas comienza a comprimirse, pero no aumenta su temperatura porque va cediendo calor a la fuente fra. Al no cambiar la temperatura tampoco lo hace la energa interna, y la cesin de calor implica que hay que hacer un trabajo sobre el sistema:
Al ser el calor negativo, la entropa disminuye: Compresin adiabtica: (4 1) Aislado trmicamente, el sistema evoluciona comprimindose y aumentando su temperatura hasta el estado inicial. La energa interna aumenta y el calor es nulo, habiendo que comunicar un trabajo al sistema:
Al ser un proceso adiabtico, no hay transferencia de calor, por lo tanto la entropa no vara: [editar]Trabajo
del ciclo
Por convencin de signos, un signo negativo significa lo contrario. Es decir, un trabajo negativo significa que el trabajo es realizado sobre el sistema. Con este convenio de signos el trabajo obtenido deber ser, por lo tanto, negativo. Tal como est definido, y despreciando los cambios en energa mecnica, a partir de la primera ley:
Como dU (diferencial de la energa interna) es una diferencial exacta, el valor de U es el mismo al inicio y al final del ciclo, y es independiente del camino, por lo tanto la integral de dU vale cero, con lo que queda
Por lo tanto, en el ciclo el sistema ha realizado un trabajo sobre el exterior.
El ciclo Otto es el ciclo termodinmico que se aplica en los motores de combustin interna de encendido provocado (motores de gasolina). Se caracteriza porque en una primera aproximacin terica, todo el calor se aporta a volumen constante.
El proceso consta de seis etapas: 01 - Admisin: la vlvula de admisin se abre, permitiendo la entrada en el cilindro de la mezcla de aire y gasolina. Al finalizar esta primera etapa, la vlvula de admisin se cierra. El pistn se desplaza hasta el denominado punto muerto inferior (PMI).
12 - Compresin adiabtica: la mezcla de aire y gasolina se comprime sin intercambiar calor con el exterior. La transformacin es por tanto isentrpica. La posicin que alcanza el pistn se denomina punto muerto superior (PMS). El trabajo realizado por la mezcla en esta etapa es negativo, ya que sta se comprime. 23 - Explosin: la buja se activa, salta una chispa y la mezcla se enciende. Durante esta transformacin la presin aumenta a volumen constante. 34 - Expansin adiabtica: la mezcla se expande adiabticamente. Durante este proceso, la energa qumica liberada durante la combustin se transforma en energa mecnica, ya que el trabajo durante esta transformacin es positivo. 41 - Enfriamiento iscoro: durante esta etapa la presin disminuye y la mezcla se enfra liberndose calor al exterior. 10 - Escape: la vlvula de escape se abre, expulsando al exterior los productos de la combustin. Al finalizar esta etapa el proceso vuelve a comenzar. El trabajo total realizado durante el ciclo es positivo (ya que ste se recorre en sentido horario). Como se observa el la parte izquierda de la animacin, el trabajo realizado por el sistema durante las etapas 01 y 10 es igual en valor absoluto pero de signo contrario, por lo que no contribuyen al trabajo total.
El movimiento del pistn se transmite a la biela (representada en naranja en la figura) y de sta al cigeal. Posteriormente este movimiento se transmite a las ruedas.
You might also like
- Teoria de ControlDocument2 pagesTeoria de ControlDeivis Rojas HerreraNo ratings yet
- Clasificación en Función Del Origen - : 1° Describir El Proceso Del Mantenimiento Basado en FalloDocument2 pagesClasificación en Función Del Origen - : 1° Describir El Proceso Del Mantenimiento Basado en FalloDeivis Rojas HerreraNo ratings yet
- EYECTORESDocument7 pagesEYECTORESl24n1rd4No ratings yet
- Introduccion A Los Sistemas de ControlDocument10 pagesIntroduccion A Los Sistemas de ControlDeivis Rojas HerreraNo ratings yet
- 1 ClasewebDocument19 pages1 ClasewebDeivis Rojas HerreraNo ratings yet
- Calibre Pie de ReyDocument11 pagesCalibre Pie de ReyDeivis Rojas HerreraNo ratings yet
- Clase 3 Calibre PDFDocument3 pagesClase 3 Calibre PDFDeivis Rojas HerreraNo ratings yet
- Guia Didactica de Ejercicios Tema 5 TurbinasDocument56 pagesGuia Didactica de Ejercicios Tema 5 Turbinasluis gustavo morocco quispeNo ratings yet
- Análisis Mecánico - SolidWorksDocument30 pagesAnálisis Mecánico - SolidWorksJosé A. Ramírez100% (2)
- Teorias de Falla en Elementos MetalicosDocument69 pagesTeorias de Falla en Elementos MetalicosJorge Andres PavónNo ratings yet
- Proteccion Contra La CorrosioinDocument15 pagesProteccion Contra La CorrosioinDeivis Rojas HerreraNo ratings yet
- Fulll Viscosidad...Document48 pagesFulll Viscosidad...Antonio ManriqueNo ratings yet
- 05 VernierDocument11 pages05 VernierofroNo ratings yet
- TermoquimicaDocument51 pagesTermoquimicaHancco Quispe Ricards0% (1)
- CorrosionDocument27 pagesCorrosionDeivis Rojas HerreraNo ratings yet
- Concepto EnergiaDocument6 pagesConcepto EnergiacastilloNo ratings yet
- Elultrasonido 120627175217 Phpapp01Document13 pagesElultrasonido 120627175217 Phpapp01Deivis Rojas HerreraNo ratings yet
- Concentradores de TensionesDocument19 pagesConcentradores de TensionesDaniel LezamaNo ratings yet
- Teoria de FallaDocument5 pagesTeoria de FallaDeivis Rojas HerreraNo ratings yet
- Automaestria LibroDocument63 pagesAutomaestria LibroValeria Aguedo PalaciosNo ratings yet
- Formato de Horario de ClasesDocument1 pageFormato de Horario de ClasesDeivis Rojas HerreraNo ratings yet
- Teorías de Falla Bajo Cargas EstáticasDocument11 pagesTeorías de Falla Bajo Cargas Estáticascadecastro100% (3)
- Capitulo 1 Sistemas LinealesDocument21 pagesCapitulo 1 Sistemas LinealesJosue P. PenicheNo ratings yet
- ALIJABDocument91 pagesALIJABDeivis Rojas HerreraNo ratings yet
- Particulas MagneticasDocument2 pagesParticulas MagneticasIleana SanchezNo ratings yet
- Mundos de Eter Graciela BarbuloDocument81 pagesMundos de Eter Graciela BarbuloDeivis Rojas HerreraNo ratings yet
- Alianza Con El AmorDocument55 pagesAlianza Con El Amorcristal999100% (1)
- Los Hijos de Los DiosesDocument84 pagesLos Hijos de Los DiosesLizNo ratings yet
- ElcaminoDocument98 pagesElcaminomayantigoNo ratings yet
- Particulas MagneticasDocument53 pagesParticulas MagneticasEduardo Rodriguez AlvarezNo ratings yet
- Litio Metálico IIDocument131 pagesLitio Metálico IIYahaira Barrueto JhonsonNo ratings yet
- Paint Car-O2-Platinum-SPDocument3 pagesPaint Car-O2-Platinum-SPAlejandro Caramés TabaresNo ratings yet
- MANEJO AMBIENTAL DEL PlásticoDocument29 pagesMANEJO AMBIENTAL DEL PlásticoNancy Mercedes Quispe Cruz0% (1)
- Ejercicios Ingenieria IIDocument23 pagesEjercicios Ingenieria IISugar Daddy0% (5)
- Los FullerenosDocument2 pagesLos FullerenosAlfredo Serna100% (1)
- Presupuesto Inicial GeneralDocument8 pagesPresupuesto Inicial GeneralRenzo Jair Arestegui TacuriNo ratings yet
- La Importancia de La Actividad Minera en El PeruDocument35 pagesLa Importancia de La Actividad Minera en El PeruKarenThaliaArizaAlvaradoNo ratings yet
- Temario Rocas Igneas - ConstruminDocument3 pagesTemario Rocas Igneas - ConstruminYute ManilaNo ratings yet
- Informe 1 Sintesis Org.Document7 pagesInforme 1 Sintesis Org.Omar Jhusset Quintero CastroNo ratings yet
- Cuadro ComparativoDocument3 pagesCuadro ComparativoGhersi DE LA CruzNo ratings yet
- Brochure Tecniflow 2020Document6 pagesBrochure Tecniflow 2020Karmen Rosa Mas HuamaniNo ratings yet
- Almacenamiento Preservacion y Manipulacion de Materiales PDFDocument17 pagesAlmacenamiento Preservacion y Manipulacion de Materiales PDFEstefani Y L100% (1)
- Tema 5Document29 pagesTema 5maxlarrea5544No ratings yet
- Estado LíquidoDocument15 pagesEstado LíquidoTomas QuispeNo ratings yet
- 3S - EBIM - QUIM - BIM04 - Varios - Formularios de Google PDFDocument5 pages3S - EBIM - QUIM - BIM04 - Varios - Formularios de Google PDFPedro Luis Almeyda RamírezNo ratings yet
- Laboratorio de Mecánica de Solidos I Reporte 1 TraccionDocument6 pagesLaboratorio de Mecánica de Solidos I Reporte 1 TraccionGustavoAraujoNo ratings yet
- Tubos Cuadrados y Rectangulares PDFDocument1 pageTubos Cuadrados y Rectangulares PDFRuben PintoNo ratings yet
- CalicatasDocument14 pagesCalicatasrafhael arias zevallosNo ratings yet
- Entrepiso MaderapinoDocument1 pageEntrepiso MaderapinoGonzalo NavarroNo ratings yet
- Trabajo N°1.1Document3 pagesTrabajo N°1.1Jordana ChávezNo ratings yet
- Calor de ReaccionDocument6 pagesCalor de ReaccionLaura StylesNo ratings yet
- 5 1 Fertilizantes y Abonos Organicos 20Document62 pages5 1 Fertilizantes y Abonos Organicos 20Jose Manuel Lara PeñaNo ratings yet
- Trabajo Escalonado de Pavimentos-UpnDocument26 pagesTrabajo Escalonado de Pavimentos-UpnJota YTNo ratings yet
- Aseguramiento de FlujoDocument10 pagesAseguramiento de FlujoJorge De La VegaNo ratings yet
- Permiso de Salida Vista Florida - 2023-12-15 (FP)Document1 pagePermiso de Salida Vista Florida - 2023-12-15 (FP)Ciro Yanac PorrasNo ratings yet
- Version 4. ProblemarioDocument109 pagesVersion 4. Problemarioenrique ramirezNo ratings yet
- Tema IV Calentamiento Indirecto - Aislación Térmica - ProducDocument20 pagesTema IV Calentamiento Indirecto - Aislación Térmica - ProducAntonio AyonNo ratings yet
- Catalogo Gral 2018 Web PDFDocument158 pagesCatalogo Gral 2018 Web PDFWilliam Andrés Peñaranda ArévaloNo ratings yet
- Laboratorio Organica FinishDocument12 pagesLaboratorio Organica FinishKevin Calderon PizarroNo ratings yet
- Dilatacion LinealDocument4 pagesDilatacion LinealErlan MedranoNo ratings yet
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadFrom EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadRating: 4.5 out of 5 stars4.5/5 (1831)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaFrom EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaRating: 5 out of 5 stars5/5 (1872)
- Recupera tu mente, reconquista tu vidaFrom EverandRecupera tu mente, reconquista tu vidaRating: 5 out of 5 stars5/5 (6)
- Resetea tu mente. Descubre de lo que eres capazFrom EverandResetea tu mente. Descubre de lo que eres capazRating: 5 out of 5 stars5/5 (196)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaFrom EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaRating: 4.5 out of 5 stars4.5/5 (766)
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)From EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Rating: 5 out of 5 stars5/5 (7)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceFrom EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceRating: 5 out of 5 stars5/5 (8)
- Homo antecessor: El nacimiento de una especieFrom EverandHomo antecessor: El nacimiento de una especieRating: 5 out of 5 stars5/5 (1)
- El poder del optimismo: Herramientas para vivir de forma más positivaFrom EverandEl poder del optimismo: Herramientas para vivir de forma más positivaRating: 5 out of 5 stars5/5 (16)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanFrom EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanRating: 4.5 out of 5 stars4.5/5 (64)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaFrom EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaRating: 5 out of 5 stars5/5 (2)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaFrom EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaRating: 5 out of 5 stars5/5 (203)
- Cómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.From EverandCómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.Rating: 4.5 out of 5 stars4.5/5 (7)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaFrom EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaRating: 5 out of 5 stars5/5 (13)
- Influencia. La psicología de la persuasiónFrom EverandInfluencia. La psicología de la persuasiónRating: 4.5 out of 5 stars4.5/5 (14)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreFrom EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreRating: 5 out of 5 stars5/5 (3)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishFrom EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishRating: 4.5 out of 5 stars4.5/5 (3)
- Teoría polivagal práctica y terapiaFrom EverandTeoría polivagal práctica y terapiaRating: 5 out of 5 stars5/5 (4)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosFrom EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosRating: 4.5 out of 5 stars4.5/5 (142)
- Lee a las personas como un libro: Cómo analizar, entender y predecir las emociones, los pensamientos, las intenciones y los comportamientos de las personasFrom EverandLee a las personas como un libro: Cómo analizar, entender y predecir las emociones, los pensamientos, las intenciones y los comportamientos de las personasRating: 4.5 out of 5 stars4.5/5 (3)
- La vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizFrom EverandLa vibración de las ondas cerebrales: Recuperar el ritmo de una vida saludable y felizRating: 5 out of 5 stars5/5 (7)
- ¿Por qué mis padres no me aman?: Empezando a sanarFrom Everand¿Por qué mis padres no me aman?: Empezando a sanarRating: 4.5 out of 5 stars4.5/5 (33)