Professional Documents
Culture Documents
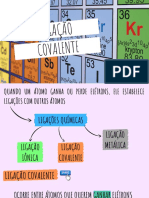
Estrutura atômica: conceitos fundamentais
Uploaded by
Andreza RodriguesOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Estrutura atômica: conceitos fundamentais
Uploaded by
Andreza RodriguesCopyright:
Available Formats
1
E ES ST TR RU UT TU UR RA A A AT T M MI IC CA A
1- CONCEITO
Denominamos de tomos a menor partcula
divisvel de um elemento qumico que conserva suas
propriedades.
2- CONSTITUIO BSICA
O tomo constitudo por duas regies
distintas:
Uma regio interna com carga eltrica positiva
formada pelos prtons e nutrons, denominada
de ncleo.
Uma regio externa com carga eltrica negativa
formada pelos eltrons, denominada de
eletrosfera.
3- CARACTERSTICAS DAS PARTCULAS
SUBATMICAS
Partcula subatmica Massa relativa Carga
relativa
Prton 1 u + 1
Nutron ~ 1 u 0
Eltron ~ 1/1836 u 1
# u unidade de massa atmica
# C Coulomb
OBS1: A massa do tomo est quase que totalmente
concentrada no ncleo.
OBS2: As quantidades de eletricidade so iguais e as
naturezas so diferentes.
TOMO NEUTRO: o n
o
de prtons igual ao
nmero de eltrons:
P = E
4- CONCEITOS FUNDAMENTAIS
4.1- ELEMENTO QUMICO: um conjunto de
tomos de mesmo nmero atmico.
4.2- NMERO ATMICO (Z): representa o
nmero de partculas positivas, ou seja, o nmero de
prtons.
Z = P
OBS3: O nmero atmico fornece as caractersticas
do tomo e do elemento qumico
4.3- NMERO DE MASSA (A): representa a soma
dos nmeros de prtons e nutrons do ncleo.
A = Z + N Z = A - N
A = P + N N = A - Z
5- REPRESENTAO DO TOMO
R tomo
A N
o
de massa
Z N
o
atmico
Z
A
R
Z
A
R R
Z
A
6- FENMENOS ATMICOS
6.1- ISOTOPIA: o fenmeno que ocorre quando
tomos de um mesmo elemento qumico (mesmo
nmero de prtons, Z) apresentam massas
diferentes. Esses tomos so chamados de istopos.
EXEMPLO: ISTOPOS DO HIDROGNIO (Z =1)
1H
1
Prtio ou hidrognio 1P, 1e, 0 N
1H
2
Deutrio 1P, 1e, 1 N
1H
3
Trtio 1P, 1 e, 2 N
(nicos istopos com nomes particulares)
OBS4: Os istopos participam da constituio de um
elemento em porcentagem diferentes e fixas.
EXEMPLO:
8O
16
99,759% 1H
1
99,985%
8O
17
0,037% 1H
2
0,015%
8O
18
0,204% 1H
3
traos
6.2- ISOBARIA: o fenmeno que ocorre quando
tomos de elementos qumico diferentes (n
o
atmicos
diferentes) apresentam o mesmo nmero de massa.
Os tomos so chamados de isbaros.
18X
39
19Y
39
OBS5: os isbaros apresentam propriedades
qumicas diferentes.
6.3- ISOTONIA: o fenmeno que ocorre quando
tomos de elementos qumicos diferentes
apresentam o mesmo nmero de nutrons. Os
istonos so quimicamente e fisicamente diferentes.
19K
39
20Ca
40
7- TRANSFORMAO DE TOMOS EM ONS
O nmero de prtons de um tomo sempre
constante, independente dos fenmenos qumicos
que ele venha, a sofrer (ncleo constante).
ons so tomos em desequilbrio eletrnico,
devido perda ou ganho de eltrons sem haver
alterao do ncleo: n
o
P = n
o
e
7.1- CTIONS: ons positivos, devido perda de
eltrons (cede eltrons): n
o
P > n
o
e
7.2- NIONS: ons negativos, devido ao ganho de
eltrons: n
o
P < n
o
e
-
7.3- ENTIDADES ISOELETRNICAS: so tomos
ou ons que apresentam o mesmo nmero de
eltrons.
EXEMPLOS:
9
19
F
13
27 3
Al
+
2
8- MODELO ATMICO
uma imagem elaborada mentalmente para
representar o tomo, sendo esta elaborao feita a
partir de dados experimentais.
8.1- MODELO DE RUTHERFORD-BOHR
Segundo os fsicos clssicos, o eltron ao
girar com grande velocidade ao redor do ncleo emite
energia continuamente, fazendo um movimento
espiralado at se chocar com o ncleo.
POSTULADO DE BOHR:
a) Os eltrons descrevem movimento circular ao
redor do ncleo em regies denominadas de rbitas
circulares.
b) Enquanto o eltron passa de uma rbita de baixa
energia para outra de alta energia, ela absorve um
quantum de energia.
c) Quando um eltron passa de uma rbita de alta
energia para outra de baixa energia, ele libera um
quantum de energia.
8.2- EVOLUO DOS MODELOS ATMICOS
9- NVEIS E SUBNVEIS DE ENERGIA
(DIAGRAMA DE LINUS PAULING)
EXERCCIOS
01- Em relao estrutura atmica correto afirmar
que:
a) Prtons e eltrons possuem cargas eltricas
iguais.
b) Prtons e nutrons possuem cargas eltricas
negativas
c) Nutrons e eltrons esto localizados na
eletrosfera.
d) Nutrons, prtons e eltrons localizam-se no
ncleo e possuem a mesma carga eltrica.
e) Prtons esto localizados no ncleo
02- Eletrosfera a regio do tomo que:
a) concentra praticamente toda a massa do tomo.
b) contm as partculas de carga eltrica positiva.
c) possui partculas sem carga eltrica.
d) permanece inalterada na formao dos ons.
e) tem volume praticamente igual ao volume do
tomo.
03- A definio mais correta de elemento qumico :
a) A menor partcula em que se pode dividir uma
substncia
b) A menor partcula em que se pode dividir uma
molcula
c) O conjunto de tomos cujo nmero atmico o
mesmo
d) O conjunto de tomos cujo peso atmico o
mesmo
e) O conjunto de tomos cujo nmero de nutrons o
mesmo
04- Dalton, Rutherford e Bohr propuseram, em
diferentes pocas, modelos atmicos. Algumas
caractersticas desses modelos so apresentadas no
quadro que se segue:
MODELO CARACTERSTICAS
I Ncleo atmico denso, com carga
positiva. Eltrons em rbitas circulares.
II tomos macios e indivisveis.
III Ncleo atmico denso. com carga
positiva. Eltrons em rbitas circulares
de energia quantizada.
A associao modelo/cientista correta :
a) I/Bohr; II/Dalton; III/Rutherford.
b) I/Dalton; II/Bohr; III/Rutherford.
c) I/Dalton; II/Rutherford; III/Bohr.
d) I/Rutherford, II/Bohr; III/Dalton.
e) I/Rutherford; lI/Dalton; III/Bohr.
05- Sabendo que o nmero atmico de um elemento
igual a 6 e que o nmero de massa de um tomo
desse elemento igual a 12, ento este tomo
possui:
a) 12 nutrons
b) 12 eltrons
c) 12 prtons
d) 6 nutrons
e) 8 nutrons
06- Ctions e nions apresentam respectivamente,
cargas eltricas:
a) Negativa e positiva
b) Positiva e nula
c) Nula e nula
d) Negativa e nula
e) Positiva e negativa
3
07- Dado
40
Ca20, ento Ca
2+
apresenta nmero
atmico igual?
a) 18 d) 40
b) 20 e) 58
c) 38
08- Um tomo possui 3 prtons, 4 nutrons e 3
eltrons. Indique a afirmao falsa:
a) Seu nmero atmico 3.
b) Seu nmero de massa 7
c) A massa desse tomo praticamente a soma das
massas de 3 prtons e 4 nutrons.
d) Existem 10 partculas no ncleo desse tomo
e) O tomo tem carga zero
09- Sabendo que o tomo neutro de alumnio possui
13 prtons. Qual a alternativa correta?
a) Al e Al
3+
possuem o mesmo nmero de eltrons
b) Al
3+
possui 3 prtons a menos que Al
c) Al possui 10 eltrons
d) Al
3+
possui 3 eltrons a menos que Al
e) Al e Al
3+
possuem 13 eltrons
10- Os ons:
F
19
9
e
1
Na
23
11
+
possuem mesmo nmero:
a) prtons
b) nutrons
c) massa
d) eltrons
e) atmico
11- Os ons Cu
+
e Cu
2+
, proveniente de um mesmo
istopo de cobre, diferem quanto ao:
a) nmero atmico
b) nmero de massa
c) nmero de prtons
d) nmero de nutrons
e) nmero de eltrons
12- Um on
92
235 4
U
+
tem:
a) 92 prtons, 235 nutrons e 92 eltrons.
b) 92 prtons, 143 nutrons e 88 eltrons.
c) 88 prtons, 235 nutrons e 92 eltrons.
d) 143 prtons, 92 nutrons e 4 eltrons.
e) 4 prtons, 235 nutrons e 88 eltrons
13- Com relao a istopos, isbaros e istonos,
pode-se afirmar:
a) Os istopos apresentam variaes apenas nos
nmeros de nutrons e de massa
b) Dois istopos de um mesmo elemento reagem de
forma diferente
c) Isbaros so tomos de mesmo elemento qumico
d) Istonos apresentam nmero de massa constante
e) Entre istopos, aquele de maior nmero de massa
reage mais rapidamente.
14- Quando se compara um tomo neutro de enxofre
(S) com on sulfeto (S
2-
), verifica-se que o segundo
possui:
a) Um eltron a mais e mesmo nmero de nutrons.
b) Dois nutrons a mais e mesmo nmero de eltrons
c) Um eltron a mais e mesmo nmero de prtons
d) Dois eltrons a mais e mesmo nmero de prtons
e) Dois prtons a mais e mesmo nmero de eltrons
15- Elementos que apresentam igual nmero de
nutrons, prton e massa so chamados
respectivamente de:
a) istopos, isbaros, istonos
b) istonos, isbaros, istopos
c) istonos, istopos, isbaros
d) istopos, istonos, isbaros
e) isbaros, istonos, istopos
16- Analisando os tomos abaixo (oxignio e
carbono)
8
16
O
6
14
C
voc conclui que eles so...
a) ismeros
b) istopos
c) isbaros
d) istonos
e) variedades alotrpicas
17- Um tomo possui nmero atmico (3x-1) e
nmero de massa (5x+4). Sabendo que seu nmero
de nutrons 15, calcule o valor de x e seu nmero
de prtons.
18- Um tomo apresenta nmero de massa igual a
8x, seu nmero de nutrons (6x-30). Este tomo
apresenta (3x-5) prtons. Determine o nmero de
prtons, de nutrons e de massa.
19- Conhecem-se os seguintes dados referentes aos
tomos A, B e C:
I. A tem nmero atmico 14 e isbaro de B.
II. B tem nmero atmico 15 e nmero de massa 30,
sendo istopo de C.
III. A e C so istonos entre si.
Qual o nmero de massa do tomo C?
4
20- Os tomos R e P so isbaros com as seguintes
caractersticas.
tomo Z A
R 2x + 4 4x +10
P 3x 8 5x + 2
Calcule valores de Z e A para cada um.
21- Os tomos Y e N so istopos. Calcule os
nmeros de nutrons dos tomos.
tomo Z A
Y 3x 6 6x
N 2x + 4 5x
22- O on 34A
2-
isoeletrnico de B
2+
. Qual o nmero
de prtons de B?
23- No quadro a seguir esto representados algumas
caractersticas de 3 tomos genricos X, Y e Z.
Observe atentamente a alternativa que indica os
nmeros atmicos e de massa do tomo Y.
a) 20 e 40
b) 21 e 41
c) 21 e 40
d) 20 e 41
e) 21 e 39
24- Um tomo A pertence ao mesmo elemento
qumico de um tomo B, o qual possui 30 nutrons.
Sabendo-se que B isbaro de um tomo C, cujo
nmero de massa 50. Quantos prtons possui A?
a) 50
b) 20
c) 30
d) 80
e) 53
25- Na figura abaixo, onde os smbolos atmicos so
arbitrrios:
X, Y e Z so respectivamente:
a) 54, 26 e 28
b) 52, 28 e 26
c) 54, 28 e 26
d) 56, 28 e 26
e) 52, 26 e 2
26- O tomo que apresenta Z prtons e N nutrons e
o tomo que contm (Z + 1) prtons e (N -1) nutrons
so:
a) Ismeros
b) Isbaros
c) Istonos
d) Isomorfos
e) Istopos
27- O sistema formado por 26 prtons e 26 eltrons
constitui um:
a) tomo neutro
b) ction bivalente
c) nion bivalente
d) ction monovalente
e) nion monovalente
28- So dadas as seguintes informaes relativas aos
tomos X, Y e Z.
I. X isbaro de Y e istono de Z.
II. Y tem nmero atmico 56, nmero de massa 137 e
istopo de Z.
III. O nmero de massa de Z 138.
O nmero atmico de X :
a) 56
b) 53
c) 57
d) 54
e) 55
29- O tomo
14
X apresenta 7 nutrons. Assim, o on
X
3-
isoeletrnico do tomo:
a) 4Be
b) 7N
c) 10Ne
d) 11Na
e) 17Cl
30- Um ction metlico trivalente tem 76 eltrons e
118 nutrons. O tomo do elemento qumico do qual
se originou tem nmero atmico e nmero de massa,
respectivamente:
a) 76 e 194
b) 79 e 197
c) 79 e 194
d) 70 e 200
e) 76 e 197
31- Sabendo-se que o magnsio tem nmero atmico
12, a estrutura eletrnica do ction Mg
2+
, no estado
fundamental representada por:
a) 1s
2
; 2s
2
; 2p
6
b) 1s
2
; 2s
2
; 2p
6
; 3s
2
c) 1s
2
; 2s
2
; 2p
6
; 3s
1
d) 1s
2
; 2s
2
; 2p
6
; 3s
2
; 3p
1
e) 1s
2
; 2s
2
; 2p
6
; 3s
2
; 3p
2
32- Sendo o nvel 4s
1
(com 1 eltron) o mais
energtico de um tomo podemos afirmar que:
I. nmero total de eltrons deste tomo 19.
II. Este tomo apresenta 4 camadas eletrnicas.
20
istonos
X Y Z
istopos isbaros
21
40
Z
X
istopos
A B C
isbaros istonos
26
54 56
Y
5
III. Sua configurao eletrnica 1s
2
; 2s
2
; 2p
6
; 3s
2
;
3p
2
So corretas:
a) I
b) II
c) III
d) I e II
e) II e III
33- Alguns elementos apresentam, no estado
fundamental e no seu nvel mais energtico, a
configurao eletrnica np
x
. Dentre os elementos
abaixo, o que representa o maior valor de x ?
a) Al (Z = 13)
b) F (Z = 9)
c) Si (Z = 14)
d) N (Z = 7)
e) Ne (Z =10)
34- A seguinte configurao da eletrosfera de uma
espcie qumica com nmero atmico 8, 1s
2
; 2s
2
; 2p
6
refere-se a um:
a) tomo neutro
b) ction monovalente
c) tomo excitado
d) nion monovalente
e) nion bivalente
35- Um tomo apresenta a seguinte distribuio
eletrnica em sua camada de valncia 3s
2
, 3p
4
,
portanto este tomo apresenta nmero atmico igual
a?
a) 3
b) 6
c) 10
d) 16
e) 18
36- Um tomo X apresenta 5 eltrons no subnvel 4p
mais energtico. Qual o nmero de prtons desse
tomo?
a) 5
b) 25
c) 7
d) 35
e) 30
37- O nmero de nutrons de um tomo o dobro do
nmero de prtons. Este tomo possui o subnvel 5p
3
como mais energtico, qual o nmero de massa
desse tomo?
a) 51
b) 252
c) 102
d) 153
e) 154.
38- O modelo atmico que suscitou a idia de tomo
com estrutura eltrica foi o:
a) de Dalton.
b) do tomo Planetrio de Rutherford.
c) de Bohr.
d) de Mecnica Ondulatria.
e) de Thomson.
39- Um tomo possui 19 prtons, 20 nutrons e 19
eltrons. Qual dos seguintes tomos seu istono?
a)
19
21
A
b)
19
20
B
c)
18
38
C
d)
39
58
D
e)
20
39
E
40- Se o istopo do chumbo que apresenta nmero
de massa 210 forma ons Pb
2+
e Pb
4+
, que possuem
respectivamente 80 e 78 eltrons, ento o nmero de
nutrons desse tomo neutro :
a) 138
b) 130
c) 132
d) 128
e) 158
41- Os istopos naturais do carbono so 12C
6
, 13C
6
e
14C
6
. Assinale a alternativa CORRETA:
a) Os ncleos dos tomos carbono listados possuem
6, 7 e 8 prtons, respectivamente.
b) O nmero de eltrons, no estado fundamental, o
mesmo em todos os istopos.
c) O istopo de nmero de massa, A = 14, possui
maior nmero de eltrons no estado fundamental.
d) Quase toda carga do tomo de carbono se
encontra no ncleo.
e) A massa atmica do elemento carbono a mdia
aritmtica das massas dos istopos.
ESTUDO DA ELESTROFERA
- CAMADA OU NVEL: a regio do
tomo onde o eltron se move sem
perder energia , indicando a distncia
que o eltron se encontra do ncleo,
6
s
p
d
f
-3 -2 -1 0 +1 +2 +3
determinando assim a energia potencial
do eltron.
1. NMERO QUNTICO PRINCIPAL (n)
Indica a camada em que o eltron se
encontra.
CAMADA K L M N O P Q
n 1 2 3 4 5 6 7
- SUB-NVEL OU SUB-CAMADA: Indica
a forma do orbital em que o eltron se
encontra, fornecendo assim o tipo de
movimento do eltron, determinando
ento a energia cintica do eltron.
Sub-nvel s sub-nvel p
Orbital s Orbital p
2. NMERO QUNTICO SECUNDRIO
OU AZIMUTAL (l) Indica a sub-camada
em que o eltron se encontra.
Sub-camada S p d f
L 0 1 2 3
K L M
l = 0 n 1 l = 0 n 1 l = 0 n 1
l = 0 l = 0 2 1 l = 0 3 1
l = 0 1 l = 0 2
l = 0 , 1 l = 0 , 1 , 2
s s p s p
d
l =0 l =0 l =1 l =0 l =1 l
=2
n=1 n=2 n=3
- ORBITAL: a regio do tomo onde se
tem a maior probabilidade de encontrar
o eltron .
3. NMERO QUANTICO MAGNTICO
(m) Indica o orbital em que o eltron se
encontra, e a orientao espacial do
orbital.
s l = 0 m = - l + l m = 0
p l = 1 m = - l + l m = -1 +1
m = -1, 0, +1
d l = 2 m = - l + l m = - 2 +2
m = - 2, - 1, 0, +1, +2
f l = 3 m = - l + l m = - 3 +3
m =- 3, - 2, - 1, 0, +1, +2, +3
4. NMERO QUNTICO SPIN (s) Indica o
sentido de rotao do eltron.
F . R . E S = - S = +
- -
F . A . M
DISTRIBUIO ELETRNICA
- feita na ordem crescente de energia;
- O eltron ir ocupar primeiro nvel e
Sub-Nvel de menor contedo
energtico disponvel;
Y
X
Z
l 0 ( n 1)
m = ( - l + l )
7
- A energia do eltron dada pela soma
(n+ l);
- O eltron ter maior contedo
energtico quanto maior for a soma (n+
l);
- Quando a soma (n+ l ) de dois eltrons
for igual, ter maior energia aquele que
apresentar maior valor de (n)
- Um tomo encontra-se no estado
fundamental, quando seus eltrons
apresentam menor contedo energtico
possvel.
DIAGRAMA DE LINUS PAULING
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
5f
14
6s
2
6p
6
6d
10
7s
2
7p
6
Configurao na ordem energtica
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
1 2 3 4 5
4d
10
5p
6
6s
2
4f
14
5d
10
6p
6
7s
2
5f
14
6d
10
7p
6
6 7 8
Configurao na ordem geomtrica
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
K L M N
5s
2
5p
6
5d
10
5f
14
6s
2
6p
6
6d
10
7s
2
7p
6
O P Q
CONFIGURAO EM ONS
1. Faz-se a configurao para o tomo
neutro
2. Para ction: retira-se os eltrons
perdidos da ultima camada
3. Para nion: adiciona-se os eltrons
ganhos na ltima camada
4. Representa-se na configurao
eletrnica final a carga do on
1s
2
2s
2
2p
6
3s
2
3p
1
13
A
+3
1s
2
2s
2
2p
6
3s
2
3p
1
K L M
(1s
2
2s
2
2p
6
)
+3
1s
2
2s
2
2p
4
8
O
2
1s
2
2s
2
2p
(4 +2)
K L
(1s
2
2s
2
2p
6
)
-2
Configurao em Sub-Nvel e Orbitais
1. O primeiro eltron que entra no Sub-
Nvel orienta a entrada dos demais
eltrons, at que se faa necessrio a
entrada dos eltrons no sentido
contrrio;
2. Regra de Hund: Em um Sub-Nvel, um
orbital s pode receber o seu segundo
eltron, se os demais orbitais estiverem
semi-preenchidos.
3. Princpio da Excluso de Pauli: Em
um orbital cabem no mximo dois
eltrons de spins contrrios.
-1 0 +1
-2 -1 0 +1 +2
-3 -2 -1 0 +1 +2 +3
1
2
3
4
5
6
7
1
2
3
4
5
6
7
8
K=2
L=8
M=18
N=32
O=32
P=18
Q=8
p
4
f
12
= 1
m = - 1
s = +1/2
=
m =
s =
d
4
=
m =
s =
8
Configurao com Gs Nobre
1 [
2
He] 2s 2p 3s
2 [
10
Ne] 3s 3p 4s
3 [
18
Ar] 4s 3d 4p 5s
4 [
36
Kr] 5s 4d 5p 6s
5 [
54
Xe] 6s 4f 5d 6p 7s
6 [
86
Rn] 7s 5f 6d 7p 8s
Ex
1
:
26
Fe [
18
Ar] 4s
2
3d
6
Ex
1.1
:
25
Mn _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Ex
2
:
19
K [
18
Ar] 4s
1
Ex
2.2
:
20
Ca _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Ex
3
:
36
Kr [
18
Ar] 4s
2
3d
10
4p
6
Ex
3.3
:
54
Xe _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Ex
4
:
34
Se [
18
Ar] 4s
2
3d
10
4p
4
Ex
4.4
:
51
Sb _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Ex
5
:
61
Pm [
54
Xe] 6s
2
4f
5
Ex
5.5
:
57
La _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Ex
6
:
92
U [
86
Rn] 7s
2
5f
4
Ex
6.6
:
96
Cm _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _
Configurao no Sub-Nvel P
P
x
P
y
P
z
-1 0 +1
01- Determine os nmeros Qunticos do
eltron diferencial do elemento usado
no combate a crie , utilizado pela
cosanpa e consultrios odontolgicos.
(
9
F ,
17
Cl ,
11
Na ,
20
Ca ,
16
O)
a) n = 2 L =1 m = 0 s = -1/2
b) n = 2 L =1 m = 0 s = +1/2
c) n = 3 L =0 m = 0 s = -1/2
d) n = 3 L =1 m = 0 s = +1/2
e) n = 4 L =0 m = -1 s = +1/2
02- Dados nmeros qunticos do eltron
diferencial do elemento que participa
da constituio da hemoglobina (n = 3,
L = 2, m = -2, s =+1/2 ). Determine o
nmero atmico e a massa deste
elemento que apresenta 30 nutrons.
a) 25 e 55
b) 26 e 56
c) 24 e 54
d) 26 e 54
e) 25 e 56
Px
1
P
y
Pz
Px
1
Py
1
Pz
Px
1
Py
1
Pz
1
Px
2
Py
1
Pz
1
Px
2
Py
2
Pz
1
Px
2
Py
2
Pz
2
Y
X
Z
9
CLASSIFICAO PERIDICA DOS
ELEMENTOS
1- A TABELA PERIDICA ATUAL
A tabela peridica atual constituda de sete
linhas horizontais denominadas de PERODOS e de
dezoito colunas verticais chamadas de FAMLIAS OU
GRUPOS.
2- PERODOS OU SRIES
Para os tomos conhecidos atualmente, o
nmero mximo de camadas eletrnicas ou nveis de
energia so sete. Por este motivo, a atual tabela
peridica possui sete perodos, que so as sete
linhas horizontais da tabela.
O perodo de um elemento corresponde ao
nmero de camadas eletrnicas do tomo desse
elemento.
Assim, se voc quer saber quantas camadas
(nveis) possui um determinado tomo, no h
necessidade de fazer sua configurao eletrnica,
basta localiz-lo na tabela peridica, verificando qual
o seu perodo.
Vamos observar agora cada perodo, seguido
do nome e do nmero de elementos que o
constituem:
1
o
PERODO = Muito Curto (2 elementos)
2
o
PERODO = Curto (8 elementos)
3
o
PERODO = Curto (8 elementos)
4
o
PERODO = Longo (18 elementos)
5
o
PERODO = Longo (18 elementos)
6
o
PERODO = Muito longo (32 elementos)
7
o
PERODO = Incompleto ( - - - - - - - )
3- GRUPOS OU FAMLIAS
A tabela peridica atual constituda de 18
grupos, tambm denominadas famlias ou colunas.
Estes grupos esto divididos em dois subgrupos,
subgrupo A e subgrupo B.
Os elementos pertencentes ao subgrupo A
so conhecidos como elementos tpicos ou
representativos, enquanto que os elementos do
subgrupo B so conhecidos como elementos de
transio.
Um grupo ou famlia caracterizado por
apresentar elementos com propriedades
semelhantes, que sofrem uma variao peridica.
Este foi o objetivo de Mendeleyev ao organizar a
tabela peridica.
Hoje, com base na estrutura eletrnica dos
tomos, afirmamos que uma famlia caracterizada
pelos eltrons do subnvel mais energtico, pois
sabemos serem estes eltrons os responsveis pelas
propriedades qumicas dos elementos.
3.1- ELEMENTOS REPRESENTATIVOS
Os elementos do subgrupo A da tabela
peridica so denominados representativos, pois
suas propriedades seguem uma variao peridica
bem definida. Apresentam como subnvel
diferenciador os subnveis s ou p no ltimo nvel.
Numa famlia os elementos possuem o mesmo
comportamento qumico.
A tabela abaixo ilustra o nmero de eltrons
de valncia (ltima camada), a configurao de
valncia, bem como a denominao dada a famlia
para os elementos representativos.
Famlia Eltrons de
valncia
Nvel de
valncia
Denominao
1A ou 1 1 ns
1
Metais alcalinos
2A ou 2 2 ns
2
Metais alcalinos
Terrosos
3A ou 13 3 ns
2
np
1
Famlia do Boro
4A ou 14 4 ns
2
np
2
Famlia do
Carbono
5A ou 15 5 ns
2
np
3
Famlia do
Nitrognio
6A ou 16 6 ns
2
np
4
Calcognios
7A ou 17 7 ns
2
np
5
Halognios
8A ou 18 8 ns
2
np
6
Gases Nobres
OBS:
1- elemento qumico hidrognio embora pertena a
famlia 1A, ele no pode ser confundido com um
metal alcalino, sua posio nesta famlia dada em
funo de sua configurao de valncia (1s
1
), porm
alguns qumicos preferem posicion-lo na famlia 7A,
por apresentar semelhanas qumicas com estes
elementos.
2- elemento qumico hlio, um gs nobre, porm
no possui configurao de valncia semelhante aos
demais elementos da famlia, pois como possui
nmero atmico igual a 2 e sua configurao de
valncia 1s
2
.
3.2- ELEMENTOS DE TRANSIO
So elementos do subgrupo B da tabela
peridica, cujas caractersticas so no apresentarem
o seu eltron de diferenciao na ltima camada. Em
funo disso, suas propriedades sofrem alteraes,
sendo mais comum a semelhana dentro do perodo
que dentro da famlia.
Os elementos de transio podem ser
divididos em dois grandes grupos; os elementos de
transio simples (ou externa) e os elementos de
transio interna.
10
a) Elementos de Transio Simples
3B 4B 5B 6B 7B 8B 1B 2B
Se Ti V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Te W Re Os Ir Pt Au Hg
Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub
So elementos de transio que apresentam
o eltron de diferenciao num subnvel d do
penltimo nvel, logo possuem configurao de
valncia do tipo ns
2
(n 1)d
x
. Os metais de transio
simples ou externa apresentam de um modo geral 1
ou 2 eltrons no ltimo nvel
b) Elementos de Transio Interna
Srie dos Lantandios
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Srie dos Actindios
Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
So constitudos pelos elementos das sries
dos lantandios e actindios. So elementos que
apresentam seus eltrons de diferenciao em
subnveis f no antepenltimo nvel.
OBS.:
1- O lutrcio (Z = 71) apresenta o subnvel
diferenciador sendo 5d
1
, e o actnio (Z = 103)
apresenta o subnvel diferenciador sendo o 6d
1
.
2- Apesar de ambos fugirem s caractersticas de
srie, continuam a ser classificados como lantandios
(Lu) e actindios (Ac).
4- METAIS, AMETAIS E GASES NOBRES
- Os metais so bons
condutores de calor e
eletricidade, apresentam
ductilidade e maleabilidade e
brilho caracterstico.
- Os ametais so maus
condutores de calor e
eletricidade, no so dcteis nem maleveis.
- Os gases nobres so formadores de molculas
monoatmicas a apresentam baixa capacidade de
combinao com outros elementos qumicos.
5- ESTADO DE AGREGAO DOS ELEMENTOS
QUMICOS NAS CONDIES AMBIENTES (p =
1 atm e T = 20
o
C)
- So gasosos: hidrognio, nitrognio, oxignio, flor,
cloro e gases nobres.
- So lquidos: mercrio e bromo.
- So slidos: os demais.
6- ELEMENTOS NATURAIS E ARTIFICIAIS
- O elemento natural de maior nmero atmico o
urnio (Z = 92).
- Os elementos artificiais de Z < 92 so classificados
como Cisurnicos. So apenas 4: tecncio, astato,
promcio e frncio.
- Os elementos artificiais de Z > 92 so classificados
como Transurnicos
7- PROPRIEDADES PERIDICAS
So propriedades dos elementos que ora
aumentam e que ora diminuem com o aumento do
nmero atmico. So Propriedades Peridicas: Raio
Atmico, Energia de Ionizao, Eletroneqatividade,
Eletroafinidade, etc.
7.1- RAIO ATMICO OU TAMANHO DO TOMO
Dois fatores so determinantes na avaliao
do tamanho de um tomo: o nmero de camadas
eletrnicas e a carga nuclear (nmero atmico).
- Quanto maior o nmero de camadas eletrnicas de
um tomo maior o seu raio.
- Quando os tomos tm o mesmo numero de
camadas eletrnicas, ter maior raio o tomo de
menor carga nuclear (menor atrao do ncleo pelos
eltrons perifricos).
- Nos grupos ou famlias, o raio atmico aumenta de
cima para baixo. Aumenta com o aumento do nmero
de camadas eletrnicas.
- Nos perodos, o raio atmico aumenta da direita
para a esquerda. Aumenta com a diminuio da
carga nuclear (nmero atmico), j que todos os
tomos do mesmo perodo tm o mesmo nmero de
camadas eletrnicas.
Concluso:
Nas famlias, o raio atmico aumenta de cima para
baixo e nos perodos aumenta da direta para a
esquerda.
OBS: RAIO INICO
Quando um tomo perde eltrons,
transforma-se em ction (on positivo), o raio do on
fica menor que o raio do tomo de origem, j que o
ncleo, que permanece o mesmo (mesma carga
nuclear) passa a exercer maior atrao pelos eltrons
restantes.
Quando um tomo ganha eltrons,
transforma-se em nion (on negativo), o raio do on
fica maior que o raio do tomo de origem, j que o
ncleo, que permanece o mesmo, tem sua carga
nuclear (nmero de prtons) inferiorizada em relao
ao nmero de eltrons da eletrosfera.
7.2- POTENCIAL DE IONIZAO OU ENERGIA
DE IONIZAO
Potencial de Ionizao a energia mnima
necessria para se arrancar um eltron de um tomo
que se encontra no estado fundamental e gasoso.
11
Na(g) + e
Na(g)
+
+ e
E1 = 1
a
energia de ionizao
- A medida que se remove um eltron de um tomo
aumenta a quantidade de energia necessria para
arrancar o prximo eltron (E1 < E2 < E3), j que
aumenta a fora de atrao do ncleo pelos eltrons
que ficam.
- Somente a 1
a
energia de ionizao de um elemento
tem interesse prtico.
- Os eltrons retirados so sempre os da camada de
valncia.
- Quanto mais afastado estiver o eltron do ncleo,
menor e a atrao ncleo-eltron e menor a
quantidade de energia necessria para arrancar o
eltron do tomo. Logo, quanto maior o raio do
tomo menor e a energia de ionizao.
- Nos grupos ou famlias, como o raio do tomo
cresce de cima para baixo, a energia de ionizao
aumenta de baixo para cima.
- Nos perodos, como o raio atmico aumenta da
direita para a esquerda, a energia de ionizao
cresce da esquerda para direita.
7.3- ELETRONEGATIVIDADE OU CARTER
AMETLICO
Eletronegatividade a tendncia que os
tomos possuem de ganhar eltrons ligantes.
Como esta propriedade mede a tendncia de
ganhar eltrons, observa-se que quanto menor o raio
atmico, menor ser a distncia do par eletrnico
ligante em relao ao ncleo do referido tomo, logo
maior ser a eletronegatividade.
A eletronegatividade aumenta de baixo para
cima nas famlias, enquanto que nos perodos,
aumenta da esquerda para a direita. Os gases nobres
no possuem eletronegatividade, pois estes tomos
no efetuam ligaes.
7.4- ELETROAFINIDADE OU AFINIDADE
ELETRNICA
a energia liberada quando um eltron
adicionado a um tomo neutro no estado gasoso.
Essa energia expressa, em geral, em eltron-volt
(eV).
Nas famlias, a eletroafinidade cresce de
baixo para cima e nos perodos, da esquerda para a
direita.
EXERCCIOS
01- Dentre os elementos abaixo aquele que no
pertence ao grupo dos metais alcalinos o:
a) Na b) Li c) K d) Fr e) Zn
02- Assinale o grupo de elementos que faz parte
somente dos metais alcalino-terrosos.
a) Ca, Mg, Ba c) Zn, Cd, Hg e) Pb, Al, Bi
b) Li, Na, K d) Ag, Au, Cu
03- A alternativa que apresenta a correspondncia
correta entre elemento e classificao :
Gs
Nobre
Metal de
transio
Alcalino Halognio Metal
alcalino
terroso
a) F Zn Li N Mg
b) He Mn Hg Cl Ca
c) Kr Fe K I Sr
d) At Cr Rb P Ba
e) Ne Cr Cs Br Al
04- Elemento qumico cujo nvel de valncia
representado pela configurao 3s
2
3p
5
tem nmero
atmico:
a) 17 b) 13 c) 11 d) 9 e) 7
05- Um elemento qumico, situado no grupo 3A e no
quinto perodo da tabela peridica, apresenta a
configurao eletrnica:
a) 3s
2
3p
1
c) [Xe] 5s
2
5p
1
e) 3s
2
3p
3
b) [Kr] 4d
10
5s
2
5p
1
d) 5s
2
5p
3
06- Na tabela peridica os elementos esto
organizados em ordem crescente de:
a) Nmero de massa
b) Raio atmico
c) Massa atmica
d) Eletroafinidade
e) Nmero atmico
07- Um elemento X qualquer tem configurao
eletrnica: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
4
.
Podemos dizer que este elemento est localizado na
tabela peridica no:
a) Quinto perodo; famlia 2A
b) Quinto perodo; famlia 6A
c) Quarto perodo; famlia 12A
d) Quinto perodo; famlia 6B
e) Quarto perodo; famlia 2A
08- Entre as alternativas abaixo, indique aquela que
contm afirmaes exclusivamente corretas sobre os
elementos cujas configuraes eletrnicas so
apresentadas a seguir:
Elemento Configurao Eletrnica
A 1s
2
2s
2
2p
6
3s
1
B 1s
2
2s
2
2p
4
C 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
D 1s
2
2s
2
2p
6
3s
2
3p
6
E 1s
2
2s
2
2p
6
3s
2
3p
5
12
a) O elemento C um gs nobre e o elemento B
um halognio.
b) Os elementos A e C situam-se, respectivamente,
no terceiro e quarto perodos da tabela peridica.
c) O elemento E um calcognio e situa-se no quinto
perodo da tabela peridica.
d) O elemento B um halognio do segundo perodo,
enquanto o elemento D situa-se no sexto perodo da
tabela peridica.
e) O elemento A um metal alcalino-terroso.
09- Baseando-se nas configuraes eletrnicas em
ordem crescente de energia dos elementos abaixo,
assinale a alternativa correta:
A 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
B 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
, 3d
2
C 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
, 3d
10
, 4p
2
D 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
6
, 4s
2
, 3d
10
, 4p
6
, 5s
2
, 4d
10
, 5p
6
,
6s
2
, 4f
2
a) C e D esto no mesmo perodo da tabela
peridica.
b) A e C pertencem ao mesmo subgrupo, mas esto
em perodos diferentes.
c) A, B, C, D so todos metais alcalino-terrosos.
d) B e D so elementos de transio externa.
e) C est no quarto perodo e na famlia 4A.
10- Qual o nmero atmico do elemento qumico do
quinto perodo da classificao peridica e que
apresenta 10 eltrons no quarto nvel energtico (n =
4)?
a) 22 b) 40 c) 38 d) 46 e) 48
11- O perodo e o grupo na tabela peridica de um
elemento com a configurao eletrnica 1s
2
2s
2
2p
6
3s
2
3p
3
so, respectivamente:
a) 1, II B c) 2, IIIA e) 3, IIIB
b) 3, VA d) 6, IIIA
12- Na classificao peridica, o elemento qumico de
configurao 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
3
est
localizado na famlia:
a) 5A do quarto perodo. d) 3A do quarto perodo.
b) 4A do quinto perodo. e) 3A do terceiro perodo
c) 4A do terceiro perodo.
13- O comportamento qumico semelhante dos
elementos de uma dada famlia da tabela peridica
mais bem explicado pelo fato de que os tomos
destes elementos tm:
a) O mesmo nmero total de eltrons.
b) O mesmo nmero de eltrons na ltima camada.
c) O mesmo nmero de prtons.
d) A mesma estrutura do ncleo.
e) N.D.A.
14- Pertencem mesma famlia da tabela peridica
os elementos qumicos de nmeros atmicos:
a) 6 e 12 d) 13 e 17
b) 8 e 16 e) 4 e 14
c) 15 e 19
15- A configurao ns
2
np
6
(n + 1) s
1
pode estar
representando nveis eletrnicos mais externos de
tomos nutrons, no estado fundamental, de metais:
a) Alcalinos.
b) Alcalinos-terrosos.
c) Semicondutores
d) De transio
e) Nobres.
16- Na classificao peridica, considerando-se uma
sequncia de elementos de transio, dispostos em
ordem crescente de nmeros atmicos, pode-se
concluir que os eltrons vo sendo acrescentados
sucessivamente na:
a) ltima camada eletrnica
b) Penltima camada eletrnica.
c) Antepenltima camada eletrnica.
d) ltima ou penltima camada eletrnica.
e) Penltima ou antepenltima camada eletrnica.
17- O elemento terminado em 4d
1
est localizado na
tabela peridica no:
a) Perodo 4 e grupo 3B
b) Perodo 5 e grupo 4B
c) Perodo 5 e grupo 3B
d) Perodo 6 e grupo 4B
e) Perodo 1 e grupo 1A
18- Os elementos qumicos clcio, cloro e cobalto
so, respectivamente:
a) Metal alcalino, halognio e actindio
b) Metal alcalino terroso, gs nobre e metal de
transio.
c) Metal alcalino terroso, halognio e metal de
transio
d) Metal de transio, actindio e metal de transio
interna.
e) Calcognio, halognio e lantandio.
19- So, respectivamente, metal, no-metal e gs
nobre:
a) Sdio, estanho e iodo.
b) Ferro, cloro e nitrognio.
c) Sdio, cloro e hlio.
d) Ao, iodo e argnio.
e) Cromo, bromo e iodo.
13
20- So metais os seguintes elementos:
a) Cloro e bromo
b) Enxofre e selnio
c) Fsforo e arsnio
d) Silcio e germnio
e) Alumnio e glio
21- So definidas quatro espcies de tomos neutros
em termos de partculas nucleares:
tomo I: Possui 18 prtons e 21 nutrons.
tomo II: Possui 19 prtons e 20 nutrons.
tomo III: Possui 20 prtons e 19 nutrons.
tomo IV: Possui 20 prtons e 20 nutrons.
Pode-se concluir que:
a) Os tomos III e IV so isbaros.
b Os tomos II e III so iso-eletrnicos (mesmo n
o
de
eltrons)
c) Os tomos II e IV so istopos.
d) Os tomos I e II pertencem ao mesmo perodo da
classificao peridica.
e) Os tomos II e III possuem o mesmo nmero de
massa.
22- Este teste se refere ao tomo do elemento de
nmero atmico 51, na tabela peridica o elemento
em questo se encontra no:
a) Quinto perodo e famlia 3A
b) Terceiro perodo e famlia 5A
c) Quinto perodo e famlia 5A
d) Terceiro perodo e famlia 3A
e) Quinto perodo e famlia 3B
23- As configuraes eletrnicas dos tomos neutros
dos elementos X e Y, no estado fundamental, so:
X: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
Y: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
2
Indique a afirmao incorreta:
a) Ambos pertencem ao 5
o
perodo da tabela
peridica.
b) X metal de transio interna.
c) Y metal de transio externa.
d) Possuem, respectivamente, nmeros atmicos 38
e 40.
e) X pertence famlia 2A e Y famlia 4B da tabela
peridica.
24- Resolva a questo com base na anlise das
afirmativas a seguir:
I. Em um mesmo perodo, os elementos apresentam
o mesmo nmero de nveis.
II. Os elementos do grupo 2A apresentam, na ltima
camada, a configurao geral ns
2
.
III. Quando o subnvel mais energtico tipo s ou p, o
elemento de transio.
IV. Em um mesmo grupo, os elementos apresentam o
mesmo nmero de camadas.
Conclui-se que, com relao estrutura da
classificao peridica dos elementos esto corretas
as afirmativas:
a) I e II c) II e III e) III e IV
b) I e III d) II e IV
25- Se a distribuio eletrnica do tomo R : 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
3
. Ento, R:
a) Pertence ao subgrupo III A
b) Apresenta o ltimo orbital p completo.
c) Pertence a famlia do nitrognio.
d) do grupo B.
e) Est no 3
o
perodo da tabela peridica
26- Quando retiramos o primeiro eltron de um tomo
neutro, no estado gasoso, podemos afirmar que:
a) Diminui a fora de atrao do ncleo sobre os
eltrons restantes, portanto a primeira energia de
ionizao sempre maior do que a segunda.
b) Diminui a fora de atrao do ncleo sobre os
eltrons restantes, portanto a primeira energia de
ionizao sempre menor do que a segunda.
c) Aumenta a fora de atrao do ncleo sobre os
eltrons restantes, portanto a primeira energia de
ionizao sempre maior do que a segunda.
d) Aumenta a fora de atrao do ncleo sobre os
eltrons restantes, portanto a primeira energia de
ionizao sempre menor do que a segunda.
e) Se o segundo eltron estiver no mesmo nvel de
energia do primeiro, ento a primeira energia de
ionizao ser sempre igual da segunda.
27- Considere os elementos 3Li, 9F, 8O, 20Ca e 16S.
Quais apresentam maior similaridade em suas
propriedades? Porqu?
28- O Diagrama de Pauling foi utilizado para a
obteno das estruturas eletrnicas dos elementos
com nmeros atmicos 53 e 87. Pede-se:
a) Apresentar as estruturas correspondentes a cada
um dos elementos indicados.
b) Apontar, nas estruturas obtidas, detalhes
estruturais que caracterizam as famlias nas quais
pertencem os elementos.
29- A energia de ionizao do cloro representa a
energia posta em jogo na reao de equao abaixo:
a) Cl2(l) + 2 e
Cl
(g) d) 2 Cl
(g) + 2 e
Cl2(g)
b) Cl(g) Cl
+
(g) + e
e) Cl2(g) Cl
(g) + Cl
+
(g)
14
c) Cl(g) + e
Cl
(g)
30- Nas expresses abaixo os E1 representam a
energia necessria para produzir as respectivas
ionizaes, onde M representa o mesmo elemento.
M(g) e
-
+ M
+
(g) E1
M
+
(g) e
-
+ M
2+
(g) E2
M
2+
(g) e
-
+ M
3+
(g) E3
Qual das afirmaes abaixo correta?
a) E1= E2 = E3 c) E1< E2 < E3
b) E1= E2 > E3 d) E1> E2 = E3
e) A ordenao dos valores do E1 depende da
natureza do elemento M.
31- Abaixo so mostradas quatro configuraes
eletrnicas:
I. 1s
2
2s
2
2p
6
III. 1s
2
2s
2
2p
6
3s
2
3p
5
II. 1s
2
2s
2
2p
6
3s
2
IV. 1s
2
2s
2
2p
6
3s
2
3p
6
Qual das configuraes correspondente:
a) A cada um dos tomos Cl, Mg, Ne?
b) A cada um dos ons Cl
-
, K
+
, Al
3+
?
32- Com relao periodicidade dos elementos
qumicos na tabela peridica, incorreto dizer que:
a) A energia de ionizao em uma famlia aumenta de
baixo para cima.
b) O tamanho do tomo num perodo aumenta da
direita para a esquerda.
c) Em um perodo, a eletroafinidade diminui da direita
para a esquerda.
d) Em uma famlia, a eletronegatividade aumenta da
direita para a esquerda.
e) O volume em um perodo decresce da direita para
a esquerda.
33- Considere os seguintes tomos neutros: A (18
eltrons), B (17 eltrons), C (11 eltrons) e D (2
eltrons).
a) A que famlia pertencem?
b) Coloque-os em ordem crescente dos potenciais de
ionizao.
34- Estabelecer e justificar a ordem crescente de
raios das espcies componentes da srie
isoeletrnica: 10Ne; 8O
2-
; 9F
-
; 12Mg
2+
; 11Na
+
.
35- Como variam, medida que cresce o nmero
atmico, a energia de ionizao, a eletronegatividade
e o raio atmico dos elementos qumicos
pertencentes a uma mesma famlia da classificao
peridica?
36- Quantos eltrons a mais que o 86Rn ter o
possvel gs nobre do stimo perodo?
37- Considere os elementos qumicos sdio (Na) e
magnsio (Mg).
a) O que existe de comum na estrutura eletrnica dos
tomos desses elementos no estado fundamental?
b) Para qual dos elementos, no estado gasoso, se
gastar menos energia para retirar o primeiro eltrons
de um tomo neutro?
38- Entre os tomos dos elementos abaixo indicados,
o que deve possuir a menor afinidade eletrnica o
de:
a) glio. d) clcio.
b) criptnio. e) potssio.
c) cromo.
39- Os nomes latinos dos elementos chumbo, prata e
antimnio do origem aos smbolos qumicos desses
elementos. Esses smbolos so respectivamente:
a) P, Ar, Sr c) Pb, Ag, Sb e) Po, S, Bi
b) Pm, At, Sn d) Pu, Hg, Si
40- Determine a que famlias pertencem os
elementos cujas configuraes eletrnicas so:
a) 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
; b) 1s
2
2s
2
2p
6
3s
2
3p
3
;
41- A eletronegatividade uma propriedade peridica
importante. Em relao a esta propriedade, indique a
afirmativa correta:
a) O flor (F) o menos eletronegativo de todos os
elementos.
b) O frncio (Fr) o mais eletronegativo de todos os
elementos.
c) O sdio (Na) o mais eletronegativo de todos os
elementos.
d) O carbono (C) mais eletronegativo que o silcio
(Si).
e) O potssio (K) mais eletronegativo que o clcio
(Ca).
42- Quanto menor o raio de um tomo:
I Maior a sua dificuldade para perder eltrons, isto
, maior a sua energia de ionizao.
II Maior a sua facilidade para receber eltrons, isto
, maior a sua afinidade com eltrons.
III Maior a sua tendncia de atrair eltrons, isto ,
maior a sua eletronegatividade.
Esto corretas somente as afirmaes:
a) I.
b) II.
c) III.
d) I e II.
e) I, II, e III.
15
RADIATIVIDADE
1- RADIAO
o fenmeno pelo qual um ncleo instvel emite
espontaneamente determinadas entidades (partculas e
ondas), genericamente chamadas de radiaes,
transformando-se em outro ncleo mais estvel. Esse
fenmeno se deve unicamente ao ncleo do tomo.
Fatores qumicos, estado fsico, presso e
temperatura no influem na radiatividade de um elemento.
Isso porque ela no depende da nuvem eletrnica do tomo,
mas apenas do fato de seu ncleo ser instvel.
Assim, por exemplo, a radiatividade do urnio
sempre a mesma, no importando o estado fsico da amostra
nem o fato de o urnio ser puro ou estar ligado a outro
elemento.
1.1- TIPOS DE RADIAES
Existem trs modalidades de radiaes,
denominadas alfa (o), beta (|) e gama (), e elas podem ser
separadas por um campo magntico ou eltrico.
a) RADIAO ALFA
Tambm denominada raios alfa ou partculas alfa,
so partculas positivas iguais ao ncleo do tomo do
elemento hlio, ou seja, cada uma constituda por dois
prtons e dois nutrons. Portanto, a partcula alfa apresenta
carga +2 e massa 4.
A demonstrao definitiva de que as partculas alfa
so iguais aos ncleos de hlio foi dada por Rutherford, em
1909. Esse cientista observou que um recipiente contendo
material emissor de partculas alfa, aps certo tempo, ficava
impregnado do elemento hlio.
As partculas alfa, como explicou Rutherford,
capturavam eltrons do ambiente e se transformavam em
tomos de hlio.
b) RADIAO BETA
A radiao beta, tambm chamada de raios beta ou
partculas beta, so partculas negativas iguais aos eltrons,
ou seja, cada partcula beta um eltron, portanto apresenta
carga -1 e massa 0.
Como no se admite que o ncleo contm eltrons,
a partcula beta deve se formar pela desintegrao de um
nutron:
nutron prton + eltron + neutrino
Esse eltron imediatamente expulso pelo ncleo,
recebendo a denominao de partcula beta.
O neutrino que se forma na desintegrao do nutron uma
partcula sem carga e de massa muito pequena. A sua
formao visa conservar a quantidade de movimento e foi
descoberta por Pauli, em 1927.
A representao da partcula beta
1
0
| .
c) RADIAO GAMA
A radiao gama, tambm chamada de raios gama,
so ondas eletromagnticas cujo comprimento de onda varia
de 0,5 A a 0,005 A. Esse tipo de radiao acompanha
normalmente as radiaes alfa e beta. Por serem ondas
eletromagnticas, apresentam carga e massa nulas.
Sua representao ou
0
0
.
Observaes:
1
a
) Um ncleo radiativo emite ou radiao alfa ou radiao
beta, mas nunca as duas ao mesmo tempo. A radiao gama
quase sempre est presente.
2
a
) As radiaes alfa, beta e gama apresentam o seguinte
comportamento diante da matria:
* As radiaes alfa apresentam uma velocidade em
torno de 20000km/s e percorrem cerca de 2,5cm no ar.
Conseguem atravessar delgadas lminas de alumnio ou
ouro de espessura igual a 0,0001 mm, mas so barradas por
uma simples tolha de papel.
* As radiaes beta apresentam uma velocidade
prxima da luz e percorrem poucos metros no ar.
Conseguem atravessar laminas de chumbo de at 2 mm ou
de alumnio de at 5 mm, mas so barradas por uma placa
de madeira de 2,5 cm de espessura.
16
* As radiaes gama apresentam a velocidade das
ondas eletromagnticas (velocidade da luz: 300.000 km/s) e
percorrem milhares de metros no ar. Conseguem atravessar
chapas de ao de at 15cm de espessura, mas so barradas
por grossas placas de chumbo ou paredes de concreto.
2- LEIS DA DESINTEGRAO RADIATIVA
As desintegraes por emisso de partculas alfa ou
beta so regidas por leis estabelecidas pelo qumico ingls
Frederick Soddy (1877-1956) e por Kasimir Fajans, em 1913.
2.1- LEI DE SODDY: Ao emitir uma partcula alfa (
2
4
o ),
O ncleo atmico tem o seu nmero atmico (Z) diminudo
em duas unidades, e o seu nmero de massa (A) diminudo
em quatro unidades.
Esse fenmeno nuclear pode ser representado pela
equao abaixo, na qual podemos notar que h conservao
da carga e conservao do da massa:
o +
4
2
4 A
2 Z
A
Z
Y X
Conservao da massa: A = A 4 + 4
Conservao da carga: Z = Z 2 + 2
2.2- LEI DE SODDY-FAJANS: Ao emitir uma partcula
beta | o ncleo atmico tem o seu nmero atmico (Z)
aumentado em uma unidade, e o seu nmero de massa
inalterado.
Esse fenmeno nuclear pode ser representado pela
equao: |
0
0
0
1 1
+ +
+
Y X
A
Z
A
Z
3- APLICAO DA RADIOATIVIDADE
3.1- PRODUO DE ENERGIA ELTRICA: Atravs das
usinas atmicas (Frana, Angra dos Reis).
3.2- INDSTRIA: Tubos metlicos para descobrir falhas e
corroses, na indstria de enlatados matando
microorganismos.
3.3- QUMICA: Na determinao do mecanismo de uma
reao.
3.4- MEDICINA: No diagnstico de doenas.
3.5- ARQUEOLOGIA: Na determinao da idade de plantas
e fsseis atravs do C
14
.
4- IMPLICAO DA RADIOATIVIDADE
O grande perigo o organismo no sentir de
imediato, pois vai absorvendo gradativamente, e quando
perceber a sade ou, mesmo a vida j se encontra
seriamente comprometida. Os primeiros sintomas da
contaminao so tonturas, vmitos e diarria.
A partir da 2
a
Guerra Mundial comeou o
agravamento atravs das exploses nucleares para testes,
principalmente pela crise poltica.
Em 1963 houve um acordo para no ocorrer testes
na atmosfera e sim subterrneos, a fim de evitar a
contaminao de rios, lagos etc.
Mesmo assim trs acidentes ficaram em evidncia.
1
o
- Na usina nuclear de Three-Mile Island: pela falha de um
dos reatores, porm no houve mortes.
2
o
- Na usina nuclear de Chernobyl. Nesta, a falha foi maior,
causando mortes, muita contaminao, inclusive nascendo
pessoas defeituosas.
3
o
- Goinia, num hospital de radioterapia desativado, foi
encontrada uma cpsula contendo Cs-137, por dois
indivduos que venderam para um ferro velho. Os
funcionrios do ferro velho destruram a cpsula, ficando
exposto cerca de 20g de CsCl, o qual brilha no escuro com
uma colorao azul.
5- EFEITOS FISIOLGICOS DAS RADIAES
As radiaes so muito perigosas para pessoas.
Esse perigo est diretamente ligado:
- intensidade da radiao, medida em roentgen, unidade
que mede a capacidade de a radiao ionizar o ar (1
roentgen (1r) produz 2,6.10
-4
C/kg de ar seco nas
CNTP). O ser humano submetido a radiaes acima de
200 r ser acometido de doenas graves e at fatais;
- ao tempo durante o qual a pessoa fica exposta s
radiaes;
- natureza das radiaes; as mais perigosas so as
radiaes gama, devido ao seu alto poder de
penetrao.
17
As radiaes, alm de provocarem destruio das
clulas, queimaduras, etc., podem tambm causar efeitos
genticos e com isso, determinar mutaes nos
descendentes.
Para evitar acidentes, j que essas radiaes,
diferentemente das luminosas e calorficas, no podem ser
percebidas pelos nossos sentidos, todas as pessoas que
trabalham com material radiativo devem faz-lo protegidas
por paredes de concreto, chumbo, etc., utilizando roupas
especiais e, na medida do possvel, manipulando os
materiais com garras mecnicas.
O sistema de alerta para que a pessoa possa perceber o
perigo constituda de uma placa, presa na sua roupa,
contendo uma substncia que escurece sob a ao de uma
intensidade perigosa de radiao.
6- FISSO NUCLEAR
Fisso nuclear a diviso do ncleo de um tomo
em dois ncleos menores, com liberao de uma quantidade
enorme de energia.
92
235
U +
0
1
n
56
142
Ba +
36
91
Kr + 3
0
1
n + 4,6 x 10
9
kcal.
Essa reao responsvel pelo funcionamento dos reatores
atmicos ou nucleares e pela desintegrao da bomba
atmica (bomba A), que foi testada em 1945 no deserto do
Novo Mxico. Alguns dias depois, uma bomba atmica de
235
U batizada de Little Boy foi detonada sobre a cidade
japonesa de Hiroshima. Trs dias depois uma outra bomba
atmica do
239
Pu, batizada de Fat Man explodiria em
Nagasqui.
A primeira usina nuclear destinada produo de
energia eltrica foi inaugurada nos Estados Unidos em 1951.
At hoje o funcionamento de um reator s se torna
possvel de duas maneiras: retardando-se os nutrons ou
usando-se um combustvel mais fssil (urnio enriquecido,
plutnio-239, etc.).
7- FUSO NUCLEAR
Fuso nuclear a juno de ncleos atmicos
produzindo um ncleo maior, com liberao de uma
quantidade enorme de energia.
De certa maneira, a fuso nuclear o fenmeno
inverso da fisso nuclear:
- a fisso quebra tomos grandes (U, Pu, etc.), reduzindo-os
a tomos menores;
- a fuso aglomera tomos pequenos (hidrognio, deutrio,
trtio, etc.), produzindo tomos maiores.
A fuso nuclear a reao que ocorre no Sol e
quando uma bomba de hidrognio (bomba H) explode. No
entanto, para que a fuso ocorra, necessria uma altssima
temperatura (10 milhes de graus Celsius), que conseguida
atravs da exploso de uma bomba atmica, que funciona
como um detonador da bomba H.
EXERCCIOS
01- Qual das seguintes afirmaes correta?
a) Raios o so ncleos de tomos de hlio, formados por 4
prtons e 4 nutrons.
b) O poder de penetrao dos raios o aumenta com a
elevao da presso.
c) Os raios | so eltrons emitidos pelos ncleos dos tomos
dos elementos radiativos.
d) Os raios so radiaes da mesma natureza que os raios
o e |.
02- Na seqncia de desintegraes radiativas:
E D C B A
226
88
230
90
230
89
230
88
234
90
temos, sucessivamente, emisses:
a) o, |, |, |. c) o, o, |, |. e) o, |, |, o.
b) o, o, o, o. d) |, o, o, |.
03- Complete as equaes, escrevendo o nmero atmico e
de massa que esto faltando:
a) U
235
92
Th + o c) Bi
210
83
Po + |
b) Ra Rn
222
86
+ o d) Pa U
234
92
+ |
04- Analise as equaes abaixo e responda s questes:
X U
239
92
+ Y X +
a) Qual a carga e a massa de Y?
b) O que Y em relao a X?
05- Dada a srie de desintegraes
E D C B A
223
87
| | o o
, identifique os
istopos, os isbaros e os istonos.
06- Quais as semelhanas e diferenas entre os istopos de
csio
55
133
Cs (estvel) e
55
137
Cs (radioativo), com relao ao
nmero de prtons, nutrons e eltrons?
07- Aponte a(s) alternativa(s) correta(s). Os raios gama:
a) no so defletidos pelos campos magnticos;
b) so uma forma de radiao eletromagntica;
c) so capazes de ionizar certos gases;
d) so resultantes da desintegrao nuclear;
e) so resultantes do rearranjo dos eltrons extranucleares.
08- O elemento
84
214
Po emite uma partcula o. Quais os
nmeros atmico (Z) e de massa (A) do novo elemento
qumico (X) formado?
09- O elemento
82
214
Pb emite uma partcula |. Quais os
nmeros atmico (Z) e de massa (A) do novo elemento (X)
formado?
18
10- Complete as equaes de transmutao ou de
decaimento radioativo, indicando o tomo produzido por
Z
A
X e calculando A e Z.
a)
92
238
U o + d)
81
208
Tl o +
b)
88
228
Ra o + e)
90
238
Th o +
c)
83
212
Bi o +
11- Na transformao do
92
238
U em
82
206
Pb , quantas partculas
o e quantas | so emitidas, por tomo de urnio inicial?
12- Ao se desintegrar, o tomo 86Rn
222
emite 3 partculas o e
4 partculas |. Determine os nmeros atmicos e de massa
do tomo resultante.
13- Na transformao do
89
228
Ac em
84
212
Po , quantas
partculas o e quantas | so emitidas?
14- Assinale a alternativa correta:
a) As radiaes so as de maior poder ionizante.
b) Quando um tomo emite uma partcula |, seu nmero de
prtons aumenta 1 unidade.
c) A partcula o tem o maior poder de penetrao.
d) Mesmo em doses muito grandes, as radiaes so
inofensivas ao organismo humano.
e) Quando um tomo emite radiaes o, seu nmero
atmico cresce 2 unidades.
15- Em 1902, Rutherford e Soddy descobriram a ocorrncia
da transmutao radioativa investigando o processo
espontneo
88
226
Ra Rn
222
86
+ x. A partcula x
corresponde a um:
a) ncleo de hlio. d) nutron
b) tomo de hidrognio. e) eltron.
c) prton.
16- Na sequncia radioativa 84A
216
82B
212
83C
212
84D
212
82E
208
temos, sucessivamente emisses:
a) o, |, |, o d) , |, |,
b) |, o, o, | e) o, |, , o
c) o, , , o
17- Partindo-se de um tomo radioativo, chega-se a um
elemento
82
206
Pb , atravs de trs decaimentos | e dois
decaimentos o. Esse elemento :
a)
83
214
Bi c)
90
218
Th e)
86
218
Rn
b)
89
214
Ac d)
88
218
Ra
18- Um elemento radioativo X emite, sucessivamente, uma
partcula alfa (o) e duas partculas beta (|
), transformando-
se no elemento Y. Os elementos X e Y so:
a) istopos. c) ismeros. e) isotnicos.
b) isbaros. d) istonos.
19- Complete a seguinte equao nuclear:
7
14
N +
2
4
o
9
17
F + ........ .
20- Qual o nmero de prtons e de nutrons existentes no
ncleo X formado na reao nuclear:
25
55
Mn +
0
1
n X +
2
4
o ?
21- Complete as seguintes equaes nucleares:
a)
7
14
N +
2
4
He
8
17
O + ........
b)
15
30
P S
30
16
+ ........
c)
1
3
H
2
3
He + ........
22- Bombardeando um istopo do cobre de nmero de
massa 63 com deutrio, podem-se obter istopos do zinco de
nmero de massa 64 e 65. Equacione essas transmutaes.
(Nmeros atmicos: Cu = 29, Zn = 30)
23- O
92
235
U sofre fisso de acordo com a equao
92
235
U +
0
1
n Sr
94
38
+
Z
A
X + 3
0
1
n . Qual o nmero de nutrons
do nucldeo
Z
A
X ?
24- O
55
137
Cs pode ser obtido como um dos produtos de
fisso do urnio irradiado e tem propriedades radioativas,
emitindo radiaes gama e partculas beta. Sua
desintegrao pode ser representada simplificadamente
como Cs
_ | ,
Ba. Qual a massa atmica e o nmero
atmico do elemento formado? Em relao ao Cs que o
originou, ele ser um isbaro ou um istopo.? Justifique suas
respostas.
25- Na famlia radioativa do trio, parte-se do 90Th
232
e
chega-se ao 82Pb
208
. Os nmeros de partculas alfa e beta
emitidas no processo todo so, respectivamente:
a) 1 e 1
b) 4 e 6
c) 6 e 4
d) 12 e 16
e) 16 e 12
26- Um dos primeiros elementos radioativos artificiais foi
obtido por Frederie Joliot e Irene Joliot Curie em 1933 pela
reao de transmutao:
5
10
B + o X +
0
1
n
O tomo desse elemento X artificial possui:
a) 9 prtons e 11 nutrons.
b) 7 prtons e 6 nutrons.
c) 7 prtons e 7 nutrons.
d) 7 prtons e 13 nutrons.
19
e) 9 prtons e 13 nutrons.
27- O nutron foi descoberto pelo bombardeamento do
istopo Be
9
4
com partculas o, como indica a equao:
4
9
Be + o
0
1
n + X
O istopo X formado nessa reao :
a)
2
4
He d)
6
13
C
b)
7
12
N e)
6
12
C
c)
7
14
N
28- Dadas as reaes nucleares:
5
12
B
6
12
C + X
7
14
N + Y
6
14
C +
1
1
H
8
16
O +
1
2
H
7
14
N + Z
X, Y e Z so, respectivamente, as partculas:
a) beta, nutron e alfa.
b) nutron, beta e alfa.
c) nutron, alfa e beta.
d) alfa, beta e nutron.
e) alfa, gama e beta.
29- Na equao nuclear
26
57
Fe + o
0
1
n + X verifica-se
que o elemento X:
a) um dos istopos do ferro.
b) um dos istopos do nquel.
c) um gs nobre.
d) um metal alcalino.
e) apresenta 30 nutrons.
30- Assinale a alternativa que indica o istopo do elemento X
que completa a reao de fisso nuclear:
92
235
U +
0
1
n
38
90
Sr + X + 3
0
1
n
a)
53
145
I
b)
53
143
I
c)
51
145
Sb
d)
54
144
Xe
e)
54
143
Xe
31- Temos o tomo U
235
92
. Se ele emitir, sucessivamente,
duas partculas alfa e quatro partculas beta, qual ser o
nmero atmico e o de massa do tomo resultante?
32- Supondo que o ncleo do istopo chumbo 206 ( Pb
206
82
)
seja composto de partculas alfa e de nutrons, quantas
dessas partculas existem?
33- O elemento plutnio (Pu) apresenta um de seus istopos
com 94 prtons e 148 nutrons. Se a partir do tomo desse
istopo houver emisses sucessivas de trs partculas alfa e
cinco partculas beta, qual ser o nmero de prtons e o de
nutrons do tomo resultante?
34- Quantas partculas alfa e beta o tomo Pa
231
91
deve
emitir, sucessivamente, para se transformar em Pb
207
82
?
35- Um tomo X, de nmero atmico 92 e nmero de massa
235, emite uma partcula alfa e transforma-se num tomo A,
o qual, por sua vez, emite uma partcula beta, transformando-
se num tomo B. Descubra os nmeros atmico e de massa
dos tomos A e B e identifique os istopos, os isbaros e os
istonos.
20
NMERO DE OXIDAO (NOX)
1- CONCEITO
a carga que se atribui ao tomo de um elemento
numa substncia devido a perda ou recebimento de eltrons.
Nos compostos inicos o NOX do elemento quando
formando on simples igual carga do on (j que esta
representa o nmero de eltrons perdidos ou recebidos pelo
tomo do elemento)
Exemplo: Formao do cloreto de clcio (CaCl2)
Ca 2 eltrons na ltima camada (subgrupo 2A)
Cl 7 eltrons na ltima camada (subgrupo 7A)
NOX do Ca no CaCl2 = +2
NOX do Cl no CaCl2 = 1
Nos compostos que apresentam ligaes covalentes, o
NOX do tomo do elemento corresponde a uma carga
terica, admitindo-se que o tomo mais eletronegativo fique
com o par de eltrons.
Exemplo 1: H
2
H H
0 0
Exemplo 2: HCl H Cl
+
1 1
Exemplo 3: HNO3
H N O
+ +
1 5
3
2
2- REGRAS PRTICAS PARA A DETERMINAO DO
NOX DE UM ELEMENTO
1
a
REGRA: Elementos que apresentam sempre o mesmo
NOX em seus compostos:
- Metais alcalinos e Ag, Ni e Cd NOX = +1
- Metais alcalinos terrosos NOX = +2
- Alumnio NOX = +3
- Flor NOX = 1
- Cloro, bromo e iodo, em compostos no-oxigenados, em
geral NOX = 1
- Enxofre, em compostos no-oxigenados, em geral NOX
= 2
- Hidrognio NOX = +1, exceto nos hidretos metlicos
(LiH, CaH2, etc.) em que o NOX do Hidrognio 1.
- Oxignio NOX = 2, exceto:
- Nos perxidos (H2O2, Na2O2, BaO2, etc.) NOX
do O = 1
- Nos superxidos (NaO2, CaO4, etc.) NOX do O
= 1/2
- Ligado ao flor: OF2 NOX do O = +2
O2F2 NOX do O= +1
2
a
REGRA: Nas substncias simples, o NOX do elemento
igual a ZERO.
NOX do H no H2 = 0
NOX do Na no sdio metlico = 0
NOX do O no O3 = 0
NOX do S no S8 = 0
3
a
REGRA: Num on simples, o NOX do elemento igual a
carga do on.
NOX do Fe no Fe
2+
= +2
NOX do S no S
2
= 2
NOX do Al no Al
3+
= +3
NOX do Cl no Cl
-
= 1
4
a
REGRA: Nos compostos, a soma algbrica das cargas
totais dos elementos sempre igual a ZERO.
Exemplo: Determinao do NOX do P no pirofosfato
magnsio (Mg2P2O7)
NOX +2 x 2
Mg2 P2 O7
Carga Total +4 2x 14 = 0 x= +5
5
a
REGRA: Nos ons compostos, ou seja, ons formados por
dois ou mais elementos diferentes, a soma algbrica das
cargas totais dos elementos igual a carga do on.
- Determinao do NOX do Mn no MnO4
(on permaganato)
NOX x 2
Mn O4
Carga Total x 8 = 1 x = +7
Valores Mximos e Mnimos dos NOX dos elementos de
acordo com a posio na Tabela Peridica.
# NOX mximo = + (n
o
do subgrupo)
# NOX mnimo = (8 n
o
do subgrupo)
Obs. Os metais no tm NOX mnimo.
Exemplos:
Elemento do 4A: NOXmx = + 4
NOXmn = 4
Elemento do 7B: NOXmx = + 7
NOXmn = no tem
EXERCCIOS
01- Qual a soma dos Nox de todos os elementos
formadores de uma molcula neutra? E no caso de um on
composto?
02- Numa transformao qumica, o estanho teve seu
nmero de oxidao aumentado em quatro unidades,
segundo a equao:
Sn Sn
4+
Nessa equao, o estanho:
a) ganhou quatro prtons.
b) ganhou quatro eltrons.
c) perdeu quatro prtons.
d) perdeu quatro eltrons.
e) perdeu dois prtons e dois eltrons.
03- Determine o NOX do elemento em destaque em cada
espcie qumica:
1) O3 17) Mn2O7 33) Zn3(BO3)2
2) S8 18) HNO3 34) NaH2PO3
21
3) BrCl 19) H4P2O7 35) H3C2O2
4) SBr2 20) H3BO3 36) HSO4
5) SF6 21) CaMnO4 37) MnO4
2
6) Na2S 22) Al(NO3)3 38) SO3
2
7) ZnI2 23) CH4O 39) ClO4
8) Ni2S 24) Mn3O4 40) SiO4
4-
9) KH 25) Na2S2O3 41) BrO
10) Fe2S3 26) Ba2Sb2O7 42) H2AsO5
2
11) AuCl 27) CaSO3 43) PO4
3
12) CoF3 28) CH3F 44) PCl4
+
13) Al2O3 29) Al2(Cr2O7)3 45) S2O6
2
14) CaO 30) AgKSO3 46) C2O4
2
15) BaO2 31) Ag3PO4 47) CrO4
2
16) K2O4 32) H2CO3 48) IO4
04- O que nmero de oxidao (Nox)?
05- Quais so os nmeros de oxidao do iodo nas
substncias I2, NaI, NaIO4 e AlI3?
06- O nmero de oxidao do mangans no permanganato
de potssio (KMnO4) :
a) + 2. c) + 5 e) 8
b) + 3. d) + 7
07- O nmero de oxidao do tomo de nitrognio nos
compostos: N2O5 NO; HNO3 e NaNO2 , respectivamente:
N2O5 NO HNO3 NaNO2
a) + 5 + 1 + 3 + 2
b) + 2 + 1 + 1 + 1
c) + 5 + 2 + 4 + 3
d) + 1 + 2 + 3 + 4
e) + 5 + 2 + 5 + 3
08- Indique, dentre as substncias apresentadas, a que
contm nitrognio com nmero de oxidao mais elevado.
a) N2 d) NH4Cl
b) Na3N e) HNO3
c) N2O3
09- Nas substncias CaCO3, CaC2, CO2, C (grafite) e CH4,
os nmeros de oxidao do carbono so, respectivamente:
a) 4 + 1 + 4 0 + 4
b) + 4 1 + 4 0 4
c) 4 2 0 + 4 + 4
d) + 2 2 + 4 0 4
e) + 4 + 4 + 4 + 4 + 4
10- No mineral perovskita, de frmula mnima CaTiO3, o
nmero de oxidao do titnio :
a) + 4 d) 1
b) + 2 e) 2
c) + 1
11- Os nmeros de oxidao dos halognios nos compostos
KBr, NaIO3, F2 e Cl2O3, so, respectivamente:
a) 1, + 5, 0, + 3. d) + 1, + 3, 0, + 5.
b) 1, 5, 2, 3. e) 1, 1, 1, 1.
c) + 1, 1, 2, + 2.
12- Quais os nmeros de oxidao dos elementos que esto
em destaque nos ons abaixo?
a) IO3
c) CrO4
2
b) MnO3
2
d) PtCl6
2
13- Os nmeros de oxidao do enxofre nas espcies SO2 e
SO4
2
so, respectivamente:
a) zero e + 4 d) + 4 e + 6
b) + 1 e 4 e) 4 e 8
c) + 2 e + 8
14- O tomo de cromo apresenta nmero de oxidao +3 na
espcie
a) Cr2O3
b) CrO
c) Cr
d) CrO4
2
e) Cr2O7
2
22
15- Os nmeros de oxidao dos elementos em destaque
nas seguintes substncias so:
KClO3 K2P2O7 Cr2O7
2
HS2O3
O3
a) + 5, + 6, + 6, + 1, 0.
b) + 5, + 6, + 7, + 3, 0.
c) + 5, + 6, + 6, + 2, 2.
d) + 6, + 5, + 6, + 2, 0.
e) + 6, + 5, + 6, + 2, 2.
16- Quais os nmeros de oxidao dos elementos
sublinhados nas substncias seguintes?
a) KClO2
b) SrCO3
c) K2SO3
d) NaNO2
e) NaNO3
f) Ba2As2O7
g) Na2MnO4
h) As2S5
17- Quais so os nmeros de oxidao do mangans (Mn)
nos xidos MnO, MnO2 e Mn2O7?
18- Quais so os nmeros de oxidao do oxignio nas
substncias H2O, O2 e BaO2?
19- Os nmeros de oxidao dos elementos grifados nas
frmulas XHPO4, YHSO3, ZSO3, R(ClO3)2 so
respectivamente:
a) +1, +2, +2, +3.
b) +2, +1, +2, +5.
c) +1, +3, +2, +3.
d) +1, +1, +2, +5.
e) +2, +3, +1, +5.
20- Os nmeros de oxidao do carbono e do ferro, no
composto K3[Fe(CN)6], so, respectivamente:
a) +4 e +3
b) +2 e +3
c) -2 e +3
d) -1 e +2
e) +3 e +2
21- Os nmero de oxidao do nitrognio nos compostos
Na3N, NH4Cl, KNO2 e Ca(NO3)2 so, respectivamente:
a) -1, +5, +2,+5.
b) +3, +1, -5, -3.
c) -3, -3, +3, +5.
d) +3, -4, +1, +3.
e) +3, +1, +5, -3
22- Os estados de oxidao dos elementos grifados nas
frmulas: HCOOH, BaO2, BeH2, K2S so, respectivamente:
a) 2-; 4+; 1+; 2-
b) 2+; 2+; 1-; 2+
c) 2-; 2+; 1+; 2-
d) 2+; 2+; 1-; 2-
e) 2+; 4+; 1+;2+
23- O nitrognio possui nmero de oxidao 3- no composto:
a) HNO2 c) NH3 e) N2O3
b) HNO3 d) NCl3
24- Observe os ons relacionados: HCO
3
1
, NH
4
1+
, S2O
7
2
,
P2O
7
4
e ClO
4
1
. Com base nas regras de determinao do
nmero de oxidao, o NOX dos elementos em negrito
nesses ons, na ordem apresentada acima, :
a) 4+; 3-; 6+; 5+; 7+
b) 4+; 3+; 4+; 3+; 7+
c) 4+; 3+; 4+; 5+; 5+
d) 4-; 3-; 4+; 3+; 5+
e) 4-; 3-; 6+; 5+; 7+
25- Descobertas recentes da medicina indicam a eficincia
do xido ntrico, NO, no tratamento de determinado tipo de
pneumonia. Sendo facilmente oxidado pelo oxignio a NO2,
quando preparado em laboratrio, o cido ntrico deve ser
recolhido em meio que no contenha O2. Os nmeros de
oxidao no NO e NO2 so respectivamente:
a) 3+ e 6+
b) 2+ e 4+
c) 2+ e 2+
d) zero e 4+
e) zero e 2+
23
LIGAO QUMICA
1- MODELO DO OCTETO
Nas condies ambientes apenas os gases nobres
(He, Ne, Ar; Xe, Kr e Rn) apresentam tomos estveis
isolados, isto , que no esto unidos a outros tomos.
Ao contrrio de todos os outros elementos, os gases
nobres apresentam a ltima camada contendo oito eltrons,
com exceo do hlio, cuja ltima camada s comporta dois.
Tudo indica, portanto, que possuir uma eletrosfera igual de
um gs nobre faz com que o tomo fique estvel.
De acordo com esse modelo, temos:
Um tomo estar estvel quando sua ltima camada
possuir oito eltrons (ou dois, no caso da camada K). Os
tomos no-estveis se unem uns aos outros a fim de
adquirir essa configurao de estabilidade.
A unio entre tomos chamada de ligao qumica,
que pode ocorrer de trs maneiras: a ligao inica, a ligao
covalente e a ligao metlica.
2- LIGAO INICA OU ELETROVALENTE
a ligao em que um tomo doa e outro recebe
eltrons. Consideremos tomos neutros dos elementos sdio
e cloro: Na e Cl.
Os ons Na
+
e Cl
-
possuem cargas eltricas opostas
e, portanto, se atraem mutuamente. Essa atrao mantm os
ons unidos, formando uma substncia muito conhecida, o
sal de cozinha, representado pela frmula NaCl. Tal unio
chamada de ligao inica ou ligao eletrovalente.
Ex2: Ca e F
Ex3: Al e O
Os elementos das famlias 1, 2 e 13, que so metais,
apresentam um, dois e trs eltrons, respectivamente e, para
ficarem estveis, de acordo com a regra do octeto, devero
perder esses eltrons. J os elementos das famlias 15,16 e
17, predominantemente ametais, devero receber o nmero
de eltrons que faltam para completar o octeto.
O mdulo da carga de um on chamado de
valncia desse on. Assim, por exemplo, Na
+
um ction
monovalente; O
2-
um nion bivalente e Al
3+
um ction
trivalente.
Todo composto inico slido, quando puro, nas
condies ambientes de presso e temperatura.
3- LIGAES COVALENTES
3.1- LIGAO COVALENTE NORMAL
a ligao em que h o compartilhamento de
eltrons que leva a formao de molculas.
O hidrognio possui apenas um eltron e necessita,
portanto, de um para ficar com a eletrosfera igual do hlio.
Ex1:Cl2 Ex2: O2 Ex3: N2
Molculas de substncias compostas so tambm
formadas por tomos que se unem atravs de ligaes
covalentes.
Ex1: HCl Ex2: H2O Ex3: CO2
O nmero de ligaes covalentes que um tomo faz
chamado de valncia desse tomo. Assim, por exemplo, H
e Cl so monovalentes; O bivalente; N trivalente e C
tetravalente.
As substncias formadas por ligao covalente so
chamadas de substncias moleculares. Podem ser slidas,
lquidas ou gasosas.
3.2- LIGAO COVALENTE COORDENADA OU
DATIVA
aquela em que um dos tomos entra com dois
eltrons para o compartilhamento e o outro com nenhum.
Consideremos o composto de frmula molecular SO2, um
poluente atmosfrico comum nas grandes cidades.
Outro exemplo de molcula em que ocorre a ligao
dativa o oznio.
4- ALOTROPIA
Altropos so diferentes substncias simples
formadas por um mesmo elemento qumico. Esse fenmeno
ocorre com o oxignio, fsforo, carbono e enxofre.
- Gs oxignio (O2) e gs oznio (O3)
- Fsforo branco (P4) e fsforo vermelho (Pn)
- Carbono grafite (CG) e carbono diamante (CD)
- Enxofre rmbico e enxofre monoclnico
5- LIGAO METLICA
Os metais no exercem uma atrao muito alta
sobre os eltrons da sua ltima camada e, por isso possuem
alta tendncia a perder eltrons. Dessa forma, um metal
slido constitudo por tomos metlicos em posies
ordenadas com seus eltrons de valncia livres para se
movimentar por todo o metal. Assim, temos um "amontoado"
organizado de ons metlicos positivos mergulhados num
"mar de eltrons" livres. Este o chamado modelo do mar de
eltrons, que explica a condutividade eltrica dos metais.
A regra do octeto no explica a ligao metlica.
O agrupamento dos tomos de metais forma o
chamado retculo cristalino metlico. Levando isso em conta,
um pedao de ferro, por exemplo, deveria ser representado
por Fen, em que n representa um nmero muito grande de
tomos de ferro presentes nesse pedao. Contudo, os
qumicos, para simplificar, representam um pedao de metal
apenas pelo smbolo do elemento, no caso, Fe.
5.1- LIGAS METLICAS
So misturas slidas de dois ou mais elementos, em
que a totalidade, ou pelo menos a maior parte dos tomos
presentes de elementos metlicos.
Ouro 18 quilates, bronze, lato e ao so materiais
que apresentam uma caracterstica comum: trata-se de ligas
metlicas.
- Ouro 18 quilates uma liga de ouro e cobre.
- Bronze uma liga de cobre e estanho.
- Lato uma liga de cobre e zinco.
24
- Ao uma liga de ferro com pequena quantidade de
carbono.
EXERCCIOS
01- Analise as afirmativas relativas aos elementos qumicos
de nmeros atmicos 3, 11 e 19.
I. Pelo fato de possurem 1 eltron no ltimo nvel, tendem a
se transformar em nion de carga -1.
II. Por pertencerem a um mesmo perodo da tabela peridica,
apresentam propriedades qumicas semelhantes.
III. Ao se combinarem, respectivamente, com os elementos
do 2
o
, 3
o
e 4
o
perodos do grupo 7A, formam compostos
inicos.
Est(o) correta(s):
a) apenas I. c) apenas III. e) apenas I e III.
b) apenas II. d) apenas I e II.
02- (E Dom Bosco-DF) Um elemento de configurao 1s
2
2s
2
2p
6
3s
2
3p
5
possui forte tendncia para:
a) perder 5 eltrons. d) ganhar 2 eltrons.
b) perder 1 eltron. e) ganhar 1 eltron.
c) perder 2 eltrons.
03- (UFRN) Na ligao qumica de um tomo X, alcalino
terroso (2A), com um tomo Y, pertencente famlia dos
halognios (7A), dever haver a formao de ction e nion,
respectivamente:
a) X
+
e Y
-
. c) X
2+
e Y
-
. e) X
7+
e Y
2-
.
b) X
+
e Y
2-
. d)X
2+
e Y
7-
.
04- (U. F. de Santa Maria-RS) Assinale a alternativa que
apresenta somente compostos com ligaes covalentes
normais.
a) HBr, NaCl, Cl2. d) HCl, CCl4, H2O.
b) Hl, NH3, H2SO4. e) BeCl2, HCN, NaF.
c) CaCl2, H2S KI
05- (Cesgranrio) Um elemento E tem, na sua camada de
valncia, a configurao 4s
2
4p
4
. Sobre o elemento E, falso
afirmar que:
a) pertence famlia dos calcognios na tabela peridica.
b) est localizado no quarto perodo, grupo 6A da tabela
peridica.
c) um elemento representativo na classificao peridica.
d) tende a receber 2 eltrons e formar o on E
2-
.
e) forma com elementos X do grupo 1A compostos inicos de
frmula XE2.
06- (UFSE) Todos os tomos esto com eletrosferas iguais
s de gases nobres na molcula representada por:
a) CF. b) CF2. c) CF3. d) CF4. e) CF5.
07- (U. E Vicosa-MG) Escreva a frmula estrutural para cada
frmula molecular representada a seguir.
a) CH5N
b) CO2
c) C2Cl2F4
08- Esta questo se refere aos seguintes elementos
qumicos: sdio, magnsio, alumnio, silcio, fsforo, enxofre
e cloro.
a) Consulte a tabela peridica e determine os smbolos e as
famlias desses elementos.
b) Sabe-se que trs deles se combinam com o hidrognio
formando compostos em que a ligao inica. Quais so
eles?
c) Escreva as frmulas dos compostos mencionados no item
anterior.
d) Sabe-se que os outros quatro elementos se combinam
com o hidrognio formando compostos em que a ligao
covalente. Escreva a frmula estrutural desses compostos.
09- (F. F. Uberlndia-MG) O fosgnio (COCl2), um gs,
preparado industrialmente por meio da reao entre o
monxido de carbono e o cloro. A frmula estrutural da
molcula do fosgnio apresenta:
a) uma ligao dupla e duas ligaes simples.
b) uma ligao dupla e trs ligaes simples.
c) duas ligaes duplas e duas ligaes simples.
d) uma ligao tripla e duas ligaes simples.
e) duas ligaes duplas e uma ligao simples.
10- (Esal-MG) O nmero mximo de ligaes coordenadas
ou dativas que o cloro pode efetuar igual a:
a) 1. c) 3. e) 5.
b) 2. d) 4.
11- Assinale se as seguintes afirmativas so verdadeiras ou
falsas.
( ) Um pedao de metal slido constitudo por molculas.
( ) Quando tomos de metal se unem por ligao metlica,
eles passam a ficar com o octeto completo.
( ) Num retculo cristalino metlico, os tomos podem estar
unidos por ligaes inicas ou covalentes.
( ) Os metais so bons condutores de corrente eltrica, pois
apresentam eltrons livres.
( ) Os metais so bons condutores de calor, pois
apresentam eltrons livres.
( ) O ao uma liga que apresenta alta resistncia trao,
da ser usado na fabricao de cabos de elevadores e na
construo civil.
12- (Ceeteps-SP) Um qumico recebeu trs amostras slidas
(X, Y, Z) e, aps alguns testes, obteve os seguintes
resultados:
I. X conduziu eletricidade no estado slido.
II. Y no conduziu eletricidade no estado slido, mas
conduziu no estado liquido.
III. Z no conduziu eletricidade no estado slido nem no
estado lquido.
25
Analisando os resultados obtidos, correto afirmar
que X, Y e Z so, respectivamente:
a) composto inico, composto molecular, metal.
b) metal, composto inico, composto molecular.
c) composto inico, metal, composto molecular.
d) composto molecular, metal, composto inico.
e) metal, composto molecular, composto inico.
13- (UFSE) Alotropia o fenmeno que envolve diferentes
substncias:
a) simples formadas pelo mesmo elemento qumico.
b) compostas formadas por diferentes elementos qumicos.
c) simples com a mesma atomicidade.
d) compostas com a mesma frmula molecular.
e) compostas formadas pelos mesmos elementos qumicos.
14- (U. F. de Santa Maria-RS/Peles) A alotropia exibida por
elementos como o carbono ou enxofre pode ser definida
como a propriedade de um mesmo elemento formar
substncias ... diferentes. Essas substncias possuem
semelhantes propriedades ... mas diferentes propriedades ...
. Assinale a alternativa que completa corretamente as
lacunas.
a) simples - fsicas - alotrpicas
b) compostas - qumicas - fsicas
c) compostas - alotrpicas - qumicas
d) compostas - fsicas - qumicas
e) simples - qumicas - fsicas
6- POLARIDADE DAS LIGAES E DAS MOLCULAS
F > O > N = Cl > Br > I = S = C > F = H > metais
Eletronegatividade decrescente
6.1- POLARIDADE DAS LIGAES
Considere uma molcula de gs fluordrico (HF). O
par de eltrons compartilhado no atrado igualmente por
ambos os tomos, uma vez que o tomo do flor mais
eletronegativo que o do hidrognio. Embora o par de eltrons
esteja sendo compartilhado, ele se encontra mais deslocado
para o lado do flor Dizemos que no flor aparece uma carga
parcial negativa (simbolizada por o-), e no hidrognio uma
carga parcial positiva (simbolizada por o+). A ligao entre H
e F chamada de ligao covalente polar.
Considere, agora, o caso da molcula de H2. Como
ambos os tomos presentes possuem a mesma
eletronegatividade, no haver polarizao da ligao e
dizemos que se trata de uma ligao covalente apolar.
H
o +
F
o
H H
Quando uma ligao covalente ser polar? Sempre
que os dois tomos que se unem por ligao covalente
possurem eletronegatividades diferentes.
6.2- POLARIDADE DAS MOLCULAS
A polarizao das ligaes apresenta uma direo,
um sentido e uma intensidade (que depende da diferena de
eletronegatividade entre os tomos).
Assim, temos:
Molcula Simtrica N
o
de pares eletrnicos ao redor do
tomo central = N
o
de grupos iguais ligados ao tomo central
MOLCULA APOLAR
Molcula Assimtrica N
o
de pares eletrnicos ao redor
do tomo central = N
o
de grupos iguais ligados ao tomo
central MOLCULA POLAR
Outros exemplos, cujas molculas apresentam maior
complexidade, so:
- Compostos polares: metanol (ou lcool metlico, CH3OH),
lcool comum (etanol ou lcool etlico, CH3CH2OH) e
acetona (H3CCOCH3).
- Compostos apolares: derivados diretos do petrleo
(gasolina, benzina, querosene, leo diesel, leo
lubrificante etc.), leos e gorduras de origem animal ou
vegetal.
6.3- POLARIDADE E SOLUBILIDADE
Substncia polar tende a se dissolver bem em outra
substncia polar.
Substncia apolar tende a se dissolver bem em outra
substncia apolar.
Quando uma substncia polar e a outra apolar,
como no caso gua e gasolina, no h tendncia para
solubilizao.
7- FORAS INTERMOLECULARES
As foras que mantm as molculas unidas nos
estados slido e lquido so chamadas de foras (interaes
ou ligaes) intermoleculares. So fundamentalmente de trs
tipos: dipolo-dipolo, pontes de hidrognio e dipolo
instantneo-dipolo induzido.
7.1- INTERAES DIPOLO-DIPOLO
tpico de molculas polares. Considere uma
molcula de cloreto de hidrognio (HCl). Sua extremidade
negativa atrai a extremidade positiva de outra molcula
vizinha, o mesmo ocorrendo com sua parte positiva, que
interage atrativamente com a parte negativa de outra vizinha.
7.2- INTERAES PONTES DE HIDROGNIO
Quando, em uma molcula, tivermos o hidrognio
ligado a um dos trs elementos mais eletronegativos (F, O,
N), haver uma grande polarizao dessa ligao, o que
acarretar ao hidrognio uma grande deficincia de eltrons.
Pontes de hidrognio so interaes que ocorrem
entre molculas que apresentem tomos de H ligados a F, O
ou N.
7.3- INTERAES DIPOLO INSTANTNEO-DIPOLO
INDUZIDO
26
tpico de molculas apolares. Elas possuem uma
nuvem de eltrons em contnuo movimento. Se, durante uma
pequena frao de segundo, essa nuvem eletrnica estiver
um pouco mais deslocada para um dos extremos da
molcula, podemos dizer que foi criado um dipolo
instantneo, ou seja, por um pequeno espao de tempo
apareceram dois plos na molcula. A extremidade positiva
desse dipolo atrai os eltrons da molcula vizinha, na qual,
por sua vez, tambm aparece um dipolo, chamado de dipolo
induzido, que provocado pela primeira molcula. Esses
dois dipolos, o instantneo e o induzido, se atraem como no
caso dos dipolos permanentes. A diferena que essa
situao dura apenas uma frao de segundo.
As interaes dipolo instantneo-dipolo induzido so
conhecidas tambm como foras dipolo induzido-dipolo
induzido, ou ainda foras de disperso de London. Na
verdade, elas ocorrem em todas as substncias - polares ou
apolares; so, porm, de grande importncia nas substncias
apolares.
7.4- FORAS INTERMOLECULARES E PONTO DE
EBULIO
Quando fervemos uma substncia, estamos, na
verdade, rompendo as ligaes entre as molculas para
separ-las.
A fervura implica quebra de ligaes
intermoleculares.
Assim, ao ferver HF, estamos rompendo pontes de
hidrognio; ao ferver HCl, HBr ou HI (polares), estamos
quebrando interaes dipolo-dipolo; e, ao ferver F2, Br2 ou I2
(apolares), estamos rompendo interaes instantneo-dipolo
induzido.
Quanto maior for a massa, mais difcil ser fazer a
molcula se desprender da fase lquida e passar para a fase
vapor e, portanto, maior a temperatura necessria para a
fervura (maior ponto de ebulio).
Quanto mais fortes tambm forem as interaes
entre as molculas, mais unidas elas estaro e, portanto,
mais difcil ser ferver a substncia (maior ponto de
ebulio).
Dipolo instantneo induzido < Dipolo permanente-dipolo
permanente < Pontes de hidrognio
EXERCCIOS
15- Determine a polaridade das molculas das seguintes
substncias:
a) SO2 c) CS2; e) H2S;
b) CH3Cl; d) NF3; f) COCl2.
16- (Vunesp) P e Cl tm, respectivamente, 5 e 7 eltrons na
camada de valncia.
a) Escreva a frmula de Lewis do tricloreto de fsforo.
b) Qual o tipo de ligao formada entre os tomos de
fsforo e cloro?
c) A molcula resultante polar ou apolar?
17- (U. E. Ponta Grossa-PR) Considerando que a forma
geomtrica da molcula influi na sua polaridade, assinale a
alternativa que contm apenas molculas apolares.
a) BeH2 e NH3.
b) BCl3 e CCl4.
c) H2O e H2.
d) HBr e CO2.
e) H2S e SiH4.
18- (Mackenzie SP) A molcula apolar que apresenta
ligaes polares : (Dados: 1H
1
, 17Cl
35
, 8O
16
, 6C
12
, 7N
14
).
Eletronegatividade: H = 2,1; Cl = 3,0; O = 3,5; C = 2,5; N =
3,0.)
a) HCl. d) NH3.
b) H2O. e) H2.
c) CO2.
19- (Vunesp) A partir das configuraes eletrnicas dos
tomos constituintes e das estruturas de Lewis:
a) determine as frmulas dos compostos mais simples que
se formam entre os elementos:
I. hidrognio e carbono;
II. hidrognio e fsforo.
b) Qual a polaridade de cada uma das molculas formadas,
considerando-se o nmero de pares de eltrons?
(nmeros atmicos: H = 1; C = 6; P = 15.)
20- (Vunesp) Entre as substncias gs amonaco (NH3),
metano (CH4), cloreto de hidrognio (HCl,) nitrognio (N2) e
gua (H2O), indique qual apresenta molcula do tipo:
a) apolar; b) polar.
21- (EMTM-MG) Considere as molculas de frmulas SO2 e
BF3.
a) Represente suas frmulas de Lewis.
b) Com base nas frmulas de Lewis, discuta sobre a
polaridade previstas para cada uma dessas molculas.
(Dados os nmeros atmicos: B = 5;O = 8; F = 9; S = 16.)
22- (U. F. Vicosa-MG) A configurao eletrnica dos
elementos a principal responsvel pelas ligaes qumicas
nas substncias. Aproveitando os exemplos:
H2O(l), NaCl(s), Ag(s) , d:
a) a estrutura de Lewis do composto que apresenta ligao
covalente, indicando se o composto polar ou apolar;
b) o conceito de ligao inica;
c) a indicao de qual dos elementos envolvidos nos
compostos do enunciado o mais eletronegativo;
d) a relao (>, < ou =) existente entre o raio atmico e o
inico de um dos elementos que fazem parte do composto
inico.
27
23- (U. F. de Santa Maria-RS/Peies) Analisando as
afirmaes a seguir, referentes ao tipo de ligaes e
polaridade da molcula NCl3, indique se so verdadeiras (V)
ou falsas (F).
( ) A molcula no possui pares de eltrons emparelhados
disponveis.
( ) Existem, nessa molcula, trs ligaes covalentes
normais.
( ) A molcula polar.
A seqncia correta :
a) F, V, V. d) V, F, V.
b) V, F, F. e) F, V, F.
c) F, F; V.
24- (U. F. de Santa Maria-RS) Analise as alternativas:
I. NH3 e H2S so molculas apolares que apresentam
ligaes polares.
II. A polaridade de uma molcula depende da polaridade das
ligaes e da geometria da molcula.
III. Molculas diatmicas entre tomos iguais so sempre
apolares.
Est(o) correta(s):
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas II e III.
25- (U. F. de Santa Maria-RS/Peles) Associe a segunda
coluna primeira.
I coluna II coluna
(1) Composto inico ( ) CaCO3
(2) Composto covalente polar ( ) AlF3
(3) Composto covalente apolar ( ) CS2
( ) PCl3
( ) HBr
( ) BF3
( ) BaCl2
A seqncia correta :
a) 1 - 1 - 2 - 1 - 3 - 2 - 3. d) 1 - 1 - 3 - 2 - 2 - 3 - 1.
b) 2 - 2 - 3 - 1 - 1 - 1 - 3. e) 3 - 2 - 1 - 2 - 3 - 2 - 2.
c) 2 - 3 - 1 - 3 - 2 - 3 - 1.
26- (Vunesp) Um slido tem cheiro acentuado temperatura
e presso ambientes e apresenta as seguintes
caractersticas fsicas:
I. Pontos de fuso e ebulio baixos.
II. isolante eltrico no estado slido e fundido.
III. insolvel em gua.
Com base nesses dados, pode-se concluir que as
interaes que mantm a substncia no estado slido devem
ser do tipo:
a) ligao covalente apolar.
b) ligao covalente polar.
c) ligao inica.
d) pontes de hidrognio.
e) interaes de Van der Waals.
27- (PUC-PR) O dixido de carbono, presente na atmosfera
e nos extintores de incndio, apresenta ligao entre os seus
tomos do tipo ... e suas molculas esto unidas por ... . Os
espaos acima so corretamente preenchidos pela
alternativa:
a) covalente apolar - forcas de Van der Waals
b) covalente apolar - atrao dipolo-dipolo
c) covalente polar - pontes de hidrognio
d) covalente polar - forcas de Van der Waals
e) covalente polar - atrao dipolo-dipolo
28- (UFC) Os agregados moleculares so mantidos por
interaes fsicas (forcas intermoleculares) distintas daquelas
que originam as ligaes qumicas. Por exemplo, as
molculas de gua so mantidas em um agregado molecular
por meio das ligaes de hidrognio, que so originadas das
interaes entre as extremidades opostas dos dipolos da
gua.
Sobre as pontes de hidrognio, correto afirmar que:
a) ocorrem freqentemente entre molculas apolares, em
baixas temperaturas.
b) so mais fortes do que as ligaes inicas ou
eletrovalentes.
c) contribuem decisivamente para a ocorrncia da gua no
estado lquido, a 25
o
C e 1 atm.
d) so forcas intermoleculares originadas da interao entre
dois tomos de hidrognio.
e) somente ocorrem nos agregados moleculares de gua, a
25
o
C e 1 atm.
29- (UnipSP) Ocorre ruptura de ligaes por pontes de
hidrognio no fenmeno:
a) 2 H2O(g) 2 H2(g) + O2(g)
b) H2O(g) H2O(l).
c) CO + H2 + O2 CO2 + H2O.
d) H2(l) H2(g).
e) H2O(l) H2O(g).
30- (U. F. Vicosa-MG) Das substncias abaixo
representadas, aquela que apresenta ligaes de hidrognio
entre suas molculas :
a) CH3CH2OCH2CH3.
b) CH3COONa.
c) CH3CH2OH.
d) CH3COCl.
e) CH3COCH3.
28
31- (Vunesp) A gua, a amnia e o metano tm massas
moleculares prximas. Apesar disso, a gua possui ponto de
ebulio muito mais elevado que os da amnia e do metano.
Essas observaes experimentais podem ser explicadas
porque:
a) a gua tem ligaes inicas, enquanto o metano e a
amnia so formados por ligaes covalentes.
b) os tipos de ligaes no interferem no ponto de ebulio.
c) todos os trs compostos apresentados tm ligaes
covalentes, porm a amnia e o metano so polares.
d) as molculas de gua tm as ligaes covalentes
oxignio-hidrognio facilmente rompveis.
e) a gua possui molculas polares que formam ligaes de
pontes de hidrognio, aumentando a fora de coeso entre
suas molculas.
32- (UFPA) O gs carbnico (CO2), quando congelado,
conhecido como gelo seco, muito utilizado nos carrinhos de
sorvete e em efeitos especiais em cinema e televiso. Nessa
condio, suas molculas esto unidas por:
a) pontes de hidrognio.
b) ligaes covalentes.
c) forcas de Van der Waals.
d) ligaes dipolo-dipolo.
e) ligaes inicas.
33- (Cesgranrio) Analise o tipo de ligao qumica existente
nas diferentes substncias: Cl2, HI, H2O e NaCl, e assinale a
alternativa que as relaciona em ordem crescente de seu
respectivo ponto de fuso.
a) Cl2 < HI < H2O < NaCl.
b) Cl2 < NaCl <HI < H2O.
c) NaCl < Cl2 < H2O < HI.
d) NaCl < H2O < HI < Cl2.
e) HI < H2O < NaCl < Cl2.
34- (IME-RJ) Indique a caracterstica apresentada pela
molcula do composto BF3 para as propriedades abaixo.
a) Polaridade de ligao.
b) Ligao intermolecular.
c) Polaridade de molcula.
35- (Osec SP) Um elemento qumico A de nmero atmico
38 forma o on:
a) A
2-
. b) A
+
. c) A
3+
. d) A
-
. e) A
2+
.
36- Qual a frmula do composto resultante da unio dos
elementos 16X e 20Y?
37- Qual a frmula do composto resultante da unio de um
elemento A da famlia 1, com outro B, da famlia 15?
38- As configuraes eletrnicas de dois elementos X e Y
terminam respectivamente, em 2p
4
e 3p
1
. Qual a frmula
do composto inico formado por eles?
39- (Mackenzie-SP) Das substncias (I) gs hlio, (II) cloreto
de sdio, (III) gs nitrognio e (IV) gua, apresentam
somente ligaes covalentes normais em sua estrutura:
a) I e III. d) II e III.
b) III e IV. e) I e II.
c) I e IV.
40 (UFSE) Qual o nmero total de eltrons em torno do
ncleo do tomo de arsnio na substncia AsCl3?
a) 36 b) 33 c) 18 d) 10 e) 8
41- (UECE) tomos do elemento X que apresentam a
distribuio eletrnica 1s
2
2s
2
2p
6
3s
2
3p
5
:
a) pertencem a famlia dos calcognios.
b) formam facilmente, com o carbono, o composto CX2.
c) formam o on X
-
.
d) apresentam cinco nveis de energia.
42- (FE-SP) Uma das preocupaes com a qualidade de vida
em nosso planeta a diminuio da camada de oznio,
substncia que filtra os raios ultravioleta do Sol, que so
nocivos nossa sade. Assinale a nica alternativa falsa
referente ao oznio.
a) uma molcula triatmica.
b) uma forma alotrpica do gs oxignio.
c) uma substncia molecular.
d) um istopo do elemento oxignio.
e) Possui ligaes covalentes.
43- (Unicamp-SP) A uria (CH4N2O) o produto mais
importante de excreo do nitrognio pelo organismo
humano.
Na molcula da uria, formada por oito tomos, o carbono
apresenta duas ligaes simples e uma dupla, o oxignio
uma ligao dupla, cada tomo de nitrognio trs ligaes
simples e cada tomo de hidrognio uma ligao simples.
tomos iguais no se ligam entre si. Baseando-se nessas
informaes, escreva a frmula estrutural da uria
representando ligaes simples por um trao (-) e ligaes
duplas por dois traos (=).
44- (Vunesp) Para as molculas N2 e N2H4 (hidrazina) pede-
se escrever as respectivas estruturas de Lewis. (Nmeros
atmicos: H = 1, N = 7.)
45- Determine a polaridade das molculas das seguintes
substncias:
a) CHCl3; d) HCN;
b) SO2; f) O3.
c) PCl3; e) H2S;
29
46- (IME-RJ) Os compostos FeO, NO, F2, NaCl e HCl
apresentam, respectivamente, os seguintes tipos de ligaes:
a) inica, covalente apolar, metlica, inica e covalente polar.
b) covalente polar, covalente polar, covalente apolar, inica e
molecular.
c) metlica, inica, covalente pura, molecular e inica.
d) inica, covalente polar, covalente apolar, inica e
covalente polar.
e) inica, covalente apolar, covalente apolar, inica e inica.
47- (PUC-MG) Dentre as afirmativas abaixo, a incorreta :
a) O composto formado entre um metal alcalino-terroso e um
halognio covalente.
b) O composto covalente HCl polar, devido diferena de
eletronegatividade existente entre os tomos de hidrognio e
cloro.
c) O composto de frmula KI inico.
d) A substncia de frmula Cl2 apolar.
e) Ligao covalente aquela que se d pelo
compartilhamento de eltrons entre dois tomos.
48- (Unifor-CE) Na substncia de frmula H Te H, os
tomos esto unidos por ligao (I) e a molcula (II).
Completa-se corretamente a afirmao quando (I) e (II) so
substitudos, respectivamente, por:
a) inica e polar
b) covalente apolar e apolar.
c) metlica e apolar.
d) covalente polar e polar.
e) covalente apolar e polar.
49- (Unifor-CE) Dadas as frmulas P4, KF, N2, HCl e H2Se,
representam substncias de molcula apolar:
a) P4 e HCl.
b) N2 e P4.
c) KF e P4.
d) HCl e H2Se.
e) KF e H2S.
50- (FaapSP) Considerando as substncias O2, CH4, H2O,
HCl e HF, indique quais apresentam molculas polares e
quais apresentam molculas no-polares.
51- (UFRJ) O dixido de carbono (CO2) solidificado, o gelo
seco, usado como agente refrigerante para temperaturas
da ordem de 78
o
C.
a) Qual o estado fsico do dixido de carbono a 25
o
C e 1
atm?
b) O dixido de carbono uma molcula apolar, apesar de
ser constitudo por ligaes covalentes polares. Justifique a
afirmativa.
52- (UFRS) A intensificao das interaes intermoleculares
ocorre quando:
a) a gua entra em ebulio.
b) o vapor de gua sofre condensao.
c) a gua, a altas temperaturas, decompe-se em oxignio e
hidrognio.
d) o vapor de gua aquecido.
e) o gelo sofre fuso.
53- (PUC/Campinas-SP) O congelamento da gua na
superfcie dos lagos, em pases frios, ocorre pela:
a) ruptura de ligaes intermoleculares.
b) ruptura de ligaes intramoleculares.
o) formao de ligaes intermoleculares.
d) formao de ligaes intramoleculares.
e) formao de ligaes inter e intramoleculares.
54- (U. E. Ponta Grossa-FR) Durante a ebulio, a passagem
da gua do estado lquido para o gasoso ocorre pelo
rompimento de urna forca de atrao conhecida como:
a) ligaes covalentes polares.
b) forcas de London.
c) ligaes covalentes apolares.
d) pontes de hidrognio.
e) ligaes inicas.
55- (UEL-PR) Ruptura de ligaes por pontes de hidrognio
ocorre quando:
a) gua gasosa decomposta em hidrognio e oxignio.
b) hidrognio lquido se vaporiza.
o) vapor d'gua se condensa.
d) gua lquida se evapora.
e) gs d'gua (mistura de CO + H2) entra em combusto.
56- (Unip-SP) O principal tipo de fora atrativa que deve ser
vencida para sublimar o gelo seco (CO2) (slido) :
a) ligao covalente.
b) fora de London (entre dipolos temporrios).
c) fora entre dipolos permanentes (devidos diferena de
eletronegatividade).
d) ligao coordenada.
e) ligao inica.
57- (UFES) A existncia de pontes de hidrognio s
possvel entre compostos quando h:
a) um elemento fortemente eletropositivo ligado a um tomo
de hidrognio.
b) dois elementos, um fortemente eletropositivo e outro
fortemente eletronegativo ligados entre si.
c) uns elementos fortemente eletronegativos, dotados de
pares de eltrons no-compartilhados, ligado ao hidrognio.
d) um aumento muito grande na intensidade das foras de
London.
e) uma ligao qumica entre o hidrognio e os elementos de
transio externa.
You might also like
- Modelos atômicos de Dalton a RutherfordDocument3 pagesModelos atômicos de Dalton a RutherfordMicaela FuneNo ratings yet
- Modelos atômicos históricosDocument29 pagesModelos atômicos históricosDiéssica Andrade AlmeidaNo ratings yet
- Exercicios de AprofundamentoDocument38 pagesExercicios de AprofundamentoJose De Jesus Silva CardosoNo ratings yet
- AULA 1 - Química - 2 º Ano CN - MASSA ATÔMICA E A MASSA MOLECULAR COM O CONCEITO DE MOL E A CONSTANTE DE AVOGRADO - Texto e AtividadesDocument4 pagesAULA 1 - Química - 2 º Ano CN - MASSA ATÔMICA E A MASSA MOLECULAR COM O CONCEITO DE MOL E A CONSTANTE DE AVOGRADO - Texto e AtividadesMadison MontgomeryNo ratings yet
- Lista de exercícios de químicaDocument4 pagesLista de exercícios de químicaAlexandre Freitas NogueiraNo ratings yet
- Química II e III - Funções oxigenadasDocument10 pagesQuímica II e III - Funções oxigenadasJuliana SousaNo ratings yet
- Exercícios Sobre Tabela PeriódicaDocument3 pagesExercícios Sobre Tabela PeriódicaChevronelleNo ratings yet
- Modelos atômicos: evolução histórica e conceitos-chaveDocument5 pagesModelos atômicos: evolução histórica e conceitos-chaveIgor AparecidoNo ratings yet
- Modelos atômicos na história da químicaDocument1 pageModelos atômicos na história da químicaFlávia Batista BritoNo ratings yet
- Atividades Sobre Ligações QuímicasDocument3 pagesAtividades Sobre Ligações QuímicasCHIARA CRISTINA MARAFON CORREIANo ratings yet
- Ligacoes QuimicasDocument8 pagesLigacoes Quimicasanon_855647014No ratings yet
- Química - Pré-Vestibular Impacto - Ligação CovalenteDocument2 pagesQuímica - Pré-Vestibular Impacto - Ligação CovalenteQuímica Qui100% (1)
- Número Atômico e Estrutura do ÁtomoDocument3 pagesNúmero Atômico e Estrutura do ÁtomoBarbara Jaqueline Ferreira dos SantosNo ratings yet
- QS3 RadioatividadeDocument10 pagesQS3 RadioatividadeJonnathann MarvysNo ratings yet
- Aula 1 - Atomo e Modelos AtômicosDocument11 pagesAula 1 - Atomo e Modelos AtômicoshildohenriqueNo ratings yet
- Atitividade de Tabela PeriodicaDocument2 pagesAtitividade de Tabela Periodicaayana karineNo ratings yet
- 8a Apostila e Lista - Tabela PeriodicaDocument5 pages8a Apostila e Lista - Tabela PeriodicaloveninNo ratings yet
- Substâncias e Misturas na QuímicaDocument4 pagesSubstâncias e Misturas na QuímicaLex AlvesNo ratings yet
- Abiogênese TeoriaDocument5 pagesAbiogênese TeoriaDário Cristovão CristovãoNo ratings yet
- Reações nucleares e radioatividadeDocument5 pagesReações nucleares e radioatividadeJustino AbiboNo ratings yet
- Exercícios TermoquímicaDocument4 pagesExercícios TermoquímicaHoo FijiNo ratings yet
- Exer Isotopos-Isobaros IsotonosDocument4 pagesExer Isotopos-Isobaros IsotonosCamila BarreirosNo ratings yet
- Historia de RessonanciaDocument39 pagesHistoria de RessonanciaLeonardo SouzaNo ratings yet
- Atividades Ligações QuímicasDocument6 pagesAtividades Ligações QuímicasVagner Fortes RosadoNo ratings yet
- Modelo AtomicoDocument19 pagesModelo AtomicoAdriano AlvesNo ratings yet
- Material 1 - 3º ANO - Aulas RemotasDocument7 pagesMaterial 1 - 3º ANO - Aulas RemotaseduNo ratings yet
- Fatores que afetam o espectro de emissão de raios XDocument10 pagesFatores que afetam o espectro de emissão de raios XMarcio VendittiNo ratings yet
- Avaliação de Química 1º AnoDocument2 pagesAvaliação de Química 1º AnoJosé Irlandio Sales AlvesNo ratings yet
- Modelos atômicosDocument4 pagesModelos atômicosvictorNo ratings yet
- Propriedades e mudanças de estado da matériaDocument22 pagesPropriedades e mudanças de estado da matériagabriellasssilvaNo ratings yet
- Exercícios de QuímicaDocument5 pagesExercícios de QuímicaantoniovdmNo ratings yet
- PDF de QuimicaDocument1 pagePDF de QuimicaFrancisco ErmessonNo ratings yet
- Folha 1-Aula Modelos Atomicos PDFDocument2 pagesFolha 1-Aula Modelos Atomicos PDFRicardo CoimbraNo ratings yet
- Modelos atômicos e propriedades interatômicasDocument3 pagesModelos atômicos e propriedades interatômicasLeticia ValeroNo ratings yet
- 1 Ano - Exercicios Isobaros IsotonosDocument3 pages1 Ano - Exercicios Isobaros Isotonosdanzootec100% (1)
- Química - Pré-Vestibular Impacto - Exercícios Extras - RadioatividadeDocument2 pagesQuímica - Pré-Vestibular Impacto - Exercícios Extras - RadioatividadeQuímica Qui100% (1)
- Elementos químicos e sua organizaçãoDocument11 pagesElementos químicos e sua organizaçãoJoão PauloNo ratings yet
- Atomistica EXERCICIOSDocument18 pagesAtomistica EXERCICIOSMario LuizNo ratings yet
- 9 Anos Sobre ÁtomosDocument2 pages9 Anos Sobre ÁtomosLeda MariaNo ratings yet
- Lista de Exercícios 2º BimestreDocument2 pagesLista de Exercícios 2º BimestreMARIAH ALVARES MOREIRANo ratings yet
- 2000 Perguntas Radiologia PDFDocument617 pages2000 Perguntas Radiologia PDFLuis Carlos SousaNo ratings yet
- O ÁTOMO - Aula Nonos Anos 2Document6 pagesO ÁTOMO - Aula Nonos Anos 2Maura Eduarda75% (4)
- Química Geral - Atomística (30 Questões)Document11 pagesQuímica Geral - Atomística (30 Questões)Ciencias PPT100% (7)
- 1 Atividade 1º Estrut Do Átomo Semelhanças Configuração NQuanticosDocument5 pages1 Atividade 1º Estrut Do Átomo Semelhanças Configuração NQuanticosNicolle kaizerNo ratings yet
- Aula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Document2 pagesAula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Ana Paula Rodrigues100% (1)
- Atividades de Química sobre Isótopos, Isóbaros e ÍonsDocument2 pagesAtividades de Química sobre Isótopos, Isóbaros e ÍonsphysicsmemNo ratings yet
- Ligações químicas covalentesDocument12 pagesLigações químicas covalenteslfdmrNo ratings yet
- Lista de Associação de Resistores e Potencia ElétricaDocument7 pagesLista de Associação de Resistores e Potencia ElétricapedroNo ratings yet
- Mecanismos de EspeciaçãoDocument8 pagesMecanismos de EspeciaçãoCamila de QuadrosNo ratings yet
- Exercícios de Fixação Estrutura AtômicaDocument2 pagesExercícios de Fixação Estrutura AtômicaCarlos Eduardo BenckeNo ratings yet
- Modelos atômicos e relações entre átomosDocument2 pagesModelos atômicos e relações entre átomoslopesqui1766100% (1)
- Avaliação de Ciências 9º AnoDocument2 pagesAvaliação de Ciências 9º AnoEvandro FerminoNo ratings yet
- Ensino Fundamental prova Química ESCOLA ALICEDocument3 pagesEnsino Fundamental prova Química ESCOLA ALICEkakayolimaNo ratings yet
- Atomistica 1Document36 pagesAtomistica 1Lindomar QuímicaNo ratings yet
- Propriedades da matéria e classificação de substâncias e misturasDocument5 pagesPropriedades da matéria e classificação de substâncias e misturasSidney Christ100% (1)
- 1 Ano - Exercicios Isobaros IsotonosDocument3 pages1 Ano - Exercicios Isobaros IsotonosdanzootecNo ratings yet
- Atividades sobre conceitos atômicosDocument3 pagesAtividades sobre conceitos atômicosAlessandra CarolinaNo ratings yet
- ExerciciosDocument9 pagesExerciciosLeon SantosNo ratings yet
- Uma análise das ações antrópicas ocorridas na área do Monte Carmelo na cidade de Santa Cruz - RN: sob o prisma da abordagem sistêmicaFrom EverandUma análise das ações antrópicas ocorridas na área do Monte Carmelo na cidade de Santa Cruz - RN: sob o prisma da abordagem sistêmicaNo ratings yet
- A Ciência que nos Rodeia: Contos Sobre Ciência e Tecnologia para Jovens CuriososFrom EverandA Ciência que nos Rodeia: Contos Sobre Ciência e Tecnologia para Jovens CuriososNo ratings yet
- Estrutura do átomo, número atômico, massa e isótoposDocument9 pagesEstrutura do átomo, número atômico, massa e isótoposAnonymous 18kqLi2R5bNo ratings yet
- Aula 02 - Estrutura Do Átomo e Isoátomos PDFDocument9 pagesAula 02 - Estrutura Do Átomo e Isoátomos PDFitnerNo ratings yet
- Evolução dos modelos atômicos e distribuição eletrônicaDocument10 pagesEvolução dos modelos atômicos e distribuição eletrônicafabiaNo ratings yet
- Pedia Tri I IiiiiiDocument15 pagesPedia Tri I IiiiiiAndreza RodriguesNo ratings yet
- Prova MDocument2 pagesProva MAndreza RodriguesNo ratings yet
- Prova HDocument2 pagesProva HAndreza RodriguesNo ratings yet
- Prova PDocument2 pagesProva PAndreza RodriguesNo ratings yet
- ABNTDocument28 pagesABNTAndreza RodriguesNo ratings yet
- Conteudo Programatico MOBIN 2011Document10 pagesConteudo Programatico MOBIN 2011Thais LorenaNo ratings yet
- AbntDocument1 pageAbntAndreza RodriguesNo ratings yet
- AC1 M1 Quimica Noturno ResolvidaDocument2 pagesAC1 M1 Quimica Noturno ResolvidaDenilsa MartinsNo ratings yet
- Roteiro e Registro de Dados-ManualDocument14 pagesRoteiro e Registro de Dados-ManualNão PessoalNo ratings yet
- Revestimentos gastrorresistentesDocument115 pagesRevestimentos gastrorresistentesMauricio TorresNo ratings yet
- Número AtômicoDocument2 pagesNúmero AtômicoAdão Marcos GracianoNo ratings yet
- TOM PARTES 1, 2 e 3Document8 pagesTOM PARTES 1, 2 e 3Amanda JustinianoNo ratings yet
- Propriedades dos elementos químicos segundo a tabela periódicaDocument6 pagesPropriedades dos elementos químicos segundo a tabela periódicaCarlos GilNo ratings yet
- 2 Fundamentos de Nanotecnologia e Conveitos AfinsDocument55 pages2 Fundamentos de Nanotecnologia e Conveitos Afinskáren britoNo ratings yet
- Modelos atômicos históricosDocument12 pagesModelos atômicos históricosHoracio Parafino Alfazema GundesNo ratings yet
- Guia da Tabela Periódica emDocument25 pagesGuia da Tabela Periódica emAna AnaNo ratings yet
- 2a Lista de Exercicios PDFDocument3 pages2a Lista de Exercicios PDFJara chagNo ratings yet
- Perfilagem Geofísica a CaboDocument2 pagesPerfilagem Geofísica a CaboEdson OliveiraNo ratings yet
- Propriedades Periódicas dos ElementosDocument2 pagesPropriedades Periódicas dos ElementosTiago MouraNo ratings yet
- Slide 1Document44 pagesSlide 1G4M3M4XNo ratings yet
- Avaliação 9º AnoDocument2 pagesAvaliação 9º AnoOlga MartinsNo ratings yet
- Quantização de energia e o modelo de BohrDocument24 pagesQuantização de energia e o modelo de BohrProf. Rubenigue SouzaNo ratings yet
- Eletrização e cargas elétricasDocument4 pagesEletrização e cargas elétricasRamon VentorimNo ratings yet
- Mecanismos Da MediunidadeDocument92 pagesMecanismos Da MediunidadeCelso JuniorNo ratings yet
- Marie Curie: A pioneira da radioatividadeDocument12 pagesMarie Curie: A pioneira da radioatividadeHAVENCLOR SACNo ratings yet
- Cópia de 1 - Ano - IFPE - Lista - de - ExerciciosDocument3 pagesCópia de 1 - Ano - IFPE - Lista - de - ExerciciosJúlia mikaelaNo ratings yet
- Rede de difracção: resolução de dobletes e espectrosDocument3 pagesRede de difracção: resolução de dobletes e espectrosBeneditoNo ratings yet
- Exp9 GP Ficha Trabalho 23Document2 pagesExp9 GP Ficha Trabalho 23RitaNo ratings yet
- Modelo Atômico de RutherfordDocument2 pagesModelo Atômico de RutherfordJay Klender WorsesNo ratings yet
- 2a Lista de ExercíciosDocument2 pages2a Lista de ExercíciosFelipe MateusNo ratings yet
- Exercicios Da Disciplina de QuimicaDocument4 pagesExercicios Da Disciplina de Quimicaadenilson dos santosNo ratings yet
- Teoria CorpuscularDocument3 pagesTeoria CorpuscularMaria DiasNo ratings yet
- Lista Aula 03-05 A Teoria Quântica e o Modelo Atômico de BohrDocument6 pagesLista Aula 03-05 A Teoria Quântica e o Modelo Atômico de BohrMatheus SouzaNo ratings yet