Professional Documents
Culture Documents
Ejercicios de Estequiometría
Uploaded by
David Nelson Vasquez JulcaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ejercicios de Estequiometría
Uploaded by
David Nelson Vasquez JulcaCopyright:
Available Formats
EJERCICIOS DE ESTEQUIOMETRA 1.
- Dada la siguiente ecuacin qumica, no balanceada: Al + HCl AlCl3 + H2 Calcular la cantidad de H2 , cuando se hace reaccionar 3.0 mol de Al con 4.0 mol de HCl. Al + HCl ___ AlCl3 + H2 2Al + 6HCl ___ 2AlCl3 + 3H 3mol 4 mol ? 2mol Al 4Mol HCl X ________ = 1,3 mol Al 6mol HCl Por lo tanto, el aluminio esta en exceso y el reactivo limitante es el acido clorhidrico (HCl) 3 mol H2 4 mol HCl X ___________ = 2 molH2 6 mol HCl R: 2.0 mol 2. Si se hace reaccionar 28 g de nitrgeno con 9.02 g de hidrgeno, calcular la masa de amoniaco formada. N2 + 3H2 ___ 2NH3 1 mol 3 mol 2 mol 28g 9,02g g? Peso n = ______ P.M 28g 9,02g n = ________ n = _______ = 4,47 mol 28g 2, 016g/ mol n = 1 mol n = 8,95 mol = n = 9 1 mol H2 4,47 mol H2 X __________ = 1,49mol N2 3 mol H2 El reactivo limitante es el N2 2 mol NH3 1 mol N2 X __________ = 2 mol NH3 1 mol N2 17,3g NH3 2 mol NH3 X __________ = 34,1g 1 mol NH3 R: 34.1 g 3. Si se hace reaccionar 64 g de metano con 355 g de cloro, de acuerdo a la ecuacin: CH4 + 4Cl2 CCl4 + 4 HCl Calcular la cantidad de CCl4 y HCl formado. CH4 + Cl2 ___ CCl4 + 4 mol 64g 355g 64g 355g n = _____ n = ________ 169/ mol 71g/ mol n = 4 mol n = 5 mol 4 mol Cl2 _________ 1 mol CH4
4 mol CH4
= 16 mol Cl2
El reactivo limitante es el Cl2 1 mol CCl4 ___________ 4 mol Cl2 4 mol HCl __________
5 mol Cl2
= 1,25 mol CCl4
5 molCl2
5 mol HCl
4 mol Cl2 R: 1.25 y 5 moles 4.- Dada la siguiente reaccin qumica. Ca(OH)2 + 2 SO2 Ca(HSO3)2 Determine la masa en g, de sulfito cido de calcio obtenida al hacer reaccionar 64,8 g de hidrxido de calcio con 52,4 g de dixido de azufre. Ca (OH)2 + 2SO2 ___ Ca (HSO3)2 1 mol 2 mol 1 mol 68,4g 52,4g g? 68,4g 52,4g n = _______ n = _______ 74g/ mol 64g / mol n = 0,92 mol n = 0,82 mol 2 mol SO2 0,92 mol Ca (OH)2 X __________ = 1,84 mol SO2 1 mol Ca (OH)2 El reactivo limitante es el SO2 luego: 1 mol Ca(HSO3)2 0,82 mol SO2 X __________________ = 0,41 mol Ca (HSO3)2 2 mol SO2 202g Ca(HSO3)2 0,41 mol Ca (HSO3)2 X ___________________ = 82,8g 1 mol Ca (HSO3)2 R: 81.8 mol 5. Al calentar sulfuro de hierro (II) en oxigeno gaseoso se produce oxido de hierro (III) y dixido de azufre. Determine la masa de oxido de hierro (III) producido al hacer reaccionar 240 g de sulfuro de hierro (II) de 87.2 % de pureza en exceso de oxigeno. FeS + O2 Fe2O3 + SO2 R: 190 g Desarrollo: 4Fe S +7 O2 --------- 2 Fe2O3 + 4 SO2 4mol 7mol ----- 2mol 4mol
Peso del Fe S puro =240gr x 87.2 / 100 = 209.28 gr N= 209.28gr / 87.85gr = 2.38 mol Fe S 2.38 mol Fe S x 2mol Fe2 O3 / 4mol Fe S =1.19 mol Fe2 O3 1.19 mol Fe2 O3 x 159.7g Fe2 O3 / 1 molFe2 O3
= 190gr
6. El tetracloruro de titanio se oxida en presencia de oxigeno dando como producto dixido de titanio y cloro: TiCl4 + O2 TiO2 + 2 Cl2 Determine la pureza del tretracloruro de titanio empleado si al hacer reaccionar 4.00 toneladas de TiCl4 en exceso de oxigeno se obtuvo 1.4 ton de dixido de titanio. ( Suponga 100% de rendimiento). DESARROLLO: 6 a) 4 ton Ti Cl 4 x 10 g / 1ton x 1mol Ti Cl 4 / 189.7g Ti Cl 4 = 21085.9 mol Ti Cl 4 b) 1.4 ton Ti O2 x 10 g / 1ton x 1mol de Ti O2 / 79.88g Ti O2 = 17526.29 mol Ti O2 Rendimiento de pureza %: %= rendimiento real / rendimiento terico x 100 % = 17526.29 / 21085.9 x 100 = 83.3 %
6
R: 83.3 % 7. El hidrxido de calcio es neutralizado por cido ntrico para formar nitrato de calcio y agua: Ca(OH)2 + HNO3 Ca(NO3)2 + H2O Si el rendimiento de la reaccin es de 75 %. Qu masa de hidrxido debe tratarse en exceso de cido ntrico para obtener 1.5 ton de nitrato de calcio?. DESARROLLO: 1.5 ton x 1000000g Ca (NO 3) 2 x 1mol /164.1g = 9140.77 mol Ca (NO 3) 2 9140.77 mol Ca (NO 3) 2 ------------- 75% X ------------------ 100% X = 12187.69 mol Ca (NO 3) 2 12187.69 mol Ca (OH) 2 X 74g Ca (OH)2 / 1mol Ca(OH)2 901889g Ca (OH)2 = 901.9kg Ca(OH)2 R: 900 kg. 8. El gas propano, C3 H8 , en presencia de oxigeno reacciona para dar CO2 y H2O. Cuntos moles de CO2 se forman cuando se queman 110,0 g de propano en presencia de aire? DESARROLLO: C3 H8 + O2 ----------- CO2 + H2O C3 H8 + 5 O2 ----------- 3 CO2 +4H2O 11Og # moles? N= 110g / 44g/mol = 2,5mol C3 H8 = 2,5mol C3 H8 x 3mol CO2 / 1mol C3 H8 = 7.5 mol R: 7,5 moles de H2O. 9. Cuntos gramos de FeS se necesitan para producir 350,0 g de H2S segn la ecuacin FeS + 2HC1 = H2S + FeCl2?. FeS + 2HCl H2S + FeCl2 n= 350g H2S =10.29 g? 34g/mol 1 mol gramos FeS = 10.29 mol FeS x 87.92g FeS 1 mol FeS = 905 - 1g FeS R: 906,5 g de FeS. 10. Cuntos moles de O2 se necesitan para formar 0,80 moles de Cl2 segn la ecuacin 4HC1 + O2 = 2H2O + 2Cl2 . 4 HCl + O2 2H2O + 2 Cl2 4 mol 1 mol 2 mol 2mol ? 0.8 mol 0.8 mol Cl2 x 1 mol O2= 0.4 mol O2 2 mol Cl2 R: 0,40 moles. 11. El zinc reacciona con el HC1 para producir ZnC12 e hidrgeno: Zn + 2HC1 = ZnC12 + H2. Si se mezclan 56,0 g de Zn con un exceso de HC1, cual es el peso de ZnC12 producido? Zn + 2HCl ZnCl2 + H2 1 mol 2 mol 1 mol 1 mol 56g g? n= 56g = 0.8564 mol Zn 65.39g/mol La relacion de Zn y ZnCl2 es de 1 a 1, entonces: 0.8564 mol ZnCl2 x 136.29g ZnCl2 1 mol ZnCl2 = 116.7g ZnCl2 R: 116,8 g. 12. Qu peso de Na2SO4 se forman en la reaccin de 250 g de H2SO4 y un exceso de
NaCl? H2O4 + 2 NaCl Na2SO4 + 2HCl 250g g? n= 250g = 2.5506 mol H2SO4 98.016 La relacion de H2SO4 y NaSO4 es de 1 1, entonces: 2.5506 mol Na2 SO4 x 142.07g Na2SO4 1 mol Na2SO4 =362.5g R: 362,5 g de Na2SO4 . 13. Qu peso de FeS se necesitan para preparar 6.75 moles de H2S?,. FeS + 2HCl = H2S + FeCl2 R: 592,5 g de FeS.
14.- Cuantos gramos de O2 se producen en la descomposicin trmica de 0.600 moles de BaO2?. R: 9.60 g
15.- Calcular el peso de oxigeno que se pueden obtener tericamente por la descomposicin de 2.0 g de K
You might also like
- Formulación y Nomenclatura de Compuestos InorgánicosDocument51 pagesFormulación y Nomenclatura de Compuestos Inorgánicosjhamfrank83% (18)
- Ejercicios de EstequiometríaDocument1 pageEjercicios de EstequiometríaPedro Vargas Quintero100% (1)
- Guía de ejercicios de Equilibrio QuímicoDocument1 pageGuía de ejercicios de Equilibrio QuímicoJorge Miranda Bernal0% (3)
- ESTEQUIOMETRIADocument28 pagesESTEQUIOMETRIAhgcuNo ratings yet
- Ejercicios Reactivo Limitante y en ExcesoDocument2 pagesEjercicios Reactivo Limitante y en ExcesoRomina Karlich100% (1)
- Ejercicios de Reacciones y BalanceoDocument1 pageEjercicios de Reacciones y BalanceoLost Generation100% (1)
- ESTEQUIOMETRIADocument5 pagesESTEQUIOMETRIAAlicia Sifuentes RodriguezNo ratings yet
- Practica RedoxDocument2 pagesPractica RedoxalvaroqeqeNo ratings yet
- Ejercicios PHDocument9 pagesEjercicios PHDavid Tunti AlanoccaNo ratings yet
- Guía de Ejercicios Nomenclatura InorgánicaDocument2 pagesGuía de Ejercicios Nomenclatura InorgánicaDallit's Sagredo Oyarce100% (1)
- Sales Halógenas Neutras...Document5 pagesSales Halógenas Neutras...Karlita Pazmiño Mutre100% (1)
- Sales Dobles y Sales Hidratadas PDFDocument4 pagesSales Dobles y Sales Hidratadas PDFDestiny lawlietNo ratings yet
- 26-Estequiometria-Ejercicios ResueltosDocument8 pages26-Estequiometria-Ejercicios ResueltosWallo48100% (5)
- RadicalDocument1 pageRadicaladolfo arguelles0% (1)
- Copia de Examen de Nomenclatura Inorganic A AdeuDocument6 pagesCopia de Examen de Nomenclatura Inorganic A Adeuwalter159080% (15)
- Solución Ejercicio Reactivo LimitanteDocument2 pagesSolución Ejercicio Reactivo Limitanteefren padronNo ratings yet
- Ejercicios de Disoluciones VolumétricasDocument4 pagesEjercicios de Disoluciones VolumétricasKevin CrespoNo ratings yet
- Taller Grupal 2-Ácidos y Bases PDFDocument2 pagesTaller Grupal 2-Ácidos y Bases PDFJuan ArévaloNo ratings yet
- Solucionario Equilibrio Químico 2014-2Document12 pagesSolucionario Equilibrio Químico 2014-2Alex Navarro Martinez100% (1)
- Ejercicios EstequiometriaDocument2 pagesEjercicios EstequiometriaAp Lp0% (1)
- Ejercicios Reactivo LimitanteDocument1 pageEjercicios Reactivo LimitanteConstanza Rojos Almuna100% (1)
- Cálculos de moles, átomos y moléculas en químicaDocument4 pagesCálculos de moles, átomos y moléculas en químicaLuis José Zamora100% (1)
- Tablas de Acidos InorganicosDocument6 pagesTablas de Acidos InorganicosHugo miranda86% (7)
- Formula de QuimicaDocument6 pagesFormula de Quimicaamigot379% (28)
- Analisis Quimico IDocument21 pagesAnalisis Quimico Igaby1811070% (1)
- Ejercicios de Redox ResueltosDocument16 pagesEjercicios de Redox ResueltosAlexCampoverdeNo ratings yet
- Ejercicios Resueltos Quimica (Molaridad, Molalidad)Document3 pagesEjercicios Resueltos Quimica (Molaridad, Molalidad)Ernesto Sanz33% (12)
- Quimica General (Luis Escobar)Document234 pagesQuimica General (Luis Escobar)Alex Vin67% (9)
- ESTEQUIOMETRÍADocument14 pagesESTEQUIOMETRÍAdabe-quimico90% (10)
- Nomenclatura de sales ácidas y neutrasDocument3 pagesNomenclatura de sales ácidas y neutrashud lo0% (1)
- Estados de Oxidacion Más ComunesDocument1 pageEstados de Oxidacion Más ComunesjonathanrrlNo ratings yet
- Ejercicios de EstequiometriaDocument5 pagesEjercicios de EstequiometriaALVARO DANIEL VASQUEZ ENEQUENo ratings yet
- Trabajo Sobre EstequiometríaDocument5 pagesTrabajo Sobre EstequiometríaTatiana UrianNo ratings yet
- Cálculos estequiométricos y problemas de conversión de unidades en químicaDocument10 pagesCálculos estequiométricos y problemas de conversión de unidades en químicaguadalupe guadalupeNo ratings yet
- Taller de Quimica Problemas de Estequiometría de Las Reacciones Químicas 1Document9 pagesTaller de Quimica Problemas de Estequiometría de Las Reacciones Químicas 1guadalupe guadalupe80% (5)
- Calculos EstequiometricosDocument12 pagesCalculos Estequiometricoscaballero_leon82No ratings yet
- Tarea GlobalDocument8 pagesTarea GlobalXavier VillonNo ratings yet
- Reactivo Limitante y Reactivo en Exceso Trabajo GrupalDocument3 pagesReactivo Limitante y Reactivo en Exceso Trabajo GrupalSarita giraldo cardona100% (1)
- Analitica Unidad4Document14 pagesAnalitica Unidad4Aldo FernandoNo ratings yet
- Práctica de cálculos estequiométricos y ejercicios químicosDocument4 pagesPráctica de cálculos estequiométricos y ejercicios químicosFernanda SanchezNo ratings yet
- Clase Práctica N7Document7 pagesClase Práctica N7Johary SevillaNo ratings yet
- Problemas Reacciones Químicas 4º ESODocument8 pagesProblemas Reacciones Químicas 4º ESOGonzalo HernandezNo ratings yet
- Química General STEDocument14 pagesQuímica General STEJulio del AngelNo ratings yet
- Ejercicios Química, Reactivos y Productos QuímicosDocument10 pagesEjercicios Química, Reactivos y Productos QuímicosFabian Rodriguez0% (1)
- Estequiometría 2016-2Document20 pagesEstequiometría 2016-2Thomas MartinezNo ratings yet
- EJERCICIOSTEMA6Document13 pagesEJERCICIOSTEMA6Carlota MartinNo ratings yet
- Cálculos estequiométricos de reacciones químicasDocument7 pagesCálculos estequiométricos de reacciones químicasJOel Cordova TadeoNo ratings yet
- Taller Evaluativo de Quimica Estequiometria Grado Once Año 2020Document5 pagesTaller Evaluativo de Quimica Estequiometria Grado Once Año 2020luisaNo ratings yet
- Actividad 22Document7 pagesActividad 22Xavier VillonNo ratings yet
- Cientifico 22Document9 pagesCientifico 22Erik AngelNo ratings yet
- Taller Reactivo Limite 5Document9 pagesTaller Reactivo Limite 5Sergio GutierrezNo ratings yet
- Serie de Estequiometría. Química General IDocument5 pagesSerie de Estequiometría. Química General IEros AlterNo ratings yet
- ESTEQUIOMETRIADocument11 pagesESTEQUIOMETRIAPariapaza Humpire Paolo MarcoNo ratings yet
- Ejercicios Quimica EstequiometriaDocument6 pagesEjercicios Quimica EstequiometriaEnmanuel De la PazNo ratings yet
- Clase Práctica 3.1 Quimica General IDocument13 pagesClase Práctica 3.1 Quimica General IJanice RomeroNo ratings yet
- Ejercicios de EstequiometríaDocument6 pagesEjercicios de EstequiometríaDayana AguasNo ratings yet
- Preguntas de Repaso Examen FinalDocument10 pagesPreguntas de Repaso Examen FinalKastNo ratings yet
- Imex - Química I - EstequiometríaDocument10 pagesImex - Química I - EstequiometríaMARIANA GABI�O ROJASNo ratings yet
- Funciones de Los Auxiliares Edicion I 2015Document14 pagesFunciones de Los Auxiliares Edicion I 2015Jose Jorge Cueva MamaniNo ratings yet
- Com5 U1 Sesion 04Document5 pagesCom5 U1 Sesion 04David Nelson Vasquez JulcaNo ratings yet
- Com5 U1 Sesion 03Document4 pagesCom5 U1 Sesion 03David Nelson Vasquez JulcaNo ratings yet
- LENGUAJEDocument1 pageLENGUAJEDavid Nelson Vasquez JulcaNo ratings yet
- MATEMATICADocument29 pagesMATEMATICAMarcos Córdova Correa100% (1)
- Com5 U1 Sesion 02Document6 pagesCom5 U1 Sesion 02David Nelson Vasquez JulcaNo ratings yet
- Com5 U1 Sesion 01Document7 pagesCom5 U1 Sesion 01David Nelson Vasquez JulcaNo ratings yet
- Com5-Pa 2016Document10 pagesCom5-Pa 2016eliana bustamanteNo ratings yet
- Com5 U1Document10 pagesCom5 U1David Nelson Vasquez JulcaNo ratings yet
- Com5-Pa 2016Document10 pagesCom5-Pa 2016eliana bustamanteNo ratings yet
- Com5-Pa 2016Document10 pagesCom5-Pa 2016eliana bustamanteNo ratings yet
- Lenguaje PreuniversitarioDocument2 pagesLenguaje PreuniversitarioDavid Nelson Vasquez Julca0% (2)
- Proceso de EnfermeriaDocument13 pagesProceso de EnfermeriaDavid Nelson Vasquez JulcaNo ratings yet
- Habitos AlimenticiosDocument18 pagesHabitos AlimenticiosDavid Nelson Vasquez JulcaNo ratings yet
- Triptico - Region AncashDocument3 pagesTriptico - Region AncashDavid Nelson Vasquez JulcaNo ratings yet
- La BrújulaDocument1 pageLa BrújulaDavid Nelson Vasquez JulcaNo ratings yet
- MATEMATICADocument29 pagesMATEMATICAMarcos Córdova Correa100% (1)
- El NeoclasicismoDocument5 pagesEl NeoclasicismoDavid Nelson Vasquez JulcaNo ratings yet
- Graficas de FuncionesDocument54 pagesGraficas de FuncionesVega R JoseNo ratings yet
- Cocina LatinoamericanaDocument3 pagesCocina LatinoamericanaDavid Nelson Vasquez JulcaNo ratings yet
- La Iliada - AnalisisDocument3 pagesLa Iliada - AnalisisDavid Nelson Vasquez JulcaNo ratings yet
- Voleibol y BaloncestoDocument9 pagesVoleibol y BaloncestoDavid Nelson Vasquez Julca0% (1)
- BiografiaDocument2 pagesBiografiaDavid Nelson Vasquez JulcaNo ratings yet
- Monografia - Mediciones DirectasDocument13 pagesMonografia - Mediciones DirectasDavid Nelson Vasquez Julca100% (1)
- Tipos de MercadoDocument3 pagesTipos de MercadoDavid Nelson Vasquez JulcaNo ratings yet
- Sistema de Ventas MarketingDocument7 pagesSistema de Ventas MarketingDavid Nelson Vasquez JulcaNo ratings yet
- La InflaciònDocument10 pagesLa InflaciònDavid Nelson Vasquez JulcaNo ratings yet
- S HanderDocument6 pagesS HanderDavid Nelson Vasquez JulcaNo ratings yet
- Cableado EstructuradoDocument35 pagesCableado EstructuradoNegroel21100% (3)
- Cruc I GramaDocument6 pagesCruc I GramaDavid Nelson Vasquez JulcaNo ratings yet
- (Ex) Une-En Iso 5167-4 2003Document3 pages(Ex) Une-En Iso 5167-4 2003coyarzun_12No ratings yet
- Tarea 3Document3 pagesTarea 3Pedro BarragánNo ratings yet
- Altazor Canto 1Document30 pagesAltazor Canto 1Marquitx Gálvez ArrietNo ratings yet
- Diagrama VDocument2 pagesDiagrama VJaneth RamirezNo ratings yet
- Diseño Estr RecipientesDocument316 pagesDiseño Estr RecipientesviglesNo ratings yet
- Estructura células eucariotas animales y vegetalesDocument112 pagesEstructura células eucariotas animales y vegetalesFlorNo ratings yet
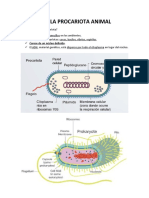
- CÉLULA PROCARIOTA y Eucariota ANIMALDocument4 pagesCÉLULA PROCARIOTA y Eucariota ANIMALMelisa Mtz. Quijano.No ratings yet
- 198-2008-SUNARP-TR-L (No Rect Area - Varas A m2)Document9 pages198-2008-SUNARP-TR-L (No Rect Area - Varas A m2)Ha AriasNo ratings yet
- Normas APADocument14 pagesNormas APARaul Tapia Paternina0% (1)
- Ridge RacerDocument7 pagesRidge Racerkarla GarciaNo ratings yet
- Homenaje a los congresos de derecho civil: Reflexiones sobre la causa jurídicaDocument620 pagesHomenaje a los congresos de derecho civil: Reflexiones sobre la causa jurídicaXnombre XapellidosNo ratings yet
- El Mundo Es PlanoDocument29 pagesEl Mundo Es PlanoAnshirley Solange Silva CabanillasNo ratings yet
- Pistas para esquiarDocument14 pagesPistas para esquiarKarinaNo ratings yet
- Análisis relatos violencia y esperanzaDocument18 pagesAnálisis relatos violencia y esperanzaCristobal SantamariaNo ratings yet
- Elaboracion de EspirulinaDocument11 pagesElaboracion de EspirulinaALEXEY PATRICIO ZARATE RODRIGUEZNo ratings yet
- Lección 1 - La CircunferenciaDocument25 pagesLección 1 - La CircunferenciaFrancisco R. Diaz GudiñoNo ratings yet
- Escuela Normal Superior "Profr. Moisés Sàenz Garza" Análisis de La Práctica Especialización: Matemáticas 4° Semestre Actividad 2Document4 pagesEscuela Normal Superior "Profr. Moisés Sàenz Garza" Análisis de La Práctica Especialización: Matemáticas 4° Semestre Actividad 2PROFE GERARDO P.M.No ratings yet
- Ejercicio 1: de Igual Forma, Se Cuenta Con Los Siguientes DatosDocument6 pagesEjercicio 1: de Igual Forma, Se Cuenta Con Los Siguientes DatosJuan PlasenciaNo ratings yet
- Capítulo 15 El Creador y La Dirección Cósmica de PerfecciónDocument6 pagesCapítulo 15 El Creador y La Dirección Cósmica de PerfecciónJose SotoNo ratings yet
- René Descartes FrasesDocument4 pagesRené Descartes FrasesKatiuska GuzmánNo ratings yet
- Importancia Y Operaciones de NúmerosDocument4 pagesImportancia Y Operaciones de NúmeroselcoqueticoclasicoNo ratings yet
- Análisis Fiscal SincelejoDocument8 pagesAnálisis Fiscal SincelejoAle ZapataNo ratings yet
- Reinicio de Obras Directiva 052020CIACEPDocument17 pagesReinicio de Obras Directiva 052020CIACEPalexNo ratings yet
- Sin Tapujos - Oscar WildeDocument42 pagesSin Tapujos - Oscar WildeRobinson Rz GerenaNo ratings yet
- Destilación BinariaDocument12 pagesDestilación BinariaMauricio Andrés Gutiérrez BravoNo ratings yet
- Entrenamientos de VO2max Carrera Sportraining Nov Dic 2010Document8 pagesEntrenamientos de VO2max Carrera Sportraining Nov Dic 2010kabut81100% (1)
- NACIONAL FedepapaDocument6 pagesNACIONAL Fedepapacvargas105No ratings yet
- UntitledDocument3 pagesUntitledJessica ArriagadaNo ratings yet
- Word 2010 MonografíaDocument31 pagesWord 2010 MonografíaMordecai SommerNo ratings yet
- Evaluaciones EmprendimientoDocument29 pagesEvaluaciones Emprendimientoclara100% (29)