Professional Documents
Culture Documents
R 41424
Uploaded by
Rodrigo DuarteOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
R 41424
Uploaded by
Rodrigo DuarteCopyright:
Available Formats
PRACTICA No.
1 TITULACION CIDO BASE
Objetivos: Titular una solucin de hidrxido de sodio, utilizando como patrn una solucin de cido clorhdrico Valorar el contenido de cido actico en el vinagre por contraste con la solucin titulada de hidrxido de sodio Familiarizarse con el manejo de materiales utilizados en volumetra Practicar frmulas , clculos y relacionar las diferentes formas de expresin de concentracin Materiales necesarios: Probeta, 2 buretas de 25 ml, erlenmeyer de 125 ml, pipeta de 5ml, solucin de cido clorhdrico 0,1N, solucin de hidrxido de sodio 0,1N, vinagre blanco, solucin alcohlica de fenolftalena al 1%. Agua destilada Procedimiento A.- Valoracin de una base con un cido Colocar 10 ml de solucin de hidrxido de sodio 0,1N en un erlenmeyer, meditos con bureta Agregar 50 ml de agua destilada y 2 o 3 gotas de fenolftalena Cargar la otra bureta con cido clorhdrico 0,1N y enrasar con 0,0 Agregar con agitacin el cido sobre la base hasta desaparicin casi del color Consignar los resultados en un cuadro Efectuar los clculos y completar el cuadro Repetir el ensayo B.- Valoracin del contenido de cido actico del vinagre Colocar 3 ml de vinagre en un erlenmeyer de 125 ml, medidos en bureta Agregar 50 ml de agua destilada y 2 o 3 gotas de fenolftalena Aadir gota a gota y con agitacin la solucin de hidrxido de sodio valorada anteriormente hasta que la solucin tome un color rosado persistente Medir el volumen de solucin de hidrxido gastado Consignar los resultados en un cuadro Efectuar los clculos y completar el cuadro Repetir el ensayo C.- Cuadros sustancia Primera Segunda determinacin determinacin Hidrxido de sodio enrase final Hidrxido de sodio enrase inicial
Volumen de la nuestra de hidrxido de sodio cido clorhdrico enrase final cido clorhdrico enrase inicial Volumen consumido de cido Normalidad del cido Vinagre enrase final Vinagre enrase inicial Volumen de la muestra de vinagre Hidrxido de sodio enrase final Hidrxido de sodio enrase inicial Volumen de hidrxido consumido N Hidrxido de sodio cido actico M %P/V
Datos para tener en cuenta: Un equivalente gramo de un cido es la masa del mismo que libera 1,008 g de ion hidrgeno Un equivalente grano de una base es la masa de la misma que libera 17,008 g de ion hidrxido La normalidad (N) de una solucin indica el nmero de equivalentes de soluto contenidos en un litro de la misma Para un volumen V (en litros) ser: V:N = N de equivalentes y en el caso de la neutralizacin (igualdad del nmero de equivalentes) de un cido con una base o recprocamente, se cumplir : V de cido . N de cido = V de base . N de base Para poner en evidencia el punto de neutralizacin se utiliza un indicador, que es una sustancia orgnica, cido o base dbil que cambia de color de acuerdo con el pH del medio. Los ms comunes son: indicador Naranja de metilo Tornasol cido Rojo Rojo Color en medio neutro bsico Anaranjado Prpura Amarillo Azul Intervalo de pH 3,1 4,4 4,5 8,3
Azul de Amarillo bromotimol fenolftalena incoloro
Verde
Azul
6,0 7,6 8,0 9,8
Casi incoloro fucsia
Para valorar una solucin se deben usar drogas patrn, las que deben cumplir con los siguientes requisitos: a.- deben ser fciles de obtener, purificar, secar, conservar b.- no deben ser higroscpicas, par aque no se humedezcan durante la pesada c.- la cantidad total de impurezas que contengan no puede ser superior a 0,01 0,02 por ciento d.- deben poseer peso equivalente alto para disminuir el error por pesada
PRACTICA No. 2 Determinacin del pH
Objetivos Preparar soluciones diluidas a partir de una de concentracin conocida Determinar el pH y compararlo con el calculado tericamente Calcular la constante de acidez del cido actico Verificar la incidencia del agregado de una de sus sales en el valor del pH de un cido Comparar el comportamiento de una solucin reguladora con una que no lo es Determinar el pH de soluciones de algunas sales e inferir el carcter de las sustancias que les han dado origen Materiales necesarios 10 tubos de ensayo pequeos y 10 tubos de ensayo comunes, gradilla, 2 pipetas. Solucin de cido clorhdrico 12 molar y 0,1 molar, solucin de hidrxido de sodio 0,1 normal, papel de pH, solucin de cido actico 0,1 molar, acetato de sodio, soluciones de cloruro de sodio, cloruro de amonio, bromuro de potasio, sulfato ferroso, carbonato de sodio y sulfato de socio (aprox 0,5F) Procedimiento A.- determinacin el pH de soluciones preparadas por dilucin Colocar en una gradilla 10 tubos de ensayos pequeos y numerarlos Poner en el nmero 1 5 ml de HCl 0,1M Tomar 0,5 ml del tubo 1 y verterlo en el 2 Agregar al tubo 2 , 4,5 ml de agua. Homogeneizar Tomar 0,5 ml del tubo 2 y verterlo en el 3 Agregar al tubo 3, 4,5 ml de agua, homogeneizar Realizar diluciones similares del tubo 3 al 4 y del 4 al 5 Calcular las concentraciones de los cincos tubos Determinar los valores de pH de los cinco tubos con papel indicador Calcular los valores de pH terico para los cincos tubos. Realizar un cuadro comparativo Poner en el tubo 6, 1 ml de hidrxido de sodio 0,1N y 9 ml de agua y homogeneizar Tomar 1 ml de solucin del tubo 6 colocarla en el tubo 7 y agregar 9 ml de agua, homogeneizar Continuar la dilucin 1:10 hasta el ltimo tubo Calcular las concentraciones en los tubos 6 y 10 Calcular los pH tericos de los tubos 6 a 10 Determinar el pH de cada uno de los cuatro ltimos tubos usando papel indicador Anotar los resultados y comparar
B.- calcula de la constante de acidez de un cido dbil En un tubo de ensayo colocar 10 ml de cido actico 0,1M Determinar el pH con papel indicador y con ese valor calcular la concentracin de H3O+ Con este dato calcular la constante de acidez suponiendo que la concentracin de H3O+ es igual a la del acetato y que la concentracin del cido sin disociar es prcticamente 0,1M Registrar C.- efecto de ion comn Agregar al tubo que contiene la solucin de cido actico 0,20 g de acetato de sodio Determinar el pH . registrar datos Justificar la variacin de pH que pueda haber observado D.- Comparacin del comportamiento de una solucin reguladora con el agua Colocar 10 ml de agua en un tubo de ensayo. Determinar el pH Agregar 2 gotas de cido clorhdrico 12 M y determinar el pH Agregar otras 4 gotas y proceder de igual forma Agregar el cido de la misma manera que se hizo con el agua, pero ahora a la solucin reguladora actico-acetato, preparada en C. Registrar y comparar los datos E.-PH de algunas soluciones En sendos tubos de ensayo colocar soluciones 0,5M de cloruro de sodio, cloruro de amonio, bromuro de potasio, sulfato ferrosa, carbonato de sodio y sulfato de sodio Determinar el pH con papel indicador Completar el informe Observaciones Un indicador universal se puede obtener mezclando en volmenes iguales soluciones de: rojo de metilo, alfa naftolftalena, timolftalena, fenolftalena, azul de bromotimol. Los pH y colores correspondientes son: pH color 4 Rojo 5 Rojo anaranjado 6 Amarillo 7 Verde amarillento 8 Verde 9 Azul verdoso 10 Azul violeta 11 Rojo violeta El clculo de pH con calculadora es sencillo, marcar la concentracin de HO+, luego la tecla LOG y la de cambio de sino para obtener el resultado -5
En el clculo de la constante de acidez solo se obtendr el orden de magnitud 10 puesto que para justificar una mayor exactitud sera necesario obtener el pH por lo menos con aproximacin al dcimo
ACTIVIDADES EQUILIBRIO ACIDO-BASE 1 Para las siguientes soluciones se determinan los siguientes valores, completar los que faltan: p H lavandin a refresco 2. 2 1.6x1 0-9 3.5 [H+] [OH-] pO H medio
3.1x1 0-12
caf negro anticid o leche
2.0x1 0-8 11. 6
vinagre
jugo gstrico sangre
1. 7 5.1x1 0-8
agua de 6x107 mar Ordena las soluciones de acuerdo a su acidez creciente. a)Cul es la diferencia entre un cido fuerte y un cido dbil? b) Cul es el concepto de Arrhenius de cido? c) Cul es el concepto de Arrhenius de base? Calcula el pH para las siguientes soluciones: HCl 0.055M, NaOH 0.38M, Ac. ntrico 1.0x10-4M solucin con pOH 3.27
You might also like
- A2 Ensayo Calculo Vol Chacón Cortina José EnriqueDocument4 pagesA2 Ensayo Calculo Vol Chacón Cortina José EnriqueEnrique ChacónNo ratings yet
- Registros de ResistividadDocument38 pagesRegistros de ResistividadVictor Hugo Rafael EscobarNo ratings yet
- Wigetta y El Antidoto Secreto PDFDocument22 pagesWigetta y El Antidoto Secreto PDFllixlemont diaz100% (2)
- AyudantaEDO2 PDFDocument3 pagesAyudantaEDO2 PDFHernán González AguirreNo ratings yet
- PsicomotricidadDocument23 pagesPsicomotricidadEugenio AlegreNo ratings yet
- Curricula ELI ISTP RFADocument1 pageCurricula ELI ISTP RFACarlos YupanquiNo ratings yet
- Cinetica ElectroquimicaDocument66 pagesCinetica ElectroquimicaIsaac Israel Talavera BlandonNo ratings yet
- Medición IndirectaDocument2 pagesMedición IndirectaGabrielaNo ratings yet
- Operaciones y Montaje ElectromecánicoDocument73 pagesOperaciones y Montaje ElectromecánicoJuan Pablo GutierrezNo ratings yet
- Experiencia NDocument4 pagesExperiencia NJosé Luis SonccoNo ratings yet
- GeometriaDocument23 pagesGeometriaEnrique MillónNo ratings yet
- Carro Marco TeoricoDocument5 pagesCarro Marco TeoricoJean Franco Tineo AtuncaNo ratings yet
- Catalogo de Productos Panel ReyDocument155 pagesCatalogo de Productos Panel Reysick216No ratings yet
- Balanza SatusDocument26 pagesBalanza SatusMiguel Angel CarlosNo ratings yet
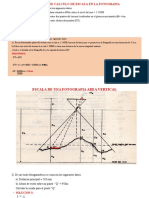
- 2 Semana 2 Ejercicios de Calculo de Escala en La FotografiaDocument16 pages2 Semana 2 Ejercicios de Calculo de Escala en La FotografiayeritzaNo ratings yet
- 0033 Ondas y Sonido ComicDocument17 pages0033 Ondas y Sonido ComicRicardo BarriosNo ratings yet
- Manual de Formacion Electromedicina 23-3-2012Document77 pagesManual de Formacion Electromedicina 23-3-2012Jose Manuel Garcia HernandezNo ratings yet
- Tema 4 Estudios en Patología GeneralDocument94 pagesTema 4 Estudios en Patología GeneralChristel Benoit VivasNo ratings yet
- Curso Completo BiomecanicaDocument82 pagesCurso Completo Biomecanicaferk8No ratings yet
- La Física y El Método Científico - MagnitudesDocument54 pagesLa Física y El Método Científico - MagnitudesManuel Sebastian Laura MamaniNo ratings yet
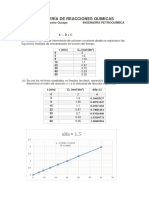
- Tarea ReaccionesDocument9 pagesTarea ReaccionesYordy QuecañoNo ratings yet
- Hds Tyfocor Ls EsDocument4 pagesHds Tyfocor Ls Estoni_82_No ratings yet
- En El Movimiento de Caída LibreDocument7 pagesEn El Movimiento de Caída LibreMagdalena Elizabeth Japa TamayoNo ratings yet
- Selección de ResortesDocument14 pagesSelección de ResortesBraulio Romero Ramirez100% (2)
- Hornos Resumen Operaciones UnitariasDocument29 pagesHornos Resumen Operaciones UnitariasVianey LunaNo ratings yet
- Cuestionario Retroalimentacion 2 Contabilidad de CostosDocument6 pagesCuestionario Retroalimentacion 2 Contabilidad de CostosArgenis Sanchez MIrandaNo ratings yet
- Taller 2 - Potencial Eléctrico y CapacitanciaDocument6 pagesTaller 2 - Potencial Eléctrico y CapacitanciaAnibal Tobar0% (1)
- Valencia, José Luis. Tesis DoctoralDocument767 pagesValencia, José Luis. Tesis DoctoralBulmaro RuizNo ratings yet
- Fuente Fija y ReguladaDocument8 pagesFuente Fija y ReguladaSantiago Aguilar100% (2)
- ACH-Sections Cut en Shells y Sólidos-070709Document21 pagesACH-Sections Cut en Shells y Sólidos-070709hernan85100% (1)