Professional Documents
Culture Documents
Quimica Física2
Uploaded by
Luis Galarreta LedesmaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Quimica Física2
Uploaded by
Luis Galarreta LedesmaCopyright:
Available Formats
LABORATORIO PROBLEMAS (PRIMERA LEY TERMODINMICA)
1. Un sistema cerrado inicialmente en reposo sobre la tierra es sometidos a un proceso en el que recibe una transferencia neta de energa por trabajo igual a 200 KJ. Durante este proceso hay una transferencia neta de energa por calor desde el sistema al entorno de 30KJ. al final del proceso el sistema tiene una velocidad de 60 m/s y una altura de 60 m. La masa del sistema es 25 Kg, y la aceleracin local de la gravedad es g= 9,8 m/s2
2. Un mol de un gas ideal, se expande isotrmicamente desde (P1,V1,T) hasta (P2,V2,T) en una etapa, frente a una P de oposicin constante e igual a P2 . Si P1=10 atm, P2=5 atm t T=300K Cul es el trabajo mximo producido?
3. Si se lleva a cabo la misma expansin isotrmica, pero en dos etapas (P1,V1,T) -> (P,V,T) -> (P2,V2,T), formular la expresin para el trabajo producido en trminos de T, P1, P2, P. Para qu valor de P es mximo el trabajo de expansin que se puede obtener en estas dos etapas?. Si el sestado inicial y final del sistema es el mismo que en el problema anterior Cul es el trabajo mximo producido?
4. Se lleva a cabo la misma expansin isotrmica, pero de forma reversible (infinitas etapas).
5. Calcular el trabajo producido por el medio sobre el sistema si el gas de los tres casos anteriores se comprime desde (P2,V2,T) a (P1,V1,T), en una etapa, en dos etapas y de forma reversible.
6. Calcular el trabajo efectuado cuando 50g de Fe se disuelven cido HCl en a) un recipiente cerrado y b) en un vaso de precipitados abierto a la atmosfera a 25 C
7. Calcular el W realizado para evaporar 1 mol de H2O a 100 C , suponiendo la idealidad del vapor de agua a esa temperatura. El volumen molar del agua lquida a 100 C es 0.018 L/mol.
8. Un gas ideal se comprime isotrmicamente y reversiblemente desde 10 L hasta 1.5 L a 25 C. El trabajo ejecutado por el recipiente trmico es de 2250 cal Cuntos moles de gas se hayan presentes en el sistema?
9. Calclese el trabajo desarrollado por 1 mol de gas que tiene la ecuacin de estado: PV=RT+APT-BP , cuando se expande segn un proceso isotrmico reversible, desde el volumen molar, V1 al volumen molar V2. A y B son constantes caractersticas del gas.
10. A temperatura constante, el efecto de la presin sobre el volumen de un liquido se describe por la ecuacin: V=V0 [1-b (P-P0)]. Para el sistema el factor de comprensibilidad es bT =0,69 X10-4 bar -1. Determinar el cambio de volumen y el trabajo que se realiza cuando el sistema de 0,28 m3 se somete a un cambio de presin desde 1 50 bar de manera reversible. Dar en resultado en Julios
11. Un cilindro al que va ajustado un pistn sin rozamiento contiene 3 moles de He gaseoso a p=1atm, est introducido en un bao grande a la T constante de 400K. Calcular el Q, W, U y H para el proceso: a) Si la P aumenta reversiblemente a 5 atm. b) si se alcanza el mismo estado final pero el proceso ocurre de forma irreversible.
12. una muestra de Ar de 1atm de presin y 25C, se expande reversiblemente y adiabticamente desde 0.5 dm3 a 1 dm3. Calcular la Tfinal del gas, el trabajo efectuado durante la expansin, el cambio en la energa interna, la presin final del gas y el cambio de la entalpa durante la expansin.
13. Una muestra de 2 moles de Ar, en un cilindro de 5cm 2 de rea transversal, a una P de 5 atm, se expande adiabticamente contra una P de 1 atm. Durante la expansin, empuja al pistn 46,3 m. si la Tinicial es 300K, Cul es la Tfinal del gas? (Cv)O2 = 12,48 J/Kmol
14. Qu cantidad de calor se necesita para elevar la temperatura de 1 mol de O 2 gaseoso desde 27 C hasta 127 C a la presin de 1 atm? Considrese que: Cp(O2)=6,095 + 3,253x10-3T -1,017 x10-6T (cal/Kmol)
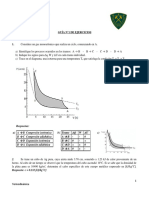
15. Supngase que 0,1 moles de un gas perfecto con Cv=1,50R, independientemente de la temperatura, sufre el proceso cclico 12341 que muestra la figura. Calcular el Q, W y U en cada etapa y para el ciclo completo.
16. Un mol de gas ideal monoatmico Cv=3/2 R, que se encuentra inicialmente a 2 atm y 273K sufre una transformacin reversible hasta un estado con una presin de 4 atm. El proceso se caracteriza por P/V = const. Calcular V1, V2 y T2, adems de U, H, Q y W (en caloras)
17. Un mol de gas monoatmico ideal que se encuentra a una presin de 1 atm y a una temperatura de 273K sufre un proceso reversible en el cual el volumen se duplica, aunque no se especifica la naturaleza del proceso, se sabe que H = 500 cal y Q=400 cal a) Calcular la temperatura y presin finales, as como U y W en el proceso b) En caso de que el sistema llegase a las condiciones finales mediante un proceso que implicase un cambio isocoro y un cambio isotermo, ambos reversibles calcular: H, U, Q y W. Tmese Cv = 3/2 R.
18. Se mezclan adiabticamente y a P constante 20g de hielo a -5C y 100g de H2O a 21C, Cul ser la Tfinal del sistema?, Sabiendo que H=6,009 fus KJ/mol y que Cp, H2O(s)=37,7 J/molK y Cp, H2O (l)=75,3 J/molK Habr hielo en el sistema?
19. Un calormetro de latn de 125g contiene un bloque de hielo de 250g y todo ello a 15 C. Calcular la cantidad de vapor de agua a 100 C que se necesita aadir para que todo el sistema llegue a la temperatura de 15C
20. Diga verdadero o falso: a) H es una funcin de estado. b) CV es independiente de T en un gas perfecto. c) U=Q + W para todo sistema termodinmico en reposo en ausencia de campos externos. d) Un proceso termodinmico se especifica al especificar el estado inicial y final del proceso. e) Para un sistema cerrado en reposo en ausencia de campos externos V = Q + W f) U permanece constante en todo proceso isotrmico en un sistema cerrado. g) Q=0 en todo proceso cclico. h) U=o en todo proceso cclico. i) T = 0 para todo proceso adiabtico en un sistema cerrado. j) en un sistema cerrado que slo realiza trabajo P-V, un proceso a presin constante con Q>0 debe implicar que T >0. k) Cuando un gas real se expansiona contra el vacio en un recinto aislado trmicamente su variacin de energa interna es distinta de cero. l) Dado que la fusin del hielo, la T se mantiene constante U =0. m) Para que haya transferencia de calor de una sustancia a otra tiene que haber una diferencia de calor entre ambas. n) La capacidad calorfica de un sistema puede ser negativa. o) Para un gas real de ecuacin de estado P(V-b)=RT, el cociente / es igual a R/(v-b). 21.- Demostrar que para un proceso adiabtico de un gas ideal se cumple
Siendo T1 y P1 las coordenadas iniciales y T2 y P2 las finales.
22.- Un gas ideal que se encuentra dentro de un cilindro con pistn pasa por un ciclo compuesto de tres procesos. Primero, el gas se expande a presin constante, donde se aaden 40 kJ de calor y el trabajo de salida es de 10kJ. Luego, es enfriado a volumen constante eliminando 50 kJ de calor. Finalmente, un proceso adiabtico lleva al gas a su estado inicial. a.- Haga un esquema P-V del proceso b.- Calcule los cambios de entalpa y energa interna de capa etapa y del ciclo completo, as como el calor y el trabajo involucrado. Tabule sus resultados en kJ.
23.- Una sustancia hipottica cumple la ecuacin de estado PV2=BT, siendo B una constante. La sustancia lleva a cabo un cambio de estado entre (T1 y V1) a (T2 y V2) a travs de una trayectoria en la que T vara linealmente con V. Segn T=C1V+C2. a) Obtenga una expresin del trabajo del trabajo W en trminos de B, C1, C2, V1 y V2. B) Exprese C1 y C2 en funcin de T1, T2, V1 y V2.
24.- 18g de agua lquida est encerrada bajo la accin de un pistn sin peso ni friccin a 100C y 1 atm de presin. La presin disminuye suavemente debajo de 1atm, de manera que el agua se vaporiza isotrmicamente hasta la total vaporizacin. Para este proceso q=40711,3 J. El volumen especfico del agua a 100C es 1,043cm3 y el volumen especfico del vapor de agua es 1677 cm3 a 100C y 1atm. Calcular el trabajo W debido a la vaporizacin, E y H para este proceso.
25.- Un aparato de cilindro y pistn sin friccin, rodado de la atmsfera, contiene un determinado gas. Inicialmente la presin del gas es de 800kPa y el volumen es 0.010m3. Si el gas se expande hasta un volumen final de 0.020m3, Calcule el trabajo desempeado en J. La presin atmosfrica es de 100kPa, suponga que el proceso que conecta a los estados inicial y final corresponde al tipo siguiente: a.- La presin es constante b.- El PV es constante c.- El producto PV2 es constante d.- Compare los tres procesos reversibles en un diagrama PV
26.- Se expande una cierta cantidad de dixido de azufre gaseoso (SO2), en el interior de un aparato de pistn y cilindro. Se obtuvieron los siguientes datos: P(bar) V(m3/kg) 3,45 0,125 2,75 0,150 2,07 0,187 1,38 0,268 0,69 0,474
Calcule el trabajo de expansin por kilogramo de SO2, en kJ.
27.- La comprensibilidad isotrmica para el agua lquida a 60C puede obtenerse mediante: T=0.125/[V(P+2740)], con T en bares y V en cm3/g. Determine el trabajo requerido en J, para comprimir 2.5 kg de agua isotrmicamente, de 1 a 600 bar.
28.- Se mantiene un aparato de pistn y cilindro que contiene 1,4kg de gas a una presin constante de 7 bares. En el curso del proceso el gas pierde 59 kJ de calor, en tanto que el volumen cambia de 1.5 a 0.09 m3. Determine el cambio de energa interna, en kJ/kg.
29.- Una persona que vive en un cuarto de 4m x 5m x 5m enciende un ventilador de 100Watts, antes de salir del cuarto que se encuentra caluroso a 100kPa y 30C. El espera que est ms fro cuando regrese luego de 5 horas. Despreciando cualquier transferencia de calor, determine la temperatura que encontrar cuando regres. Cul sera el resultado si la potencia del ventilador fuese de 50W?
30.- Un tanque rgido aislado se divide en dos partes iguales mediante una membrana. Al principio, una parte contiene 3kg de nitrgeno a 500kPa, 50C, y la otra parte est completamente vaca. La membrana es perforada y se expande hasta ocupar todo el tanque. Determina la presin y temperatura finales. Cul sera el resultado si la seccin llena contuviera 3kg de nitrgeno a 300kPa?
31.- Un dispositivo de cilindro- mbolo tiene un anillo para limitar su carrera de expansin. Inicialmente como se muestra en la figura, la masa de aire es 2kg a 500 kPa, 30C. Ahora se transfiere calor hasta que el mbolo toque el anillo, punto en el cul el volumen es dos veces el volumen original. Se sigue transfiriendo calor hasta que la presin llega al doble. Determine la cantidad de calor transferida y la temperatura final.
You might also like
- Problemas resueltos de Hidráulica de CanalesFrom EverandProblemas resueltos de Hidráulica de CanalesRating: 4.5 out of 5 stars4.5/5 (7)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Ejercicio 3Document22 pagesEjercicio 3Carlos Raul67% (3)
- Ejercicios Procesos TermodinamicosDocument8 pagesEjercicios Procesos TermodinamicosEduardo Lopez GonzalezNo ratings yet
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- El Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaFrom EverandEl Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaNo ratings yet
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesFrom EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNo ratings yet
- La Orgonita PDFDocument3 pagesLa Orgonita PDFTeslamemNo ratings yet
- C109C109M-SP.31470 EspañolDocument14 pagesC109C109M-SP.31470 EspañolLuis Galarreta LedesmaNo ratings yet
- Receptores celulares y acción de fármacosDocument22 pagesReceptores celulares y acción de fármacossarahimanzoNo ratings yet
- Ejercicios Termodinamica BasicaDocument13 pagesEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- Termodinámica: Procesos de gases ideales y realesDocument5 pagesTermodinámica: Procesos de gases ideales y realesJanela MostaceroNo ratings yet
- Problemas Propuestos para El Segundo ExamenDocument5 pagesProblemas Propuestos para El Segundo ExamenVictor V IeNo ratings yet
- Parcial Cerámica Con TodoDocument222 pagesParcial Cerámica Con TodoPochito Anacleto Grandote PardoNo ratings yet
- Laboratorio de Problemas 1ra LeyDocument4 pagesLaboratorio de Problemas 1ra LeyVicente TitoNo ratings yet
- Laboratorio de Problemas 1ra LeyDocument4 pagesLaboratorio de Problemas 1ra LeyMary Cielo LlerenaNo ratings yet
- Física 2 - Guía 7 - 1er Principio TermoDocument4 pagesFísica 2 - Guía 7 - 1er Principio TermoTamara FigueroaNo ratings yet
- Taller Primera Ley Sistemas CerradosDocument3 pagesTaller Primera Ley Sistemas CerradosMarianela Rodriguez LozanoNo ratings yet
- Guía 1 PDFDocument3 pagesGuía 1 PDFDaniel Andres Roa UmañaNo ratings yet
- Termodinámica problemas gases idealesDocument2 pagesTermodinámica problemas gases idealesMiguel A. Aguilar VeraNo ratings yet
- ProbCap 2 TermAvDocument5 pagesProbCap 2 TermAvHiram LsNo ratings yet
- Problem As MinasDocument17 pagesProblem As MinasDaniel GaeteNo ratings yet
- Gua N1 Termodinmica 2015Document9 pagesGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoNo ratings yet
- Tarea 2 Sep Dic 2019Document2 pagesTarea 2 Sep Dic 2019Juan Manuel Mendoza Turmero0% (1)
- Enunciados Ejercicios Entregados en Clase Examen 1Document6 pagesEnunciados Ejercicios Entregados en Clase Examen 1Jennifer YataNo ratings yet
- Problemas 1Document3 pagesProblemas 1Pablo De Lera RodríguezNo ratings yet
- Problemas de Termotecnia sobre sistemas cerrados y abiertos con agua y gases idealesDocument17 pagesProblemas de Termotecnia sobre sistemas cerrados y abiertos con agua y gases idealesClaudio Pincheira RozasNo ratings yet
- Guía de TermodinámicaDocument9 pagesGuía de TermodinámicaJavier CortésNo ratings yet
- Problemas de TermodinámicaDocument33 pagesProblemas de Termodinámicakillerkool666No ratings yet
- Primera ParcialDocument12 pagesPrimera ParcialCRISTHIAN NUÑEZ LIMACHENo ratings yet
- 1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Document3 pages1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Wendy Dávila ArteagaNo ratings yet
- Guia Numero 4Document7 pagesGuia Numero 4eutectic19920% (1)
- 2do Parcial FQDocument15 pages2do Parcial FQCamila Zapata AriasNo ratings yet
- Colección de Problemas TTyTC - 2020 - 2021Document12 pagesColección de Problemas TTyTC - 2020 - 2021Laura VercherNo ratings yet
- Problemas Termodinámica 2015Document12 pagesProblemas Termodinámica 2015Jose DanielNo ratings yet
- Termodinámica I: Serie de primera ley en sistemas cerradosDocument2 pagesTermodinámica I: Serie de primera ley en sistemas cerradossabineNo ratings yet
- TermodinamicaDocument2 pagesTermodinamicaAlexisNo ratings yet
- Discusion 5Document3 pagesDiscusion 5elbetoavila0% (2)
- Guia 1 Fscoquimica PDFDocument3 pagesGuia 1 Fscoquimica PDFjuanannaNo ratings yet
- Guía 6 Termodinámica - Balance de Energía en Sistemas Cerrados 2-2022Document8 pagesGuía 6 Termodinámica - Balance de Energía en Sistemas Cerrados 2-2022Fernanda MuñozNo ratings yet
- Pr醕tico 3 - 2014 - Primera Ley de La Termodin醡icaDocument2 pagesPr醕tico 3 - 2014 - Primera Ley de La Termodin醡icaBelen LilianNo ratings yet
- PD2Document4 pagesPD2botametunosegaNo ratings yet
- TP 4Document4 pagesTP 4Gabii Van CauwenbergheNo ratings yet
- Primera ley termodinámica: ejercicios de calor, trabajo y energía internaDocument7 pagesPrimera ley termodinámica: ejercicios de calor, trabajo y energía internaOleggValVilNo ratings yet
- Problemario QeaDocument8 pagesProblemario QeaJesus Escalera GuerraNo ratings yet
- Serie de Primera Ley en Sistemas Cerrados y Termoquimica 1Document2 pagesSerie de Primera Ley en Sistemas Cerrados y Termoquimica 1Mafer RangelNo ratings yet
- 02 +primer+principio +calor,+trabajo+y+energía +reversibilidadDocument5 pages02 +primer+principio +calor,+trabajo+y+energía +reversibilidadMARÍA ISABEL PEREYRA TELLADONo ratings yet
- Tema 1.problemas Primer Principio (2016-2017)Document4 pagesTema 1.problemas Primer Principio (2016-2017)Raquel Suárez López100% (1)
- TERMODINÁMICA ITA 335Document3 pagesTERMODINÁMICA ITA 335Adan Lopez MuñozNo ratings yet
- Ejercicios Propuesto TermodinámicaDocument12 pagesEjercicios Propuesto TermodinámicaPilar UsonNo ratings yet
- Deber Capitulo 2-3-4Document4 pagesDeber Capitulo 2-3-4Ronny Recalde MerchanNo ratings yet
- Ejercicios Capitulo 1 y 2Document4 pagesEjercicios Capitulo 1 y 2jhanrataNo ratings yet
- Taller FisicoDocument4 pagesTaller FisicoAndres MorenoNo ratings yet
- Termodinámica II problemasDocument2 pagesTermodinámica II problemasErika ElizabethNo ratings yet
- Guia Termod Unidad1,2,3,4Document8 pagesGuia Termod Unidad1,2,3,4Jose Abraham MontoyaNo ratings yet
- Segundo ParcialDocument8 pagesSegundo ParcialPasp SPNo ratings yet
- Hoja 1 NewDocument3 pagesHoja 1 NewJony GarciaNo ratings yet
- Cálculos de rendimiento y cambios de entropía para procesos termodinámicosDocument6 pagesCálculos de rendimiento y cambios de entropía para procesos termodinámicosDaniel NoreñaNo ratings yet
- Método Normalizado Malla 200Document13 pagesMétodo Normalizado Malla 200Luis Galarreta LedesmaNo ratings yet
- GraficosDocument35 pagesGraficosLuis Galarreta LedesmaNo ratings yet
- Luis Galarreta: Contacto Nombre Del DestinatarioDocument1 pageLuis Galarreta: Contacto Nombre Del DestinatarioLuis Galarreta LedesmaNo ratings yet
- Ecu345 PDFDocument3 pagesEcu345 PDFLuis Galarreta LedesmaNo ratings yet
- EtiquetaDocument2 pagesEtiquetaLuis Galarreta LedesmaNo ratings yet
- Aseguramiento de La Calidad en El LaboratorioDocument23 pagesAseguramiento de La Calidad en El LaboratorioeduardoNo ratings yet
- Enconcreto PDFDocument2 pagesEnconcreto PDFviyerodNo ratings yet
- Capitulo 1 Canteras DefinitivoDocument112 pagesCapitulo 1 Canteras DefinitivoLuis Galarreta LedesmaNo ratings yet
- Ac 04Document7 pagesAc 04Fernando Henao HenaoNo ratings yet
- Muestra Cemento: Ef-Ti Muestra Cemento: Eq-TiDocument1 pageMuestra Cemento: Ef-Ti Muestra Cemento: Eq-TiLuis Galarreta LedesmaNo ratings yet
- Configuración Equipo Elix Essential 5 UV (Agua Tipo II)Document2 pagesConfiguración Equipo Elix Essential 5 UV (Agua Tipo II)Luis Galarreta LedesmaNo ratings yet
- RyB MS CE M01+Introducción+a+MATLABDocument23 pagesRyB MS CE M01+Introducción+a+MATLABLuis Galarreta LedesmaNo ratings yet
- Solicitud para acreditación de organismos de certificación de productosDocument7 pagesSolicitud para acreditación de organismos de certificación de productosLuis Galarreta LedesmaNo ratings yet
- Test de CoopersmithDocument11 pagesTest de CoopersmithZean Cardoso PonceNo ratings yet
- OutputDocument3 pagesOutputLuis Galarreta LedesmaNo ratings yet
- Base CorrelacionalDocument12 pagesBase CorrelacionalLuis Galarreta LedesmaNo ratings yet
- A Veces Quisiera Que El Reloj Avance Más RápidoDocument1 pageA Veces Quisiera Que El Reloj Avance Más RápidoLuis Galarreta LedesmaNo ratings yet
- Solicitud para acreditación de organismos de certificación de productosDocument7 pagesSolicitud para acreditación de organismos de certificación de productosLuis Galarreta LedesmaNo ratings yet
- Y Le Pedí Un AbrazoDocument1 pageY Le Pedí Un AbrazoLuis Galarreta LedesmaNo ratings yet
- Interfaz de Usuario TraduccionDocument1 pageInterfaz de Usuario TraduccionLuis Galarreta LedesmaNo ratings yet
- Al Perderte Yo A TiDocument1 pageAl Perderte Yo A TiLuis Galarreta LedesmaNo ratings yet
- Es Media NocheDocument1 pageEs Media NocheLuis Galarreta LedesmaNo ratings yet
- Citrato de TrisodioDocument1 pageCitrato de TrisodioLuis Galarreta Ledesma100% (1)
- Muestra Manual Gestion CalidadDocument7 pagesMuestra Manual Gestion CalidadantoniosolizNo ratings yet
- A Veces Quisiera Que El Reloj Avance Más RápidoDocument1 pageA Veces Quisiera Que El Reloj Avance Más RápidoLuis Galarreta LedesmaNo ratings yet
- Dicen Que Cuando Estas Apunto de Dormirte y Piensas en Tu Alma GemelaDocument1 pageDicen Que Cuando Estas Apunto de Dormirte y Piensas en Tu Alma GemelaLuis Galarreta LedesmaNo ratings yet
- Cap It 2Document52 pagesCap It 2Silver DanielNo ratings yet
- TaqueDocument1 pageTaqueLuis Galarreta LedesmaNo ratings yet
- Imhof ModificadoDocument2 pagesImhof ModificadoAquinoNo ratings yet
- Propiedades Cosmeticas 2Document2 pagesPropiedades Cosmeticas 2RosariosNo ratings yet
- Motores de Combustión Interna 5 C2 2019-2Document36 pagesMotores de Combustión Interna 5 C2 2019-2Pacco MaberickNo ratings yet
- Antecedentes Generales SiliceDocument5 pagesAntecedentes Generales SiliceMiguel Jesus Tito HuarcayaNo ratings yet
- PC Inyeccion de FisurasDocument12 pagesPC Inyeccion de FisurasjhonitalocastilloNo ratings yet
- Manejo Nutricional Del Politraumatizado y Gran QuemadoDocument31 pagesManejo Nutricional Del Politraumatizado y Gran QuemadoDiana SalasNo ratings yet
- ADN ÁCIDOS NUCLEICOS BIOLOGÍA BACHILLERATODocument3 pagesADN ÁCIDOS NUCLEICOS BIOLOGÍA BACHILLERATOnicolasmartincomino0% (1)
- Ampliación de Las Instalaciones de Un Supermercado: Construcción de Una GasolineraDocument16 pagesAmpliación de Las Instalaciones de Un Supermercado: Construcción de Una GasolineraJack SparrowNo ratings yet
- Diseño de filtro casero para tratamiento de aguaDocument4 pagesDiseño de filtro casero para tratamiento de aguaSantiago Arley MuñozNo ratings yet
- Taller#2 Estados de OxidacionDocument4 pagesTaller#2 Estados de OxidacionJulian Camilo CantorNo ratings yet
- Particulas Constituyentes Del AtomoDocument6 pagesParticulas Constituyentes Del AtomoWENDY FLORES LoPEZNo ratings yet
- Lineamientos y Criterios de Inspección Rev.08Document18 pagesLineamientos y Criterios de Inspección Rev.08Ricardo RamirezNo ratings yet
- PETROSOL solvente especificacionesDocument1 pagePETROSOL solvente especificacionesRene MachadoNo ratings yet
- FISICOQUIMICA VERANO 2022 (Autoguardado)Document126 pagesFISICOQUIMICA VERANO 2022 (Autoguardado)Eduardo OgandoNo ratings yet
- Electroquimica Clase 1Document14 pagesElectroquimica Clase 1Anonymous JVyqoMiriL100% (1)
- Practica Problemas Resueltos de Fisica 2 PDFDocument153 pagesPractica Problemas Resueltos de Fisica 2 PDFKlara BurgosNo ratings yet
- Tema 3-Propiedades de Las Sutancias Puras y Mezclas-19-3Document46 pagesTema 3-Propiedades de Las Sutancias Puras y Mezclas-19-3Armando CastroNo ratings yet
- Área Ciencia Y Tecnología: Experiencia de Aprendizaje #03 / Actividadn°01Document5 pagesÁrea Ciencia Y Tecnología: Experiencia de Aprendizaje #03 / Actividadn°01Mariana Castro MarcosNo ratings yet
- Proporciones de Los OxoácidosDocument1 pageProporciones de Los Oxoácidosalex yanez100% (1)
- Informe N 2 Tecno AzucaresDocument10 pagesInforme N 2 Tecno AzucaresAnel MamaniNo ratings yet
- Practica 1 Pretratamiento SimultaneoDocument8 pagesPractica 1 Pretratamiento SimultaneoLuís AvendañoNo ratings yet
- Semana 8Document66 pagesSemana 8Hipolito Vargas0% (1)
- Mezclas HeterogéneasDocument2 pagesMezclas HeterogéneasAndres FlauteroNo ratings yet
- Bioquímica P6Document9 pagesBioquímica P6Angélica JiménezNo ratings yet
- Sso Guia Aprendizaje Parte 2 (2019-1)Document16 pagesSso Guia Aprendizaje Parte 2 (2019-1)Pamela GallegosNo ratings yet
- Guia para Combatir IncendiosDocument105 pagesGuia para Combatir Incendioschristian vilañaNo ratings yet
- Seminario MTBE y ETBEDocument25 pagesSeminario MTBE y ETBEcamila soto gonzalez100% (1)
- Problemas TracciónDocument3 pagesProblemas TracciónjoanNo ratings yet