Professional Documents
Culture Documents
Corrosión Métalica
Uploaded by
Jessica MaquedaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Corrosión Métalica
Uploaded by
Jessica MaquedaCopyright:
Available Formats
JESSICA MAQUEDA MEDRANO Ingeniera Metalrgica
CORROSIN MTALICA Cuando se hace referencia a la termodinmica y cintica de la corrosin metlica, el objetivo es la evaluacin de la velocidad de los procesos corrosivos.
Para que un metal sufra corrosin, un requisito indispensable es que la termodinmica implique que dicha reaccin sea posible. Por tanto el potencial de corrosin debe ser positivo. Para ello, tienen que producirse un conjunto de situaciones favorables, tales como el potencial adecuado para que la reaccin global se produzca, la concentracin de iones metlicos (si es que se liberan en disolucin), la del oxgeno disuelto (si es que es este el gas que se reduce), el pH (pues los potenciales de todas las posibles reducciones dependen del pH), y finalmente la posibilidad de que el metal forme complejos con el medio, fundamentalmente porque la corrosin es un fenmeno de deterioro creciente. CINTICA DE LA CORROSIN: Como en cualquier proceso electroqumico, la cintica de corrosin viene dada por la cuantificacin de la corriente generada entre dos puntos en cuestin. Aunque entre los puntos andico y catdico el voltaje puede ser virtualmente cero, el metal puede haber adquirido un potencial que se podra determinar mediante un electrodo de referencia externo. Este es el valor que se conoce como potencial de corrosin. La corriente electroqumica generada depende de diversos factores: - La transferencia electrnica en el nodo. - El transporte de masa a travs del electrolito. - La transferencia de electrones en el ctodo. Para ensayar a escala de laboratorio la resistencia a la corrosin de forma acelerada, se emplean las cmaras de niebla salina para la simulacin del ambiente marino.
JESSICA MAQUEDA MEDRANO Ingeniera Metalrgica
Las cinticas de los sistemas en corrosin son muy complejas y no estn comprendidas totalmente. Sin embargo, examinaremos algunos de los aspectos bsicos de la cintica de la corrosin. La cantidad de metal uniformemente corrodo de un nodo o electrodepositado sobre un ctodo, en una disolucin acuosa durante un periodo de tiempo, se puede determinar usando la ecuacin de Faraday, que establece: w=ItM/nF donde w = peso del metal (g), corrodo o electrodepositado en una solucin acuosa en un tiempo t (segundos), I = flujo de corriente (A), M = masa atmica del metal (g/mol), n = nmero de electrones/tomo producido o consumido en el proceso F es la constante de Faraday, 96500 C/mol o 96500 As/mol. A veces la corrosin acuosa uniforme de un metal se expresa en trminos de una densidad de corriente, i, o intensidad de corriente de corrosin, que se suele dar en unidades A/cm2. Sustituyendo I por iA, la ecuacin se convierte en:
JESSICA MAQUEDA MEDRANO Ingeniera Metalrgica
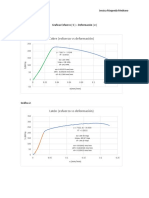
w = iAtM / nF donde i = densidad de corriente, A/cm2, A = rea en cm2, si el cm se usa de longitud. Existen diversos procedimientos electroqumicos para medir el valor de la intensidad de corriente. Si representamos las correlaciones del potencial E frente al logaritmo de la densidad de corriente, figura 12.6, para las reacciones que suceden en el nodo y en el ctodo de forma aislada, tenemos una representacin de la cintica de ambas semirreacciones, hasta que ambas se encuentran en un punto de voltaje Ecorr e Icorr. Figuara 12.6
Los puntos A y B de dicha figura representan el potencial de equilibrio E0 y el correspondiente cambio de densidad de corriente i0 para cada semirreaccin. El cambio de densidad de corriente i0 es la velocidad de reaccin de oxidacin y
JESSICA MAQUEDA MEDRANO Ingeniera Metalrgica
reduccin en un electrodo en equilibrio expresado en trminos de densidad de corriente. El cambio en las densidades de corriente debe determinarse experimentalmente cuando no hay corriente neta. Cada electrodo con su electrodo especfico tendr un propio valor de i0. Cuando el metal empieza a reaccionar, a corroerse, puesto que es un buen conductor elctrico, debe estar a un potencial constante. Este potencial es Ecorr (punto C). As, cuando un metal comienza a corroerse, el potencial de las reas catdicas se hace cada vez ms negativo hasta alcanzar valores alrededor del Ecorr y el de las reas andicas ms positivo hasta alcanzar el mismo Ecorr. En el punto C de la figura 12.6 la velocidad de disolucin del metal, Zn, es igual a la velocidad de desprendimiento de hidrgeno. La densidad de corriente correspondiente a esta velocidad de reaccin se llama icorr y, por consiguiente, es igual a la velocidad de disolucin del cinc o corrosin. As cuando un metal se corroe por el cortocircuito debido a la accin de celdas galvnicas microscpicas, las reacciones netas de oxidacin y reduccin se producen sobre la superficie del metal. Los potenciales de las regiones andica y catdica locales no son mayores en el equilibrio; lo que hacen es cambiar los potenciales para alcan-zar un valor intermedio constante de Ecorr. El desplazamiento de los potenciales de electrodo desde sus valores de equilibrio a un potencial constante de algn valor intermedio y la creacin de un flujo de corriente neta llamada polarizacin. El montaje de la figura 12.7 permite analizar las cadas de potencial, polarizacin del ctodo y nodo de una forma separada. La necesidad del anlisis de las causas de la polarizacin es obvia. Cuanto mayor es la polarizacin menor ser Icorr y, por tanto, la masa que se corroe.
JESSICA MAQUEDA MEDRANO Ingeniera Metalrgica
Figura 12.7
Podemos modelizar para la polarizacin catdica y andica de la forma: E = E0c - b log Icorr [Ctodo] E = E0a + g log Icorr [Anodo] pudiendo hallarse log Icorr del sistema anterior. log Icorr = (E0c - E0a)/(b + g)
You might also like
- ESFERA ComputacionalDocument2 pagesESFERA ComputacionalJessica MaquedaNo ratings yet
- Proveedores cera perdida fundiciónDocument4 pagesProveedores cera perdida fundiciónJessica MaquedaNo ratings yet
- TTQ Mat Met - Cuestion 1 19ODocument1 pageTTQ Mat Met - Cuestion 1 19OJessica MaquedaNo ratings yet
- Práctica5 - Moldeo en Verde - Maqueda y VargasDocument18 pagesPráctica5 - Moldeo en Verde - Maqueda y VargasJessica MaquedaNo ratings yet
- Limites de GranoDocument3 pagesLimites de GranoJessica MaquedaNo ratings yet
- Pmm-16p-Eva-R2-V2-29 Julio 2016Document31 pagesPmm-16p-Eva-R2-V2-29 Julio 2016Jessica MaquedaNo ratings yet
- Materiales CeramicosDocument3 pagesMateriales CeramicosJessica MaquedaNo ratings yet
- Proveedores cera perdida fundiciónDocument4 pagesProveedores cera perdida fundiciónJessica MaquedaNo ratings yet
- Método Hidrotermal para La Síntesis de NanopartículasDocument29 pagesMétodo Hidrotermal para La Síntesis de NanopartículasJessica Maqueda100% (1)
- TrefiladoDocument17 pagesTrefiladoJessica MaquedaNo ratings yet
- FundicionDocument20 pagesFundicionJessica MaquedaNo ratings yet
- NoyosDocument1 pageNoyosJessica MaquedaNo ratings yet
- Root0 Cap10FenomenosdefragilizacionenacerosDocument21 pagesRoot0 Cap10FenomenosdefragilizacionenacerosGazpachoesiNo ratings yet
- Bravais 14IDocument31 pagesBravais 14IJessica MaquedaNo ratings yet
- Mediciones en IngDocument1 pageMediciones en IngJessica MaquedaNo ratings yet
- Graficas Esfuerzo-DeformacionDocument1 pageGraficas Esfuerzo-DeformacionJessica MaquedaNo ratings yet
- ApuntesPlasticidad Vector BurgersDocument27 pagesApuntesPlasticidad Vector BurgersEgon Delgado RamìrezNo ratings yet
- Microscopio de Fuerza AtómicaDocument3 pagesMicroscopio de Fuerza AtómicaJessica MaquedaNo ratings yet
- Practica 2. Metalurgia MecanicaDocument3 pagesPractica 2. Metalurgia MecanicaJessica MaquedaNo ratings yet
- Presentación IAEA Básico FórjaDocument141 pagesPresentación IAEA Básico FórjaGustavo Leandro Quispe PaquiNo ratings yet
- Método intersección límite granoDocument6 pagesMétodo intersección límite granoJessica MaquedaNo ratings yet
- Medios de TempleDocument4 pagesMedios de TempleJessica MaquedaNo ratings yet
- Privatización de TrasportesDocument22 pagesPrivatización de TrasportesJessica MaquedaNo ratings yet
- Análisis de La PelículaDocument4 pagesAnálisis de La PelículaJessica MaquedaNo ratings yet
- English - SpanishDocument109 pagesEnglish - SpanishjequirogNo ratings yet
- Privatización de TrasportesDocument22 pagesPrivatización de TrasportesJessica MaquedaNo ratings yet
- Apuntes de TGD3Document12 pagesApuntes de TGD3Jessica MaquedaNo ratings yet
- Privatización de TrasportesDocument22 pagesPrivatización de TrasportesJessica MaquedaNo ratings yet
- Plan Ing MetalurgicaDocument1 pagePlan Ing MetalurgicaJessica MaquedaNo ratings yet
- Dislocaciones-La Naturaleza de Las DislocacionesDocument42 pagesDislocaciones-La Naturaleza de Las DislocacionesJessica MaquedaNo ratings yet
- Unidad 1 - Intesidades CortocircuitoDocument41 pagesUnidad 1 - Intesidades CortocircuitoManuel Rodriguez LatorreNo ratings yet
- Pracrtica N.°2 Caracterizacion Del Par de CobreDocument11 pagesPracrtica N.°2 Caracterizacion Del Par de Cobrejose valdes100% (1)
- S8 Celdas GalvánicasDocument26 pagesS8 Celdas GalvánicasBruno Quispe UwuNo ratings yet
- 2 Logica SecuencialDocument6 pages2 Logica SecuencialJosue ChavarriaNo ratings yet
- Métodos Ópticos de AnálisisDocument16 pagesMétodos Ópticos de AnálisisVanquelin89% (9)
- Tableros eléctricos EISSA control motores baja tensiónDocument16 pagesTableros eléctricos EISSA control motores baja tensiónAlejandro Salas Vásquez100% (1)
- Dispositivos Analogicos y Digitales Cuestionario 1er ParcialDocument11 pagesDispositivos Analogicos y Digitales Cuestionario 1er Parcialcarolina100% (1)
- Aplicaciones de Fuentes Control Ad AsDocument15 pagesAplicaciones de Fuentes Control Ad Asnapster_4525gNo ratings yet
- Fosfuro de GalioDocument28 pagesFosfuro de GalioOlga Lucero IllescasNo ratings yet
- STTULV-SUB-MCA-108 Seleccion de Cadenas de Aisladores-Rev BDocument15 pagesSTTULV-SUB-MCA-108 Seleccion de Cadenas de Aisladores-Rev BBoris Soto Matos100% (1)
- Máquinas CD 12°Document12 pagesMáquinas CD 12°Spoty PreamiunNo ratings yet
- Tubo de Jean Baptiste PerrinDocument6 pagesTubo de Jean Baptiste PerrinManuel GeorgeNo ratings yet
- Arranque carga fríaDocument4 pagesArranque carga fríaALEXIS RICARDO MERO MACIASNo ratings yet
- Libro Basico ArduinoDocument120 pagesLibro Basico ArduinoJimena AL95% (21)
- L1000-55 Compatibilidad Electromagnetica Entre Ductos y Lineas de Transmision 69 A 400 KVDocument28 pagesL1000-55 Compatibilidad Electromagnetica Entre Ductos y Lineas de Transmision 69 A 400 KVgusNo ratings yet
- Reporte Unidad I Equipo 3Document37 pagesReporte Unidad I Equipo 3juan martelNo ratings yet
- Nombre de La Actividad: Redes Electricas: 1.1 Nombre Del Estudiante y GrupoDocument20 pagesNombre de La Actividad: Redes Electricas: 1.1 Nombre Del Estudiante y GrupoHEBERTH MARTINEZNo ratings yet
- Procedimiento Instalacion de Pararrayos .CompressedDocument7 pagesProcedimiento Instalacion de Pararrayos .Compresseddocumentossaf100% (2)
- Un Análisis de La Norma ANSI-1Document2 pagesUn Análisis de La Norma ANSI-1freddy lopez gonzalesNo ratings yet
- Registrador de Llamadas Telefónicas y Localizador de Conexiones PiratasDocument7 pagesRegistrador de Llamadas Telefónicas y Localizador de Conexiones PiratasRamón AlvarezNo ratings yet
- 1 Electrostática - Actualizada 2021Document10 pages1 Electrostática - Actualizada 2021Leonardo HuaccalloNo ratings yet
- Mayo2020 I12 PP PDFDocument87 pagesMayo2020 I12 PP PDFSabrina PazNo ratings yet
- Medición de la resistencia de puesta a tierraDocument17 pagesMedición de la resistencia de puesta a tierraMartin RiveraNo ratings yet
- Informe Electro 1Document19 pagesInforme Electro 1llugsaNo ratings yet
- Motor A Pasos en VHDLDocument3 pagesMotor A Pasos en VHDLKevin Alan Sanchez Martinez0% (1)
- Lab 3 Fisica2Document13 pagesLab 3 Fisica2JeferssonNo ratings yet
- Ley de OHM (Informe I)Document6 pagesLey de OHM (Informe I)Andriu FlowersNo ratings yet
- Parctica 7 Lab de Fisica 3Document8 pagesParctica 7 Lab de Fisica 3Francisco Maher Iracheta gamezNo ratings yet
- Convertidor ElevadorDocument3 pagesConvertidor ElevadorWasho HerreraNo ratings yet
- Manual - de - Instalacion 18 Paneles (5 Nodos) PDFDocument7 pagesManual - de - Instalacion 18 Paneles (5 Nodos) PDFMoises QuispeNo ratings yet