Professional Documents
Culture Documents
Informe Quimica Valledupar
Uploaded by
Ruben AcevedoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe Quimica Valledupar
Uploaded by
Ruben AcevedoCopyright:
Available Formats
ESCUELA DE CIENCIAS BSICAS, TECNOLOGA E INGENIERA UNIDAD DE CIENCIAS BSICAS QUMICA ORGNICA 100416 PRE INFORME PRCTICAS DE LABORATORIO
DE QUMICA ORGNICA NO. 1 DETERMINACIN DE ALGUNAS CONSTANTES FSICAS DE COMPUESTOS ORGNICOS No. 2 ALCOHOLES Y FENOLES No. 3 ALDEHIDOS, CETONAS Y CARBOHIDRATOS Luisana Amalia Meja lvarez luca_0406@hotmail.com Grupo CV: 100416_118 CEAD: Valledupar Estudiante del curso de Qumica Orgnica Tutor de laboratorio: Diego Naranjo Universidad Nacional Abierta y a Distancia Medelln, Abril 21 de 2013 ESCUELA DE CIENCIAS BSICAS, TECNOLOGA E INGENIERA UNIDAD DE CIENCIAS BSICAS QUMICA ORGNICA 100416 PRE INFORME PRCTICA DE LABORATORIO DE QUMICA ORGNICA NO. 1 DETERMINACIN DE ALGUNAS CONSTANTES FSICAS DE COMPUESTOS ORGNICOS 1. Objetivos de la prctica General
1. Identificar las propiedades fsicas punto de fusin, punto de ebullicin, densidad y solubilidad como constantes fsicas tiles la para la identificacin de algunas sustancias Especficos 1. Conocer los fundamentos de anlisis cualitativos de sustanciasorgnicas 2. Determinar algunas propiedades fsicas de sustancias orgnicas. 2. Marco terico Las sustancias ms simples en la qumica orgnica son los hidrocarburos, compuestos formados exclusivamente por carbono e hidrogeno. Sus propiedades fsicas y qumicas se toman como fundamento para analizar las de otros grupos de sustancias orgnicas ms complejas, por ello su anlisis y comprensin se hace vital para entender as a los dems grupos funcionales. Punto de Fusin El punto de fusin de un slido cristalino es la temperatura a la que cambia a lquido a la presin de una atmsfera. Cuando est puro, dicha modificacin fsica es muy rpida y la temperatura es caracterstica, siendo poco afectada por cambios moderados de la presin ambiental, por ello se utiliza para la identificacin de sustancias (Brewster, Vanderwerf, &McEwen, 1982, p4). Adems, debido a la alteracin que sufre esta constante fsica con las impurezas, es un valioso criterio de pureza. Para una sustancia pura el rango del punto de fusin no debe pasar de 0,5 a 1,0 C o funde con descomposicin en no ms de un grado centgrado. Si el rango de fusin es mayor, se debe a varios factores entre ellos: 1) La sustancia es impura (es necesario recristalizarla en un solvente apropiado y determinar de nuevo su punto de fusin). 2) La muestra ha sido calentada rpidamente y la velocidad de dilatacin del mercurio (en el termmetro) es menor que la velocidad de ascenso de la temperatura en la muestra. 3) Se tiene mucha sustancia como muestra en el sistema de determinacin del punto de fusin. Algunas sustancias orgnicas como, aminocidos, sales de cidos, aminas y carbohidratos funden descomponindose en rangos grandes de temperatura aun siendo puros. Cuando esto sucede es muy difcil determinar el punto de fusin. Por ello para estas sustancias se recomienda efectuar el calentamiento previo del sistema a unos 10C por debajo de su valor de fusin e introducir la sustancia y calentar cuidadosamente. Por otro lado para aquellas sustancias que tienen bajo punto de ebullicin y que son lquidas a condiciones ambientales, se puede utilizar un bao refrigerante (hielo seco, hielo con sal).
Una vez solidificada la sustancia, se extrae y se observa el ascenso del termmetro hasta determinar el valor de temperatura cuando la sustancia recupera nuevamente su estado lquido. A veces, cuando la sustancia no est lo suficientemente pura, la congelacin puede ser difcil de realizar (Martinez, 1985). Punto de Ebullicin El punto de ebullicin de las sustancias es otra constante que puede ayudar a la identificacin de las mismas, aunque no con la misma certeza que el punto de fusin debido a la dependencia tan marcada que tiene este, con respecto a la variacin de la presin atmosfrica y a la sensibilidad a las impurezas. Un lquido que no se descompone cuando alcanza un valor de presin de vapor similar a la presin atmosfrica, hierve a una temperatura caracterstica puesto que depende de la masa de sus molculas y de la intensidad de las fuerzas intermoleculares; en una serie homloga de sustancias orgnicas los puntos de ebullicin aumentan al hacerlo el peso molecular. Los lquidos puros de sustancias polares tienen puntos de ebullicin ms altos que los no polares de pesos moleculares semejantes. Por ejemplo, el etanol hierve a 78,8C, comparado con el ter metlico (sustancia polar no asociado) que lo hace a 23,7 C, el propano (sustancia no polar, no asociada) ebulle a 42, 1 C. Si se desea un trabajo un poco ms preciso, sobre todo cuando no se realiza bajo condiciones atmosfricas normales (una atmsfera de presin), es necesario efectuar una correccin utilizando la ecuacin de Sydney Young: T = K (760 P)(273 + TO) Donde: T Correccin a efectuar al valor experimental (TO) TO Temperatura experimental (tomada en el laboratorio) P Presin atmosfrica donde se ha efectuado la medicin (mm Hg) K Constante (0,00010 para un lquido asociado) (0,00012 para lquidos no asociados) Densidad La densidad es la relacin entre masa y volumen que ocupa un lquido. En la experiencia se hace una determinacin relativa, es decir la comparacin entre una densidad experimental y la densidad del agua, esto para eliminar errores sistemticos en la determinacin. La densidad relativa debe tener un valor semejante al de la densidad absoluta. Para esto se utiliza un volumen exactamente conocido de la sustancia, de modo que se establezcan relaciones entre masa y volumen.
Por lo general, se suele referenciar el valor de la densidad relativa del agua a 4 C; normalmente dicha determinacin se hace a temperatura diferente por lo que se debe efectuar una correccin. La mayora de laboratorios tienen una temperatura de 20 C por lo que la frmula a aplicar sera: D20C4C = D20C20C (0,99823) Donde: D20C4C Densidad relativa a 4C D20C20C Densidad relativa a 20C Solubilidad Esta propiedad determina la cantidad de una sustancia (fase dispersa o soluto) que se disuelve en una fase dispersante llamada solvente. En el caso de las sustancias orgnicas un solvente es un fluido como el agua u otros orgnicos como el ter, la acetona, el etanol, el cloroformo, el ter de petrleo, el hexano o el tetracloruro de carbono. Las solubilidad esta ampliamente relacionada con la polaridad, as una sustancia polar disuelve a sustancias igualmente polares; lo mismo ocurre con las no polares, estas solo disuelven a otras que sean no polares. En caso opuesto, las no polares sern insolubles en polares y viceversa. Olor Es una caracterstica particular asociada al peso molecular de la sustancia. Se genera por la facilidad o no de la molcula de poderse volatilizar a temperatura ambiente (esta facilidad esta mediada por las fuerzas de cohesin molecular). La presencia de olor de una sustancia tambin se asocia a estructuras sencillas, poco polares y de bajo punto de ebullicin. Color Esta propiedad depende en las sustancias orgnicas de la presencia de grupos atmicos crom foros que al interactuar con la luz visible, la descomponen emitiendo un paquete energtico particular. La aparicin de un color puede ser caracterstica, para una determinada sustancia orgnica. Son grupos crom foros las funciones u organizaciones: nitro, quinonas, azoicos, carbonio (colorantes del trifenil metano) y sistemas insaturados extensos conjugados (caso del caroteno). En algunos casos, la presencia de color tambin puede ser seal de impurezas sobre todo en aquellos compuestos orgnicos que son fcilmente oxidables. 3. Relacin de la prctica No. 1 del laboratorio de Qumica con la carrera de Agronomia
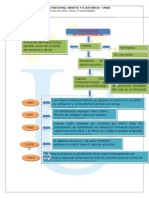
La prctica recoge los fundamentos que son aplicables a (distintos a los consignados en la gua de laboratorio) ______________________ 4. Metodologa: La prctica se divide en tres partes: Parte I: Se determina el punto de fusin de una sustancia por el mtodo capilar Parte II: Se determina el punto de ebullicin de la sustancia por el mtodo siwoloboff Parte III: Se determina la densidad relativa de la muestra. El siguiente es el esquema de desarrollo de la prctica: PRCTICA DE LABORATORIO DE QUMICA ORGNICA NO. 2 ALCOHOLESY FENOLES 1. Objetivos de la prctica General 1. Determinar la reactividad de algunos alcoholes y fenoles, comprobando as algunas caractersticas qumicas particulares. Especficos 1. Analizar el comportamiento qumico del grupo hidroxilo presente en alcoholes y fenoles, a travs de reacciones qumicas y procesos especficos. 2. Realizar el anlisis elemental de sustancias como los alcoholes y los fenoles 2. Marco terico Los alcoholes y fenoles se consideran como derivados orgnicos del agua al remplazar uno de sus hidrgenos por un radical alquilo (alcohol) o arilo (fenol). Los alcoholes pueden ser primarios, secundarios o terciarios dependiendo sobre qu tipo de carbono se encuentre enlazado el grupo funcional (OH). El orden y la velocidad de la reactividad de cada uno de ellos ser objeto de estudio en esta prctica. Los alcoholes tambin pueden ser monohidroxlicos o polihidroxlicos cuando tienen uno o varios grupos hidroxilo asociados a la misma cadena carbonada. Los primeros miembros de la serie son lquidos incoloros, menos densos que el agua, destilables sin descomposicin y de olor caracterstico. A partir del C12 (alcohol dodeclico) son slidos blancos de consistencia cerosa semejantes a la parafina. Poseen gran tendencia a asociarse a travs de puentes de hidrgeno, causa de su elevado punto de ebullicin y de la solubilidad en agua de los cinco primeros alcoholes.
Como se ha dicho, los alcoholes tienen como caracterstica la presencia del grupo hidroxilo (OH), el cual est unido a una cadena aliftica por un enlace sencillo. El carbono al cual se une el grupo funcional esta en hibridacin sp3, lo cual explica la formacin de cuatro enlaces simples. La frmula general para describir un alcohol es: R-OH Los alcoholes pueden tener partes aromticas, sin ser necesariamente fenoles, as si el grupo funcional est unido a un tomo de carbono aliftico y este a su vez a un anillo bencnico, el compuesto es un alcohol, p.ej.: CH2OH Cuando el grupo hidroxilo est acompaado por un grupo alquilo (de cadena abierta), la formula general del alcohol se puede predecir: (CnH2n+1OH), donde n, es la cantidad de tomos de carbono presentes. De acuerdo con la cantidad de hidroxilos se pueden clasificar en: monohidroxilados (un solo grupo de hidroxilo), dihidroxilos (dos grupos dioles o glicoles), trihidroxilados (trioles) y alcoholes polihidroxilados (polioles) Importancia de los alcoholes en el sector productivo: El de mayor utilidad es el alcohol etlico o etanol, en los procesos de fermentacin biolgica, es por ello que se utiliza de materias que provienen de azucares o almidones, por tal motivo es fundamental en la industria del vino, el aguardiente, la cerveza (industria de los licores) y en los ltimos das se viene utilizando para la produccin de biocombustibles. En la industria farmacutica los alcoholes se utilizan como antispticos o desinfectantes, depresores del sistema nervioso central (hipnticos), sedantes y disolventes. Los fenoles tienen como funcin al grupo hidroxilo, el cual esta enlazado directamente sobre un anillo aromtico. La frmula general que los describe es ArOH, donde Ar, representa a un grupo arilo. Los fenoles qumicamente tienen propiedades distintas a las de los alcoholes. Los fenoles se pueden clasificar de acuerdo a la cantidad de grupos hidroxilos que se encuentren en el anillo, siendo monodroxilados, dihidroxilados y trihidroxilados. El miembro ms simple de los fenoles, es el fenol (C6H5OH), tambin llamado hidroxibenceno. Los fenoles de acuerdo al sistema comn se nombran como derivados del fenol o con nombres vulgares. Segn el sistema IUPAC, estas sustancias se denominan como derivados del hidrocarburo aromtico correspondiente. Utilizacin o aplicacin de los fenoles: Los fenoles se han utilizado como materia prima en la fabricacin de explosivos tales como el cido pcrico, en productos utilizados para enchapar como es el caso de la resina baquelita y en adhesivos. Tienen en trminos generales propiedades germicidas, fueron los primeros utilizados como desinfectantes, pero se remplaz por otros menos peligrosos debido a su alta toxicidad. Algunos fenoles de inters son: Hexaclorofeno se usa como componente de jabones, cremas dentales y detergentes.
Pentaclorofenol se utiliza en la preservacin de la madera y en el control de crecimiento de algas. Aunque no es un fenol el cido 2,4diclorofenoxiactico o 2,4D es un derivado del 2,4 diclorofenol, utilizado como herbicida. Timol se encuentra en el aceite esencial del tomillo, es un poderoso antisptico con olor aromtico. Guayacol se extrae como producto de destilacin del guayaco, se usa como antioxidante. El carbonato de guayacol se emplea como expectorante. cido norhidroguayartico (NDGA) y la mezcla de 2 y 3terbutil4-metoxifenol (BHA) son utilizados para controlar la descomposicin por oxidacin de los aceites y grasas. Eugenol es un producto del aceite esencial del clavo, utilizado como condimento en alimentos. Resorcinol tiene efectos biolgicos, impide la absorcin del yodo necesario para que la glndula tiroides produzca sus hormonas en cantidad suficiente, esto ocasiona un aumento anormal en la glndula ocasionando el bocio. Este efecto se descubri al usar el resorcinol para el tratamiento tpico de las lceras de las piernas (Guerrero, 2005, p90). Amino fenoles como la adrenalina, norepinefrina y fenilefrina se utilizan ampliamente en productos farmacuticos. 3. Relacin de la prctica 2 del laboratorio de Qumica con la carrera de Agronoma La prctica recoge los fundamentos que son aplicables a (distintos a los consignados en la gua de laboratorio) ______________________ 4. Metodologa: Comprende dos partes: Parte I: Determinacin de propiedades fsicas. Parte II: Reactividad qumica, la cual comprende 7 ensayos: Prueba de acidez, con papel tornasol y con hidrxido de calcio. Reemplazo del grupo hidroxilo. Reacciones de oxidacin, con bicromato de potasio en medio cido y permanganato de potasio. Ensayo del xantato. Reaccin con cloruro frrico. Ensayo con agua de bromo.
Formacin de acido pcrico. PRCTICA DE LABORATORIO DE QUMICA ORGNICA NO. 3 ALDEHIDOS, CETONAS Y CARBOHIDRATOS 1. Objetivos de la prctica General 1. Determinar la reactividad de algunos aldehdos, cetonas y carbohidratos a travs de pruebas de anlisis, identificando caractersticas qumicas particulares de cada grupo de sustancias. Especficos 1. Analizar el comportamiento qumico del grupo carbonilo presente en los aldehdos y cetonas. 2. Analizar la reactividad de los carbohidratos a travs de reacciones qumicas y procesos especficos. 2. Marco terico Los aldehdos y las cetonas son sustancias alifticas y aromticas o mixtas, que se caracterizan por tener como grupo funcional a un tomo de carbono y oxgeno unidos mediante un doble enlace (C=O), este grupo es denominado grupocarbonilo, las otras valencias del tomo de carbono pueden estar sustituidas por cadenas carbonadas o hidrogeno (en esto radica la diferencia entre las dos series de sustancias). Los carbohidratos son otra serie de compuestos orgnicos, que se encuentran ampliamente distribuidos en los seres vivos. En estos aparte del grupo carbonilo, esta presente el grupo hidroxilo. Los aldehdos y cetonas por poseer el grupo carbonilo pueden establecer puentes de hidrogeno con otras molculas polares, pero no entre ellas, ya que no presentan hidrgenos unidos al oxgeno. La solubilidad en agua de aldehdos y cetonas es parcial, siendo relativa al peso molecular de la cadena carbonada; los compuestos carbonlicos de hasta C5 son completamente miscibles en agua, al incrementarse el peso molecular la insolubilidad en agua tambin aumenta. 3. Relacin de la prctica 3 del laboratorio de Qumica con la carrera de Agronoma La prctica recoge los fundamentos que son aplicables a (distintos a los consignados en la gua de laboratorio) ______________________ 4. Metodologa: Comprende dos partes:
Parte I: Pruebas para anlisis de aldehdos y cetonas. Parte II: Carbohidratos 3. Relacin de las practicas de laboratorio de Quimica Organica No. 1, 2 y 3 con la Carrera de Agronomia. Nos ayuda al control de diversos procesos agricolas como por ejemplo la fermentacion para la elaboracion de vinos y cervezas, o el destilado de bebidas alcoholicas. Pero su campo mas importante es el de los fertilizantes y los pesticidas. Se encargan del control de produccion de los abonos, de analizar su composicion y de investigar nuevas fuentes, y de crear nuevos pesticidas y herbicidas que controlen plagas. La qumica es de vital importancia, sobre todo la orgnica, pues la agricultura maneja seres vivos como las plantas, estas realizan muchos procesos bioqumicos, como la fotosintesis, respiracin, absorcin de nutrientes etc. etc. Adems tiene que ver con qumica inorgnica, pues en la agricultura se usan un sin numero de productos qumico, como fungicidas para tratar enfermedades causadas por hongos, insecticidas, fertilizantes tanto foliares(que se absorben atravez del follaje) y radiculares(a travs del sistema radicular = races), Adems de bactericidas y herbicidas que se utilizan para matar plantas indeseable. Cabe sealar que muchos productos de estos son altamente contaminantes, sobre todo de acuferos y cuerpos de agua, por eso el agricultor tiene que saber calcular cantidades apropiadas, y reconocer tambin las formulas de estos productos, para utilizar dosis apropiadas y formulas qumica que no daen al medio ambiente, los exedentes de estos productos cuando se usan indiscriminadamente, se lixibian y percolan(se filtran o acarrean) asa el subsuelo, contaminandolo. 5. Referencias Mdulo de Qumica General, Ignacio Gonzlez Carmona. Politcnico Colombiano Jaime Isaza Cadavid. Medelln, Colombia. 1989. Mdulo de Qumica Orgnica, Johny Roberto Rodrguez Prez. Universidad Nacional Abierta y a Distancia UNAD. Bogot, D.C. 2012. Brewster, R.Q. Y Mc Ewen, W.E. 1978. Qumica Orgnica, Buenos Aires. http://www.todomonografias.com/quimica/aldehidos-y-cetonas/
You might also like
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Olimpiadas Químicas Parte-3 PDFDocument885 pagesOlimpiadas Químicas Parte-3 PDFFRANCISCO JAVIER CHANA COLORADONo ratings yet
- Cuestionarios Organica (FINAL)Document39 pagesCuestionarios Organica (FINAL)Arturo100% (1)
- Psicometría. Principios básicos y protocolos experimentales diversosFrom EverandPsicometría. Principios básicos y protocolos experimentales diversosNo ratings yet
- Diferencia Entre Compuestos Organicos e InorganicosDocument11 pagesDiferencia Entre Compuestos Organicos e InorganicosWendy Faroni Cruz Valverde100% (1)
- Previo Práctica 1.zempoaltecaDocument6 pagesPrevio Práctica 1.zempoaltecaJoshua ZempoaltecatlNo ratings yet
- Alcoholes, Aldehídos y Cetonas InformeDocument21 pagesAlcoholes, Aldehídos y Cetonas InformeGdex Zia100% (2)
- Ensayos de Solubilidad en Compuestos OrgánicosDocument19 pagesEnsayos de Solubilidad en Compuestos OrgánicosFaustoJosephRomeroRecio61% (18)
- 146 Evelyn Dayana Morales Trejos Pre - 1Document9 pages146 Evelyn Dayana Morales Trejos Pre - 1Evelyn Morales TrejosNo ratings yet
- ConstFísOrgDocument13 pagesConstFísOrgRichard Antonio QuitianNo ratings yet
- Práctica de Laboratorio de Química Orgánica No. 1Document21 pagesPráctica de Laboratorio de Química Orgánica No. 1luchoduqueNo ratings yet
- Informe de Laboratorio Qumica OrganicaDocument50 pagesInforme de Laboratorio Qumica OrganicaGitequiTenoquiNo ratings yet
- Informe Quimica OrganicaDocument46 pagesInforme Quimica Organicamaikoalangie88% (33)
- Determinación de constantes físicasDocument10 pagesDeterminación de constantes físicasDiego1075211036No ratings yet
- Informe Practicas FinalDocument39 pagesInforme Practicas FinalFernanda CabreraNo ratings yet
- Informe 1 de OrganicaDocument11 pagesInforme 1 de OrganicaDey CalcinaNo ratings yet
- Análisis de compuestos orgánicosDocument82 pagesAnálisis de compuestos orgánicosDiana Marcela Garcia GonzalezNo ratings yet
- Practica #1Document7 pagesPractica #1Miguel Angel Sejas VillarroelNo ratings yet
- Correccion Parcial Lab de Organic ADocument6 pagesCorreccion Parcial Lab de Organic AjulianNo ratings yet
- Punto de FusiónDocument10 pagesPunto de FusiónMariana GarrónNo ratings yet
- Lab.3 Organica Punto EbullicionDocument9 pagesLab.3 Organica Punto EbullicionRichard Ameth100% (1)
- Pre Informe de Quimica OrganicaDocument51 pagesPre Informe de Quimica Organicaeliana montagutNo ratings yet
- Informe I FisicoquimicaDocument23 pagesInforme I FisicoquimicamiguelNo ratings yet
- Trabajo Colab. 1 Quimica Organica (Compañero)Document24 pagesTrabajo Colab. 1 Quimica Organica (Compañero)walterNo ratings yet
- Determinación de Puntos de Fusión y Ebullición de Compuestos Orgánicos-1Document11 pagesDeterminación de Puntos de Fusión y Ebullición de Compuestos Orgánicos-1Juan MoralesNo ratings yet
- Informe1 QMC 200Document5 pagesInforme1 QMC 200anghelitoss89% (9)
- Manual de Laboratorio Quimica Organica (Reparado)Document29 pagesManual de Laboratorio Quimica Organica (Reparado)Erika Lorena Cardozo DomínguezNo ratings yet
- Reacciones QuimicasDocument16 pagesReacciones QuimicasJuan Jose Morales GomezNo ratings yet
- Lab Quimica Organica IDocument21 pagesLab Quimica Organica IEliana Caceres TorricoNo ratings yet
- Determinación de constantes físicas orgánicasDocument14 pagesDeterminación de constantes físicas orgánicasPaola TorresNo ratings yet
- Propiedades Fisicas y Clasificacion de Compuestos Organicos de Acuerdo Con Su SolubilidadDocument9 pagesPropiedades Fisicas y Clasificacion de Compuestos Organicos de Acuerdo Con Su SolubilidadNelly Johanna Soto CastañedaNo ratings yet
- Reconocimiento de Propiedades de Los Compuestos OrgánicosDocument5 pagesReconocimiento de Propiedades de Los Compuestos OrgánicosValentinaSilva902No ratings yet
- Reportes Primer Parcial Pedro HernándezDocument6 pagesReportes Primer Parcial Pedro Hernándezescondidas travelNo ratings yet
- Informe1 QMC 200Document5 pagesInforme1 QMC 200Miky Siles RodasNo ratings yet
- Informe Propiedades FísicasDocument14 pagesInforme Propiedades FísicasDiego Nicolas ManceraNo ratings yet
- Informe 2Document6 pagesInforme 2NeibethNo ratings yet
- Laboratorio Organica 2 PracticaDocument14 pagesLaboratorio Organica 2 Practicalilibeth ramosNo ratings yet
- Guía de Laboratorio Química Orgánica Ing PDFDocument49 pagesGuía de Laboratorio Química Orgánica Ing PDFReinaldo LizarazoNo ratings yet
- Informe 3 de Lab de OrganicaDocument16 pagesInforme 3 de Lab de OrganicaMilagros AleNo ratings yet
- Punto ebullición compuestos orgánicosDocument4 pagesPunto ebullición compuestos orgánicosPaolaNo ratings yet
- Propiedades físicas de compuestos orgánicosDocument61 pagesPropiedades físicas de compuestos orgánicosmonica acosta100% (1)
- Cuestionarios Organica (FINAL) Complemento para La Fácil ComprensiónDocument38 pagesCuestionarios Organica (FINAL) Complemento para La Fácil ComprensiónHernández Hernández Naima AbigailNo ratings yet
- Recristalización y sublimación del ácido benzoicoDocument11 pagesRecristalización y sublimación del ácido benzoicoSebaas Linares0% (1)
- Practica de Laboratorio 1 Solubilidad de Compuestos OrganicosDocument18 pagesPractica de Laboratorio 1 Solubilidad de Compuestos OrganicosNatRodriguezNo ratings yet
- Guias de Practica Laboratorio No Presencial Semana 3Document17 pagesGuias de Practica Laboratorio No Presencial Semana 3CONVERCIO ESTELA FIORELLANo ratings yet
- Determinación de puntos de fusión y ebulliciónDocument30 pagesDeterminación de puntos de fusión y ebulliciónJuan Camilo Ortiz AyaNo ratings yet
- Pre Informes Quimica Organica.1Document12 pagesPre Informes Quimica Organica.1Elisa Jarava LiñanNo ratings yet
- Práctica No 2 CONSTANTES FÍSICASDocument5 pagesPráctica No 2 CONSTANTES FÍSICASMaFeR PaytanNo ratings yet
- TP Quimica General de 4to AñoDocument5 pagesTP Quimica General de 4to AñoSilvina SimonettiNo ratings yet
- Lab Quim Org I 2014Document17 pagesLab Quim Org I 2014Juan Carlos Escalera VallejosNo ratings yet
- Informe 2 OrgánicaDocument11 pagesInforme 2 OrgánicaEstefany Moreno Valenzuela0% (1)
- Informe Lab Organica Solubilidad y RecristalizacionDocument5 pagesInforme Lab Organica Solubilidad y RecristalizacionMartin EliasNo ratings yet
- Preinforme Práctica de Laboratorio de Química OrgánicaDocument26 pagesPreinforme Práctica de Laboratorio de Química OrgánicamariaNo ratings yet
- Informes Quimica OrganigaDocument12 pagesInformes Quimica Organigaluisgabriel5190No ratings yet
- 4 - Ensayos Preliminares y Propiedades Físicas (V David Díaz) - 2Document4 pages4 - Ensayos Preliminares y Propiedades Físicas (V David Díaz) - 2Deisy LorenaNo ratings yet
- Punto Ebullicion Sustancias OrganicasDocument12 pagesPunto Ebullicion Sustancias Organicaspaulina100% (3)
- Cuestionario Recristalizacion y Puntos de FusionDocument13 pagesCuestionario Recristalizacion y Puntos de FusionYarmila Agramont Loayza100% (8)
- Pre Informe de Química OrgánicaDocument55 pagesPre Informe de Química Orgánicaloritomendoza96% (45)
- AporteDocument3 pagesAporteRuben AcevedoNo ratings yet
- Actividad 3Document2 pagesActividad 3Ruben AcevedoNo ratings yet
- Aporte 3 Ruben AcevedoDocument4 pagesAporte 3 Ruben AcevedoRuben AcevedoNo ratings yet
- Actividad Inhysidividual Ruben AcevedoDocument4 pagesActividad Inhysidividual Ruben AcevedoRuben AcevedoNo ratings yet
- Actividad 3Document2 pagesActividad 3Ruben AcevedoNo ratings yet
- Actividad 3Document3 pagesActividad 3Ruben Acevedo0% (1)
- Resumen Determinantes SocialesDocument3 pagesResumen Determinantes SocialesRuben AcevedoNo ratings yet
- Act 6 Trabajo Colaborativo 1 Administracion de InventariosDocument13 pagesAct 6 Trabajo Colaborativo 1 Administracion de InventariosRuben AcevedoNo ratings yet
- TC 1 301503 20Document11 pagesTC 1 301503 20Ruben AcevedoNo ratings yet
- Aporte Colaborativo 2Document6 pagesAporte Colaborativo 2Ruben AcevedoNo ratings yet
- Etapa 2Document3 pagesEtapa 2Ruben AcevedoNo ratings yet
- Actividad Individual Logica MatematicasDocument7 pagesActividad Individual Logica MatematicasjfromeroeNo ratings yet
- Grupo 17 Ruben Acevedo Actividad 2Document5 pagesGrupo 17 Ruben Acevedo Actividad 2Ruben AcevedoNo ratings yet
- Grupo 90004 17 Colaborativo 2Document11 pagesGrupo 90004 17 Colaborativo 2Ruben AcevedoNo ratings yet
- Grupo 17 Ruben Acevedo Actividad 2Document5 pagesGrupo 17 Ruben Acevedo Actividad 2Ruben AcevedoNo ratings yet
- REVISIÓN DE SABERES CELULARES Y METABÓLICOSDocument39 pagesREVISIÓN DE SABERES CELULARES Y METABÓLICOSRuben Acevedo100% (1)
- EnsayoDocument5 pagesEnsayorubencho7No ratings yet
- 3morfo JuliethDocument4 pages3morfo JuliethRuben AcevedoNo ratings yet
- LipidosDocument9 pagesLipidosRuben AcevedoNo ratings yet
- 3morfo JuliethDocument4 pages3morfo JuliethRuben AcevedoNo ratings yet
- EtasDocument44 pagesEtasRafa Morales GonzálezNo ratings yet
- Aporte 1Document4 pagesAporte 1Ruben AcevedoNo ratings yet
- Aporte 4Document1 pageAporte 4Ruben AcevedoNo ratings yet
- 3morfo JuliethDocument4 pages3morfo JuliethRuben AcevedoNo ratings yet
- REVISIÓN DE SABERES CELULARES Y METABÓLICOSDocument39 pagesREVISIÓN DE SABERES CELULARES Y METABÓLICOSRuben Acevedo100% (1)
- T Reconocimiento R AcevedoDocument15 pagesT Reconocimiento R AcevedoRuben AcevedoNo ratings yet
- Quiz 3Document5 pagesQuiz 3Ruben AcevedoNo ratings yet
- Marco TeoricoDocument5 pagesMarco TeoricoRuben Acevedo100% (1)
- Act 12Document9 pagesAct 12Ruben AcevedoNo ratings yet
- Quiz 2 Farmacia HospitalariaDocument3 pagesQuiz 2 Farmacia HospitalariaRuben AcevedoNo ratings yet
- Preinforme Práctica de Laboratorio de Química OrgánicaDocument26 pagesPreinforme Práctica de Laboratorio de Química OrgánicamariaNo ratings yet
- Informe #8Document29 pagesInforme #8Mayli Martinez AñancaNo ratings yet
- Quimica III 1Document42 pagesQuimica III 1Flores Valencia Diego José100% (1)
- Alcoholes orgánicosDocument26 pagesAlcoholes orgánicosEdwin QuezadaNo ratings yet
- Anexo 3 Quimica (Recuperado Automáticamente)Document23 pagesAnexo 3 Quimica (Recuperado Automáticamente)Kely Marroquin Rozo100% (1)
- INFORME GRUPAL 3 - Identificacion de Una Sustancia Desconocida.Document10 pagesINFORME GRUPAL 3 - Identificacion de Una Sustancia Desconocida.Jonathan TipantuñaNo ratings yet
- Química Orgánica U0016 2016 Segundo 4Document12 pagesQuímica Orgánica U0016 2016 Segundo 4Fernanda UrquiagaNo ratings yet
- GeneralidadesDocument3 pagesGeneralidadesSulmy Olivera zeladaNo ratings yet
- Nomenclatura de Aldehidos y CetonasDocument4 pagesNomenclatura de Aldehidos y CetonasEsther Gutierrez LupeNo ratings yet
- Orga 2 CambiadoDocument37 pagesOrga 2 CambiadoJhasmin SantiagoNo ratings yet
- Unidad N°4Document11 pagesUnidad N°4Nayely VillarroelNo ratings yet
- Reacciones Del Grupo Carbonilo. Obtención de Iminas. Obtención N - ( (E) - Fenilmetilén) - AnilinaDocument5 pagesReacciones Del Grupo Carbonilo. Obtención de Iminas. Obtención N - ( (E) - Fenilmetilén) - AnilinaItzelCruzNo ratings yet
- Derivados de ácidos carboxílicosDocument117 pagesDerivados de ácidos carboxílicosJosuè SánchezNo ratings yet
- Química orgánica: Nomenclatura y propiedades de los hidrocarburosDocument59 pagesQuímica orgánica: Nomenclatura y propiedades de los hidrocarburosCaroPérezNo ratings yet
- Guia N3aldehidos y Cetonas. Grado 11 2020Document5 pagesGuia N3aldehidos y Cetonas. Grado 11 2020SEBASTIANNo ratings yet
- Apuntes Formulacion OrganicaDocument22 pagesApuntes Formulacion OrganicaGraduraNo ratings yet
- I.E.D El Pueblo: Actividades de Trabajo en CasaDocument89 pagesI.E.D El Pueblo: Actividades de Trabajo en CasajkjhkNo ratings yet
- 22 Acidos Carboxilicos Esteres Amidas 2020Document40 pages22 Acidos Carboxilicos Esteres Amidas 2020JUAN ORLANDO CHUQUILIN ARBILDONo ratings yet
- Unidad 5 Funciones Oxigenadas 2Document23 pagesUnidad 5 Funciones Oxigenadas 2Alisson AgüeroNo ratings yet
- DISCUSION Marcha FitoquimicaDocument5 pagesDISCUSION Marcha FitoquimicaJhenny GuzmanNo ratings yet
- Ácidos carboxílicos: nombres, estructuras y propiedadesDocument29 pagesÁcidos carboxílicos: nombres, estructuras y propiedadesedwin tarquiNo ratings yet
- Glosario de términos de química orgánicaDocument5 pagesGlosario de términos de química orgánicaJohan Flores100% (2)
- Sesion 7Document5 pagesSesion 7Andrés A. Rocha UsugaNo ratings yet
- Bioquímica Estructural y Metabólica (Presentación) Autor Jesús Navas MéndezDocument66 pagesBioquímica Estructural y Metabólica (Presentación) Autor Jesús Navas MéndezyohanyfloresNo ratings yet
- Ésteres Grupo 4Document16 pagesÉsteres Grupo 4Carla SaraviaNo ratings yet
- Reporte. Práctica #2Document3 pagesReporte. Práctica #2Ramses DRHONo ratings yet
- Propiedades y Reacciones de Los Aldehidos y CetonasDocument10 pagesPropiedades y Reacciones de Los Aldehidos y CetonasabdielNo ratings yet
- Laboratorio Aldehidos y Cetonas 2019 GHGHGHGHGDocument22 pagesLaboratorio Aldehidos y Cetonas 2019 GHGHGHGHGAlexander QuispeNo ratings yet