Professional Documents
Culture Documents
97 1123
Uploaded by
hizballah27Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
97 1123
Uploaded by
hizballah27Copyright:
Available Formats
Cancérologie
389
Radiothérapie
Notions radiobiologiques, principaux effets
secondaires
Pr Françoise MORNEX 1, Dr Éric LARTIGAU 2, Pr Jean-Marc COSSET 3
1. Département de radiothérapie et oncologie (Pr Gérard), centre hospitalier Lyon-Sud,
69310 Pierre Bénite.
2. Département de radiothérapie, institut Gustave-Roussy, 94805 Villejuif.
3. Département d’oncologie radiothérapique, institut Curie, 75005 Paris.
Points Forts Le but de la radiothérapie est d’utiliser les radiations ionisantes à visée théra-
peutique, afin de détruire les cellules cancéreuses. La radiobiologie étudie les
à comprendre effets des radiations sur les cellules normales et tumorales. Son but ultime, en
● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ●
clinique, est de permettre l’amélioration de l’efficacité des radiations sur les
• On utilise en radiothérapie tumeurs et de minimiser les effets secondaires sur les tissus sains traversés par
deux types principaux les radiations ionisantes.
de radiations :
– les photons (X ou γ),
qui agissent en profondeur Notions radiobiologiques
et permettent de traiter
des tumeurs profondes ; Mécanismes d’action des radiations ionisantes
– les électrons, qui pénètrent Les effets biologiques d’une irradiation sur les tissus sont l’aboutissement d’une
moins profondément les tissus, chaîne de phénomènes déclenchés par le passage du rayonnement. Les événe-
et permettent de traiter ments initiaux sont des ionisations (éjection d’un électron) ou des excitations
des tumeurs superficielles. (passage d’un électron sur une couche d’énergie supérieure), provoquées par
• L’action des radiations l’interaction des radiations avec les atomes des molécules. Ces modifications
ionisantes est due à une cascade physiques entraînent des effets physico-chimiques puis chimiques, avant d’abou-
d’événements. tir à un effet biologique. Les différentes étapes de cette action biologique finale
• Les effets secondaires sont ont des temps très différents, très courts pour les étapes physico-chimiques, plus
précocement observés pour longs pour les effets biologiques, représentés sur la figure 1.
les tissus à renouvellement
rapide, et tardivement observés Action sur la cellule
pour les tissus à renouvellement 1. Différents sites d’action
lent. Les lésions cellulaires élémentaires se font à 3 niveaux.
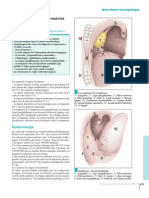
Au niveau du noyau, l’ADN représente la principable cible de l’action des radia-
tions sur la cellule. La molécule d’ADN est lésée directement par les électrons
ou indirectement par les radicaux libres, formés à partir de la radiolyse de l’eau
sous l’influence des photons (fig. 2). Il peut s’agir de lésions des bases ou des
sucres, de pontages, ou surtout de ruptures de chaînes, ruptures simples lorsqu’un
seul brin d’ADN est rompu, ou ruptures doubles, lorsque les deux brins sont rom-
pus. Classiquement, une dose d’irradition de 1 Gy induit 40 lésions double brin,
de 500 à 1 000 lésions simple brin, 1 000 à 2 000 lésions des bases et environ
200 pontages. Les lésions double brin sont souvent létales pour la cellule.
L’irradiation agit au niveau de la membrane cellulaire sur la perméabilité et en
induisant des chaînes de réactions encore incomplètement connues, par l’inter-
médiaire de la dégradation des phospholipides (peroxydation lipidique).
L’irradiation agit au niveau du cytoplasme sur les ribosomes et les mitochon-
dries. Ce site d’action semble peu important.
2. Mort cellulaire
Les lésions dues aux radiations, dites radiolésions, peuvent entraîner la mort cel-
lulaire aussi bien pour les cellules normales que cancéreuses. Cependant, les
radiolésions peuvent être réparées, dans certaines conditions, par des enzymes
LA REVUE DU PRATICIEN (Paris) 1123
1997, 47
R A D I OT H É R A P I E
Effet photo-électrique, 0 IRRADIATION
effet Compton
10-15 s IONISATIONS - EXCITATIONS
• Dans les niveaux d’énergie utilisés en
radiothérapie, deux effets sont importants à 10-5 s RADICAUX LIBRES
connaître : l’effet photo-électrique et l’effet
Compton, qui est largement prédominant en seconde RÉACTIONS BIOCHIMIQUES
radiothérapie de haute énergie.
• Effet photo-électrique : l’intégralité de minute
l’énergie du photon incident est transmise à RÉPARATION CELLULAIRE
un électron arraché à une couche interne heure
d’un atome. L’arrachement de l’électron
entraîne un réarrangement électronique, qui MORT DIFFÉRÉE
jour
produit à son tour soit un électron Auger,
soit un photon de fluorescence.
• Effet Compton : l’énergie du photon inci- semaine
dent est partagée entre un électron arraché à RÉPARATION TISSULAIRE
une couche périphérique de l’atome, et un mois
photon, dit photon diffusé. La proportion
d’énergie emportée par l’électron est année
d’autant plus forte que l’énergie initiale est
élevée. CANCÉRISATION
descendance MUTATIONS
1
Séquence des phénomènes induits par les radiations ionisantes. (D’après
Mazeron JJ, Locoche T, Maugis T. Techniques d’irradiation des cancers, Vigot ed ; 1994).
Différents types
de rayonnements
• Les radiations ionisantes comprennent :
– les rayonnements électromagnétiques de
haute énergie, composés de photons, qui
comprennent les rayons X et les rayons γ ;
ces deux types de photons ont les mêmes
propriétés biologiques ; la différence repose
sur leur mode de production (cf. infra) ;
– des particules chargées (électrons, protons,
atomes ionisés) ou non chargées (neutrons),
animées d’une vitesse élevée, du même
ordre de grandeur que celle de la lumière.
Les photons et les électrons sont, de très loin,
les plus utilisés en radiothérapie.
• Les radiations ionisantes sont produites par
2 types de mécanismes :
– la désintégration des atomes radioactifs
naturels ou artificiels (électrons et surtout
photons γ) : Co60 (cobalt) provenant des
appareils de cobalt, Ce137 (césium) et Ir192 (Iri-
dium) utilisés en curiethérapie ;
– l’accélération artificielle de particules
(neutrons, protons, ions lourds et surtout
photonx X et électrons), obtenue grâce aux
accélérateurs de particules, qui représentent
actuellement la majorité des équipements
des départements de radiothérapie.
Les radiations ionisantes utilisables en radio-
thérapie ont une énergie généralement com-
prise entre quelques dizaines de KeV (kilo-
électronvolt) et quelques dizaines de MeV
(mégaélectronvolt). 2
L’ADN nucléaire peut être lésé, soit directement, soit indirectement, par l’intermé-
diaire des produits de la radiolyse de l’eau cellulaire (cassure simple brin ou double brin).
(D’après Mazeron JJ, Locoche T, Maugis T. Techniques d’irradiation des cancers,
Vigot ed ; 1994).
1124 LA REVUE DU PRATICIEN (Paris)
1997, 47
Cancérologie
contenues dans la cellule, et empêcher ainsi la mort cellulaire. Ces systèmes
Définition du gray enzymatiques hautement performants dans les cellules saines le seraient moins
• Les doses délivrées en radiothérapie dans les cellules tumorales.
externe font appel au gray (Gy). • Effet différentiel : la différence de comportement entre une cellule normale,
• Le gray est l’unité qui définit la dose absor- qui répare, et une cellule cancéreuse, qui ne répare pas ou répare mal les radio-
bée par l’eau ou un tissu ; elle correspond à lésions, permet d’utiliser les radiations ionisantes de façon indirectement sélec-
une absorption d’énergie de 1 J/kg ; 1 Gy = tive, en entraînant la mort des cellules cancéreuses et le maintien des cellules
1 J/kg-1.
• Cette unité remplace le rad (1 Gy = normales. Ce phénomène est appelé « effet différentiel ».
100 rads). Utilisée en Europe, elle est plus • Lésions létales, sublétales, potentiellement létales : les lésions sont dites létales
progressivement adoptée aux États-Unis, où si elles sont irréparables et touchent des fonctions vitales pour la cellule. Elles
l’on s’exprime souvent en centigray (cGy), sont dites sublétales si elles ne sont pas individuellement létales, et sont répa-
qui correspond au rad, unité utilisée depuis
1953. Cette unité décrit la dose d’une irra- rables. Ce n’est que leur accumulation dans une cellule qui aboutit à la mort de
diation, dose totale, ou dose par séance d’ir- celle-ci. Les lésions potentiellement létales entraînent la mort de la cellule après
radiation. une division rapide, mais peuvent se réparer si les conditions survenant après
irradiation sont favorables (pH…).
• Mort immédiate, mort différée, apoptose : la mort immédiate est rare, elle se
produit après une irradiation à très haute dose (plusieurs centaines de Gy), ou si
les lésions de l’ADN sont létales d’emblée, ou par l’intermédiaire du phénomène
Radiothérapie d’apoptose (cf. infra).
de conformation La plupart du temps, la cellule irradiée cesse de se diviser après une ou plusieurs
mitoses : c’est le phénomène de mort mitotique différée ; la cellule continue à
• Il s’agit d’un progrès technique, nécessi- vivre jusqu’à la division suivante (c’est une mort en mitose). Dans certains cas,
tant l’acquisition d’un équipement lourd, qui la cellule peut se diviser un certain nombre de fois, mais finalement le clone est
associe un accélérateur linéaire, porteur d’un
système de collimation permettant d’obte-
abortif, ce qui correspond à une perte de la capacité d’une cellule à proliférer de
nir un faisceau de forme complexe, grâce à façon infinie (cela explique le délai observé entre l’irradiation et la régression
l’interposition dans le faisceau primaire de clinique du volume tumoral).
lames (collimateur multilames) ou de caches L’apoptose est une mort cellulaire programmée, active, qui fait partie du pro-
personnalisés, qui bloquent la transmission cessus normal de développement cellulaire. L’apoptose radio-induite est encore
des radiations, et un système informatique
sophistiqué permettant l’acquisition des mal connue ; un fonctionnement normal du gène p53 est indispensable au phé-
images anatomiques en 3 dimensions. nomène d’apoptose radio-induite. Les radiations ionisantes activeraient certains
• Des moyens de contention (masques, mate- gènes, dits radio-inductibles, qui entraîneraient de façon inéluctable la cellule
las…) et de vérification du repositionnement dans le cycle de l’apoptose.
du patient (imagerie portale) permettent
d’assurer une reproductibilité parfaite de
l’installation d’un jour à l’autre.
3. Facteurs influençant l’effet des radiations
• On peut alors mieux épargner les tissus • Radiosensibilité intrinsèque : c’est la capacité qu’a une cellule de réparer ou
sains et, de ce fait, délivrer une dose plus éle- non les radiolésions qui la rend radiosensible (si elle ne répare pas les radiolé-
vée dans le volume tumoral, afin d’aug- sions), ou radiorésistante (si elle répare les radiolésions).
menter les chances d’obtenir la stérilisation
de la lésion considérée. Les résultats obte- On définit, aussi bien pour les tissus normaux que pour les tissus cancéreux, dif-
nus sont en cours d’évaluation. férents degrés de radiosensibilité, connus des oncologues, radiothérapeutes et
utilisés en clinique.
• Cycle cellulaire : le cycle cellulaire se décompose en 4 phases : la phase G1,
qui suit la mitose et dont la durée est variable ; la phase S, pendant laquelle l’ADN
est répliqué ; la phase G2 ; la phase de mitose M. Les cellules qui ne se divisent
Choix du rayonnement pas sont dites hors cycle, ou en G0. La radiosensibilité est maximale durant les
en fonction phases G2 et M, et minimale en S. L’irradiation provoque un ralentissement de
de la tumeur la synthèse de l’ADN, donc un allongement de la phase S, et un blocage tem-
poraire des cellules en G2, avec un retard à la mitose et une synchronisation cel-
On dispose de différentes énergies de pho- lulaire. On cherche actuellement des moyens d’utiliser la variation de sensibi-
tons et d’électrons, qui permettent de traiter lité des cellules aux radiations au cours du cycle pour rendre l’irradiation plus
toutes les tumeurs quelle que soit leur pro- efficace.
fondeur. Les lésions superficielles (chaînes
ganglionnaires spinales, tumeurs cuta-
• Effet oxygène : la présence d’oxygène est indispensable à l’action biologique
nées…) peuvent être traitées par des élec- des radiations ionisantes. Des radicaux libres à durée de vie très courte (de l’ordre
trons qui pénètrent sur quelques centimètres. de 10-5 s) sont formés par les particules chargées traversant la matière. Ils entraî-
Les lésions plus profondes sont traitées par nent des manifestations biochimiques au niveau des cellules-cibles, avec for-
des photons, d’énergie variable de 5 à 25 mation, en présence d’O2, de peroxydes responsables de lésions de l’ADN (cas-
MV : 6 MV pour un cancer du sein, cancer sures) qui ne peuvent être toutes réparées. L’efficacité de ce processus est
de la sphère ORL, 10 à 18 MV pour un can-
cer bronchique, cancer abdominal ou pel- maximale si l’oxygène est présent au moment de l’irradiation.
vien. En l’absence d’oxygène (hypoxie), les cellules sont moins sensibles aux radia-
tions. La dose nécessaire pour détruire une cellule en hypoxie est 2,5 à 3 fois
LA REVUE DU PRATICIEN (Paris) 1125
1997, 47
R A D I OT H É R A P I E
plus importante que celle nécessaire pour détruire la même cellule bien oxygé-
Différents types née. Ce phénomène, appelé effet oxygène est très important en radiothérapie.
de radiothérapie On sait qu’une cellule située à plus de 200 microns d’un vaisseau est hypoxique.
Or, si une cellule tumorale est hypoxique, elle est peu sensible aux radiations,
• Radiothérapie externe
la dose nécessaire à sa stérilisation sera beaucoup plus élevée que si cette cel-
C’est de très loin la forme d’irradiation la lule tumorale était bien oxygénée. On utilise cette observation pour tenter de
plus utilisée. Elle fait appel à un équipement réoxygéner les tumeurs, afin de les rendre plus radiosensibles.
lourd, appareil de cobalthérapie qui tend à • Facteurs temps : ils comprennent le fractionnement et l’étalement d’une irra-
être remplacé par les accélérateurs de parti- diation. Le fractionnement est le nombre de fractions (ou de séances) d’une irra-
cules. La source d’énergie est à distance du
volume à irradier.
diation, le fractionnement conventionnel est d’une fraction par jour de 2 Gy. Le
Les radiations ionisantes traversent l’air, fractionnement permet la restauration, grâce aux systèmes enzymatiques de répa-
puis les tissus sains et déposent leur énergie ration, de l’ADN des cellules normales ; il est un élément important de la sur-
en profondeur, détruisant ainsi les cellules venue ou non des complications tardives. Le bifractionnement (2 séances par
tumorales. La multiplication des faisceaux jour) permet de délivrer à chaque séance une faible dose, non toxique pour les
d’irradiation permet de concentrer l’énergie
dans la tumeur et de ne pas irradier à haute
cellules normales qui réparent, et plus toxique pour les cellules tumorales qui
dose les tissus sains traversés. réparent mal. On protège donc les tissus sains, tout en délivrant une dose d’ir-
Une technique récente est représentée par radiation efficace.
l’irradiation peropératoire, qui consiste à L’étalement est la durée totale du traitement. La plupart des tumeurs prolifèrent
délivrer une dose unique d’irradiation pen- rapidement. En réduisant l’étalement, on « prend de vitesse » la prolifération des
dant une intervention chirurgicale. Ainsi on
peut irradier, après résection du pancréas par
cellules tumorales, leur destruction est plus importante. Ainsi, il est possible de
exemple, le lit tumoral si l’on suspecte la modifier l’efficacité biologique d’une irradiation en agissant sur les facteurs
résection de n’être pas complète. À ventre temps.
ouvert, l’irradiation n’intéresse que la zone • Effet dose : in vitro, les cellules tumorales ne sont pas entourées de tissu sain,
à risque de récidive, et épargne au maximum
les tissus sains environnants.
et de très fortes doses d’irradiation permettent d’obtenir 100 % de stérilisation.
En clinique, l’augmentation des doses se heurte cependant à la tolérance des tis-
• Curiethérapie
sus sains, qui est limitée, expliquant certains échecs observés. Néanmoins, il a
Cette méthode d’irradiation utilise des
sources radioactives mises en place à l’inté-
été montré (cancers bronchiques, ORL, gynécologiques) que l’augmentation de
rieur de l’organisme. On distingue la curie- la dose totale d’irradiation, pour une même tumeur, améliore ses chances de sté-
thérapie interstitielle (les sources sont pla- rilisation. Cet effet dose est constamment recherché en clinique pour les tumeurs
cées à l’intérieur du tissu à irradier) et la radiorésistantes.
curiethérapie endocavitaire ou intralumi-
nale, (où les sources sont introduites dans
une cavité naturelle, au contact ou à faible
proximité du tissu à irradier). Durant le Doses de tolérance des tissus sains,
temps pendant lequel les sources sont à l’in- doses nécessaires à la stérilisation des tumeurs
térieur de l’organisme, l’irradiation est
continue. Elle dure de quelques minutes à
quelques jours, en fonction du débit utilisé Il est important de connaître les doses de tolérance de chaque organe ou tissu.
(haut débit = quelques minutes), et de la dose En effet, lorsqu’on veut irradier et détruire une tumeur qui, le plus souvent, est
à délivrer. En France, on utilise comme profonde et entourée de tissus sains, on irradie obligatoirement ces tissus sains.
sources radioactives l’iridium (Ir192) et le Dans la technique d’irradiation choisie, on respecte les doses de tolérance de
césium (Cs137). L’intérêt de la curiethérapie
par rapport à l’irradiation externe est de déli-
chaque organe sain. On peut délivrer de fortes doses sur une partie d’un organe,
vrer en un faible laps de temps une dose forte et une dose beaucoup plus faible sur la totalité de cet organe. Ainsi la moelle
dans un très petit volume, car la dose chute épinière tolère 45 Gy, le parenchyme pulmonaire 70 Gy sur un petit volume et
très vite en périphérie du volume irradié. 20 Gy sur un poumon entier.
• Radio-immunothérapie On connaît également la dose nécessaire à la stérilisation d’une tumeur, qui
ou radiothérapie interne dépend de la tumeur considérée (radiosensibilité propre), et du volume de cette
De développement récent, elle utilise tumeur.
comme vecteur d’un agent irradiant un anti-
corps monoclonal dirigé contre une struc- Ainsi, schématiquement, un séminome du testicule est détruit par une dose de 30
ture spécifiquement portée par une cellule Gy, une maladie de Hodgkin par 40 Gy, un cancer du sein par 50-60 Gy, un petit
tumorale. Le but est d’irradier de façon cancer ORL par 60 Gy, un très volumineux cancer ORL par 70-80 Gy. Il semble
sélective la cellule tumorale, grâce à un iso- qu’une dose de plus de 100 Gy serait nécessaire à la destruction d’un gliome.
tope radioactif lié à l’anticorps monoclonal.
Une fois l’anticorps fixé sur la cellule tumo-
rale, l’isotope, choisi pour son rayonnement
puissant mais peu pénétrant (quelques Principaux effets secondaires
microns) va irradier la cellule tumorale sans
endommager les tissus sains. Cette tech- Les effets secondaires sont en fait souvent le « prix à payer » de la guérison. Leur
nique est en voie de développement en
France.
gravité varie selon l’organe considéré et leur fréquence est de plus en plus faible
avec l’amélioration des techniques d’irradiation.
Le principal facteur à considérer est la tolérance limitée des organes sains situés
dans le volume à irradier : la plupart des tissus sains sont lésés pour une dose
1126 LA REVUE DU PRATICIEN (Paris)
1997, 47
Cancérologie
TABLEAU
Principaux effets secondaires des radiations ionisantes
Organe Cellules Effets histologiques Effets cliniques Traitement Effets histologiques Effets cliniques Traitement Diagnostic
en cause précoces précoces effets précoces * tardifs tardifs effets tardifs * différentiel
Encéphale Astrocytes œdème hypertension macromolécules démyélinisation somnolence corticoïdes évolution T
oligodendrocytes intracrânienne corticoïdes troubles cognitifs
vaisseaux majoration signes diurétiques troubles mémoire
neurologiques hydrocéphalie dérivation
préexistants démence
radionécrose exérèse zone
nécrotique
Moelle épinière olifodendrocytes œdème signe de Lhermitte macromolécules démyélinisation myélite radique métastase,
astrocytes Brown-Séquard ± corticoïdes Brown-Séquard ± atteinte
vaisseaux complet complet vasculaire
Nerfs Cellules de Schwann plexite radique corticoïdes compression
vaisseaux signes sensitifs vitamines B tumorale
et/ou moteurs (chirurgie)
Poumon pneumocytes œdème alvéolaire toux, fièvre corticoïdes fibrose rétractile dyspnée O2 si besoin évolution T
vaisseaux prolif. vasculaire dyspnée oblitération vaisseaux surinfection
Tissu conjonctif
Œsophage muqueuse dénudation dysphagie anesthésiques locaux sclérose conjonctive dysphagie dilatation évolution T
muscle, séreuse muqueuse, corticoïdes oblitération vaisseaux hémorragie
vaisseaux antifungiques ulcérations
Cœur endocarde, myocarde troubles rythme et
péricarde péricardite aiguë corticoïdes conduction, péricardite corticoïdes, évolution T
coronaires constrictive chirurgie
sténose des coronaires dilatation, chirurgie
Pancréas nausées sétrons, corticoïdes
vomissements métoclopramide
(primpéran)
Estomac muqueuse œdème paroi nausées, sétrons, corticoïdes ulcérations hémorragie
muscle, séreuse vomissements métoclopramide atrophie muqueuse
vaisseaux (primpéran)
Foie hépatocytes veines cytolyse hépatomégalie thrombose veines malaladie veino-
centrolobulaires biologique centrolobulaires occlusive
Intestin muqueuse œdème diarrhée, antidiarrhéiques ulcérations hémorragies nutrition IV évolution T
muscle, séreuse dénudation météorisme régime sans résidus sclérose paroi fistules chirurgie
vaisseaux muqueuse douleurs et sans produits lactés sténose paroi occlusion
Rein néphron atrophie néphron insuffisance
vaisseaux fibrose rénale
rétropéritoine rétropéritonéale hydronéphrose
Vessie muqueuse œdème cystite antiseptiques atrophie muqueuse hématurie évolution T
musculeuse dénudation sclérose atrophie vésicale
vaisseaux muqueuse oblitération vasculaire
Rectum muqueuse œdème, faux besoins, épreintes corticoïdes sclérose sténose évolution T
musculeuse dénudation ténesme anesthésiques atrophie muqueuse rectorragies cautérisation
vaisseaux locaux télangiectasies lavements
Peau épiderme érythème érythème antiseptiques ulcérations atrophie dermo- corticoïdes
derme œdème desquamation corps gras fibrose épidermique,
vaisseaux phlyctènes antibiotiques pigmentation nécrose
ORL Voir peau et muqueuse œsophagienne « larynx radique » dysphonie, dyspnée (trachéotomie) évolution T
atrophie glandes asialie salive
salivaires jabot, douleurs artificielle
fibrose cutanée douleurs, trismus,
ostéoradionécrose O2, chirurgie
fracture
Cristallin cataracte troubles visuels chirurgie
* Le traitement est précisé lorsqu’il est spécifique.
inférieure à celle requise pour stériliser la tumeur. Les doses délivrées peuvent
donc entraîner des effets néfastes.
Les effets stochastiques (ou probabilistes) sont essentiellement des effets carci-
nogènes, à type de cancers secondaires (rares) chez les survivants à long terme
(maladie de Hodgkin par exemple), dont le risque d’apparition est lié notam-
ment au volume d’irradiation et aux thérapeutiques associées (chimiothérapie).
Les effets déterministes, apparaissent pour une dose seuil et leur sévérité est
dose-dépendante. Il s’agit des effets tissulaires, à traduction clinique immédiate
ou différée.
Parmi les effets déterministes, on doit différencier les effets précoces (transi-
toires et réversibles, attendus et inévitables, dont le patient sera prévenu, surve-
nant au cours du traitement et dans les 6 premiers mois qui suivent) et les effets
tardifs (définitifs, survenant après 6 mois, et pouvant être observés après un délai
LA REVUE DU PRATICIEN (Paris) 1127
1997, 47
R A D I OT H É R A P I E
Points Forts parfois de 10 ans, qu’on cherche à minimiser car ils peuvent handicaper le confort
de vie du patient). Il n’y a pas de lien direct systématique entre les effets aigus
à retenir et la gravité potentielle des séquelles tardives.
● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ●
L’intensité des effets des rayonnements ionisants est liée à la proportion de cel-
• De nombreux facteurs lules saines détruites. Cette mort cellulaire se traduit par une diminution de la
influencent l’effet fonction de l’organe auquel ces cellules appartiennent. Les cellules survivantes
des radiations : peuvent heureusement compenser ces effets, si les cellules souches ont survécu
– radiosensibilité intrinsèque et peuvent proliférer.
(certains types cellulaires sont L’intensité des réactions aiguës est liée à la dose totale délivrée pendant l’irra-
radiosensibles, d’autres diation, et non à la dose délivrée par fraction, à l’inverse des réactions tardives.
radiorésistants) ; Pour une dose totale équivalente, les réactions aiguës augmentent si la durée
– cycle cellulaire totale du traitement est diminuée. L’effet clinique n’apparaît qu’à partir d’une
(radiosensibilité maximale dose seuil, correspondant à un taux de dépeuplement cellulaire responsable d’al-
en G2 et M) ; térations de la fonction de l’organe irradié.
– effet oxygène (O2 potentialise Le délai d’apparition des lésions dépend directement de la vitesse de proliféra-
l’effet des radiations) ; tion d’une cellule. Si le temps de division (ou de renouvellement) d’une cellule
– facteurs temps : est de 2 jours, les lésions apparaissent très précocement. Si ce temps de division
le fractionnement influence est de 6 mois, les lésions sont tardives. Ainsi, l’irradiation de la cavité buccale
surtout les tissus donne-t-elle des réactions aiguës (atteinte muqueuse d’un tissu à renouvellement
à renouvellement lent ; rapide) et des réactions tardives (atteinte du tissu conjonctif et des parois vas-
l’étalement influence surtout les culaires, tissus à renouvellement lent).
tissus à renouvellement rapide ; Les lésions tissulaires vont conjuguer des atteintes des tissus de soutien et des
– effet dose : l’efficacité d’une atteintes des tissus fonctionnels, expliquant la diversité des types de réactions
irradiation augmente avec observées en fonction des organes irradiés, et la variabilité du délai d’apparition.
la dose totale. La sensibilité aux radiations peut varier d’un individu à l’autre.
• Un bon rapport dose utile La sensibilité aux radiations est également influencée par les antécédents des
(fixée pour chaque patients (brides intestinales, chirurgies délabrantes) et d’éventuelles tares vis-
tumeur)/dose seuil (fixée pour cérales (diabète, athéromatose sévère, tabagisme…), pouvant fragiliser les tis-
chaque type cellulaire) sus irradiés. Les principaux effets secondaires, précoces et tardifs, sont résumés
est nécessaire pour obtenir dans le tableau.
une efficacité thérapeutique
(destruction de la tumeur)
en limitant les effets secondaires Conclusion
(toxicité des tissus sains).
Les progrès technologiques ainsi que l’augmentation des connaissances biolo-
giques permettent d’optimiser l’efficacité de la radiothérapie et de réduire les
effets secondaires, afin d’augmenter le taux de guérison sans séquelles du can-
cer. ■
Les auteurs tiennent à remercier Gérald Raverot, interne des hôpitaux de Lyon, pour son aide pré-
cieuse à la rédaction du manuscrit.
POUR EN SAVOIR PLUS
Cosset JM. Radiothérapie, notions radiobiologiques, principaux effets secon-
daires. Impact Med 1996 ; 429-38.
Monographie, Rev Prat (Paris) 1994 ; 44 : 1001-50.
Monographie. Sem Hop Paris 1995 ; 19-20 : 557-610.
Mornex F, Mazeron JJ. Radiobiologie. In : Techniques d’irradiation des cancers.
Mazeron JJ, Locoche T, Maugis A, eds. Paris : Vigot 1992 : 9-33.
LA REVUE DU PRATICIEN (Paris)
1997, 47
You might also like
- Bernadac - Les Médecins MauditsDocument118 pagesBernadac - Les Médecins MauditsStephanie Hernandez100% (4)
- Admission Et Sortie Du Malade A L'hopitalDocument16 pagesAdmission Et Sortie Du Malade A L'hopitalgaglo jean-lucNo ratings yet
- GRILLE D AUDIT PostanalytiqueDocument11 pagesGRILLE D AUDIT PostanalytiqueSKPACANo ratings yet
- 98 1011Document7 pages98 1011hizballah27100% (1)
- 98 1003Document7 pages98 1003hizballah27No ratings yet
- 98 909Document3 pages98 909hizballah27No ratings yet
- Antagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À ProtonsDocument6 pagesAntagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À Protonshizballah27No ratings yet
- 98 987Document3 pages98 987hizballah27No ratings yet
- 98 881Document5 pages98 881hizballah27No ratings yet
- 98 919Document5 pages98 919hizballah27No ratings yet
- 98 999Document4 pages98 999hizballah27No ratings yet
- 98 991Document7 pages98 991hizballah27No ratings yet
- 98 913Document6 pages98 913hizballah27No ratings yet
- 98 899Document6 pages98 899hizballah27No ratings yet
- 98 905Document4 pages98 905hizballah27No ratings yet
- 98 875Document5 pages98 875hizballah27No ratings yet
- 98 887Document5 pages98 887hizballah27100% (1)
- 98 797Document5 pages98 797hizballah27No ratings yet
- 98 802Document3 pages98 802hizballah27No ratings yet
- 98 787Document10 pages98 787hizballah27No ratings yet
- 98 805Document5 pages98 805hizballah27No ratings yet
- 98 781Document5 pages98 781hizballah27No ratings yet
- 98 771Document6 pages98 771hizballah27100% (1)
- 98 679Document6 pages98 679hizballah27No ratings yet
- 98 765Document5 pages98 765hizballah27No ratings yet
- 98 667Document4 pages98 667hizballah27No ratings yet
- 98 689Document5 pages98 689hizballah27No ratings yet
- Lipothymie, Syncope Et Perte de Connaissance Brève: Orientation DiagnostiqueDocument4 pagesLipothymie, Syncope Et Perte de Connaissance Brève: Orientation Diagnostiquehizballah27100% (1)
- 98 653Document4 pages98 653hizballah27No ratings yet
- 98 685Document3 pages98 685hizballah27No ratings yet
- 98 671Document4 pages98 671hizballah27No ratings yet
- 98 661Document6 pages98 661hizballah27No ratings yet
- 98 657Document3 pages98 657hizballah27No ratings yet
- Hipnotiques BarbituriquesDocument28 pagesHipnotiques BarbituriquesAnwar Salama100% (4)
- Antibiotiques PDFDocument11 pagesAntibiotiques PDFbelalia_amineNo ratings yet
- Les Mauvaises Habitudes Alimentaires Des Personnes StresséesDocument3 pagesLes Mauvaises Habitudes Alimentaires Des Personnes StresséesDavid KernNo ratings yet
- Alimentation Femme EnceinteDocument4 pagesAlimentation Femme EnceinteflawraNo ratings yet
- Globules RougesDocument17 pagesGlobules RougesMounia El YousfiNo ratings yet
- LivresDocument10 pagesLivresIbrahim Diallo0% (1)
- Myopathies Des CeinturesDocument9 pagesMyopathies Des CeinturesaissaNo ratings yet
- Diarrhée Du Sevrage Des Porcelets - Tout Est Dans La PréventionDocument3 pagesDiarrhée Du Sevrage Des Porcelets - Tout Est Dans La PréventionBénédictus Bachir BankaNo ratings yet
- Les Trous NoirsDocument3 pagesLes Trous Noirsevan.mazzoliniNo ratings yet
- Cours 6 - MYELOME MULTIPLEDocument40 pagesCours 6 - MYELOME MULTIPLEHichem KenounNo ratings yet
- Gale DjohanDocument36 pagesGale DjohanSahouin Claude Medard100% (1)
- ESOPREXDocument2 pagesESOPREXazizatheoneNo ratings yet
- Exercice 2 A2 Feuille 2Document8 pagesExercice 2 A2 Feuille 2Profesora SilviaNo ratings yet
- 2017LIL2E080Document127 pages2017LIL2E080Mansouri AhmedNo ratings yet
- FR Medicament Vdef Crea-2Document15 pagesFR Medicament Vdef Crea-2Henri MauriceNo ratings yet
- Livret Exercices de Renforcement Musculaire Pour LombalgiesDocument4 pagesLivret Exercices de Renforcement Musculaire Pour LombalgiesYves ST VALNo ratings yet
- Document 3Document2 pagesDocument 3Zina ChenafiNo ratings yet
- Toxine Botulique PDFDocument4 pagesToxine Botulique PDFNicoletaNo ratings yet
- Evaluation Et Prise en Charge GynécomastiteDocument5 pagesEvaluation Et Prise en Charge GynécomastiteIbrahimNo ratings yet
- 1-Généralité Sur Le Corps HumainDocument6 pages1-Généralité Sur Le Corps HumaindjoualalaeNo ratings yet
- Cassagne MathieuDocument89 pagesCassagne Mathieuelisepinel3No ratings yet