Professional Documents
Culture Documents
3.pile Et Électrolyse
Uploaded by
Abdelhakim BailalOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
3.pile Et Électrolyse
Uploaded by
Abdelhakim BailalCopyright:
Available Formats
Le sens SPONTANE dvolution dun systme est-il P E!"S"#LE $ Le sens dvolution dun systme %&imi'ue (eut-il )tre "N!
N!E S*$
Les savoir-faire 1- Un systme chimique volue spontanment vers l'tat d'quilibre (carte mentale) En disposant de l'quation d'une raction, donner l'expression littrale du quotient de raction Qr , et calculer sa valeur dans un tat donn du systme. Savoir qu'un systme volue spontanment vers un tat d'quilibre. Etre capable de dterminer le sens d'volution d'un systme donn en comparant la valeur du quotient de raction dans l'tat initial la constante d'quilibre, dans le cas de ractions acido basiques et d'oxydorduction. 2- . Les piles, dispositifs mettant en jeu des transformations spontanes permettant de rcuprer de l'ner ie (carte mentale) Sc!matiser une pile. "tiliser le critre d'volution spontane dterminer le sens de dplacement des porteurs de c!ar#es dans une pile. $nterprter le %onctionnement d'une pile en disposant d'une in%ormation parmi les suivantes& sens de circulation du courant lectrique, %..m. , ractions aux lectrodes, polarit des lectrodes ou mouvement des porteurs de c!ar#es. 'nimation (las! )ile Ecrire les ractions aux lectrodes et relier les quantits de matire des espces %ormes ou consommes l'intensit du courant et la dure de la trans%ormation, dans une pile et lors d'une lectrolyse. * ! - "#emples de transformations forces (version imprimable) Savoir qu'une lectrolyse est une trans%ormation %orce.
Partie C :
+onnaissant le sens du courant impos par le #nrateur, identi%ier l'lectrode laquelle se produit la raction d'oxydation (anode) et l'lectrode laquelle se produit la raction de rduction (cat!ode). 'nimation (las! lectrolyse
+- Comment P E!O"
1- 1
le SENS dvolution dun systme %&imi'ue $
Rappel sur le quotient de raction $finition de %r
,n associe une raction du type & a '(aq) - b .(aq) / c +(aq) - d 0(aq) avec a, b, c, d les nombres st1c!iomtriques et ', . & les racti%s et + et 0 & les produits, le quotient de raction Qr d%ini un instant t de son volution, par & +e quotient de raction est sans unit. 2es nombres qui correspondent 3'4 ou 3.4 sont les m5mes nombres que les concentrations molaires (exprimes en mol.2 6) des entits c!imiques ' ou . sau% que ces nombres sont sans dimension. 0e plus, on admettra que le solvant (eau) et les corps solides n'interviennent pas dans le quotient de raction. ( 378,4 / 6 et 3entit4s / 6). & l'quilibre ( %rq ) * 2orsqu'un systme c!imique atteint son tat d'quilibre (les concentrations en racti%s et produits n'voluant plus), son quotient de raction Qrq se calcule en prenant les concentrations obtenues l9quilibre. +ette valeur, indpendante de la composition initiale, est appele la constante dquilibre, :uibal .ellevue ;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/ 6<=
note K associe l9quation de la raction considre . +omme K = #alement sans unit. Elle n'est fonction que de la temprature. 1- 2 Critre dvolution spontane
Qrq
cette constante est donc
"ne trans%ormation est dite spontane si elle a lieu > naturellement ? ou > toute seule ? (en opposition > %orce ?). +eci ne donne aucune in%ormation sur la cintique de la raction. "n systme c!imique volue spontanment, comme tout systme (ressort tir qui revient sa lon#ueur initiale @), vers l9tat d9quilibre. 'insi, si un systme c!imique donn est un instant t caractris par une valeur Qr di%%rente de A, alors, le systme voluera de %aBon ce que son Qr tende vers A. 1- 3 Comment prvoir le sens dvolution spontane dun systme chimique ?
'%in de prvoir le sens d9volution spontane d9un systme c!imique, il su%%it de comparer le quotient de raction Qr avec la constante d9quilibre A. ;rois situations sont possibles & ,i %r ) * 29tat d9quilibre est dC atteint. Dacroscopiquement, le systme n9volue plus. E9oublions pas qu9en ralit la vitesse dans un sens est > compense ? par la vitesse dans l9autre sens. ,i %r 0 * 2e systme volue dans le sens direct & sens (6). En e%%et, Qr doit au#menter. )our cela, les termes du numrateur (les produits) doivent au#menter et les termes du dnominateur (les racti%s) doivent diminuer. +eci implique la consommation des racti%s au pro%it de la %abrication des produits, donc le sens direct. ,i %r 1 * 2a situation est exactement l9inverse de la prcdente. 2e systme volue dans le sens indirect & sens (8). 6 a '(aq) - b .(aq) c +(aq) - d 0(aq) 8 Qr F A sens direct & sens 1- 4 Application 6 Qr G A
sens indirect & sens 8
une raction acido-!asique
;oute raction acido basique est caractrise par une constante A qui peut 5tre calcule partir des di%%rents A' ou Ae. 'insi, pour un mlan#e donn %abriqu l9instant t/H (Etat $nitial), il su%%ira de calculer le quotient de raction initial & QIi et de le comparer A pour savoir quel sera le sens spontan de la raction. 'pplication une solution tampon (3acide4 / 3sa base conCu#ue4) qui prsente la particularit de conserver un p7 constant mal#r un l#er aCout d9acide ou de base. 1- " Application une raction do#ydo-rduction $ Autour d'une transformation dans le domaine de l'oxydorduction - Polynesie 2003 diaporama de correction(.pps) 2tude d'une raction d'o#ydorduction lorsque les deu# ractifs sont directement en contact+ "n bc!er contient un volume J6 / 8H m2 de solution de nitrate d'ar#ent de concentration +6 / 6,H.6H 6 mol.2 6 auquel on aCoute J8 / 8H m2 de solution de nitrate de cuivre de concentration +8 / K,H.6H 8 mol.2 6. ,n obtient une solution dans laquelle coexistent les ions '#- , +u8- et E,*L . ,n plon#e ensuite dans le bc!er un %il de cuivre et un %il d'ar#ent bien dcaps. ,n observe une couleur bleue plus intense et un dpMt d9ar#ent sur le %il de cuivre. ,n donne 8 '#-(aq) - +u(s) / 8 '#(s) - +u8-(aq) ( A / 8,8.6H6K ) :uibal .ellevue ;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/ 8<=
'prs avoir calcul les concentrations initiales des 3'#-4i et 3+u8-4i dans le bec!er, quel est le sens spontan N Est ce co!rent avec les observations N
,- -es T ANS.O /AT"ONS SPONTANEES : les P"LES
"ne pile lectroc!imique est un #nrateur qui trans%orme de l'ner ie chimique issue d'une raction d'oxydorduction spontane en ner ie lectrique. "ne partie est perdue en c!aleur (e%%et Ooule). 2e courant lectrique est dP au trans%ert spontan d9lectrons, via un %il lectrique, entre les espces c!imiques de deux couples oxydant < rducteur. 2- 1 %es di&&rentes parties de la pile $eu# lectrodes constitues de matriaux conducteurs (des mtaux ou du carbone). Une ou plusieurs solutions lectrolytiques Une paroi poreuse ou un pont salin contenant des espces ioniques. ,on r3le est de fermer le circuit a%in de permettre le passa#e du courant dans la pile. 2e contact lectrique entre les deux solutions est ainsi assur sans que les solutions se mlan#ent. 2e pont salin assure alement la neutralit lectrique des solutions. 'onctionnement : une pile est un systme chimique hors quilibre.
2- 2
2orsque la pile %onctionne, elle volue en respectant le critre de l9volution spontane. 2a pile volue vers l9tat d9quilibre. 2a valeur du quotient de raction ( Q I ) tend vers celle de la constante d9quilibre ( A) associe l9quation de la raction de %onctionnement de la pile. 2a pile est use lorsque l9tat d9quilibre est atteint. & l'anode ( il se produit l'oxydation du mtal le plus rducteur (souvent le Qinc). $l est not ici & rducteur 6. 29anode est la borne n#ative. +e dernier s'oxyde et libre des lectrons. Eous retiendrons o ydation anodique Ied6 / ,x6 - n6 e (multiplier par n8) & la cathode ( ( borne -) il se produit la rduction de l'oxydant 8 ,x8 - n8 e / Ied8 (multiplier par n6) Le bilan lectroc!imique est alors & (pas d'lectrons dans ce bilan) n8 Ied6 - n6 ,x8 n8 ,x6 - n6 Ied8
(#emple $ la pile )aniell & la pile cuivre L Qinc
Daniell.ppt diaporama du fonctionnement de cette pile : la pile
29quation de %onctionnement de cette pile s9crit & Rn (s) - +u8- (aq) / Rn8- (aq) - +u (s) )endant son %onctionnement SnormalT, la pile se dc!ar#e pour apporter de l9ner#ie aux rcepteurs relis. Elle respecte le critre de l9volution spontane. ,n peut observer la diminution de l9anode en Qinc (masse in%rieure l9tat %inal). En revanc!e la cat!ode > #rossit ?. $l se %orme un dpMt de cuivre sur l9lectrode en cuivre. 2a concentration en ion cuivrique +u8-(aq) diminue. +eci se traduit par une dcoloration pro#ressive de la solution. (+e sont les ions +u8- (aq) qui sont l9ori#ine de la couleur bleue) 2- 3 Reprsentation &ormelle dune pile
:uibal .ellevue
;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/
*<=
2a reprsentation %ormelle de la pile est obtenue en plaBant la borne n#ative (donc l9anode) #auc!e et en indiquant les espces c!imiques rencontres dans la pile en commenBant c!aque couple redox par le racti%. 2e pont salin est reprsent par une double barre. 2a pile 0aniell est donc reprsente par & Rn < Rn8- << +u8- < +u 2- 4
-.
*ouvement des porteurs de char+es $ lorsque la pile dbite, les porteurs de c!ar#es sont& $ans le circuit e#trieur 4 la pile ( ce sont des lectrons qui circulent dans les %ils et dans les conducteurs de la borne n#ative vers la borne positive & sens oppos au sens conventionnel du courant ( $ va de la borne positive vers la borne n#ative). $ans le pont salin et dans les solutions ( ce sont des ions qui se dplacent. 2e mouvement des ions dans le pont salin est tel que les solutions restent lectriquement neutre. 0ans la demi pile qui s'enric!it en cations (lectrode n#ative) le pont salin apporte des anions et dans la demi pile qui s'appauvrit en cations (lectrode positive) le pont salin apporte des cations.
2- "
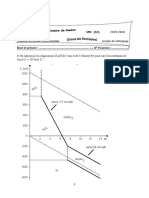
'orce lectromotrice ( et rsistance interne r dune pile 2a caractristique intensit tension d'une pile est donne ci contre. Son quation est& U56 ) " - r 7 " est appele %orce lectromotrice (%.e.m) de la pile. Elle se mesure en volt. +'est la tension aux bornes de la pile lorsqu'elle ne dbite pas (tension vide). )our la mesurer il su%%it de branc!er un voltmtre aux bornes de la pile lorsqu'elle n'est pas relie un circuit. E est alors #ale la valeur absolue de la valeur a%%ic!e par le voltmtre. 2a %.e.m d9une pile ne dpend ni de sa %orme, ni de ses dimensions, ni de la nature du pont salin. En revanc!e, elle dpend de la nature des couples redox (potentiel standard EU) et des concentrations des espces qui interviennent. r est la rsistance interne de la pile. Elle se mesure en o!m ( V ). Elle est numriquement #ale l'oppos du coe%%icient directeur de la caractristique intensit tension. 788 est le courant de court circuit.
2- ,
-uantit d.lectricit ma#imale -ma# / en coulom!0 d!ite par la pile $ capacit en char+e de la pile $
2a quantit maximale d9lectricit %ournie par une pile dpend de la quantit de matire du racti% limitant. Si l'on suppose que l'intensit (en ampre) du courant dbit est constante, alors& avec Wtmax & la dure de %onctionnement en seconde.
-ma# 1 2
3tma#
2a quantit d9lectricit porte par une mole d9lectrons est appel le %araday. $l est not ( ou F et vaut ( / E' x e / =,H8 . 6H 8* x 6,= . 6H 6X / X= KHH +.mol 6. Si l9quation de %onctionnement d9une pile %ait intervenir n lectrons alors une mole de rducteur %ournit
ne! moles d'lectrons , alors la quantit d9lectricit maximale
:uibal .ellevue
;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/
Y<=
%ournie par la pile pendant la dure Wtmax , est aussi &
'
-ma# = ne! ' 1 n #ma#
Iemarque & 2a quantit d9lectricit peut 5tre exprime en ampre !eure ('!). +omme Q / $.Wt , la correspondance est & 6 '! / * =HH +
0- 1ne T ANS.O /AT"ON .O CEE : l le%trolyse
3- 1 Comment 4 &orcer 5 une raction ?
)our aller > contre ? le sens spontan, il %aut apporter de lner"ie au systme . 'insi, il su%%it de placer correctement un #nrateur. 29ner#ie apporte sera sous %orme lectrique. 2e passa#e du courant dans un lectrolyte (liquide contenant des ions) s9accompa#ne d9une transformation force & c9est une lectrolyse qui permet de raliser la trans%ormation inverse de celle qui se passe dans une pile. 'u cours de cette trans%ormation, le Q# sloi"nera de la constante d9quilibre A. 3- 2 (#prience n61 $ lectrolyse dune solution de !romure de cuivre
2e symbole du #nrateur barr d'une %lc!e reprsente un #nrateur de tension continue r#lable. 2orsque la tension applique est trop %aible ( F 6,8 J ) il ne se passe rien. )our une tension applique suprieure 6,8J, on observe un dpMt de cuivre sur l'lectrode n#ative (cat!ode) et l'apparition de dibrome en solution au voisina#e de l'lectrode positive (anode). ' la cat!ode n#ative & +u8- (aq) - 8e / +u(s) , #ain d'lectrons, c'est une rduction. ' l'anode positive & 8 .r (aq) / .r8 - 8 e , perte d'lectrons c'est une oxydation. 8.ilan & +u (aq) - 8 .r (aq) +u(s) - .r8 +e bilan est l'inverse de celui correspondant l'volution spontane. +ette trans%ormation %orce est appele lectrolyse+ 3- 3 Anode et cathode oxydation ( il perd des lectrons). Selon le cas, il peut y avoir & ,xydation de l9lectrode ,xydation d9un ion prsent dans la solution ,xydation de l9eau ( en dioxy#ne ) K<=
&node ( l'lectrode laquelle se produit une o#ydation est appele anode (lectrode par laquelle le courant arrive dans l'lectrolyseur est l9anode)
' l9anode, des lectrons partent dans le circuit extrieur. +es lectrons sont %ournis par un rducteur de l9lectrolyseur, qui subit alors une :uibal .ellevue
;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/
8athode ( l'lectrode laquelle se produit une rduction est appele cathode (lectrode par laquelle le courant sort de l'lectrolyseur) ' la cat!ode, des lectrons sont apports par le circuit extrieur. +es lectrons sont capts par un oxydant prsent dans l9lectrolyseur, qui subit
alors une rduction ( il #a#ne des lectrons). Selon le cas, il peut y avoir & Iduction de l9lectrode Iduction d9un ion prsent dans la solution Iduction de l9eau ( en di!ydro#ne )
2e bilan lectrique #lobal correspond un trans%ert d9lectrons de l9anode vers la cat!ode par l9extrieur. 3- 4 -uelques applications de llectrolyse $ $rparation ou purification de certains mtau : le Qinc et l'aluminium sont prpars par lectrolyse d'une solution contenant leurs cations ou leurs oxydes. 2e cuivre est puri%i par lectrolyse anode soluble. $rparation de substances non mtalliques & le dic!lore (ainsi que petite proportion de di!ydro#ne) et la soude sont prpars par lectrolyse d'une saumure (solution trs concentre de c!lorure de sodium). %p&ts de mtau sur un support mtallique & ils se %ont par lectrolyse anode soluble. 2'lectrolyte contient les cations du mtal dposer. 2a cat!ode est constitue de l'obCet (mtallis) recouvrir. 2a #alvanoplastie a pour but de reproduire un obCet, la #alvanost#ie a pour but de le prot#er. 'es accumulateurs ou les piles rec!ar#eables %ont intervenir l'lectrolyse lors de la p!ase de rec!ar#e.
$l existe ne c!imie et en bioc!imie des ractions spontanes et des ractions %orces qui ne relvent pas d'un processus lectrolytique. )ar exemple& la respiration et la p!otosynt!se c!lorop!yllienne. 'a respiration & c'est un processus biolo#ique dont le droulement complexe passe par la d#radation d'un nutriment or#anique. $l apparaZt une succession de ractions d'oxydorduction mettant en Ceu le dioxy#ne. Elle a, entre autres, pour e%%et de synt!tiser la molcule d'';), rservoir d'ner#ie des cellules. )ar exemple & +=768,= = ,8 = +,8 - = 78,
'a synthse chlorophyllienne & $l s'a#it de la synt!se de matire or#anique avec l'aide de la lumire par les v#taux dits[c!lorop!ylliens[. = +,8 = 78, +=768,= - = ,8 $l s'a#it de la raction inverse de la prcdente (respiration). +'est donc ncessairement une raction %orce. 2'ner#ie ncessaire est apporte par la lumire.
2- /t&odolo3ie
2nterprter le &onctionnement dune pile $ raction spontane QI tend vers A +onnaZtre le %onctionnement d9une pile, c9est connaZtre & 2e sens de dplacement des porteurs de c!ar#es (lectrons dans les %ils) ou le sens du courant 2a polarit des lectrodes 2es ractions aux lectrodes (anode ( borne 9 o\ s9e%%ectue l9oxydation & o#ydation anodique) +es trois caractristiques sont lies entre elles. )our une pile donne, il su%%it de connaZtre une in%ormation pour en dduire les autres. :uibal .ellevue ;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/ =<=
"n des obCecti%s d9un exercice peut 5tre de demander un bilan en quantit de matire des racti%s et des produits (%aire un tableau d9avancement) ou de demander la dure de %onctionnement de la pile en donnant la valeur de l9intensit du courant qu9elle dbite (relation Qma = ( )tma / ne! * = n ma * +. (tude dune lectrolyse $ raction %orce QI s9loi#ne de A 2ors d9une lectrolyse, le sens de dplacement des lectrons est %acile dterminer car il est impos par le #nrateur. L'anode est ici la borne : , en revanc!e nous avons touCours l9o#ydation anodique. 2e reste repose sur le m5me raisonnement.
:uibal .ellevue
;S c! & !+ ,ens spontan d'volution est-il prvisible- .pile et lectrolyse/
]<=
You might also like
- Applications de la spectrophotomérie en phytochimie: sciencesFrom EverandApplications de la spectrophotomérie en phytochimie: sciencesNo ratings yet
- Theorie ElectrodeDocument18 pagesTheorie ElectrodeSophia Sofia SahouliNo ratings yet
- Courbes I V PDFDocument13 pagesCourbes I V PDFAbdelhakim BailalNo ratings yet
- Travaux Pratiques de Chimie Première AnnéeDocument27 pagesTravaux Pratiques de Chimie Première AnnéeBrahim MerakchiNo ratings yet
- Conductivite Des SolutionsDocument4 pagesConductivite Des Solutionsmohamed laghribNo ratings yet
- Chapitre 5 La Cinetique ChimiqueDocument11 pagesChapitre 5 La Cinetique Chimiquemarwan2nouichiNo ratings yet
- Méthode - Calcul - Verrerie Pour La DissolutionDocument1 pageMéthode - Calcul - Verrerie Pour La DissolutionphysiqueNo ratings yet
- Chapitre IIIDocument11 pagesChapitre IIIAmadji YassminNo ratings yet
- 1-Verreries: F4: Matériels de ChimieDocument14 pages1-Verreries: F4: Matériels de ChimieFd MtNo ratings yet
- FICHE TECHNIQUE N°2 PipetteDocument2 pagesFICHE TECHNIQUE N°2 PipetteSimo Mekki100% (1)
- Fiche de TD N 5 - 2Document4 pagesFiche de TD N 5 - 2ANes ツ100% (1)
- Courbes I F (E) Aspect CinétiqueDocument13 pagesCourbes I F (E) Aspect Cinétiquebchedhly malakNo ratings yet
- La Pile ElectrochimiqueDocument13 pagesLa Pile ElectrochimiqueRabihNo ratings yet
- Uv Visible l3Document111 pagesUv Visible l3Ben WafaaNo ratings yet
- InfrarougeDocument46 pagesInfrarougeOussama El BouadiNo ratings yet
- Chapitre 4 Cinétiques Des Réactions ÉlectrochimiquesDocument21 pagesChapitre 4 Cinétiques Des Réactions ÉlectrochimiquesridhaNo ratings yet
- Techniques VolumetriquesDocument33 pagesTechniques VolumetriquesAoulmi AmaniNo ratings yet
- Cours Hilali MH 2016-SMC5Document41 pagesCours Hilali MH 2016-SMC5Mohamed sadik100% (1)
- Refractometrie Et PolarimetrieDocument4 pagesRefractometrie Et PolarimetrieKpabou KpabouNo ratings yet
- Cours 5 Les Solutions Acides Et BasiquesDocument2 pagesCours 5 Les Solutions Acides Et Basiquesourhi farahNo ratings yet
- ÉlectrolyseDocument4 pagesÉlectrolyseMALEK. HDNo ratings yet
- Cinetique 01Document3 pagesCinetique 01badreNo ratings yet
- SmortierBlaisePascalPC Courbes Intensite Potentiel PDFDocument4 pagesSmortierBlaisePascalPC Courbes Intensite Potentiel PDFPrince AbdooNo ratings yet
- ChmTheo S5 Chapitre 7Document32 pagesChmTheo S5 Chapitre 7Abdelhakim BailalNo ratings yet
- Travaux PratiquesDocument20 pagesTravaux PratiquesLéa MontemarNo ratings yet
- Poly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireDocument13 pagesPoly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireSélène Chausson100% (1)
- 2021 - 22 - PolyTP-L3 ElectrochimieDocument14 pages2021 - 22 - PolyTP-L3 Electrochimiealain bouledeterre100% (1)
- Chap.6 TP12 Titrage PH Metrique D Un Vinaigre Correction PDFDocument2 pagesChap.6 TP12 Titrage PH Metrique D Un Vinaigre Correction PDFYouSsef EchafaiNo ratings yet
- TP Conductimetrie PDFDocument13 pagesTP Conductimetrie PDFHajar AMENAOUNo ratings yet
- Chapitre C3 Conductimetrie PDFDocument5 pagesChapitre C3 Conductimetrie PDFMANSOURINo ratings yet
- TD4 4Document6 pagesTD4 4WIJDANENo ratings yet
- Cours Avancement D'une Reaction 2015Document2 pagesCours Avancement D'une Reaction 2015Daghsni SaidNo ratings yet
- Cours de RMN S4Document56 pagesCours de RMN S4EmadNo ratings yet
- Spectroscopie D'Absorption Dans L'Uv-VisibleDocument77 pagesSpectroscopie D'Absorption Dans L'Uv-Visiblehadil rezioukNo ratings yet
- Polycopies TP Chimie SM ST LMD Ingenieur S1 2022 2023Document36 pagesPolycopies TP Chimie SM ST LMD Ingenieur S1 2022 2023Younes bengouiaNo ratings yet
- Cin PDFDocument31 pagesCin PDFMeryam AmsNo ratings yet
- Ouvrir SA Chap1 ConductimétrieDocument44 pagesOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- Liaisons Chimiques - CoursDocument5 pagesLiaisons Chimiques - CoursJabirDargoulNo ratings yet
- A-TP-1 RedoxDocument7 pagesA-TP-1 RedoxPathmanathanNo ratings yet
- Développent Historique Du Concept de L'atomeDocument32 pagesDéveloppent Historique Du Concept de L'atomefad hmaNo ratings yet
- C3Phy Lumiere Modele Ondulatoire PDFDocument3 pagesC3Phy Lumiere Modele Ondulatoire PDFAzizElheniNo ratings yet
- 1 Intermediaires Reactionnels 1Document12 pages1 Intermediaires Reactionnels 1Rachid Guend100% (1)
- Fiche Technique 7-ConductimetrieDocument2 pagesFiche Technique 7-ConductimetrieYassir RochdNo ratings yet
- chp4 s3 PDFDocument18 pageschp4 s3 PDFAbdelhakim Bailal50% (2)
- Techniques Caractérisation (Cours) SMP S6Document44 pagesTechniques Caractérisation (Cours) SMP S6Daoud ElalouanyNo ratings yet
- Cours Electrochimie l3gpDocument36 pagesCours Electrochimie l3gpidouiNo ratings yet
- Polycopie TP Chimie 1Document24 pagesPolycopie TP Chimie 1Yanis BoukerouiNo ratings yet
- Fiche Technique Dilution2Document1 pageFiche Technique Dilution2NabilDouadiNo ratings yet
- SV1 Chimie1Document49 pagesSV1 Chimie1Yassine ElkaNo ratings yet
- 1 Equilibres ChimiquesDocument6 pages1 Equilibres ChimiquesMira MslNo ratings yet
- Exer Spectro - Suppl Et CorrigeDocument34 pagesExer Spectro - Suppl Et CorrigeMichael Lee100% (1)
- Liaisons ChimiquesDocument42 pagesLiaisons ChimiquesOumar Sall100% (1)
- 1 La SpectrophotométrieDocument6 pages1 La SpectrophotométrieRekik MohamedNo ratings yet
- Lec 15 Les PHDocument12 pagesLec 15 Les PHPierreEustacheNo ratings yet
- Hartree FockDocument18 pagesHartree FockKhalid ZegNo ratings yet
- 04 PH Tau CorrectionDocument4 pages04 PH Tau CorrectionChartier JulienNo ratings yet
- Electrochimie-Chapitre 1-R-KIHALDocument15 pagesElectrochimie-Chapitre 1-R-KIHALManar Smith100% (1)
- Cours 1 - Evolution D'un Système (WWW - Pc1.ma)Document6 pagesCours 1 - Evolution D'un Système (WWW - Pc1.ma)mohamed laghribNo ratings yet
- Chimie - Chap 6 Et 7 - CoursDocument4 pagesChimie - Chap 6 Et 7 - CoursAymen GhozlaniNo ratings yet
- Examen Blanc SM Inter2222 PDFDocument8 pagesExamen Blanc SM Inter2222 PDFMouad Chaker100% (1)
- Correction Epreuve de Chimie Des Electrolytes 2013 2014Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2013 2014Abdelhakim BailalNo ratings yet
- SMC S3 Chim Exp Norm 2021Document2 pagesSMC S3 Chim Exp Norm 2021Abdelhakim BailalNo ratings yet
- Correction Epreuve de Chimie Des Electrolytes 2014 20152Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 20152Abdelhakim BailalNo ratings yet
- CHP 1 2023Document14 pagesCHP 1 2023Abdelhakim BailalNo ratings yet
- SMC s3 Ratt 2017Document8 pagesSMC s3 Ratt 2017Abdelhakim BailalNo ratings yet
- Série 1 s5 20Document9 pagesSérie 1 s5 20Abdelhakim BailalNo ratings yet
- SMPC S1 Série 2 2021Document11 pagesSMPC S1 Série 2 2021Abdelhakim BailalNo ratings yet
- ChmTheo S5 Chap3 PDFDocument24 pagesChmTheo S5 Chap3 PDFAbdelhakim BailalNo ratings yet
- Corr Serie 3 Prob SMC s4 - CompressedDocument4 pagesCorr Serie 3 Prob SMC s4 - CompressedAbdelhakim BailalNo ratings yet
- Chapitre IIDocument48 pagesChapitre IIAbdelhakim Bailal100% (1)
- SMPC s1chp IV 2020Document40 pagesSMPC s1chp IV 2020Abdelhakim Bailal100% (1)
- SMPC S2 CHP 1 Chimie Des Solutions 21Document15 pagesSMPC S2 CHP 1 Chimie Des Solutions 21Abdelhakim BailalNo ratings yet
- DM 5 Option PCDocument8 pagesDM 5 Option PCAbdelhakim BailalNo ratings yet
- SMPC s2 CHP 2Document31 pagesSMPC s2 CHP 2Abdelhakim BailalNo ratings yet
- SMC S3 Ratt 2021Document7 pagesSMC S3 Ratt 2021Abdelhakim BailalNo ratings yet
- SMPC 2020 RattDocument3 pagesSMPC 2020 RattAbdelhakim BailalNo ratings yet
- Master CHP 4 Corrosion 2021Document31 pagesMaster CHP 4 Corrosion 2021Abdelhakim BailalNo ratings yet
- ChmTheo S5 Chap1Document12 pagesChmTheo S5 Chap1Abdelhakim Bailal100% (2)
- Energie Réticulaire PDFDocument1 pageEnergie Réticulaire PDFAbdelhakim BailalNo ratings yet
- ChmTheo S5 Chap3 PDFDocument24 pagesChmTheo S5 Chap3 PDFAbdelhakim BailalNo ratings yet
- Biochimie ElectrodesDocument12 pagesBiochimie ElectrodesAbdelhakim Bailal100% (2)
- SMPC S2 Exam 2016Document4 pagesSMPC S2 Exam 2016Abdelhakim BailalNo ratings yet
- Energie RéticulaireDocument1 pageEnergie RéticulaireAbdelhakim Bailal0% (1)
- ChmTheo S5 Chapitre 7Document32 pagesChmTheo S5 Chapitre 7Abdelhakim BailalNo ratings yet
- SMC S3 Chim Exp Ratt 2020 PDFDocument2 pagesSMC S3 Chim Exp Ratt 2020 PDFAbdelhakim BailalNo ratings yet
- Chromatographie Op PDFDocument41 pagesChromatographie Op PDFAbdelhakim BailalNo ratings yet
- Acide Base PDFDocument3 pagesAcide Base PDFAbdelhakim BailalNo ratings yet
- Série 4 19Document9 pagesSérie 4 19Abdelhakim BailalNo ratings yet
- Chapitre 14 Diagramme e PHDocument9 pagesChapitre 14 Diagramme e PHAbdelhakim BailalNo ratings yet
- SMPC Exm CH - Sol 2015Document4 pagesSMPC Exm CH - Sol 2015Abdelhakim BailalNo ratings yet
- Coordonnateurs: PhilippeDocument10 pagesCoordonnateurs: Philippemansouri noureddineNo ratings yet
- b1 Junior Modéle Des ÉpreuveDocument20 pagesb1 Junior Modéle Des ÉpreuveMARIA GIL GANNo ratings yet
- Coeur Inro AnatDocument15 pagesCoeur Inro AnatDjallal HassaniNo ratings yet
- Exercices La Reproduction Sexuee Ches Les Plants A Fleurs1Document8 pagesExercices La Reproduction Sexuee Ches Les Plants A Fleurs1sarah nabilNo ratings yet
- Différences Essentielles Des Puits ZDocument16 pagesDifférences Essentielles Des Puits ZSlim.BNo ratings yet
- Cariste 1 3 5Document5 pagesCariste 1 3 5loua cece antoineNo ratings yet
- Serie TD Proba 2020 2021 Gmec1 1Document8 pagesSerie TD Proba 2020 2021 Gmec1 1أشرف عبودNo ratings yet
- Poly Proba Stat V2Document32 pagesPoly Proba Stat V2Med MouzounNo ratings yet
- Grand Oral SesDocument2 pagesGrand Oral Sesapi-657069168No ratings yet
- Edt SMP 1 PDFDocument3 pagesEdt SMP 1 PDFismail elaameryNo ratings yet
- Respuestas Al Examen de ATC A y BDocument2 pagesRespuestas Al Examen de ATC A y BSilvia Ribes CatalaNo ratings yet
- Cerballiance Res 20210706 210706L5007201Document1 pageCerballiance Res 20210706 210706L5007201Vsevolod SazonovNo ratings yet
- Piscca2023-Termes de ReferenceDocument6 pagesPiscca2023-Termes de ReferenceLucien RutashaNo ratings yet
- Code Des Douanes - MarocDocument88 pagesCode Des Douanes - MarocbvbarcNo ratings yet
- TD 1 Glucides 23-24Document1 pageTD 1 Glucides 23-24evrard.kinnenonNo ratings yet
- Carte Du Bénin: Informations Pratiques Et PrésenDocument11 pagesCarte Du Bénin: Informations Pratiques Et PrésenFerekou DouarouNo ratings yet
- 43316451Document37 pages43316451MrManagerNo ratings yet
- Au Bord de L'eau by MaupassantDocument7 pagesAu Bord de L'eau by MaupassantCarmelita RolandezNo ratings yet
- Catalogue Formation NexcomDocument52 pagesCatalogue Formation NexcomCastro FidèleNo ratings yet
- Exercice Type Brevet 2Document2 pagesExercice Type Brevet 2houda khaterNo ratings yet
- Devoir 1 Modele 5 Physique Chimie 1er Bac Semestre 1Document3 pagesDevoir 1 Modele 5 Physique Chimie 1er Bac Semestre 1Ikram Baya100% (1)
- 6 NotationDocument4 pages6 NotationrayamNo ratings yet
- Manuel Street Triple RSDocument248 pagesManuel Street Triple RSfranck.massolNo ratings yet
- 08 75 9p BaguelinDocument9 pages08 75 9p Baguelinmichael2No ratings yet
- Service Redal FRDocument15 pagesService Redal FRRachid mhajiNo ratings yet
- Regimbald - Le Rock N'Roll, Viol de La Conscience Par Les Messages SubliminauxDocument68 pagesRegimbald - Le Rock N'Roll, Viol de La Conscience Par Les Messages SubliminauxNunusseNo ratings yet
- L2 Architecture DordinateurDocument5 pagesL2 Architecture DordinateurMichel MusasaNo ratings yet
- Chapitre 5 Big DataDocument6 pagesChapitre 5 Big DataSYRINE SDIRINo ratings yet
- Livre de La Vache Du CielDocument2 pagesLivre de La Vache Du CielBabacar Latgrand DioufNo ratings yet
- Algorithmes MLDocument4 pagesAlgorithmes MLJuleNo ratings yet