Professional Documents
Culture Documents
Propiedades Termodinamicas Helio
Uploaded by
ferchosb12Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Propiedades Termodinamicas Helio
Uploaded by
ferchosb12Copyright:
Available Formats
PROPIEDADES TERMODINMICAS HELIO SOBRECALENTADO William Fernando Sotelo Bernal Cod.
245306
INTRODUCCIN Las propiedades termodinmicas son vitales para los balances de energa, diseo y anlisis de procesos y/o equipos, son de especial importancia en reas como la ingeniera qumica e ingeniera mecnica. Pero desafortunadamente hay situaciones en las cuales no se cuenta con esta valiosa informacin de ah la importancia de determinar correlaciones empricas y/o con fundamento terico, con las cuales evaluar dichas propiedades, con la mejor relacin entre complejidad y exactitud.
MARCO TERICO Ecuacin Virial de estado Una ecuacin virial de estado expresa la cantidad P /RT como una serie de potencias del inverso del volumen especifico, esta se deduce de la teora cintica o de la termodinmica estadstica:
Para propsitos de ingeniera su uso es prctico solo cuando la convergencia es muy rpida, esto es, cuando dos o tres trminos son suficientes para una aproximacin razonable a los valores de las series. La ecuacin virial truncada al segundo trmino, se basa en el hecho de que el factor de compresibilidad se comporta linealmente respecto a la presin, esto ocurre para gases y vapores de bajas a moderadas presiones.
Esta ecuacin expresa proporcionalidad directa entre Z Y P, y con frecuencia aplica a vapores a temperaturas subcriticas hasta sus presiones de saturacin. A temperaturas altas se proporciona una aproximacin razonable para los gases hasta una presin de varios bar, incrementando el intervalo de presin a medida que aumenta la temperatura.
El termino B, conocido como segundo coeficiente virial, depende de la sustancia y de una funcin de la temperatura. Los valores experimentales estn disponibles para varios gases. Adems, es posible calcular el segundo coeficiente virial por medio de una correlacin generalizada para gases, especficamente la correlaciones de Pitzer para el segundo coeficiente virial, la cual da una expresin analtica aproximada para un intervalo limitado de presiones.
Donde Tc y Pc son la temperatura y presin crticas, w es el factor acntrico (parmetro que refleja la geometra y polaridad de la molcula), B0 junto con B1 se definen como funciones de la Tr =T/Tc.
Como ya se ha dicho esta ecuacin es una buena aproximacin Z se comporta linealmente respecto a la presin y para especies no polares. Otra caracterstica de destacar es que el rango de presiones donde es aplicable aumenta con la temperatura, esto debido a que a Tr ms altas (>3) el factor de comprensibilidad tiende a comportarse linealmente respecto a la presin. Entalpia y Entropa como funcin de la presin y la temperatura
La entalpia y la entropa son propiedades termodinmicas usadas con bastante frecuencia, por lo que sera deseable tener una aproximacin a ellas en ausencia de informacin exacta. Para ello nos valemos de las ecuaciones de maxwell y de ciertas relaciones termodinmicas fundamentales, a partir de un desarrollo adecuado, logramos la siguiente forma para el cambio de entalpia en funcin de la presin y la temperatura. ( ) ) ( Como se observa, evaluar esta funcin requerir de una expresin para el calor especfico a presin constante, y de una ecuacin de estado. En este caso particular se opt por usar la ecuacin de estado virial truncada al segundo trmino, debido a su relativa simplicidad y que se puede hacer explicita para el volumen, a diferencia, de las ecuaciones de estado cubicas. Realizando las sustituciones adecuadas se llega a la siguiente expresin. ( ( ))
De igual forma podemos obtener una expresin para el cambio de entropa por medio de las ecuaciones de maxwell y de algunas relaciones termodinmicas. ( )
Esta expresin como en el caso de la entalpia se desarroll usando la ecuacin virial truncada al segundo trmino, obteniendo tras el tratamiento respectivo la siguiente expresin. ( )
Construccin de tablas termodinmicas a partir de ecuaciones de estado
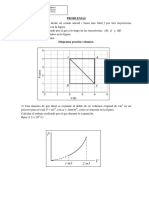
Previo a la construccin de la tabla de propiedades se debe calcular el volumen especifico del vapor sobrecalentado a determinadas presiones y temperaturas, esto se realiza resolviendo la ecuacin de estado (virial en este caso), a estos estados sern los que posteriormente se les determinara las propiedades termodinmicas. Para realizar la construccin de la tabla termodinmica en este caso de Helio sobrecalentado debemos definir el mecanismo que permitir el clculo a diferentes presiones y temperaturas, para ellos nos valemos del hecho de que todas las propiedades termodinmicas a aproximar son funciones de estado, por lo cual podemos definir cualquier trayectoria adecuada que logre el mismo cambio de estado. Un factor a considerar para definir la trayectoria es que no poseemos datos acerca de la capacidad o calor especfico para un gas real, solo conocemos este calor especfico para un gas ideal. Adems de la trayectoria se debe definir el estado de referencia as como el valor de las propiedades en ese punto, para definir este punto se debe tener en cuenta el rango de aplicabilidad de la expresin para el calor especfico. En el caso del Helio por ser un gas simple su calor especfico es constante para todas las temperaturas, por lo que la decisin del estado de referencia se debi a la comodidad de representacin que presenta mostrar las entalpias y entropas con valores positivos para el rango de trabajo. La trayectoria definida para calcular el cambio desde (Tref, Pref) hasta (T, P) es la siguiente: 1. Expansin a temperatura constante desde el estado de referencia hasta una isobara lo suficientemente baja para que se considere el comportamiento como gas ideal (5kPa). (trayectoria 3-4, ver figura). 2. Calentamiento a presin constante desde la temperatura de referencia hasta la isoterma T (trayectoria 4-5). 3. Compresin a temperatura constante desde la isobara de gas ideal hasta la isobara P (trayectoria 5-6).
Trayectoria para el clculo de propiedades desde el estado ref (punto3) hasta otro estado arbitrario de la regin vapor (punto 6)
Como se observa esta trayectoria se basa en una serie de procesos isobricos e isotrmicos de tal forma que la ecuacin que se aplica en cada caso. Se ver reducida segn sea el caso: 1. Isotrmica ( ( ( ) ))
2. Isobrica
DESCRIPCIN DE LA HOJA ELECTRNICA En la hoja electrnica para el clculo de las propiedades termodinmicas del helio se definieron ciertas funciones para mejorar la presentacin y simplificar la manipulacin de la hoja de clculo, entre las ms importantes se destacan: Function VirialforV(T As Double, P As Double) As Double Calcula por medio de la ecuacin virial truncada a un trmino, previa lectura de los parmetros respectivos (w), el volumen molar dada una temperatura y una presin. Function EntalpiaPcte(T2 As Double, T1 As Double) As Double Calcula el cambio de entalpia a presin constante, por medio del calor especfico de gas ideal, dado una temperatura final T2 y una temperatura inicial T1.
Function EntalpiaTcte(P2 As Double, P1 As Double, T As Double) As Double Calcula el cambio de entalpia a temperatura constante, por medio de la expresin desarrollada a partir de la ecuacin virial, dado una presin final y una presin inicial, a una isoterma dada, Function Entalpia(T As Double, P As Double) As Double Calcula el cambio de entalpia desde el estado de referencia fijado hasta un estado arbitrario por medio de la ya descrita. Function EntropiaPcte(T2 As Double, T1 As Double) As Double Similar a la funcin EntalpiaPcte, pero esta calcula el cambio de entropa. Function EntropiaTcte(P2 As Double, P1 As Double, T As Double) As Double Similar a la funcin EntalpiaTcte, pero esta calcula el cambio de entropa. Function Entropia(T As Double, P As Double) As Double Similar a la funcin Entropa, pero esta calcula el cambio de entropa.
Todos los parmetros de la funcin deben estar en Kelvin y kPa.
La hoja de clculo, est dividida en 3 partes principales: La primera de ellas contiene los parmetros de clculo (constantes crticas, constantes de la funcin de calor especfico), adems de un pequeo apartado que permite calcular directamente el cambio para la entalpia y entropa, para dos estados arbitrarios definidos por el usuario. La hoja de clculo le permitir cambiar todos los parmetros, de tal forma que la puede usar para cualquier sustancia (cada vez que cambie un parmetro presione el botn recalcular). La segunda parte es propiamente las tablas de propiedades calculadas para diversas presiones y temperaturas, en esta parte tambin se encuentran las tablas de referencias para el helio de la bibliografa, que permiten comparar fcilmente entre los valores calculados y los valores de referencia o reales. La tercera parte, que se encuentra en la hoja 2 grficos, del archivo, se muestran unos grficos que muestran el error relativo (valores calculados vs valores reales) en funcin de la temperatura para diversas isobaras.
ANLISIS DE RESULTADOS Se obtuvieron las tablas de propiedades para el vapor sobrecalentado junto con las tablas de referencia de manera que se pudiera cuantificar la desviacin o el error en las propiedades calculadas. En trminos generales se observa que los mtodos desarrollados para el clculo de las propiedades, generaron valores que se aproximan extremadamente bien (errores menores al 1.0%) para la mayor parte de estados propuestos para el clculo, esto muestra que la ecuacin de estado virial y la expresin del calor especfico son tiles para representar el comportamiento del Helio. Sin embargo es de destacar, tal como lo muestran las grficas de errores en la hoja de clculo, que a temperaturas bajas (Tr <3) y a presiones altas (>2000 kPa) se observaron fuertes desviaciones de los valores reportados (errores >5%) especialmente en lo que al clculo de la entalpia y el volumen especifico se refiero. Esto es muestra que la ecuacin virial no presenta buenos resultados a altas presiones y temperaturas reducidas menores que 3, ya que en estos estados el comportamiento del factor de comprensibilidad no es lineal, si no por el contrario tenemos una fuerte variacin de la tendencia. Esto es evidente si se analiza un diagrama de comprensibilidad generalizado. Adems es de resaltar que la entalpia se vio ms afectada que la entropa, por la aplicacin de la ecuacin virial en los estados ya mencionados, esto se debe a que la entalpia es una funcin ms dependiente de la ecuacin de estado, ya que el 100% del cambio isotrmico en dicha propiedad depende de la ecuacin de estado; caso contrario con la entropa, en la cual un cambio isotrmico tiene dos componentes uno que depende de la ecuacin de estado y otro que no, adems el termino dependiente de la ecuacin de estado solo aporta alrededor del 5% del cambio isotrmico total.
CONCLUSIONES Es posible construir tablas de propiedades con una buena exactitud, siempre que se use la ecuacin de estado y la expresin de calor especifico, dentro de sus rangos ptimos de aplicacin. La ecuacin virial truncada a dos trminos representa satisfactoriamente el comportamiento del Helio para una temperatura mayor a 100 K y una presin menor a 10 Mpa.
BIBLIOGRAFA Fuente usada como referencia de comparacin para el helio: NIST, Thermophysical Properties of helium-4 from 0,8 to 1500 K with pressures to 2000 Mpa, NIST Technical Note 1334(revised); Boulder, Colorado; Septiembre 1998. Perry, R.H., Green, D.W., Perrys Chemical Engineerss Handbook 8th Editon. McGraw-Hill, United States of America, 2008. Seccin 2-138. Prausnitz, J.M., Reid, R.C., Poling, B.E., The Properties of Gases & Liquids 4th Edition. McGraw-Hill, United States of America, 1987. Pag.682. Smith, J.M., Van Ness, H.C., Abbott, M.M., Introduccin a la Termodinmica en Ingeniera Qumica 7th Edicin. McGraw-Hill, Mxico ,2007. Captulo 3 y 6. Van Wylen, G.J., Sonntag, R.E., Borgnakke, C., Fundamentos de Termodinmica 2th Edicin, Limusa Wiley, Mxico, 2006. Capitulo 10.
You might also like
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Tutorial TermografDocument18 pagesTutorial TermografLuiska OrozcoNo ratings yet
- Integración numérica: métodos y aplicaciones en ingenieríaDocument11 pagesIntegración numérica: métodos y aplicaciones en ingenieríajimenaNo ratings yet
- Capítulo 1 - Campo Eléctrico y Curvas Equipotenciales PDFDocument11 pagesCapítulo 1 - Campo Eléctrico y Curvas Equipotenciales PDFksojoel100% (2)
- Simulacion de Procesos PDFDocument25 pagesSimulacion de Procesos PDFgustavoemir100% (1)
- PDF Ecuacion de Peng Robinson - CompressDocument18 pagesPDF Ecuacion de Peng Robinson - CompressSuri Perez Maria TeresaNo ratings yet
- Presión vapor líquidoDocument6 pagesPresión vapor líquidoNelly Karina100% (1)
- Informe de La Práctica Placa OrificioDocument4 pagesInforme de La Práctica Placa OrificioFreddyMinayaNo ratings yet
- Transmisión de calor entre agua y alcoholDocument9 pagesTransmisión de calor entre agua y alcoholNacho ContrerasNo ratings yet
- CuestionarioDocument2 pagesCuestionarioRafael MendezNo ratings yet
- Inf. 8 de FisicoquimicaDocument9 pagesInf. 8 de FisicoquimicaLucía Molina RamírezNo ratings yet
- PREPARACIÓN DE HCL 0.1 N Y DE NaOH 0.1 NDocument7 pagesPREPARACIÓN DE HCL 0.1 N Y DE NaOH 0.1 NGuadalupe FloresNo ratings yet
- Metodo DumasDocument10 pagesMetodo DumasSantiago DangerNo ratings yet
- Aplicaciones de La CombustiònDocument17 pagesAplicaciones de La CombustiònBianca Quiroga AndiaNo ratings yet
- Analisis de GasesDocument16 pagesAnalisis de GasesJulio C. Samanés CardenasNo ratings yet
- Torres de EnfriamientoDocument113 pagesTorres de EnfriamientoSantiago Molina HuertasNo ratings yet
- Curso Termodinámica IIDocument145 pagesCurso Termodinámica IIDante Santiago Ruiz De La RosaNo ratings yet
- Carta PsicometricaDocument6 pagesCarta PsicometricamatematicafimeNo ratings yet
- Apuntes de Termodinamica GeneralDocument12 pagesApuntes de Termodinamica GeneralyuleNo ratings yet
- Inf. 8 de FisicoquimicaDocument8 pagesInf. 8 de FisicoquimicaLucía Molina RamírezNo ratings yet
- Problemas 3. Classroom 2019 IDocument4 pagesProblemas 3. Classroom 2019 IAlain Llanqui ChocataNo ratings yet
- Pila GalvanicaDocument13 pagesPila GalvanicaLess ÁvilaNo ratings yet
- Tarea-6 Flujo CompresibleDocument7 pagesTarea-6 Flujo CompresibleMagali Carolina0% (1)
- Laboratorio 5 TermodinamicaDocument9 pagesLaboratorio 5 TermodinamicaNicolas Alvarez LunaNo ratings yet
- CapacidadDocument58 pagesCapacidadGermán Cristian Camacho Silva0% (2)
- Diagrama de Solubilidad 3Document24 pagesDiagrama de Solubilidad 3Anonymous Rgc8jdtkXENo ratings yet
- 5to Parcial FQ PDFDocument26 pages5to Parcial FQ PDFdiegoNo ratings yet
- HidrocarburosDocument24 pagesHidrocarburosMary CentenoNo ratings yet
- Circuitos Electricos TrifasicosDocument11 pagesCircuitos Electricos TrifasicosJhonatan Santa Cruz ChiloNo ratings yet
- Practica 3 - Determinacion de Viscosidad para Un Aceite A Diferentes TempDocument5 pagesPractica 3 - Determinacion de Viscosidad para Un Aceite A Diferentes TempVaaLe GarciiaNo ratings yet
- Tarea 6 2018ADocument4 pagesTarea 6 2018AMaríjo TorresNo ratings yet
- Silabo Electricidad y MagnetismoDocument9 pagesSilabo Electricidad y MagnetismoHedrich Apaza ZarateNo ratings yet
- Informe 4. Virtual-TIT ACIDO BASE CON PHMETRODocument13 pagesInforme 4. Virtual-TIT ACIDO BASE CON PHMETROLaura SánchezNo ratings yet
- Fisica 6Document19 pagesFisica 6jordiNo ratings yet
- Termograf UsoDocument30 pagesTermograf UsoNel HZNo ratings yet
- Estado Gaseoso IDocument18 pagesEstado Gaseoso IRosmery Ramos ManriqueNo ratings yet
- 1.2 Procesos de Combustion Teoricos y RealesDocument14 pages1.2 Procesos de Combustion Teoricos y RealesMARIA SERRANONo ratings yet
- Guia de Ejercicios Estado GaseosoDocument5 pagesGuia de Ejercicios Estado GaseosoRamiro CuentasNo ratings yet
- Ejercicios Resueltos de Ciclo Rankine PDFDocument21 pagesEjercicios Resueltos de Ciclo Rankine PDFSergio SabaNo ratings yet
- Diseño central compuestoDocument3 pagesDiseño central compuestoWendy Aguilar ImitolaNo ratings yet
- Libro de Microbiologia IndustrialDocument91 pagesLibro de Microbiologia IndustrialROY RAMOS MELENDEZNo ratings yet
- SlumpDocument6 pagesSlumpRaul Hilari LipaNo ratings yet
- Segundo Trabajo de TermodinamicaDocument18 pagesSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaNo ratings yet
- WWW - Dcb.unam - MX CoordinacionesAcademicas FisicaQuimica Quimica Formularios F GeometriaDocument2 pagesWWW - Dcb.unam - MX CoordinacionesAcademicas FisicaQuimica Quimica Formularios F GeometriaDjghkdfg FdgdfgdNo ratings yet
- Calculo de Torres de DestilacionDocument3 pagesCalculo de Torres de DestilacionckleinnikeNo ratings yet
- Metodo de KernDocument14 pagesMetodo de KernVanessaMoralesMejiaNo ratings yet
- Laboratorio de Operaciones Unitarias - 4to InformeDocument17 pagesLaboratorio de Operaciones Unitarias - 4to InformeCamilo RamosNo ratings yet
- Quimiometria 2021Document11 pagesQuimiometria 2021Yeferson VeraNo ratings yet
- Ecuaciones de Estado para Gases RealesDocument25 pagesEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASNo ratings yet
- 8º Mezcla EutecticaDocument6 pages8º Mezcla Eutecticaalvarogutierreztroch0% (1)
- Resumen de FasoresDocument7 pagesResumen de FasoresFabian Rodríguez VíquezNo ratings yet
- Laboratorio Integral 4Document13 pagesLaboratorio Integral 4Analy NolascoNo ratings yet
- Balances de materia y energía en procesos no reactivosDocument33 pagesBalances de materia y energía en procesos no reactivosMarce BravoNo ratings yet
- Termo TesisDocument30 pagesTermo TesisRaquel Jrz SvNo ratings yet
- Grafiacas Generalidas para La Entropia y La EntalpiaDocument6 pagesGrafiacas Generalidas para La Entropia y La EntalpiaEfrenC.CalvoNo ratings yet
- La entropía: propiedad y cálculoDocument6 pagesLa entropía: propiedad y cálculoEdie RodríguezNo ratings yet
- Practica 3. Presion de VaporDocument7 pagesPractica 3. Presion de VaporAdrastus ZavaletaNo ratings yet
- 3 Capacidad Calorifica de Los GasesDocument30 pages3 Capacidad Calorifica de Los GasesyesiquisNo ratings yet
- Practica de Modelamiento y Simulacion de Procesos Ingenieria Quimica 8 Ciclo Viii CicloDocument3 pagesPractica de Modelamiento y Simulacion de Procesos Ingenieria Quimica 8 Ciclo Viii CicloPedro AlcantaraNo ratings yet
- NPSHDocument7 pagesNPSHferchosb12No ratings yet
- Guía de Aprendizaje Unidad 1Document8 pagesGuía de Aprendizaje Unidad 1Jose David AlvaoNo ratings yet
- Protocolo Pruebas de Botella PDFDocument6 pagesProtocolo Pruebas de Botella PDFEduardo Peña MartínezNo ratings yet
- Resolución 1351 de 1995 IE-1 informe emisionesDocument19 pagesResolución 1351 de 1995 IE-1 informe emisionesferchosb12No ratings yet
- Cuesco de PalmaDocument13 pagesCuesco de PalmaIsaías FTNo ratings yet
- Auto CardDocument2 pagesAuto CardEnrique RamirezNo ratings yet
- Cooler AireDocument87 pagesCooler Aireferchosb12No ratings yet
- Golpe de Ariete FDDocument10 pagesGolpe de Ariete FDAngel Inga MartinezNo ratings yet
- Guia de Diseno para Los Sistemas de AlivDocument302 pagesGuia de Diseno para Los Sistemas de Alivjroberto_1223100% (1)
- Crear Sólidos Por RevoluciónDocument9 pagesCrear Sólidos Por RevoluciónHarinhol MFNo ratings yet
- TernariiDocument1 pageTernariiferchosb12No ratings yet
- 58-Convocatoria Estudiantes AuxiliaresDocument2 pages58-Convocatoria Estudiantes Auxiliaresferchosb12No ratings yet
- SFLA 7946-2-Es-0703Document88 pagesSFLA 7946-2-Es-0703ferchosb12No ratings yet
- Catálogo CGAM (USA) PDFDocument59 pagesCatálogo CGAM (USA) PDFWill Baca Badajos100% (1)
- Crear Láminas A Partir de Sólidos y AlineacionDocument6 pagesCrear Láminas A Partir de Sólidos y AlineacionRichard MedinaNo ratings yet
- Características de Autocad PDFDocument7 pagesCaracterísticas de Autocad PDFSandraNo ratings yet
- Curvas características de bomba centrífugaDocument230 pagesCurvas características de bomba centrífugaAna Maria Muñoz GonzalezNo ratings yet
- Guia Autocad 1Document45 pagesGuia Autocad 1Jefer Valencia OcNo ratings yet
- Apendice Q Combustibles y CombustionDocument24 pagesApendice Q Combustibles y CombustionGabriel BerrioNo ratings yet
- Energía de EnlaceDocument3 pagesEnergía de Enlaceferchosb12No ratings yet
- Disparo Con Euler y Diferencias FinitasDocument7 pagesDisparo Con Euler y Diferencias FinitasNestor JaimezNo ratings yet
- Aleta TriangularDocument6 pagesAleta TriangularEduardo Bautista0% (1)
- 01 PPDocument5 pages01 PPferchosb12No ratings yet
- UNIDAD VII IntegracionEnergeticaDocument29 pagesUNIDAD VII IntegracionEnergeticaMiguel Angel ArevaloNo ratings yet
- Deshidratación de EtanolDocument12 pagesDeshidratación de Etanolvalenciagc-biolcelNo ratings yet
- Aleta TriangularDocument6 pagesAleta TriangularEduardo Bautista0% (1)
- Disparo Con Euler y Diferencias FinitasDocument7 pagesDisparo Con Euler y Diferencias FinitasNestor JaimezNo ratings yet
- Malla Ing Quimica Mar2013Document1 pageMalla Ing Quimica Mar2013Julián Felipe Rodríguez RubianoNo ratings yet
- Anexo inglés 2018 PunoDocument12 pagesAnexo inglés 2018 PunoWilber BlyNo ratings yet
- UntitledDocument53 pagesUntitledSandra CruzNo ratings yet
- Material y Metodos AmbientalDocument5 pagesMaterial y Metodos AmbientalJuanPercyMonzonDavilaNo ratings yet
- Reporte Prac 4 Fisica Basica Usac 2016Document4 pagesReporte Prac 4 Fisica Basica Usac 2016JoseOsegueda33% (3)
- Modulo 7.2 PDFDocument11 pagesModulo 7.2 PDFKIESER DE LA PEÑA GASPARNo ratings yet
- Unidad I (ACPD)Document6 pagesUnidad I (ACPD)Edith VargasNo ratings yet
- Paradigmas y Regimenes de Bienestar - FLACSO1 PDFDocument92 pagesParadigmas y Regimenes de Bienestar - FLACSO1 PDFCoco Vidaurre ReyesNo ratings yet
- Guia Patrones Ritmicos y NumericosDocument6 pagesGuia Patrones Ritmicos y Numericosevelyn riverosNo ratings yet
- Articulo El Branding Territorial Ante Los Nuevos Desafios de La SociedadDocument12 pagesArticulo El Branding Territorial Ante Los Nuevos Desafios de La SociedadOrlando M Vega CNo ratings yet
- Tecnicas de ConteoDocument17 pagesTecnicas de ConteoElliot DamonNo ratings yet
- Concesion Jessy Influencia Directa PDFDocument1 pageConcesion Jessy Influencia Directa PDFGeovannyZhiminaicelaAstudilloNo ratings yet
- Gestión y Dirección de Obras Complejas. Tomo I - (PG 1 - 210)Document210 pagesGestión y Dirección de Obras Complejas. Tomo I - (PG 1 - 210)Jeremy Lusao Castillo FonsecaNo ratings yet
- Ejercicios 4 - Resueltos Perdida Deposito-TanqueDocument12 pagesEjercicios 4 - Resueltos Perdida Deposito-TanqueJORGE LORENZO CHUQUIMIA CALDERONNo ratings yet
- Evolucion de La SociologiaDocument3 pagesEvolucion de La SociologiaFanático de los FelinosNo ratings yet
- Alejandro AreasDocument13 pagesAlejandro AreasEduarAguilarNo ratings yet
- ENXTV-X4 Data Sheet SP110120 PDFDocument3 pagesENXTV-X4 Data Sheet SP110120 PDFcleverman1No ratings yet
- Qué Es HIDROCAR ECOLOGICO®Document9 pagesQué Es HIDROCAR ECOLOGICO®SALGASNo ratings yet
- Cuadro Comparativo Tres AutoresDocument4 pagesCuadro Comparativo Tres AutoresSIRCARLOS MOLINA RETAMOZONo ratings yet
- Unidad 2 SucesionesDocument33 pagesUnidad 2 SucesionesSuNo ratings yet
- La Filosofia de Gilles DeleuzeDocument303 pagesLa Filosofia de Gilles DeleuzeCR TrujilloNo ratings yet
- Aporte Indicadores de GestiónDocument7 pagesAporte Indicadores de GestiónDiana Marcela CastroNo ratings yet
- Formato Persona NaturalDocument2 pagesFormato Persona NaturalDaEn TorrenzNo ratings yet
- 6 1 3 Caso 2 Experiencia 6Document2 pages6 1 3 Caso 2 Experiencia 6Gustavo GarínNo ratings yet
- Cómo enseñar a preadolescentes y adolescentes en la escuela dominicalDocument6 pagesCómo enseñar a preadolescentes y adolescentes en la escuela dominicalFrancisco Acual100% (1)
- Funciones auxiliar contabilidadDocument5 pagesFunciones auxiliar contabilidadMiguel Zuluaga100% (1)
- Godelier Maurice - Lo Ideal Y Lo MaterialDocument294 pagesGodelier Maurice - Lo Ideal Y Lo MaterialJacqueline AndradeNo ratings yet
- Folleto de Motivación Actividad 5Document2 pagesFolleto de Motivación Actividad 5Luisa Fernanda SanCortes0% (1)
- Defecto Cristalino (Vacancia Intersticial)Document3 pagesDefecto Cristalino (Vacancia Intersticial)Enrique CastilloNo ratings yet
- Ejercicios SecuenciaciónDocument7 pagesEjercicios SecuenciaciónroalNo ratings yet
- EcuacionesDocument25 pagesEcuacionesAídaObesoNo ratings yet