Professional Documents
Culture Documents
So Luci Ones
Uploaded by
Karla LunaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
So Luci Ones
Uploaded by
Karla LunaCopyright:
Available Formats
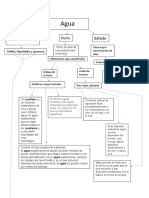
SOLUCIONES
Las soluciones en qumica, son mezclas homogneas de sustancias en iguales o distintos estados de agregacin. La concentracin de una solucin constituye una de sus principales caractersticas. Bastantes propiedades de las soluciones dependen exclusivamente de la concentracin. Su estudio resulta de inters tanto para la fsica como para la qumica. Algunos ejemplos de soluciones son: agua salada,oxgeno y nitrgeno del aire, el gas carbnico en los refrescos y todas las propiedades: color, sabor, densidad, punto de fusin y ebullicin dependen de las cantidades que pongamos de las diferentes sustancias. La sustancia presente en mayor cantidad suele recibir el nombre de solvente, y a la de menor cantidad se le llama soluto y es la sustancia disuelta. El soluto puede ser un gas, un lquido o un slido, y el solvente puede ser tambin un gas, un lquido o un slido. Una solucin (o disolucin) es una mezcla de dos o ms componentes, perfectamente homognea ya que cada componente se mezcla ntimamente con el otro, de modo tal que pierden sus caractersticas individuales. Esto ltimo significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (slida, lquida o gas) bien definida. En general, la solucin es la respuesta a un problema. De forma ms especfica, puede referirse a:
en matemticas, se denomina raz o cero de una funcin, o solucin de la ecuacin asociada, al valor o valores de las incgnitas de la funcin que la anulan; en qumica, una disolucin o solucin es una mezcla homognea a nivel molecular o inico de dos o ms sustancias, que no reaccionan entre s; en narratologa, el desenlace o solucin es la conclusin del argumento de una obra de ficcin, mediante la que se resuelve el nudo de la trama principal; y en marketing, una solucin es un producto, un servicio o una mezcla de los dos. Se considera un clich del mundo del marketing.1
la palabra solucin viene del latn soluto, solutionis, formada de la raz del verbo solvere, solu- y el sufijo- to (-cion=accin y efecto. Del mismo modo se forma la palabra solutus que es el participio del verbo solvere (soltar-liberar), que encontramos en las palabras absoluto y disoluto.
Una solucin est formada por uno o ms solutos y el disolvente o solvente. El soluto es las sustancias que se disuelve para formar la mezcla, y siempre se
encuentra en menor proporcin que el disolvente, que es el medio de dispersin. Por ejemplo, en una solucin formada por 5 Ml de alcohol y 95 ml de agua, el soluto es el alcohol y el disolvente es el agua. La mezcla de ambos forma la solucin. En el mbito de la qumica el trmino solucin o disolucin alude a las mezclas que poseen dos o ms sustancias y que son homogneas. Aquellas sustancias que se encuentran en menor cantidad y que son las que se disuelven en la mezcla se las conoce bajo el nombre de soluto. El solvente, en cambio, es la sustancia en la que el soluto se disuelve. Segn la conductividad elctrica que posean las soluciones, se las clasifica en: No electrolticas: estas soluciones, como su nombre indica, tienen una capacidad casi inexistente de transportar electricidad. Se caracterizan por poseer una disgregacin del soluto hasta el estado molecular y por la no conformacin de iones. Algunos ejemplos de estas soluciones son: el alcohol y el azcar. Electrolticas: estas soluciones, en cambio, s pueden transportar electricidad de manera mucho ms perceptible. A esta clase de soluciones tambin se las conoce bajo el nombre de inicas, y algunos ejemplos son las sales, bases y cidos. Dependiendo de la cantidad de soluto que haya, existen distintas soluciones: Soluciones saturadas: en las soluciones en que existe la mayor cantidad de soluto capaz de mantenerse disuelto, a una temperatura estable, en un solvente, se las conoce bajo el nombre de soluciones saturadas. En caso de que se agregue mayor cantidad de soluto, la mezcla superara su capacidad de disolucin. Soluciones insaturadas: estas soluciones, tambin conocidas bajo el nombre de diluidas, son aquellas en las que la masa de solucin saturada es, en relacin a la del soluto disuelta, mayor para la misma masa de solvente y a igual temperatura. Soluciones concentradas: en estas soluciones, el porcentaje de soluto es cercano al establecido por la solubilidad a la misma temperatura. Soluciones sobresaturadas: en dichas soluciones existe una cantidad menor de solucin saturada que de soluto a una determinada temperatura.
Clasificacin de las soluciones PR SU ESTADO DE SLIDAS POR SU CONCENTRACION SOLUCION NO-SATURADA; es aquella en donde la fase dispersa y la dispersante no estn en equilibrio a una temperatura dada; es decir, ellas pueden admitir ms soluto hasta alcanzar su grado de saturacin. Ej: a 0 C 100 g de agua disuelven 37,5 NaCl, es decir, a la temperatura dada, una disolucin que contengan 20g NaCl en 100g de agua, es no saturada. SOLUCION SATURADA: en estas disoluciones hay un equilibrio entre la fase dispersa y el medio dispersante, ya que a la temperatura que se tome en consideracin, el solvente no es capaz de disolver ms soluto. Ej una disolucin acuosa saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 C. SOLUCION SOBRE SATURADA: representan un tipo de disolucin inestable, ya que presenta disuelto ms soluto que el permitido para la temperatura dada. Para preparar este tipo de disoluciones se agrega soluto en exceso, a elevada temperatura y luego se enfra el sistema lentamente. Estas soluciones son inestables, ya que al aadir un cristal muy pequeo del soluto, el exceso existente precipita; de igual manera sucede con un cambio brusco de temperatura.
LIQUIDAS
GASEOSAS
A qu nos referimos cuando hablamos de la concentracin de una solucin y cmo puede calcularse? En general nos referimos a la cantidad de soluto respecto a la cantidad total de solucin o de solvente. Esas cantidades pueden expresarse de manera vaga, poco precisa, tal como lo hacemos en nuestra vida cotidiana, por ejemplo, dos cucharadas de azcar en una taza de t. Pero muchas veces nos
interesa conocer con precisin cual es la relacin soluto solucin. En esos casos la cantidad de soluto se expresa como masa, volumen o moles y la de solucin como masa o volumen. Algunos ejemplos son aquellos que expresan la concentracin como un porcentaje % masa/masa % masa/volumen % volumen/volumen La graduacin alcohlica de una bebida se expresa en % volumen / volumen, as si tiene 42, contiene 42 ml de alcohol por cada 100 ml de bebida. Otros ejemplos: Si se lee en una etiqueta que una solucin salina es de 4% m/V implica que tiene 4 g de sal en 100 ml de solucin. En otras ocasiones se expresa en g/l lo que indica cuantos gramos de soluto tiene cada litro de solucin. Si se desea preparar una solucin de determinada concentracin debe considerarse en primer lugar cuanto se va a preparar y luego se realizara el clculo para determinar cuanto soluto debedisolverse en ese volumen. Ejemplo: 250 ml de solucin 2 % m/ V, 250 ml x 2g/100 ml = 5 g es la cantidad de soluto necesaria para mantener la concentracin. Cuando se expresa en % m/m generalmente se debe conocer la densidad de la solucin por cuanto lo comn al preparar una solucin es tener como dato la masa o volumen de soluto y el volumen total de solucin. Ejemplo Se disuelven 2 g de un soluto, llevando el volumen final a 500 ml. Cual ser la concentracin expresada en % m/ V y % m/m % m/V = 2 / 500x 100 = 0,4 % m/V
Ahora si se quiere expresar el % m/m, es necesario averiguar cual es la masa de los 500 solucin para lo que se requiere conocer la densidad. Si esta fuera 1,2g/ml, se tendra: 500 ml x 1,2 g/ml =600 g y % m/m = 2 /600 x 100 = 0,33 % m/m
BIBLOGRAFIA
http://www.monografias.com/trabajos14/soluciones/soluciones.shtml#ixzz2t3x9yh 8i http://www.profesorenlinea.cl/Quimica/Disoluciones_quimicas.html http://es.wikipedia.org/wiki/Soluci%C3%B3n http://www.enciclopediadetareas.net/2010/07/componentes-de-una-solucionquimica.html http://www.tiposde.org/ciencias-naturales/115-tipos-de-soluciones/ http://quimicaparatodos.blogcindario.com/2009/07/00019-calculo-de-laconcentracion-de-una-solucion.html En 1800 se invent la pila elctrica, y su usopermiti descubrir aos despus que algunassustancias, como los cidos, las bases y las sales,disueltas en agua, eran capaces de conducir lacorriente elctrica. En 1884, el qumico suecoSvante Arrhenius, inspirado en los experimentos deMichael Faraday, propuso una teora para explicarel comportamiento de estas sustancias en medioacuoso, las que denomin electrolitos. Svante Arrhenius, estudiando el comportamientode algunas sustancias en agua, descubri queestas se disocian completamente, generando ionespositivos y negativos. Esta observacin forma partede su teora de la disociacin electroltica, la cualpropuso respaldado por el siguiente experimento. 1.Prepar una disolucin acuosa de sulfato decobre (II) (CuSO 4) con gelatina. 2.Arm un montaje (celda), constituido por doselectrodos de platino (ctodo y nodo), una pila,una ampolleta y una disolucin de electrolito(sulfato de cobre). 3.Conect el sistema con una pila, produciendoel paso de corriente elctrica dentro de la celda
You might also like
- Filosofía de Diseño - Juan Marcos FinalDocument23 pagesFilosofía de Diseño - Juan Marcos FinalJuan Marcos Bautista HNo ratings yet
- NRF 030 Pemex 2006Document109 pagesNRF 030 Pemex 2006Anibal Lopez100% (7)
- Tema 3 La Hidrosfera Agua Dulce y Agua SaladaDocument2 pagesTema 3 La Hidrosfera Agua Dulce y Agua SaladaJoelVillanuevaNo ratings yet
- Gas HumedoDocument32 pagesGas HumedoLuis OliverosNo ratings yet
- Unidad 5Document26 pagesUnidad 5Blas NoeNo ratings yet
- Presentación MCDocument27 pagesPresentación MCEduardo Figueroa CancinoNo ratings yet
- Catalogo Sensores Atek EsDocument9 pagesCatalogo Sensores Atek EsKaren Julieth Z FNo ratings yet
- Mecanica de Los Fluidos Teoria Unidad 2Document13 pagesMecanica de Los Fluidos Teoria Unidad 2Prueba star SupercellNo ratings yet
- Cuestionario Grupo 5 Humidificación-DeshumidificacionDocument2 pagesCuestionario Grupo 5 Humidificación-Deshumidificacionoscar toapanta100% (1)
- Wa0025Document3 pagesWa0025Nelson MuñozNo ratings yet
- Informelaboatorio Fisicoquimica Carmenza AguileraDocument37 pagesInformelaboatorio Fisicoquimica Carmenza AguileraCARMENZANo ratings yet
- PracticaAula 2 2018-1Document5 pagesPracticaAula 2 2018-1Klenner CamayoNo ratings yet
- Trabajo Servicios y Sistemas Auxiliares MinerosDocument25 pagesTrabajo Servicios y Sistemas Auxiliares MinerosMarco Antonio Hernández RojasNo ratings yet
- Ley de DarcyDocument16 pagesLey de DarcyDiana PadiiNo ratings yet
- Informe-Intercambio IonicoDocument12 pagesInforme-Intercambio IonicoJOSE DAVID MARTINEZ MENCO ESTUDIANTENo ratings yet
- INFOGRAFIADocument1 pageINFOGRAFIAazulceleste42No ratings yet
- 3 en EsDocument57 pages3 en EsMi MiawNo ratings yet
- INFORME N 3-Ley de CharlesDocument9 pagesINFORME N 3-Ley de CharlesJafetSoriaPaimaNo ratings yet
- Equilibrio Con Reacción Química - Parte III - 2021-2SDocument28 pagesEquilibrio Con Reacción Química - Parte III - 2021-2SJose Maria Forero MartinezNo ratings yet
- Trabajo de Word Fibra Optica - OkDocument20 pagesTrabajo de Word Fibra Optica - OkRaul CanchaNo ratings yet
- Multiple RecolectorDocument36 pagesMultiple RecolectorLeón Alberto Gallego CampuzanoNo ratings yet
- Metodo Bleich de CimentacionesDocument100 pagesMetodo Bleich de CimentacionesLuis Alonso OcsaNo ratings yet
- Seminario Sobre SemiconductoresDocument6 pagesSeminario Sobre SemiconductoresGerald Saint Silva UrdanetaNo ratings yet
- SVMB030122 Fi T MiscelaneaDocument28 pagesSVMB030122 Fi T MiscelaneaMargott DyanNo ratings yet
- Experimento 3Document5 pagesExperimento 3Laura Rojas BeltranNo ratings yet
- Símbolos MeteorológicosDocument5 pagesSímbolos MeteorológicosMa AvlisNo ratings yet
- Diseño y Análisis Del ChasisDocument16 pagesDiseño y Análisis Del ChasisAnita DíazNo ratings yet
- PrismaDocument7 pagesPrismaLorenzo MontzonNo ratings yet
- El AguaDocument2 pagesEl AguaIsabella Pillon GhiglioneNo ratings yet
- Taller Cinemática Grados 10ABCDEFDocument5 pagesTaller Cinemática Grados 10ABCDEFAlbert HerreraNo ratings yet