Professional Documents
Culture Documents
Estructura de La Materia
Uploaded by
Cristian ArámbulaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Estructura de La Materia
Uploaded by
Cristian ArámbulaCopyright:
Available Formats
Estructura de la materia
La materia consiste de partculas extremadamente pequeas agrupadas juntas para formar el tomo. Hay 92 ocurrencias naturales de estas agrupaciones de partculas llamadas elementos. Estos elementos fueron agrupados en la tabla peridica de los elementos en secuencia de acuerdo a sus nmeros atmicos y peso atmico. Hay adems 14 elementos hechos por el hombre que no ocurren en la naturaleza, por lo que al final son unos 106 elementos conocidos hasta la fecha. Estos elementos no pueden cambiarse por procesos qumicos. Ellos solo pueden ser cambiados por reaccin nuclear o atmica, sin embargo pueden ser combinados para producir el incontable nmero de compuestos con los que tropezamos da a da.
Modelo atmico de John Dalton
Varios tomos y molculas representados en A New System of Chemical Philosophy (1808) de John Dalton.
El modelo atmico de Dalton, surgido en el contexto de la qumica, fue el primer modelo atmico con bases cientficas, fue formulado en 1808 por John Dalton.
450 a.c. - Modelo atmico de Demcrito.
El desarrollo filosfico de Demcrito postulaba la imposibilidad de la divisin infinita de la materia y la consecuente necesidad de la existencia de una unidad mnima, de la cual estaran compuestas todas las sustancias. Interesante el que se haya pensado durante 2.500 aos que Demcrito pudiera haber acertado plenamente; la verdad es que lo pareca, pero ahora uno de los postulados o principios ms importantes de la Mecnica Global es precisamente lo contrario. En el modelo actual de la Teora de la Equivalencia Global todas las sustancias forman parte de una nica partcula llamada Globus, constituida por una red tridimensional reticular irrompible que se extiende por todo el universo.
1808 - Modelo atmico de Dalton. La evolucin del modelo de Dalton apuntaba ya al tomo moderno pero como una sola partcula; si bien al principio no estaba muy claro si el modelo atmico de Dalton sera un tomo o una molcula.
1897 - Modelo atmico de Thompson. El siguiente paso importante en la historia del tomo actual lo aade la teora atmica de Thomson con la divisin del tomo entre cargas positivas y negativas, tipo pastel de frutas o sopa de ajo, con fuerzas de atraccin elctricas.
1911 - Modelo atmico de Rutherford. El modelo de Rutherford separa el ncleo con carga positiva de los electrones con carga negativa. Los electrones estaran en rbitas circulares o elpticas alrededor del ncleo. El neutrn se aadi al modelo de Rutherford en 1920 de forma terica y fue descubierto experimentalmente en 1932. El modelo de Rutherford es la imagen visual que todos tenemos del tomo moderno, pero tena dos problemas:
o
Contradeca las leyes de Maxwell del electromagnetismo por las que las partculas cargadas en movimiento deberan emitir fotones continuamente. Por ello los electrones deberan perder energa y caer al ncleo del tomo. La teora atmica de Rutherford no explicaba los espectros atmicos.
Modelo atmico de Rutherford
1913 - Modelo atmico de Bohr.
La teora atmica de Bohr introduce mejoras sustanciales al modelo de Rutherford al incorporar aspectos energticos derivados de la energa de Planck y del efecto fotoelctrico de Einstein. Aunque una descripcin detallada del modelo de Bohr es compleja, las siguientes caractersticas son relevantes en relacin al modelo que va a introducir la Mecnica Global:
o
Los electrones se sitan en rbitas circulares estables; es decir, donde no emiten energa y no todas estn permitidas.
Las rbitas permitidas de los electrones del modelo atmico de Bohr tienen un momento angular que es un mltiplo exacto de hbar (constante de Planck dividido por 2) Los electrones emiten o absorben un fotn al cambiar de rbitas atmicas, cuya energa coincide con la diferencia de energa de las rbitas y no necesitan pasar por estados intermedios. En el tomo de Bohr, las rbitas de los electrones siguen las reglas de la Mecnica Clsica pero no as los cambios de rbita.
Al margen del gran acierto de este modelo en muchos aspectos, el problema del modelo de Bohr y de toda la Mecnica Cuntica es que se van aadiendo supuestos a lo largo de la historia, pero sin explicar las razones que los justifican, nicamente que funcionan y explican mejor la realidad; lo cual, no estando nada mal, no ayuda mucho a la comprensin de la realidad si se apoyan en principios fsicos despistantes. Para variar, podran haber intentado una explicacin plausible.
Modelo de Bohr
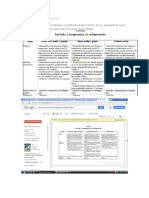
Modelo atmico La imagen del tomo expuesta por Durante el s.XVIII y principios del XIX Dalton en su teora atmica, para algunos cientficos haban explicar estas leyes, es la de minsculas investigado distintos aspectos de las partculas esfricas, indivisibles e reacciones qumicas, obteniendo las 1808 inmutables, llamadas leyes clsicas de la Iguales entre s en Qumica. cada elemento qumico. John Dalton De este descubrimiento dedujo que el Demostr que dentro de los tomos tomo deba de ser una esfera de hay unas partculas diminutas, con materia cargada positivamente, en cuyo carga elctrica negativa, a las que se interior estaban incrustados los llam electrones. 1897 electrones. (Modelo atmico de Thomson.) J.J. Thomson Demostr que los tomos no eran macizos, como se crea, sino que estn vacos en su mayor parte y en su centro hay un diminuto ncleo. Dedujo que el tomo deba estar formado por una corteza con los electrones girando alrededor de un ncleo central cargado positivamente. (Modelo atmico de Rutherford.)
Ao
Cientfico
Descubrimientos experimentales
1911
E. Rutherford Espectros atmicos discontinuos originados por la radiacin emitida por los tomos excitados de los elementos en estado gaseoso. Propuso un nuevo modelo atmico, segn el cual los electrones giran alrededor del ncleo en unos niveles bien definidos. (Modelo atmico de Bohr.)
1913
Niels Bohr
You might also like
- Condiciones de AlmacenamientoDocument3 pagesCondiciones de AlmacenamientoCristian ArámbulaNo ratings yet
- Tecno de Ferment. Expo VinosDocument3 pagesTecno de Ferment. Expo VinosCristian ArámbulaNo ratings yet
- MempanDocument414 pagesMempanJ J Carlos SalazarNo ratings yet
- Trigo 2011Document11 pagesTrigo 2011FranklynElardNo ratings yet
- Guia Manual Tecnico DistribuidoDocument13 pagesGuia Manual Tecnico DistribuidoLilian Martínez100% (1)
- Lista de Aditivos PermitidosDocument3 pagesLista de Aditivos PermitidosCristian ArámbulaNo ratings yet
- Serie 16 - Ley de Enfriamiento y Mezclado de TanquesDocument4 pagesSerie 16 - Ley de Enfriamiento y Mezclado de TanquesÁngelJaffetLeónTorresNo ratings yet
- Apa El Mercado en Los AnimalesDocument2 pagesApa El Mercado en Los AnimalesCristian ArámbulaNo ratings yet
- Capítulo 2 Fuerza IonicaDocument20 pagesCapítulo 2 Fuerza IonicaClaudia LujanNo ratings yet
- Prioridad de Grupos FuncionalesDocument1 pagePrioridad de Grupos FuncionalesCristian ArámbulaNo ratings yet
- Comercio Ilegal de AnimalesDocument7 pagesComercio Ilegal de AnimalesShokubutsu AmeNo ratings yet
- CalaveraDocument1 pageCalaveraCristian ArámbulaNo ratings yet
- CarbohidratosDocument14 pagesCarbohidratosMau JimenezNo ratings yet
- Granados Sanchez Sergio AugustoDocument3 pagesGranados Sanchez Sergio AugustoCristian ArámbulaNo ratings yet
- Producto Ind Enlace QuímicoDocument1 pageProducto Ind Enlace QuímicoCristian ArámbulaNo ratings yet
- Ley Gauss Ejer ResueltosDocument21 pagesLey Gauss Ejer ResueltosTazann24No ratings yet
- MezclasDocument45 pagesMezclasCristian Brinez100% (2)
- 8.-La Celula Como Unidad Fundamental de La Vida Bio 1Document40 pages8.-La Celula Como Unidad Fundamental de La Vida Bio 1Cristian ArámbulaNo ratings yet
- Acta InspeccionDocument31 pagesActa InspeccionCristian Arámbula100% (1)
- Apelacion de Auto Se ContinuaDocument2 pagesApelacion de Auto Se ContinuaCristian ArámbulaNo ratings yet
- Como Pasar Musica de La Computadora PC Al Iphone Ipod 4952 NDQXMNDocument2 pagesComo Pasar Musica de La Computadora PC Al Iphone Ipod 4952 NDQXMNCristian ArámbulaNo ratings yet
- Práctica 10. Descomposición Del Peróxido de HidrógenoDocument4 pagesPráctica 10. Descomposición Del Peróxido de HidrógenoCristian ArámbulaNo ratings yet
- Croquis FQ PDFDocument12 pagesCroquis FQ PDFAbiCorreaNo ratings yet
- Exposicion de Historia VietnamDocument17 pagesExposicion de Historia VietnamCristian ArámbulaNo ratings yet
- PL2 Dureza Del AguaDocument2 pagesPL2 Dureza Del AguaCristian ArámbulaNo ratings yet
- Práctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFDocument4 pagesPráctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFCristian ArámbulaNo ratings yet
- Historia de La DifteriaDocument1 pageHistoria de La DifteriaCristian ArámbulaNo ratings yet
- BITACORADocument1 pageBITACORACristian ArámbulaNo ratings yet
- ANTOLOGIADocument3 pagesANTOLOGIACristian ArámbulaNo ratings yet
- Diagramas de Composicion Liquido VaporDocument1 pageDiagramas de Composicion Liquido VaporCristian ArámbulaNo ratings yet
- Intercambiadores de Calor 1Document35 pagesIntercambiadores de Calor 1VanessaVG100% (1)
- Simulador TintayaDocument96 pagesSimulador TintayaFALCKOR100% (1)
- Cap16 Diseño Por Fuerza CortanteDocument62 pagesCap16 Diseño Por Fuerza CortanteSthefanny Reyes GomezNo ratings yet
- NTC 2050 y RETIEDocument4 pagesNTC 2050 y RETIEHugo HurtadoNo ratings yet
- 0 3264 1Document357 pages0 3264 1Heather AdamsNo ratings yet
- Contracción Plástica Por SecadoDocument34 pagesContracción Plástica Por SecadoJaime ALvites BarraganNo ratings yet
- Sistemas EolicosDocument28 pagesSistemas Eolicossantigo9100% (1)
- Tarea Molycop Modelo Plitt y RaoDocument8 pagesTarea Molycop Modelo Plitt y RaomichaelNo ratings yet
- Clase 3Document24 pagesClase 3MariaNo ratings yet
- Ejercitario 12.2Document4 pagesEjercitario 12.2MONSERRATH PereiraNo ratings yet
- Actividad #14 - Conclusiones de La Diagrama de Fuerza Cortante - LLTRDocument3 pagesActividad #14 - Conclusiones de La Diagrama de Fuerza Cortante - LLTRRomel Lliuya0% (2)
- Preguntas de Repaso, Ejercicios Corriente Eléctrica Capítulo 23 Física Conceptual Décima EdiciónDocument62 pagesPreguntas de Repaso, Ejercicios Corriente Eléctrica Capítulo 23 Física Conceptual Décima EdiciónJorgeEnriqueMedinaRiveros50% (4)
- Condiciones de Equilibrio y EspontaneidadDocument8 pagesCondiciones de Equilibrio y EspontaneidadlilisacasNo ratings yet
- Fase 1 - Conocimientos PreviosDocument6 pagesFase 1 - Conocimientos PreviosLedherzon ContrerasNo ratings yet
- Monografia en FisicaDocument6 pagesMonografia en FisicaDickNo ratings yet
- Produccion de Acido Nitrico A Partir de AmoniacoDocument27 pagesProduccion de Acido Nitrico A Partir de AmoniacoLuis Alberto Flores Rioja67% (3)
- Guía Trabajos Prácticos Termodinámica y Máquinas TérmicasDocument45 pagesGuía Trabajos Prácticos Termodinámica y Máquinas TérmicasGustavo FerreyraNo ratings yet
- Taller #2 G2 (Alpala, Cedeño, Garcia, Moyano, Santana)Document38 pagesTaller #2 G2 (Alpala, Cedeño, Garcia, Moyano, Santana)Narci CedeñoNo ratings yet
- Equipos para La Mineria SubterraneaDocument17 pagesEquipos para La Mineria SubterraneaFabricio Agüero Marcelo100% (1)
- Memoria Estribo Pte ChakimayuDocument9 pagesMemoria Estribo Pte ChakimayuJorge lopezNo ratings yet
- Monografia RMR y Q de BartonDocument47 pagesMonografia RMR y Q de BartonEtelvino Chavez HuanshaNo ratings yet
- Calderas HumotubularDocument4 pagesCalderas HumotubularMaximo Miranda VeraNo ratings yet
- Cambio de Seccion LaboDocument29 pagesCambio de Seccion LaboPicón Gamarra Alex JuniorNo ratings yet
- Historia de Los Metodos NumericosDocument5 pagesHistoria de Los Metodos NumericosOscar MondragónNo ratings yet
- 7 Leyes Hermes TrimegistoDocument12 pages7 Leyes Hermes TrimegistodiegoNo ratings yet
- Discusion OsmosisDocument3 pagesDiscusion OsmosisDana JimenezNo ratings yet
- Subestacion RosarioDocument8 pagesSubestacion RosarioJoel MontalvanNo ratings yet
- 2 CalorimetriaDocument4 pages2 Calorimetriarocio salome chura alarconNo ratings yet
- 12Document18 pages12LucíaNo ratings yet
- Tesis ModeloDocument86 pagesTesis ModeloabelNo ratings yet