Professional Documents
Culture Documents
4.1.4 (2) - Conceptos Ácido-Base-2 PDF
Uploaded by
Mateo ValenciaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
4.1.4 (2) - Conceptos Ácido-Base-2 PDF
Uploaded by
Mateo ValenciaCopyright:
Available Formats
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
1
Conceptos Acido-Base (2)
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
2
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 333.
Medida de la fortaleza Acido-Base
Conceptos No Prticos de las Reacciones Acido-Base
Concepto de Lux
BaO + H
2
O Ba(OH)
2
(aq)
CO
2
+ H
2
O H
2
CO
3
(aq)
BaCO
3
(s) + H
2
O
Base
Acido
BaO + CO
2
BaCO
3
Base
dador
Acido
aceptor
Se conocen otros muchos ejemplos de reacciones directas entre xidos bsicos y xidos cidos en
ausencia de disolvente, y por lo tanto en ausencia de protones.
3 Na
2
O + P
2
O
5
2 Na
3
PO
4
CaO + SiO
2
CaSiO
3
(siderurgia)
(termitas)
La definicin de Bronsted
Acido, cede protones
no es aplicable en estos casos
Base, capta protones
AH A
+ H
+
Acido Base
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
3
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 333.
Medida de la fortaleza Acido-Base
Conceptos No Prticos de las Reacciones Acido-Base
Concepto de Lux
B O
2
+ A
Base Acido
Acido:es un aceptor de grupos xido
Base:es un dador de grupos xido
Concepto particularmente aplicable a la qumica a alta temperatura, tal como la cermica y la
metalurgia. Algunas menas pueden ser disueltas en Na
2
S
2
O
7
para extraer el mineral:
TiO
2
+ Na
2
S
2
O
7
Na
2
SO
4
+ (TiO)SO
4
Base Acido
Anlogamente a otras definiciones cido-base, podemos tener xidos anfteros:
ZnO + S
2
O
7
2
Zn
2+
+ 2 SO
4
2
Base Acido
ZnO + Na
2
O 2 Na
+
+ ZnO
2
2
Acido Base
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
4
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 333.
Medida de la fortaleza Acido-Base
Conceptos No Prticos de las Reacciones Acido-Base
Concepto de Lux
Este esquema de transferencia de iones xido de Lux, puede ser ampliado para cualquier otro
proceso que implique la transferencia de un anin
B X
n
+ A
Base Acido
Base: Acido:
dador de aniones aceptor de aniones
3 NaF + AlF
3
3 Na
+
+ AlF
6
3
F
Na
2
S + CS
2
2 Na
+
+ CS
3
2
S
2
NaEt + Et
2
Zn Na
+
+ ZnEt
3
Et
NaH + AlH
3
Na
+
+ AlF
4
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
5
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 334.
Medida de la fortaleza Acido-Base
Conceptos No Prticos de las Reacciones Acido-Base
Acidos y Bases de Lewis
En 1938 Lewis propuso la siguiente definicin operacional de cidos y bases, en trminos de las
reacciones que pueden experimentar:
Neutralizacin: Los cidos y bases reaccionan rpidamente para neutralizarse entre s.
Desplazamiento: Un cido fuerte desplaza a uno dbil de sus compuestos.
Una base fuerte desplaza a una dbil de sus compuestos.
Valoracin: Puede utilizarse un indicador para determinar el punto final de la neutralizacin.
Catlisis: Los cidos (y las bases) pueden catalizar muchas reacciones.
Estas propiedades ya haban sido ampliamente asociados con reacciones cido-base prticas.
Lewis seal que compuestos No prticos pueden exhibir propiedades cido-base, tales como SO
3
(ac), SnCl
4
(ac), AlCl
3
(ac) y BF
3
(ac), entre otros.
Acidos: Disponen de un orbital vaco que puede aceptar un par electrnico para formar un enlace
covalente.
Base: Disponen de un par electrnico no compartido, par solitario.
Lewis extiende su concepto cido-base a compuestos no inicos, centrando su atencin en la fuerza
del nuevo enlace covalente formado
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
6
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 334.
Medida de la fortaleza Acido-Base
Conceptos No Prticos de las Reacciones Acido-Base
Acidos y Bases de Lewis Fuerza de los cidos y bases de Lewis
Acidos: puede aceptar un par electrnico ...
BF
3
BCl
3
BBr
3
BI
3
Conforme aumenta la electronegatividad de los sustituyentes,
retiran densidad electrnica del tomo central,
aumenta su avidez por capturar electrones,
aumenta la acidez del cido de Lewis
Base: puede compartir (ceder) un par electrnico ...
:NF
3
:NH
3
Conforme aumenta la electronegatividad de los sustituyentes,
retiran densidad electrnica del tomo central,
retiene con ms fuerza a su par solitario, no lo comparte
disminuye la basicidad de la base de Lewis
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
7
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Acidos y Bases de Pearson Duros y blandos
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 344.
Acidos Duros AD Cationes muy pequeos y muy cargados.
Cationes fuertemente polarizantes r
+
+, q
+
|
H
+
, Alcalinos, alcalinotrreos, Elementos de transicin ligeros
en altos estados de oxidacin (Ti
4+
, Cr
3+
, Fe
3+
, Co
3+
)
Acidos Blandos AB Cationes grandes o con poca carga.
Cationes poco polarizantes r
+
|, q
+
+
Elementos de transicin ms pesados o en bajo estado de
oxidacin (Ag
+
, Cu
2
2+
, Hg
2
2+
, Hg
2+
, Pd
2+
, Pt
2+
)
Bases Duras BD Aniones muy pequeos o con poca carga.
Aniones poco polarizables r
+, q
+
OH
, haluros, que atraen fuertemente sus electrones
Bases Blandas BB Aniones grandes y muy cargados.
Aniones fuertemente polarizables r
|, q
|
Sujetan poco a sus electrones (I
, S
2
, H
)
El duro con el duro pequeos poco deformables Interaccin electrosttica
El blando con el blando grandes polarizacin Interaccin covalente
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
8
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Acidos y Bases de Pearson Clasificacin como duros o blandos
Referencia como AD H
+
AB CH
3
Hg
+
(BH)
+
+ CH
3
Hg
+
(CH
3
HgB)
+
+ H
+
K
eq
K
eq
|, desplazado a la derecha, B prefiere unirse al AB, B es una BB
K
eq
+, desplazado a la izquierda, B prefiere unirse al AD, B es una BD
El orden de K
eq
coincide con el orden de dureza blandura
K
eq
mayor, base ms blanda
K
eq
menor, base ms dura
Conceptos cido-base, duro-blanco, son conceptos relativos
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 344.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
9
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Acidos y Bases de Pearson Clasificacin como duros o blandos
Fig - 126
Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3
Ed., John Wiley & Sons, 1994, pp 342.
Li
+
, Na
+
, K
+
, son cidos duros
Na
+
es ms duro que K
+
, pero ms blando que Li
+
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 344.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
10
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Acidos y Bases de Pearson Clasificacin como duros o blandos
Fig - 127
Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of
Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 347.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 344.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
11
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Fuerza de los sistemas cido-base y su relacin con la dureza-blandura
Duro-blando, alude a la especial estabilidad de las interacciones duro-duro y blando-blando, que
debe distinguirse claramente de la fuerza inherente del sistema cido o base.
OH
y F
son dos bases duras, OH
es unas 10
13
veces ms bsico que F
(ref H
+
/MeHg
+
).
SO
3
2
y Et
3
P son dos bases blandas, Et
3
P es unas 10
7
veces ms fuerte que SO
3
2
(ref H
+
/MeHg
+
).
Un cido o base fuerte puede desplazar a otro ms dbil, aunque esto aparentemente viole el
principio de dureza-blandura.
SO
3
2
+ HF HSO
3
+ F
K
eq
= 10
4
Base
fuerte
Acido
fuerte
Acido
dbil
Base
dbil
BB AD-BD AD-BB BD
SO
3
2
(base ms fuerte) desplaza al F
(base ms dbil), a partir de un cido duro H
+
OH
(base muy fuerte) desplaza al SO
3
2
(base ms dbil), a partir de un cido blando MeHg
+
OH
+ CH
3
HgSO
3
CH
3
HgOH + SO
3
2
K
eq
= 10
BD AB-BB AB-BD BB
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 346.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
12
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Fuerza de los sistemas cido-base y su relacin con la dureza-blandura
Duro-blando, alude a la especial estabilidad de las interacciones duro-duro y blando-blando, que
debe distinguirse claramente de la fuerza inherente del sistema cido o base.
OH
y F
son dos bases duras, OH
es unas 10
13
veces ms bsico que F
(ref H
+
/MeHg
+
).
SO
3
2
y Et
3
P son dos bases blandas, Et
3
P es unas 10
7
veces ms fuerte que SO
3
2
(ref H
+
/MeHg
+
).
Un cido o base fuerte puede desplazar a otro ms dbil, aunque esto aparentemente viole el
principio de dureza-blandura.
En ambos casos, la fuerza de las bases (SO
3
2
> F
) (OH
> SO
3
2
) son lo suficientemente
grandes como para forzar a estas reacciones hacia la derecha.
Slo aparentemente, puesto que si se encuentra una situacin competitiva, se aplica la regla
duro-blando.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 346.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
13
SO
3
2
+ HF HSO
3
+ F
K
eq
= 10
4
Base
fuerte
Acido
fuerte
Acido
dbil
Base
dbil
BB AD-BD AD-BB BD
SO
3
2
(base ms fuerte) desplaza al F
(base ms dbil), a partir de un cido duro H
+
OH
(base muy fuerte) desplaza al SO
3
2
(base ms dbil), a partir de un cido blando MeHg
+
OH
+ CH
3
HgSO
3
CH
3
HgOH + SO
3
2
K
eq
= 10
BD AB-BB AB-BD BB
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Fuerza de los sistemas cido-base y su relacin con la dureza-blandura
AB-BD AD-BB AB-BB AD-BD
K
eq
10
3
CH
3
HgF + HSO
3
CH
3
HgSO
3
+ HF
K
eq
> 10
7
CH
3
HgOH + HSO
3
CH
3
HgSO
3
+ HOH
AB-BD AD-BB AB-BB AD-BD
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 346.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
14
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Simbiosis La dureza o blandura de un sitio cido o bsico no es algo inherente al tomo particular,
sino que puede ser influido decisivamente por los sustituyentes que soporta.
La adicin de sustituyentes blandos y polarizables, ablanda un sitio que era duro, y
La adicin de sustituyentes electrn-atractores (fuertemente electronegativos), endurece el sitio.
* El tomo cido de boro, B
3+
, es intermedio entre duro y bando.
Con sustituyentes duros como F
(BD), obtenemos el BF
3
un cido de Lewis duro.
Con sustituyentes blandos como H
(BB), obtenemos el BH
3
un cido de Lewis blando.
* El cido duro prefiere incorporar un 4 ligando duro, y el cido blando lo prefiere blando.
BF
3
+ F
BF
4
B
2
H
6
+ 2 H
2 BH
4
AD + BD AB + BB
* En una reaccin de competencia, duro con duro y blando con blando
BF
3
H
+ BH
3
F
BF
4
+ BH
4
Los metanos isoelectrnicos fluorizados se comportan de modo similar
CF
3
H + CH
3
F CF
4
+ CH
4
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 348.
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
15
Conceptos No Prticos de las Reacciones Acido-Base
Medida de la fortaleza Acido-Base
Acidos y bases de Pearson Bases tericas de la dureza y la blandura
De modo relativamente sencillo
Interacciones Acido blando base blanda son bsicamente de tipo covalente
(Ag
+
, Hg
2+
) (Cl
, I
)
Acidos blandos, cationes de transicin que NO tienen configuracin de
Gas Noble, luego son ms polarizantes, muy en particular los cationes
con configuracin d
10
.
Bases blandas, fuertemente polarizables, unidas a cidos polarizantes.
Una mayor polarizacin apoya la existencia de una interaccin
covalente.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 350.
Interacciones Acido duro base dura son bsicamente de tipo electrosttico, inico.
(Li
+
, Na
+
, K
+
) (F
, OH
)
Cuanto ms pequeos sean los iones (ms duros)
Mayor ser la fuerza de interaccin
El duro con el duro
U
r
=
Z
+
Z
r
+
+ r
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
16
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
En 1965 Drago y Wayland introducen una ecuacin emprica de 4 parmetros para describir la
energa que acompaa a la reaccin entre cidos y bases dbiles y neutros (sin carga) en disolventes
poco solvatantes o en fase gaseosa.
A + B A-B
En el caso de una reaccin de intercambio entre dos aductos cido base
La ecuacin adopta la forma
AH = AE
A
AE
B
+ AC
A
AC
B
A
1
B
1
+ A
2
B
2
A
1
B
2
+ A
2
B
1
AH = E
A
E
B
+ C
A
C
B
E
A
, C
A
Son los parmetros del cido, que arbitrariamente toman para el I
2
los valores
E
A
= 0,50 y C
A
= 2
E
B
, C
B
Son los parmetros de la base
E
A
, E
B
Reflejan la parte electrosttica de la interaccin cido-base
C
A
, C
B
Reflejan la parte covalente de la interaccin cido-base
Fig - 128 y 129
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
17
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of
Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 345.
Fig - 129
Estos datos pueden utilizarse para seleccionar
disolventes que tengan aproximadamente el
mismo grado de interaccin cido-base que los
solutos comparando los parmetros E y C.
E C
Amina 1 MeNH
2
2,16 3,12
Amina 2 Me
2
NH 1,80 4,21
Amina 3 Me
3
N 1,21 5,61
Piridina 1,78 3,54
La Piridina tendra un comportamiento
intermedio entre una amina 1 y una
amina 2
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
18
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
Una modificacin de la ecuacin de Drago-Wayland incluye el trmino W = R
A
T
B
, que
habitualmente toma valor 0 para cidos y bases neutros, pero que cobra importancia en el caso de
cidos catinicos y/o bases aninicas.
AH = E
A
E
B
+ C
A
C
B
+ R
A
T
B
E
A
, C
A
Son los parmetros del cido, que arbitrariamente toman para el I
2
los valores
E
A
= 0.50 y C
A
= 2.00
E
B
, C
B
Son los parmetros de la base
E
A
, E
B
Reflejan la parte electrosttica de la interaccin cido-base
C
A
, C
B
Reflejan la parte covalente de la interaccin cido-base
R
A
Trmino para el cido como aceptor
T
B
Trmino para la base como transmisor / donador
Fig - 128 y 129
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
19
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of
Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 345.
Fig - 129
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
20
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of
Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 337.
Fig - 128
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
21
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
AH = E
A
E
B
+ C
A
C
B
+ R
A
T
B
Calcular la entalpa de formacin del aducto para la
combinacin del H
+
con H
2
O y formas las sucesivas
H(H
2
O)
n
+
(n = 1, 2, 3, 4)
H
+
+ H
2
O H
3
O
+
AH = 159.89 kCal/mol
AH = 45.00E
B
+ 13.03C
B
+ 130.21T
B
?
AH = 45.002.28 + 13.030.10 + 130.210.43
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
22
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
AH = E
A
E
B
+ C
A
C
B
+ R
A
T
B
Calcular la entalpa de formacin del aducto para la
combinacin del H
+
con H
2
O y formas las sucesivas
H(H
2
O)
n
+
(n = 1, 2, 3, 4)
H
+
+ H
2
O H
3
O
+
AH = 159.89 kCal/mol
H(H
2
O)
+
+ H
2
O H(H
2
O)
2
+
AH = 39.65 kCal/mol
H(H
2
O)
2
+
+ H
2
O H(H
2
O)
3
+
AH = 29.74 kCal/mol
H(H
2
O)
3
+
+ H
2
O H(H
2
O)
4
+
AH = 27.03 kCal/mol
Profesor: Rafael Aguado Bernal
QUIMICA GENERAL I
Qumica Inorgnica
Tema 4: Conceptos bsicos de reactividad qumica
4.1.- Conceptos Acido-Base
23
Ecuacin de Drago-Wayland
Medida de la fortaleza Acido-Base
* Douglas, B.; McDaniel, D.; Alexander, J., Concepts and Models of Inorganic Chemistry, 3 Ed., John Wiley & Sons, 1994, pp 343.
* Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4 Ed., Harper Collins, 1993, pp 336.
AH = E
A
E
B
+ C
A
C
B
+ R
A
T
B
Calcular la entalpa de formacin del aducto para la
combinacin del H
+
con H
2
O y formas las sucesivas
H(H
2
O)
n
+
(n = 1, 2, 3, 4)
H
+
+ NH
3
NH
4
+
AH = 203.45 kCal/mol
H
3
O
+
+ NH
3
NH
4
+
+ H
2
O
AH = 57.95 kCal/mol
HCl + NH
3
NH
4
+
+ Cl
AH = 10.34 kCal/mol
Preguntad ! ! !
Para casa
Vosotros hacis los clculos para
los siguientes sistemas
Y si surge alguna duda
You might also like
- Informe 2 - Analisis Bromatologico OriginalDocument14 pagesInforme 2 - Analisis Bromatologico OriginalMateo Valencia100% (1)
- Exposicion FarmacosDocument24 pagesExposicion FarmacosMateo ValenciaNo ratings yet
- Solubilidad en Agua para Los ÓxidosDocument2 pagesSolubilidad en Agua para Los ÓxidosMateo ValenciaNo ratings yet
- Carga Nuclear EfectivaDocument2 pagesCarga Nuclear EfectivaMateo ValenciaNo ratings yet
- Marco TéoricoDocument3 pagesMarco TéoricoMateo ValenciaNo ratings yet
- Condensación de Knoevenagel JennyDocument8 pagesCondensación de Knoevenagel JennyMateo ValenciaNo ratings yet
- PRACTICA 7 Sintesis 2-FenilindolDocument14 pagesPRACTICA 7 Sintesis 2-FenilindolMateo Valencia78% (9)
- Practica 6 Preparacion de La AspirinaDocument9 pagesPractica 6 Preparacion de La AspirinaMateo ValenciaNo ratings yet
- El Aldeano de Paris - Louis AragonDocument167 pagesEl Aldeano de Paris - Louis Aragonelapestoso100% (1)
- Maternidades Y Paternidades en Adolescentes Escolarizados/As: Facilitadores Y Obstáculos en Sus Trayectorias EducativasDocument5 pagesMaternidades Y Paternidades en Adolescentes Escolarizados/As: Facilitadores Y Obstáculos en Sus Trayectorias EducativasMatias CartochioNo ratings yet
- Simetria en Figuras Guia #26 2Document2 pagesSimetria en Figuras Guia #26 2Slendy Arévalo100% (2)
- Arbol ACHSDocument3 pagesArbol ACHSjaviera paz parra henríquez88% (8)
- Historia de España EVAUDocument33 pagesHistoria de España EVAUirina MMNo ratings yet
- Actividades Celebracion de La Semana de La Educacion TecnicaDocument2 pagesActividades Celebracion de La Semana de La Educacion TecnicaJoAn MeCaNo ratings yet
- Formato Evidencia Itaewon ClassDocument1 pageFormato Evidencia Itaewon ClassLorena GarzónNo ratings yet
- Las Fuentes de La Teología CuestionarioDocument10 pagesLas Fuentes de La Teología CuestionarioFrancisco FJNo ratings yet
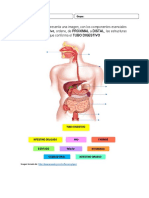
- Ficha Interactiva Anatomia Digestivo..Document4 pagesFicha Interactiva Anatomia Digestivo..Johanna Sofia Londoño ValenciaNo ratings yet
- Analisis Economico Tarea6Document11 pagesAnalisis Economico Tarea6ERICK REVOLORIONo ratings yet
- Pauta de Guía de Ejercicios Ingeniería Económica 2014 (I)Document11 pagesPauta de Guía de Ejercicios Ingeniería Económica 2014 (I)MarkTweinNo ratings yet
- El Secreto OscuroDocument14 pagesEl Secreto OscuroGiulianna DíazNo ratings yet
- Derecho MercantilDocument5 pagesDerecho MercantilSofiaFloresNo ratings yet
- Empalmes TangentesDocument7 pagesEmpalmes TangentesGrace JujuyNo ratings yet
- IMSS-Seguridad Paciente CONAMEDDocument32 pagesIMSS-Seguridad Paciente CONAMEDEduardo Salas100% (1)
- Tarea DecimoDocument7 pagesTarea DecimoKaren YaimaNo ratings yet
- Lynn Hagen - Lobos Desire 3 - Malos HábitosDocument103 pagesLynn Hagen - Lobos Desire 3 - Malos Hábitossheyla lima gutierrezNo ratings yet
- Tarea 4 - NorbeyChaparroDocument7 pagesTarea 4 - NorbeyChaparroNorbey Sebastian Chaparro MezaNo ratings yet
- Complejo de Montículos y Recintos Geométricos de La Tradición Taquara - Itararé, Provincia de Misiones, Argentina - PDFDocument30 pagesComplejo de Montículos y Recintos Geométricos de La Tradición Taquara - Itararé, Provincia de Misiones, Argentina - PDFzilar kaiNo ratings yet
- Kínder - Cuentos InfantilesDocument2 pagesKínder - Cuentos InfantilesletyNo ratings yet
- Examen Final - Semana 8 - INV - SEGUNDO BLOQUE-RESPONSABILIDAD SOCIAL EMPRESARIAL - (GRUPO1) PDFDocument19 pagesExamen Final - Semana 8 - INV - SEGUNDO BLOQUE-RESPONSABILIDAD SOCIAL EMPRESARIAL - (GRUPO1) PDFPaola Gutierrez100% (1)
- La Isla Del CorderoDocument1 pageLa Isla Del CorderoFrancis Guzman100% (1)
- Planilla Evaluaciones2010 Fisica3Document9 pagesPlanilla Evaluaciones2010 Fisica3Carolina FigueroaNo ratings yet
- División Con Números Decimales para Cuarto Grado de PrimariaDocument9 pagesDivisión Con Números Decimales para Cuarto Grado de PrimariaKarla Rodriguez VargasNo ratings yet
- Clase 3 Parte IiDocument16 pagesClase 3 Parte IiDanielaNo ratings yet
- Bruno MunariDocument10 pagesBruno MunariLuis BlancoNo ratings yet
- ANTIVALORESDocument6 pagesANTIVALORESAlbertoSanchezNo ratings yet
- Prueba Prohibida y Prueba IlícitaDocument12 pagesPrueba Prohibida y Prueba Ilícitarevisa1960No ratings yet
- 2.2. Modelos y Herrramientas para La Formulacion de EstrateiasDocument7 pages2.2. Modelos y Herrramientas para La Formulacion de EstrateiasKitty GR100% (1)
- Biodisel Por AceiteDocument111 pagesBiodisel Por AceiteLuis Leonardo Llanos EscobarNo ratings yet