Professional Documents
Culture Documents
Map A Conceptual
Uploaded by
Tijerina KarenOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Map A Conceptual
Uploaded by
Tijerina KarenCopyright:
Available Formats
Mapa Conceptual
Nombre: Karen Alejandra Tijerina Medrano Leobardo Gracia Moreno Karla Zamudio Ramos Alan Garza Garza Nombre del curso: Termodinamica Mdulo: 18 .Propiedades Termicas de la Materia Fecha: 25-marzo-2014 Bibliografa: Fsica Universitaria, Freedman
Matrcula: Nombre del profesor: Roberto Castillo Actividad: 2. Rubricas Resumen Profesional.
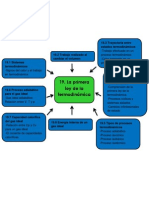
PROPIEDADES TERMICAS DE LA MATERIA
ECUACIONES DE ESTADO
PROPIEDADES MOLARES DE LA MATERIA
MODELO CINETICO DE UN GAS IDEAL
CAPACIDADES CALORIFICAS
RAPIDEZ MOLECULAR
FASES DE LA MATERIA
La presin p, el volumen V y la temperatura absoluta T de una cantidad dada de una sustancia se llaman variables de estado y estn relacionadas por una ecuacin de estado. Esa relacin implica nicamente estados de equilibrio, con p y T uniformes en todo el sistema. La ecuacin de estado del gas ideal relaciona p, V, T y el nmero de moles n a travs de una constante R que es la misma para todos los gases. Una grca pV presenta una serie de curvas, llamadas isotermas, que muestran la presin en funcin del volumen, cada una a cierta temperatura constante.
La masa molar M de una sustancia pura es la masa por mol. La masa total mtotal de una cantidad de sustancia es igual a M multiplicada por el nmero de moles n. El nmero de Avogadro NA es el nmero de molculas que hay en un mol. La masa m de una molcula individual es M dividida entre NA.
mtotal = nM
pV = nRT
M= MAN
En un gas ideal, la energa cintica de traslacin total del gas en conjunto (Ktr) y la energa cintica de traslacin media por molcula son proporcionales a la temperatura absoluta T. La rapidez ecaz de las molculas de un gas ideal es proporcional a la raz cuadrada de T. En estas expresiones interviene la constante de Boltzmann k 5 R>NA. (La trayectoria libre media l de las molculas de un gas ideal depende el nmero de molculas por volumen (N>V) y del radio molecular r.
La capacidad calorfica molar Cv a volumen constante se puede expresar como mltiplo sencillo de la constante de los gases R, en ciertos casos idealizados
Cv = 3/2 R (gas monoatmico)
Las rapideces de las molculas, de un gas ideal se distribuyen segn la distribucin de Maxwell Boltzmann f(v)dv, describe la fraccin de las molculas que tiene rapideces entre u y v + dv.
Cv = 5/2 R (gas diatomico)
Cv = 3R (solido monoatmico)
La materia ordinaria existe en las fases slida, lquida y gaseosa. Un diagrama de fases muestra las condiciones en las que dos fases pueden coexistir en equilibrio. Las tres fases pueden coexistir en el punto triple. La curva de vaporizacin termina en el punto crtico, arriba del cual desaparece la distincin entre las fases lquida y gaseosa.
You might also like
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesFrom EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Rubrica Cuadro SinopticoDocument2 pagesRubrica Cuadro SinopticoTijerina KarenNo ratings yet
- Cuadro Sinoptico Cap. 18Document2 pagesCuadro Sinoptico Cap. 18Maryani Segura100% (1)
- 2.7. Relaciones P-V-T de Los Gases IdealesDocument19 pages2.7. Relaciones P-V-T de Los Gases IdealesCarlosCarrilloNo ratings yet
- 01 Diapositiva de Gases IdealesDocument14 pages01 Diapositiva de Gases IdealesCarla Cruz RojasNo ratings yet
- Marco Teórico GASESDocument3 pagesMarco Teórico GASESMayraAlejandraVargas100% (2)
- Resumen Capítulo 18 y 19 Del Libro de Física UniversitariaDocument10 pagesResumen Capítulo 18 y 19 Del Libro de Física UniversitariaJuan Orias BarrantesNo ratings yet
- GasesDocument12 pagesGasesLuis Iriarte LayaNo ratings yet
- Termodinamica Laboratorio 7 Gases RealesDocument13 pagesTermodinamica Laboratorio 7 Gases RealesDavid DuranNo ratings yet
- Teoría cinética de los gases idealesDocument17 pagesTeoría cinética de los gases idealesmiguel angel Huaman LezmaNo ratings yet
- Relaciones Termodinamicas Parte 2Document22 pagesRelaciones Termodinamicas Parte 2Maria caballeroNo ratings yet
- Unidad IVDocument20 pagesUnidad IVYubiri Marcano SuarezNo ratings yet
- 115 Gases IdealesDocument14 pages115 Gases IdealesKhaterine QuispeNo ratings yet
- Gases Ideales Eq 1Document32 pagesGases Ideales Eq 1Valeria MoralesNo ratings yet
- S12.s2 - MaterialDocument17 pagesS12.s2 - MaterialDARK REASON D'ETRENo ratings yet
- Gases 2 HojasDocument26 pagesGases 2 HojasHector LuceroNo ratings yet
- Informe FIQUIDocument17 pagesInforme FIQUIPedroNo ratings yet
- Sesión 4 Gases Ideales y RealesDocument8 pagesSesión 4 Gases Ideales y RealesPaola Stefania Villarreal VeraNo ratings yet
- Teoría Cinético-Molecular y Leyes de Los GasesDocument9 pagesTeoría Cinético-Molecular y Leyes de Los GasesPapeleria Y Ciber BengNo ratings yet
- CollahuasiDocument34 pagesCollahuasiAndres Eduardo Pizarro MontecinosNo ratings yet
- Teoría cinética gasesDocument20 pagesTeoría cinética gasesErik victor Anchivilca ZavaletaNo ratings yet
- Gases Ideales y RealesDocument13 pagesGases Ideales y RealesLee HansonNo ratings yet
- s12.s2 - Teoria Cinetica de Los Gases Semana 13Document18 pagess12.s2 - Teoria Cinetica de Los Gases Semana 13David Cruz AlzamoraNo ratings yet
- 5 Capitulo V LFFIIDocument38 pages5 Capitulo V LFFIIMarcus ClaydNo ratings yet
- Densidad y Peso Molecular de Un GasDocument7 pagesDensidad y Peso Molecular de Un GasRafa VegaNo ratings yet
- Propiedades Termodinámicas de Los Gases IdealesDocument5 pagesPropiedades Termodinámicas de Los Gases IdealesEdwin GarcesNo ratings yet
- GasesDocument31 pagesGasesGivion WeaverNo ratings yet
- Estado GaseososDocument47 pagesEstado GaseososYOYONo ratings yet
- Term Odin A MicaDocument16 pagesTerm Odin A Micaલિસા એન્ડ્રીયા એન્ડ્રીયાNo ratings yet
- Gas IdealDocument10 pagesGas IdealAlejandra ChacónNo ratings yet
- Leyes de los gases idealesDocument24 pagesLeyes de los gases idealesJoaquín Raymundo Muñoz MartínezNo ratings yet
- Ley de Las Presiones ParcialesDocument37 pagesLey de Las Presiones ParcialesEver Rodrigo Merlo Villca0% (1)
- Densidad y difusión de gases: determinación experimentalDocument13 pagesDensidad y difusión de gases: determinación experimentalALEXANDRA IRENE DEL AGUILA MENDOZANo ratings yet
- Cuestionario Grupo 5. Plantas Térmicas 2020-IIDocument56 pagesCuestionario Grupo 5. Plantas Térmicas 2020-IICesar LimasNo ratings yet
- Marco TeoricoDocument5 pagesMarco TeoricoPatricia CalleNo ratings yet
- Teoria Cinetica de Los GasesDocument11 pagesTeoria Cinetica de Los GasesEl Gato SsaleMNo ratings yet
- V. Teoria Cinetica de Los GasesDocument28 pagesV. Teoria Cinetica de Los Gasesanon_580798559No ratings yet
- Primera Ley de La TermodinamicaDocument19 pagesPrimera Ley de La TermodinamicaClaros AguilarNo ratings yet
- Ley de Los Gases IdealesDocument9 pagesLey de Los Gases IdealesJean MartínezNo ratings yet
- 2.5 y 2.6. Termodinamica Exposicion-Leyes y Ecuaciones de Los Gases IdealesDocument24 pages2.5 y 2.6. Termodinamica Exposicion-Leyes y Ecuaciones de Los Gases IdealesCarlosCarrilloNo ratings yet
- Teoria Cinética de Los Gases IdealesDocument23 pagesTeoria Cinética de Los Gases Idealescielo tacaNo ratings yet
- Gases RealesDocument35 pagesGases RealesMarco Cisneros,Yheferson Maza,Diego Díaz,Jairo Giohayro,David Samamé,Gino Cuadros,Ricardo Trinidad100% (1)
- Teoria Cinetica de Los GasesDocument7 pagesTeoria Cinetica de Los GasesMax Blade ErosNo ratings yet
- Segundo Trabajo de TermodinamicaDocument18 pagesSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaNo ratings yet
- El Estado Gaseos. Teoría CinéticaDocument6 pagesEl Estado Gaseos. Teoría CinéticaEdu OlivaNo ratings yet
- Ley de Los GasesDocument7 pagesLey de Los Gasesjulio camposNo ratings yet
- Calor Específico A Volumen ConstanteDocument3 pagesCalor Específico A Volumen ConstanteErn Ern ErnNo ratings yet
- Ley de Los Gases IdealesDocument9 pagesLey de Los Gases IdealesVladimir OsunaNo ratings yet
- Propiedades CríticasDocument5 pagesPropiedades CríticasPaola Carpio75% (4)
- Plantas de conversión térmica 1er examen parcialDocument19 pagesPlantas de conversión térmica 1er examen parcialLuis F. Estrada GutierrezNo ratings yet
- 1.gases 2013Document38 pages1.gases 2013Nico OrdenesNo ratings yet
- Leyes y teorías de los gases idealesDocument27 pagesLeyes y teorías de los gases idealesJP VSNo ratings yet
- P Sem12 Ses2 TCGDocument17 pagesP Sem12 Ses2 TCGjhony gamboa123No ratings yet
- Informe Fisicoquimica 1Document11 pagesInforme Fisicoquimica 1PedroNo ratings yet
- FisicaI 3º ParteDocument199 pagesFisicaI 3º ParteAnabel AcostaNo ratings yet
- Apuntes Sobre GasesDocument34 pagesApuntes Sobre GasesAlvaro Ivan Irala Barrios100% (1)
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Modelamiento y casos especiales de la cinética química heterogéneaFrom EverandModelamiento y casos especiales de la cinética química heterogéneaRating: 3 out of 5 stars3/5 (1)
- Resumen Profesional Cap. 19Document4 pagesResumen Profesional Cap. 19Maryani SeguraNo ratings yet
- Cuadro Sinoptico 19Document1 pageCuadro Sinoptico 19Tijerina KarenNo ratings yet
- ReporteDocument4 pagesReporteTijerina KarenNo ratings yet
- Ejemplo Practica de Ejercicios Profesional - NewDocument5 pagesEjemplo Practica de Ejercicios Profesional - NewTijerina Karen100% (2)
- Ejemplo Comentario Profesional - NewDocument2 pagesEjemplo Comentario Profesional - NewTijerina KarenNo ratings yet
- Mapa Conceptual Cap. 18Document2 pagesMapa Conceptual Cap. 18Maryani SeguraNo ratings yet
- Practica Profesional Cap. 19Document2 pagesPractica Profesional Cap. 19Maryani SeguraNo ratings yet
- Rubrica 4Document3 pagesRubrica 4Tijerina KarenNo ratings yet
- Rubrica 4Document3 pagesRubrica 4Tijerina KarenNo ratings yet
- Rubrica 1Document4 pagesRubrica 1Tijerina KarenNo ratings yet
- Rubrica 3Document4 pagesRubrica 3Tijerina KarenNo ratings yet
- Rubrica 2Document4 pagesRubrica 2Tijerina KarenNo ratings yet
- Generador Eolico Caracoles UruguayDocument55 pagesGenerador Eolico Caracoles Uruguaylucke81No ratings yet
- Solucionario Fisica2Document10 pagesSolucionario Fisica2Patricia Santana LozadaNo ratings yet
- 1-Fisica de Las RadiacionesDocument55 pages1-Fisica de Las RadiacionesChristina MillerNo ratings yet
- Capitulo 13Document23 pagesCapitulo 13Antonio PérezNo ratings yet
- Ficha de Trabajo Estatica Fuerza Leyesnewto ParacompletarDocument6 pagesFicha de Trabajo Estatica Fuerza Leyesnewto ParacompletarWilber Edison Quispe Oncebay100% (2)
- Exergía en Sistemas BiológicosDocument15 pagesExergía en Sistemas BiológicosVictors SubelzaNo ratings yet
- Balanza JollyDocument7 pagesBalanza JollyvirtorjazzNo ratings yet
- Densidad y Peso Molecular Aparente Del AireDocument10 pagesDensidad y Peso Molecular Aparente Del AireKevin CelisNo ratings yet
- Temper Tarifa 2016Document144 pagesTemper Tarifa 2016VEMATELNo ratings yet
- Actividad de Aprendizaje Sobre La Energìa Solar PDFDocument11 pagesActividad de Aprendizaje Sobre La Energìa Solar PDFELMERHIPOLITO100% (4)
- Formulas CengelDocument12 pagesFormulas CengelIvan RuedaNo ratings yet
- Auditoria y Eficiencia EnergeticaDocument3 pagesAuditoria y Eficiencia EnergeticaJavier Vasquez0% (1)
- Taller 3 Juan Sebastián MonroyDocument7 pagesTaller 3 Juan Sebastián MonroyJuan Sebastián MonroyNo ratings yet
- Rendimiento de lavadores Venturi para control de emisionesDocument7 pagesRendimiento de lavadores Venturi para control de emisionesandresfm419No ratings yet
- Informe masa resorte verticalDocument16 pagesInforme masa resorte verticalRobert Soberón EspinozaNo ratings yet
- Prueba Estados de La MateriaDocument6 pagesPrueba Estados de La MateriaChelita Machuca100% (1)
- Informe TG2 CT ChilcaDocument18 pagesInforme TG2 CT Chilcajoelcruzing_mecanicodefluidosNo ratings yet
- Ejercicios TermodinámicaDocument31 pagesEjercicios TermodinámicareturboNo ratings yet
- Practica 1 TermoDocument9 pagesPractica 1 TermoTany's De MuaNo ratings yet
- EjerciciosCalorTemperaturaDocument2 pagesEjerciciosCalorTemperaturatigrever2277No ratings yet
- Teoría cinético molecular gasesDocument5 pagesTeoría cinético molecular gasesPabla PinoNo ratings yet
- Paneles Solares Estudio de CasoDocument15 pagesPaneles Solares Estudio de CasojlolaNo ratings yet
- Ley de Hooke Informe UNJBGDocument13 pagesLey de Hooke Informe UNJBGRodrigo Elías Quenta100% (1)
- Determinación densidad materialesDocument6 pagesDeterminación densidad materialesEver Ivan Goicochea PrincipeNo ratings yet
- El Campo de Acción de La Enertrónica - José Antonio Aquino - AcademiaDocument7 pagesEl Campo de Acción de La Enertrónica - José Antonio Aquino - AcademiahenryrogrNo ratings yet
- Energías No ConservativasDocument3 pagesEnergías No ConservativasJaime AcaroNo ratings yet
- LHC Seguro - CidDocument5 pagesLHC Seguro - CidJuan Antonio Valls FerrerNo ratings yet
- Energía solar fotovoltaicaDocument27 pagesEnergía solar fotovoltaicamaxparionaNo ratings yet
- Trabajo, Energia e Impulso en La Dinámica de La PartículaDocument7 pagesTrabajo, Energia e Impulso en La Dinámica de La PartículaSebastian Martinez CuautencoNo ratings yet
- Apoyos y Financiamientos Del FIDE A Las ERDocument14 pagesApoyos y Financiamientos Del FIDE A Las ERPaulina Rotter TurnerNo ratings yet