Professional Documents
Culture Documents
Analisis Cuantitativo de Tabletas de Aspirina Por Espectrometria
Uploaded by
Nelly Johanna Soto CastañedaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Analisis Cuantitativo de Tabletas de Aspirina Por Espectrometria
Uploaded by
Nelly Johanna Soto CastañedaCopyright:
Available Formats
ANALISIS CUANTITATIVO DE TABLETAS DE ASPIRINA POR
ESPECTROMETRIA- UV
GELVEZ, Jhon Efrn; SOTO, Nelly Johana
Departamento De Ingenieras y Arquitectura. . Universidad de Pamplona. Km 1 va
Bucaramanga. Norte de Santander. Colombia.
RESUMEN
Durante la prctica de laboratorio se busco la familiarizacin con la Ley de Beer-
Lambert y su aplicacin en el anlisis cuantitativo haciendo uso de un
Espectrmetro UV-VIS, preparando los estndares de NaOH y Acido saliclico
para as medir la absorbancia de cada uno de las soluciones datos necesarios
para la realizacin de la curva de calibracin de los estndares de acido saliclico
(Absorbancia VS. Concentracin). Finalmente se hizo el anlisis de la aspirina
para calcular la concentracin de acido acetilsaliclico comparando el resultado
obtenido con el contenido especificado en la etiqueta de la tableta.
PALABRAS CLAVES: Absorbancia, Anlisis, Espectrometra, Radiacin,
Ultravioleta.
RESUMEN
Durante la prctica de laboratorio se busco la familiarizacin con la Ley de Beer-
Lambert y su aplicacin en el anlisis cuantitativo haciendo uso de un
Espectrmetro UV-VIS, preparando los estndares de NaOH y Acido saliclico
para as medir la absorbancia de cada uno de las soluciones datos necesarios
para la realizacin de la curva de calibracin de los estndares de acido saliclico
(Absorbancia VS. Concentracin). Finalmente se hizo el anlisis de la aspirina
para calcular la concentracin de acido acetilsaliclico comparando el resultado
obtenido con el contenido especificado en la etiqueta de la tableta.
PALABRAS CLAVES: Absorbancia, Anlisis, Espectrometra, Radiacin,
Ultravioleta.
INTRODUCCION
La espectroscopia ultravioleta-visible o
espectrofotometra ultravioleta-visible
(UV/VIS) es una espectroscopia de
emisin de fotones y una
espectrofotometra. Utiliza radiacin
electromagntica (luz) de las regiones
visible, ultravioleta cercana (UV) e
infrarroja cercana (NIR) del espectro
electromagntico, es decir, una longitud
de onda entre 380nm y 780nm. La
radiacin absorbida por las molculas
desde esta regin del espectro provoca
transiciones electrnicas que pueden ser
cuantificadas.
La espectroscopia UV-visible se utiliza
para identificar algunos grupos
funcionales de molculas, y adems,
para determinar el contenido y fuerza de
una sustancia.
Se utiliza de manera general en la
determinacin cuantitativa de los
componentes de soluciones de iones de
metales de transicin y compuestos
orgnicos altamente conjugados.
Se utiliza extensivamente en laboratorios
de qumica y bioqumica para determinar
pequeas cantidades de cierta
sustancia, como las trazas de metales
en aleaciones o la concentracin de
cierto medicamento que puede llegar a
ciertas partes del cuerpo.
El principio de la espectroscopia
ultravioleta-visible involucra la absorcin
de radiacin ultravioleta visible por una
molcula, causando la promocin de un
electrn de un estado basal a un estado
excitado, liberndose el exceso de
energa en forma de calor. La longitud de
onda ( ) comprende entre 190 y 800 nm.
El origen del cido acetilsaliclico
proviene de la corteza del sauce, que los
antiguos pobladores desde el continente
americano hasta europeo,
emplearon para ayudar a ali viar
algunos tipos de dolor. A principios
del siglo XIX era conocido como
Salicilina, como se le llam al principio
activo de la corteza del sauce.
La Aspirina contiene un nico principio
activo: el cido acetilsaliclico; es un
ster aceti lado del cido sali cl ico.
Su proceso de sntesis consiste en tratar
el cido saliclico con anhdrido actico,
en presencia de un poco de cido
sulfrico que acta como catalizador.
Sus cristales son alargados, de sabor
ligeramente amargo y de color
blanquecino.
METODOLOGIA EXPERIMENTAL:
En esta prctica de laboratorio iniciamos
preparando las soluciones estndares:
Primero se pes en balanza analtica
alrededor de 25mg de acido saliclico
puro, fue transferido a un baln aforado
de 25ml y diluido con una solucin de
NaOH 0.1M. se calcul la concentracin
(M) de la solucin estndar. Se
prepararon cinco diluciones de su
solucin estndar usando 100, 200,
300, 400, 500 L y diluidos a 10ml con
0.1M de NaOH. Adems se calcul la
concentracin (M) de cada una de las
soluciones patrn.
Haciendo uso de una de las diluciones
de acido saliclico, se midi el espectro
de absorcin UV y se determin la
longitud de onda de mxima absorcin.
Se medi la absorbancia de cada uno de
las soluciones patrn preparadas a la
longitud de onda de mxima absorcin y
se realiz la curva de calibracin para
los estndares de acido saliclico
(Absorbancia VS. Concentracin)
Finalmente en el anlisis de la aspirina
se Dej disolver una tableta de aspirina
en una solucin 0.1M de NaOH en un
baln aforado de 100ml.
Se diluy esta solucin 1 a 50 con 0.1M
de NaOH y se midi la absorbancia de
esta solucin a la misma longitud de
onda que midi los estndares.
Adems, se hizo uso de la curva de
calibracin para determinar la
concentracin de acido saliclico
presente en la solucin problema.
Se calcul el peso de acido
acetilsaliclico en la tableta de aspirina
usando el factor estequiomtrico
apropiado y considerando la diluciones
involucradas. Como tambin se
compararon los resultados obtenidos con
el contenido especificado en la etiqueta
de la tableta para que de esta manera
calcular el porcentaje de recuperacin.
MATERIALES Y REACTIVOS
Agua destilada.
Espectrmetro UV-VIS (Shimadzu ),
balones aforados de (10, 25,100, 50 ) ml,
micropipetas graduadas, pipeteador y
celdas de Cuarzo.
Acido saliclico Puro, Hidrxido de Sodio
Analtico, Agua destilada, Tableta de
Aspirina.
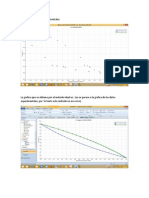
RESULTADOS Y DISCUSION
CONCLUSIONES
Anexos.
Por qu se usa la solucin de
NaOH 0.1M como solvente en
este experimento, porque se usa
cido saliclico?
El hidrxido de sodio actua como un
estabilizador o controlador para el
anlisis cuantitativo de la aspirina,
cuando la aspirina reacciona (cido
acetilsaliclico) reacciona con una base,
como hidrxido de sodio, se hidroliza
rpidamente para formar un dianin.
.
You might also like
- Estudio de Caso - Semana 4Document2 pagesEstudio de Caso - Semana 4Nelly Johanna Soto Castañeda83% (30)
- Informe Practica0Document6 pagesInforme Practica0Emmanuel Osorno CaroNo ratings yet
- Cuestionario PolarimetriaDocument3 pagesCuestionario PolarimetriaEdgar De la CruzNo ratings yet
- Separacion de Dicromato Permanganato Usando Una Columna de AlúminaDocument6 pagesSeparacion de Dicromato Permanganato Usando Una Columna de AlúminaSamuel Fernando DelgadoNo ratings yet
- Análisis Cuantitativo de Tabletas de Aspirina Por Espectrometría UVDocument7 pagesAnálisis Cuantitativo de Tabletas de Aspirina Por Espectrometría UVLezkatheZapataNo ratings yet
- Análisis Cuantitativo de La Concentracion de Acido Acetil Salicilico Por Espectrometría UvDocument11 pagesAnálisis Cuantitativo de La Concentracion de Acido Acetil Salicilico Por Espectrometría UvYorman Zambrano SilvaNo ratings yet
- Analisis Informe 3Document7 pagesAnalisis Informe 3Carla Belén ArenasNo ratings yet
- Informe Análisis Microscópico y Adulteraciones 2022-1Document14 pagesInforme Análisis Microscópico y Adulteraciones 2022-1Angélica María González SánchezNo ratings yet
- AcidimetriaDocument6 pagesAcidimetriaWiliams CHNo ratings yet
- Informe 1 Calibracion de Material Volumetrico 1Document4 pagesInforme 1 Calibracion de Material Volumetrico 1Julian SalcedoNo ratings yet
- RE-10-LAB-290 QUIMICA APLICADA v2Document27 pagesRE-10-LAB-290 QUIMICA APLICADA v2Ivan PortugalNo ratings yet
- Preparacion Del Acido AcetilsalicilicoDocument11 pagesPreparacion Del Acido AcetilsalicilicolizNo ratings yet
- Introduccion y Metodos de Laboratorio ArgentometriaDocument3 pagesIntroduccion y Metodos de Laboratorio ArgentometriaAndres Felipe Espitia ForeroNo ratings yet
- Practica de Metabolitos SecundariosDocument5 pagesPractica de Metabolitos SecundariosPersephone Obscure QueenNo ratings yet
- Practica 1 - Determinación de La Curva Espectral y Cuantificación de Fe (II) Por Espectroscopia Visible PDFDocument8 pagesPractica 1 - Determinación de La Curva Espectral y Cuantificación de Fe (II) Por Espectroscopia Visible PDFKevin CueroNo ratings yet
- Informe Infrarrojo CompletarDocument15 pagesInforme Infrarrojo CompletarPaolo Guerra SteinNo ratings yet
- Justificación Del TrabajoDocument1 pageJustificación Del TrabajoAngel TapiaNo ratings yet
- Almidones 2021 ObservacionDocument3 pagesAlmidones 2021 ObservacionMaria Celina Moyano CarreteroNo ratings yet
- Practica 6 Fisiología de LevadurasDocument4 pagesPractica 6 Fisiología de LevadurasNoemi SaavedraNo ratings yet
- TAREA 1 Métodos de ControlDocument3 pagesTAREA 1 Métodos de ControlLau Rivera0% (2)
- Determinación de Hierro Por El Método de OrtofenantrolinaDocument3 pagesDeterminación de Hierro Por El Método de OrtofenantrolinaBonnet HernándezNo ratings yet
- Determinación de HidroximetilfurfuralDocument6 pagesDeterminación de HidroximetilfurfuralKateryn Arana Villanzona100% (1)
- Re 10 Lab 244 Microbiologia General v5Document45 pagesRe 10 Lab 244 Microbiologia General v5Jhoany SanchezNo ratings yet
- Ejercicios Tema IDocument2 pagesEjercicios Tema IMercedes Pinedo TiconaNo ratings yet
- Farmacognocia CuestionarioDocument1 pageFarmacognocia CuestionarioFatima Escarleth Nogales OropezaNo ratings yet
- Aspirin ADocument9 pagesAspirin ADiego VelásquezNo ratings yet
- Practica de CaseinaDocument6 pagesPractica de CaseinaRonil TrujilloNo ratings yet
- FarmacotecniaDocument13 pagesFarmacotecniaVeronica Estefania CabezaNo ratings yet
- Reporte Voltametria y PolarografiaDocument46 pagesReporte Voltametria y Polarografiadiogenes2011No ratings yet
- Espectrofotometrà A - UV - Análisis de Nitratos en AguaDocument16 pagesEspectrofotometrà A - UV - Análisis de Nitratos en AguaLuis Diego Cardenas PadillaNo ratings yet
- Guia de Analisis de Jugos - 2Document17 pagesGuia de Analisis de Jugos - 2Antigona2001100% (1)
- Refractometria en Bebida Aoholica-Polarimetria en AzucarDocument8 pagesRefractometria en Bebida Aoholica-Polarimetria en AzucarJuanjo RamNo ratings yet
- Determinación de Humedad y CenizasDocument8 pagesDeterminación de Humedad y CenizasHeinz Jimenez Infantes50% (2)
- Guía de Práctica 7 Cuantificación de Vitamina CDocument5 pagesGuía de Práctica 7 Cuantificación de Vitamina CJanneth TubonNo ratings yet
- Informe 5. Determinación de La Concentración de Una Muestra ProblemaDocument8 pagesInforme 5. Determinación de La Concentración de Una Muestra ProblemaErika EcheverryNo ratings yet
- Practica 2 Determinacion de CafeinaDocument11 pagesPractica 2 Determinacion de Cafeinapaulina zamudioNo ratings yet
- Informe Caseina PDFDocument8 pagesInforme Caseina PDFMoni AntolinezNo ratings yet
- Practica 1 de BromatologiaDocument4 pagesPractica 1 de BromatologiaAdi JzNo ratings yet
- Determinación Del Punto de Fusión PDFDocument2 pagesDeterminación Del Punto de Fusión PDFJefferson aNo ratings yet
- Algunas Propiedades Físicas de Las ProteínasDocument2 pagesAlgunas Propiedades Físicas de Las ProteínasAndrea JJJ100% (1)
- ANIMALES DE LABORATORIO BioterioDocument7 pagesANIMALES DE LABORATORIO BioterioJofytYoveraTroncosNo ratings yet
- Espectrofotometria (Ejercicios) ResueltoDocument3 pagesEspectrofotometria (Ejercicios) ResueltoCesar Baldeon GuzmanNo ratings yet
- Informe de Practica #3Document24 pagesInforme de Practica #3Natalia hmNo ratings yet
- HPLCDocument5 pagesHPLCjorgeeduardogarciaNo ratings yet
- PFGE Metarhizium 2005.en - EsDocument6 pagesPFGE Metarhizium 2005.en - EsDayana LizcanoNo ratings yet
- Práctica Virtual Uv-VisDocument2 pagesPráctica Virtual Uv-VisJhon OviedoNo ratings yet
- Informe 4 y 5 - InstrumentalDocument6 pagesInforme 4 y 5 - InstrumentalMeel ACNo ratings yet
- Determinación de Acidez en VinosDocument2 pagesDeterminación de Acidez en VinosExli JfrNo ratings yet
- Problemas Resueltos Analitica PDFDocument4 pagesProblemas Resueltos Analitica PDFDavid GirondaNo ratings yet
- Ensayos de Identidad PARACETAMOLDocument7 pagesEnsayos de Identidad PARACETAMOLJahuey UnalescoNo ratings yet
- PRACTICA No. 6 Determinación de Hierro Por EspectrofotometríaDocument3 pagesPRACTICA No. 6 Determinación de Hierro Por EspectrofotometríaJOAN PABLO GARNICA ZAPATANo ratings yet
- Informe Polarimetria InstrumentalDocument3 pagesInforme Polarimetria InstrumentalYenci Daniela Cubillos GiraldoNo ratings yet
- Practica EnterobacteriasDocument7 pagesPractica EnterobacteriasSelene Ruiz MoriNo ratings yet
- Descripcion de Medios de CultivoDocument2 pagesDescripcion de Medios de CultivoAlan Aguacate MartinezNo ratings yet
- Informe 1 de ApaDocument4 pagesInforme 1 de ApaxxxelyxxxNo ratings yet
- Cromatografía de Fluidos Supercríticos (SFC)Document19 pagesCromatografía de Fluidos Supercríticos (SFC)Jessica Pardo SarmientoNo ratings yet
- Introduccion de Conductimetria 1Document2 pagesIntroduccion de Conductimetria 1mariaNo ratings yet
- Informe de Acidez BromatologiaDocument9 pagesInforme de Acidez BromatologiaJohnAndresPinargoteNo ratings yet
- Practica AlcalimetriaDocument6 pagesPractica AlcalimetriaLuciana Fernanda Padilla ClavijoNo ratings yet
- Analisis Cuantitativo de Tabletas de Aspirina Por EspectrometriaDocument6 pagesAnalisis Cuantitativo de Tabletas de Aspirina Por EspectrometriaMisael Mendez GarayNo ratings yet
- Ensayo Importancia AICDocument1 pageEnsayo Importancia AICNelly Johanna Soto CastañedaNo ratings yet
- Distribucion de Una Planta de ProduccionDocument2 pagesDistribucion de Una Planta de ProduccionNelly Johanna Soto CastañedaNo ratings yet
- Nelly Johanna Soto CastañedaDocument10 pagesNelly Johanna Soto CastañedaNelly Johanna Soto CastañedaNo ratings yet
- Informe EjecutivoDocument3 pagesInforme EjecutivoNelly Johanna Soto CastañedaNo ratings yet
- Nosotras Morimos para Que Ustedes Puedan Tener Sus SmartphonesDocument3 pagesNosotras Morimos para Que Ustedes Puedan Tener Sus SmartphonesNelly Johanna Soto CastañedaNo ratings yet
- Oración de RecomendaciónDocument6 pagesOración de RecomendaciónNelly Johanna Soto CastañedaNo ratings yet
- Planta de Produccion de MCVDocument12 pagesPlanta de Produccion de MCVNelly Johanna Soto CastañedaNo ratings yet
- Escalado de Reactores QuimicosDocument18 pagesEscalado de Reactores QuimicosNelly Johanna Soto Castañeda100% (1)
- Grafica de Los Datos ExperimentalesDocument4 pagesGrafica de Los Datos ExperimentalesNelly Johanna Soto CastañedaNo ratings yet
- Biodiesel de Producción Por Un Proceso Continuo Utilizando Un Catalizador HeterogeneoDocument6 pagesBiodiesel de Producción Por Un Proceso Continuo Utilizando Un Catalizador HeterogeneoNelly Johanna Soto Castañeda100% (1)
- (Lab) Bioquimica - CentrifugaciónDocument17 pages(Lab) Bioquimica - CentrifugaciónUSMP FN ARCHIVOS100% (1)
- EmpujeDocument7 pagesEmpujeJuanMolaNo ratings yet
- Trabajo 1 - CombustiblesDocument51 pagesTrabajo 1 - CombustiblesNicolas Valle100% (2)
- Los Molinos de BolasDocument3 pagesLos Molinos de BolasEliana Vega TapiaNo ratings yet
- 1er Examen Parcial MaquinariaDocument4 pages1er Examen Parcial MaquinariaRensolt Javier Silva QuispeNo ratings yet
- Quimica IIDocument59 pagesQuimica IIAnonymous qEAEExzNh100% (1)
- Avance 2 ProcesosDocument20 pagesAvance 2 ProcesosLuisMPortillaBenavidesNo ratings yet
- Guía de Estudio FISICOQUÍMICA IIDocument3 pagesGuía de Estudio FISICOQUÍMICA IIAlejandro SanchezNo ratings yet
- 1.1 Taller Materia y EnergiaDocument6 pages1.1 Taller Materia y EnergiaLeslie MoralesNo ratings yet
- Sevilla Cruz Alfredo Salomón 3BM2 MC P7Document3 pagesSevilla Cruz Alfredo Salomón 3BM2 MC P7Alfredo SevillaNo ratings yet
- Se Le Llama Soldadura A La Unión de Dos MaterialesDocument17 pagesSe Le Llama Soldadura A La Unión de Dos Materialesbrainer canabalNo ratings yet
- HOTEL VENTURIplanseguridadDocument85 pagesHOTEL VENTURIplanseguridadJose Gustavo Campero SanchezNo ratings yet
- Xenoinjertos y Sustitutos Oseos 1Document20 pagesXenoinjertos y Sustitutos Oseos 1Pam Ramirez75% (4)
- Unidad 3, Práctico 4 - CALOR, TERMOMETRÍA Y DILATACIÓN TÉRMICA (Temperatura y Dilatación) OkDocument4 pagesUnidad 3, Práctico 4 - CALOR, TERMOMETRÍA Y DILATACIÓN TÉRMICA (Temperatura y Dilatación) OkKeyla Janett Cortez MamaniNo ratings yet
- Fag Catalogo Aplicações Rolamentos e Componentes para Motocicletas 2017 - 2018Document50 pagesFag Catalogo Aplicações Rolamentos e Componentes para Motocicletas 2017 - 2018LEODECIO BELO DE OLIVEIRANo ratings yet
- 12345Document19 pages12345PatrickGustavoSuyoMarinNo ratings yet
- Guia de Ciencias - Medir La MateriaDocument3 pagesGuia de Ciencias - Medir La Materiamarlene luarteNo ratings yet
- Operacion y Mantto de SubestacionesDocument83 pagesOperacion y Mantto de Subestacionescashcens1801100% (1)
- Ficha Tecnica Secuestrante de QS SCAV 3000Document1 pageFicha Tecnica Secuestrante de QS SCAV 3000jrarizmendibNo ratings yet
- Druetta - Manual CompletoDocument19 pagesDruetta - Manual CompletoAdrianArinoNo ratings yet
- Acido Base Anion CationDocument13 pagesAcido Base Anion CationDaniel Diaz MolanoNo ratings yet
- Funcion Del Bicarbonato en ArequipeDocument2 pagesFuncion Del Bicarbonato en ArequipeÄlejändro Viña T'100% (6)
- Balance de Materia de PollosDocument21 pagesBalance de Materia de PollosAle OreNo ratings yet
- Lab N°3 - Reacciones Redox RecuperaciónDocument10 pagesLab N°3 - Reacciones Redox RecuperaciónMadelaine Ained Alvarado AnriaNo ratings yet
- Convertidores 2009Document76 pagesConvertidores 2009frankNo ratings yet
- Analisis Granulometrico Mediante El HidrometroDocument20 pagesAnalisis Granulometrico Mediante El HidrometroJhonatan Fernando Herrada CruzadoNo ratings yet
- Sistema de EncendidoDocument31 pagesSistema de EncendidoMarvin MoreiraNo ratings yet
- Liquidos Corporales. Liqido ExtracelularM 5870db8565b27Document49 pagesLiquidos Corporales. Liqido ExtracelularM 5870db8565b27Jesús MoraNo ratings yet
- Practica #5 InformeDocument24 pagesPractica #5 InformeMiluscaNo ratings yet