Professional Documents
Culture Documents
Propiedades Coligativas de Las Soluciones PDF
Uploaded by
Gina Gabriel VeraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Propiedades Coligativas de Las Soluciones PDF
Uploaded by
Gina Gabriel VeraCopyright:
Available Formats
Propiedades
Coligativas de
las Soluciones
Prof. Claudia Berzoy Llerena
Propiedades coligativas
Dependen del nmero de partculas y no de la
naturaleza de las mismas.
Importancia de las propiedades
coligativas
Permiten:
Separar los componentes de una solucin
por medio de la destilacin fraccionada
Formular y crear mezclas anticongelantes
Determinar masas molares de solutos
desconocidos
Formular sueros o soluciones fisiolgicas que
no provoquen desequilibrio hidrosalino en
los organismos animales o que permitan
corregir una anomala del mismo.
Soluciones
de solutos
no electrolitos
(no se disocia en iones
con carga)
electrolitos
(se disocia en iones)
En el estudio de las propiedades coligativas se debe
tener en cuenta una caracterstica importante de las
soluciones:
Soluciones no
electrolticas
Propiedades coligativas
Son:
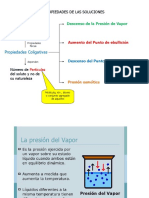
1) Descenso de la presin de vapor del solvente
2) Aumento del punto de ebullicin de la solucin
3) Descenso del punto de congelacin de la
solucin
4) Presin osmtica
Propiedades coligativas
Para el anlisis termodinmico suponemos que:
1) La disolucin es ideal
2) El soluto es no voltil
3) El soluto no se disuelve en el disolvente slido puro
4) Soluciones diludas 0,2 M
Descenso de la presin de vapor
del solvente
Recordemos que:
La presin de vapor sobre un lquido es el resultado
de un equilibrio dinmico entre la fase de vapor y
la fase lquida del compuesto
La velocidad a la que las molculas dejan la
superficie lquida para pasar a la fase gaseosa es
igual a la velocidad con que las molculas de la
fase gaseosa regresan a la superficie del lquido
Descenso de la presin de vapor
del solvente
Por tanto:
Un soluto no voltil que se aade al lquido reduce
la capacidad de las molculas del solvente de
pasar a la fase vapor debido a que se generan
nuevas fuerzas de interaccin
Por ello se produce un desplazamiento del
equilibrio que conduce a un descenso de la
presin de vapor
Descenso de la presin de vapor
del solvente
Solvente A, soluto B
Como el soluto no voltil no contribuye a la
presin total, la presin total ser la presin
de A puro.
B A
A A A A A A A
A A
A A A
x P P
x P x P P P P P
P P
P x P
*
* * * *
*
*
) 1 (
= A
= = = A
s
=
Aumento del Punto de ebullicin
de las soluciones
Debido a que los
solutos no voltiles
disminuyen la presin
de vapor de la
solucin, se requiere
una temperatura ms
elevada para que la
solucin hierva
Aumento del Punto de ebullicin
de las soluciones
Clausius-Clapeyron
) ( ln
.
)
.
( ln
2
*
2
*
o
v
o o o
o
o v
T
T
R
H
P
P
T T T T T
T T
T T
R
H
P
P
A A
=
= ~
A
=
T
o
T
Como la solucin es diluda el H
vap
se
toma del solvente puro
Solucin es diluda
P
*
P
Cuando la ley de Raoult es aplicable a la
solucin
Si x
B
es pequeo
B
v
o
o
v
B
o
v
B
B A
x
H
RT
T
T
T
R
H
x
T
T
R
H
x
x x
P
P
A
= A
A A
=
A A
=
= =
2
2
2
*
) 1 ln(
1
No depende de la
naturaleza del soluto
m: moles de soluto
por 1000g de
solvente
n
1
moles en
solvente en 1000 g
Para soluciones
diludas m se
desprecia frente a
n
1
K
b
constante
ebulloscpica
m K T
n H
RT
K
m
n H
RT
T
M
n
n
m
m n
m
x
b
v
o
b
v
o
B
= A
A
=
(
A
= A
=
~
+
=
1
2
1
2
1
1
1 1
1000
Aumento del punto de
ebullicin
El ascenso del punto
de ebullicin se aplica
en la formulacin de
refrigerantes para
motores de
automviles
Descenso del punto de congelacin
El punto de congelacin de un lquido
corresponde a la temperatura a la cual las
molculas de un compuesto pasan del estado
lquido al estado slido.
El descenso en el punto de congelacin de la
solucin es una consecuencia de la
disminucin de la presin de vapor ocasionada
por el soluto.
Esto es debido a que en el punto de
congelacin de la solucin, la presin de vapor
del slido debe ser igual a la presin de vapor
del lquido con el que est en equilibrio pero
como la solucin ha bajado su Pv, el slido
deber formarse a una temperatura menor
Descenso del punto de congelacin
Descenso del punto de congelacin
m K T
m
n H
RT
T
x
H
RT
T
f f
f
o
f
B
f
o
f
= A
A
= A
A
= A
1
2
2
Kf constante crioscpica
Determinacin de pesos
moleculares a partir del descenso
en el punto de congelacin
Sea W
2
g soluto, W
1
g solvente, M
2
peso
molecular
W
2
x1000/W
1
peso de soluto en 1000 g ste
|
|
.
|
\
|
= A
=
2 1
2
2 1
2
1000
1000
M W
W
K T
M W
W
m
f f
Descenso del punto de congelacin
Un soluto como el
cloruro de sodio
disminuye el punto de
congelacin del agua.
Por eso se echa sal a la
nieve en las calles: esto
hace que el hielo se
derrita.
Separacin de soluciones slidas
por congelacin
Las ecuaciones anteriores son vlidas
cuando el slido que se separa es el
solvente puro.
En el caso que se forme una solucin slida,
T
f
=K
f
(1-k)m
krelacin de la x
B
en el slido y la x
B
en la
solucin
Si el soluto es ms soluble en el solvente
lquido,
1-k (+) k < 1
Viceversa, si k>1, 1-k es (-) y tambin T
f
(se
observa un ascenso)
Presin Osmtica
smosis: proceso
espontneo en
el que hay un
flujo de
disolvente a
travs de una
membrana
semipermeable
hacia el seno de
una solucin ms
concentrada
Presin osmtica: presin que debe aplicarse sobre la
solucin para impedir la smosis del solvente.
Ecuacin de Vant Hoff
La condicin de equilibrio es que el potencial
qumico debe ser el mismo a cada lado de la
membrana.
A
>
A(solucin)
En el lado de la solucin el disminuye debido a
que la fraccin molar del solvente disminuye de 1 a
x
A
Para alcanzar el equilibrio
A(solucin)
tiene que
aumentar elevando la presin externa de la
solucin.
La condicin de equilibrio es
A
(T,P) =
A
(T,P+,x
A
)
t
t
t
t
t
t
V RTn
V RTx
x x x
dP V x RT
dP V P T P T
x RT P T P T
B
B
B B A
P
P
A
P
P
A A
A A A
=
=
~ =
=
+ = +
+ + =
}
}
+
+
) 1 ln( ln
ln
) , ( ) , (
ln ) , ( ) , (
Al combinar estas tres ecuaciones obtenemos,
El volumen del solvente es constante y sale de la
integral
Presin osmtica
Vant Hoff propuso la ecuacin de la
presin osmtica
la presin osmtica
Vvolumen de la solucin
nnmero de moles de soluto
R constante universal de los gases
nRT V = t
Presin osmtica
En soluciones se prefiere usar
concentracin, C=n/V
La ecuacin de Vant Hoff solo se puede
aplicar a soluciones muy diludas.
Morse propuso cambiar el volumen de la
solucin por V, que es el volumen del
solvente y as se mejor la ecuacin de
Vant Hoff.
nRT V
CRT
=
=
' t
t
Presin osmtica
Mediante la termodinimca se ha
conseguido una ecuacin muy exacta
de la presin osmtica,
Donde P es la presin de vapor del
solvente puro y P la presin de vapor del
solvente en la solucin.
V
1
es el volumen de un mol de solvente.
P
P
RT V
= ln
1
t
Propiedades coligativas de
electrolitos
You might also like
- 4COLIGATIVASDocument43 pages4COLIGATIVAScristianNo ratings yet
- Clase 5 Propiedades ColigativasDocument47 pagesClase 5 Propiedades ColigativasDel1al9No ratings yet
- Diapos No ElectroliticasDocument50 pagesDiapos No ElectroliticasNéstor Bazán ArribasplataNo ratings yet
- 4a Props Coligativas-3Document46 pages4a Props Coligativas-3Brayan Fernando RangelNo ratings yet
- Propiedades Coligativas de Las DisolucionesDocument40 pagesPropiedades Coligativas de Las DisolucionesRudy Mamani CuellarNo ratings yet
- Unidad 7-PT2Document41 pagesUnidad 7-PT2Alvaro GuerreroNo ratings yet
- Diapositivas - Unidad 4 - FisicoquímicaDocument22 pagesDiapositivas - Unidad 4 - FisicoquímicaJuan SalazarNo ratings yet
- Clase 5 Propiedades ColigativasDocument39 pagesClase 5 Propiedades ColigativascristianNo ratings yet
- QUIMICA Presentación de Propiedades Coligativas 2° Medio Héctor CarrilloDocument46 pagesQUIMICA Presentación de Propiedades Coligativas 2° Medio Héctor CarrilloricardoNo ratings yet
- 2 Soluciones Concentracion y Propiedades ColigativasDocument24 pages2 Soluciones Concentracion y Propiedades ColigativasGómez Sánchez Luis GustavoNo ratings yet
- Propiedades ColigativasDocument42 pagesPropiedades ColigativasEduardo Ricci100% (1)
- Solucion y Prop. Coligativa 2Document38 pagesSolucion y Prop. Coligativa 2MaximimilianoNo ratings yet
- ColigativasDocument37 pagesColigativasjuancc2916No ratings yet
- Prop ColigCB103Document30 pagesProp ColigCB103rita aguirreNo ratings yet
- 03 Propiedades de Las SolucionesDocument35 pages03 Propiedades de Las SolucionesSÁENZ ANDAGUA LUIS MIGUELNo ratings yet
- Disoluciones - Propiedades Coligativas-2 PDFDocument43 pagesDisoluciones - Propiedades Coligativas-2 PDFJuan Canales QNo ratings yet
- COLIGATIVASDocument38 pagesCOLIGATIVASBritney Nina ArganaNo ratings yet
- Propiedades de Las SolucionesDocument19 pagesPropiedades de Las SolucionescristianNo ratings yet
- Propiedades Coligativas de Las DisolucionesDocument31 pagesPropiedades Coligativas de Las DisolucionesMarianet ZereneNo ratings yet
- Variación de La Presión de VaporDocument13 pagesVariación de La Presión de VaporFannyEspinozaGiraldezNo ratings yet
- Propiedades ColigativasDocument3 pagesPropiedades ColigativascristianNo ratings yet
- Propiedades ColigativasDocument3 pagesPropiedades ColigativascristianNo ratings yet
- Propiedades Coligativas de Las DisolucionesDocument40 pagesPropiedades Coligativas de Las DisolucionesALEXANDER PAUL LIQUINCHANA MARTINEZNo ratings yet
- Cap 4 Propiedades Coligativas 2021Document33 pagesCap 4 Propiedades Coligativas 2021Abigail CallisayaNo ratings yet
- 4to. Introducción - Propiedades Coligativas de Solutos No ElectrolíticosDocument43 pages4to. Introducción - Propiedades Coligativas de Solutos No Electrolíticosdarwins pintoNo ratings yet
- Prop CaligativasDocument51 pagesProp CaligativasDany ElliotNo ratings yet
- 2disoluciones 120223163244 Phpapp01Document46 pages2disoluciones 120223163244 Phpapp01Jorge Maximo Moran SantamariaNo ratings yet
- Propiedades ColigativasDocument5 pagesPropiedades ColigativasLuis PerezNo ratings yet
- Disminución de La Temperatura de Fusión y Aumento de La Temperatura de EbulliciónDocument3 pagesDisminución de La Temperatura de Fusión y Aumento de La Temperatura de EbulliciónLilianaFernandezCamachoNo ratings yet
- Teorico 6 - Soluciones 2Document30 pagesTeorico 6 - Soluciones 2Rocio CerutiNo ratings yet
- Práctica Propiedades Coligativas FisicoquimicaDocument15 pagesPráctica Propiedades Coligativas FisicoquimicaIsi-romeo FuentesNo ratings yet
- Clase #02 Propiedades ColigativasDocument25 pagesClase #02 Propiedades ColigativasJOSE MARTIN RIVERO CORCUERANo ratings yet
- Soluciones de Liquidos en LíquidosDocument35 pagesSoluciones de Liquidos en LíquidosJuliana ContrerasNo ratings yet
- Propiedades ColigativasDocument21 pagesPropiedades ColigativasMike RodriguezNo ratings yet
- Aplicaciones ColigativasDocument9 pagesAplicaciones ColigativasMiriam Guerra RodríguezNo ratings yet
- Propiedades ColigativasDocument16 pagesPropiedades Coligativaskvilla9No ratings yet
- Clase SolucionesDocument36 pagesClase SolucionesJean AlarconNo ratings yet
- GUIAS Practice Segundo MedioDocument4 pagesGUIAS Practice Segundo MedioMadai Trabol TorresNo ratings yet
- PROPIEDADES COLIGATIVAS Agro BDocument25 pagesPROPIEDADES COLIGATIVAS Agro BmilenkaNo ratings yet
- 7 - Propiedades ColigativasDocument18 pages7 - Propiedades ColigativasEmma SarliNo ratings yet
- Propiedades Coligativas - Cátedra de Química, Guía de Problemas Número 5Document5 pagesPropiedades Coligativas - Cátedra de Química, Guía de Problemas Número 5Patricio Castillo ManquecoyNo ratings yet
- TEMA4Document25 pagesTEMA4aanitahpNo ratings yet
- Propiedades ColigativasDocument25 pagesPropiedades ColigativasJhoelVM vargasNo ratings yet
- Propiedades Coligativas de Las Soluciones Químca 4to Año Lapso IDocument7 pagesPropiedades Coligativas de Las Soluciones Químca 4to Año Lapso ISandraCuquejoNo ratings yet
- Propiedades Coligativas 2023Document12 pagesPropiedades Coligativas 2023agus brozoNo ratings yet
- 5 Quimica 1.propiedades ColigativasDocument33 pages5 Quimica 1.propiedades ColigativasMa Vi Garzón PazmiñoNo ratings yet
- Propiedades ColigativasDocument20 pagesPropiedades ColigativasSebastían MartínezNo ratings yet
- Propiedades Coligativas de Las SolucionesDocument5 pagesPropiedades Coligativas de Las SolucionesYonar Shmit Gallo QuispeNo ratings yet
- XV Propiedades Coligativas de SolucionesDocument41 pagesXV Propiedades Coligativas de SolucionesEd CotNo ratings yet
- 4COLIGATIVASDocument43 pages4COLIGATIVASJesusAngelTasaycoMaldonadoNo ratings yet
- Propiedades Coligativas de Las SolucionesDocument6 pagesPropiedades Coligativas de Las SolucionesXerman Prieto DezaNo ratings yet
- S07.s1 - Material FQDocument41 pagesS07.s1 - Material FQJanira DominguezNo ratings yet
- Aumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaDocument18 pagesAumento Del Punto de Ebullicion .Descenso Del Punto de Ebullicion - Presion OsmoticaJesús NavarroNo ratings yet
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- Psicometría. Principios básicos y protocolos experimentales diversosFrom EverandPsicometría. Principios básicos y protocolos experimentales diversosNo ratings yet
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesFrom EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNo ratings yet
- MKMLÑDocument6 pagesMKMLÑGina Gabriel VeraNo ratings yet
- Informe IndecopiDocument38 pagesInforme IndecopiGina Gabriel VeraNo ratings yet
- Informe IndecopiDocument38 pagesInforme IndecopiGina Gabriel VeraNo ratings yet
- 04 Informacion Documentada PDFDocument2 pages04 Informacion Documentada PDFGina Gabriel VeraNo ratings yet
- Estudio de Mercado de Mermeladas-Ord.Document46 pagesEstudio de Mercado de Mermeladas-Ord.Gina Gabriel VeraNo ratings yet
- Sedimentación 2017-1Document19 pagesSedimentación 2017-1Gina Gabriel VeraNo ratings yet
- Electrodo InerteDocument20 pagesElectrodo InerteGina Gabriel Vera100% (1)
- El Gato de TizaDocument3 pagesEl Gato de TizaGina Gabriel VeraNo ratings yet
- Ultraresumenes Onco HematologíaDocument5 pagesUltraresumenes Onco HematologíaFernandoNo ratings yet
- Seguridad en MedicacionDocument14 pagesSeguridad en MedicacionAna lilyNo ratings yet
- Determinación de La Concentración de Flúor en Pastas DentalesDocument113 pagesDeterminación de La Concentración de Flúor en Pastas DentalesElizabeth Collins100% (8)
- Lista Libros PrekinderDocument2 pagesLista Libros PrekinderJoselyn ArancibiaNo ratings yet
- Morfologia Cacao y PapayaDocument4 pagesMorfologia Cacao y PapayaDiego MartinezNo ratings yet
- Lista de Cotejo para Trabajar Equidad de GéneroDocument2 pagesLista de Cotejo para Trabajar Equidad de GéneroRolando Villanueva Pariona40% (5)
- Combustion de Una Vela en Un VasoDocument8 pagesCombustion de Una Vela en Un Vasodar2828No ratings yet
- Un Día AmanecioDocument17 pagesUn Día AmanecioJess BazNo ratings yet
- Doblado de VidrioDocument24 pagesDoblado de VidrioBrayan LemusNo ratings yet
- Miércoles 6 de Octubre de 2021Document12 pagesMiércoles 6 de Octubre de 2021Diario SoldelCuscoNo ratings yet
- Armas BiologicasDocument2 pagesArmas BiologicasVanessa Caro AyalaNo ratings yet
- Diario de Reflexión 1 EmpatíaDocument7 pagesDiario de Reflexión 1 EmpatíaYessica GonzálezNo ratings yet
- Xenobioticos 2017Document40 pagesXenobioticos 2017Syovis HopeNo ratings yet
- DisestesiaDocument21 pagesDisestesiaLincoln López GodoyNo ratings yet
- Modulo Entrega de ResultadosDocument36 pagesModulo Entrega de Resultadossara camila pulgarin acevedoNo ratings yet
- Trabajo Final Transferencia de Calor Grupo de JoseDocument6 pagesTrabajo Final Transferencia de Calor Grupo de JoseGabriel LezcanoNo ratings yet
- Gastronomia Del Perú Por RegionesDocument4 pagesGastronomia Del Perú Por RegionesLaura DannielaNo ratings yet
- Sobre La Inevitabilidad de Lo Tragico (D) 3Document9 pagesSobre La Inevitabilidad de Lo Tragico (D) 3Camilo E. Jacome A.No ratings yet
- PR - Montaje y Desmontaje MecánicoDocument14 pagesPR - Montaje y Desmontaje Mecánicoclaudia100% (1)
- Teoria 13Document29 pagesTeoria 13Maria AquinoNo ratings yet
- Romero 2007placeboDocument12 pagesRomero 2007placeboLeonel CamposNo ratings yet
- AnexoI EditableDocument2 pagesAnexoI EditableLuis R. Linares0% (1)
- Te Zeamax 75 WP (16 - 06 - 2015)Document2 pagesTe Zeamax 75 WP (16 - 06 - 2015)Lukis DasopigaNo ratings yet
- Caracteristicas e Importancia de AprestacionDocument5 pagesCaracteristicas e Importancia de Aprestacionmaritza mincholaNo ratings yet
- Química General 2 (4 Unidades)Document35 pagesQuímica General 2 (4 Unidades)Rodrigo Ignacio Chacon RivasNo ratings yet
- Evaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICODocument4 pagesEvaluación III UNIDAD DANZAS PUEBLOS ORIGINARIOS 2 BÁSICOCamila Paz Farias CorreaNo ratings yet
- Enfermedades Transmisibles y No TransmisiblesDocument7 pagesEnfermedades Transmisibles y No Transmisiblesnohelizdyana100% (1)
- Apoyo Nutricional 2023Document9 pagesApoyo Nutricional 2023Alexis Sandoval La RosaNo ratings yet
- Uni 3 ReproDocument30 pagesUni 3 ReproYocelin FernándezNo ratings yet
- Proteccion RadiologicaDocument152 pagesProteccion RadiologicavladimirNo ratings yet