Professional Documents
Culture Documents
Relación CP
Uploaded by
Gustavo Adolfo RodriguezOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Relación CP
Uploaded by
Gustavo Adolfo RodriguezCopyright:
Available Formats
Relacin Cp-Cv mtodo
Clement Desormes
Resumen
El objetivo de este
laboratorio fue obtener la
relacion entre la capacidad
calorifica a presion
constante y la capacidad
calorifica a volumen constante, para esto se utilizo el metodo de Clement
Dsormes,
Introduccin
La capacidad calorifica es el calor transferido al sistema con respecto a el
cambio de la temperatura del mismo durante un proceso. En general estas
capacidades dependen de la temperatura, sin embargo en pequeos intervalos
de temperatura, a temperaura ambiente y por encima de ella estas pueden
tratarse como casi independientes de esta. Dependiendo de la naturaleza del
proceso nos referimos a Cv como la capacidad calor!fica a volumen constante y
Cp como la capacidad calor!fica a presi"n constante. La relaci"n de C
p
#C
v
se
denomina gamma. $dem%s estas capacidades son propiedades e&tensivas, es
decir, dependen de la cantidad de masa.
'na observaci"n importante es que C
v
se relaciona con los cambios de energ!a
interna y C
p
con los cambios de entalpia, entonces como u y ( dependen de la
temperatura C
v
y C
p
tambin ser%n funci"n de la temperatura.
)or otra parte e&isten varios mtodos e&perimentales que permiten encontrar la
relaci"n definida como . Los mtodos m%s conocidos son el mtodo de
Clement * Dsormes, +,c(ardt y +in-el. En este caso se utiliz" el mtodo
Clment y Dsormes, el cual se considera el m%s antiguo, pero es el m%s
sencillo de comprender y su montaje e&perimental es el que se encuentra en la
mayor!a de los laboratorios docentes, por tal motivo es el mtodo de inters
para encontrar el valor de .
La raz"n de los calores espec!ficos de un gas perfecto es igual a la raz"n de
las pendientes de la adiab%tica y de la isoterma en un punto del diagrama .) vs
/0.
La ecuaci"n de la isoterma de un gas perfecto, , se escribe en forma diferencial
Ec. 4
La pendiente de la isoterma en el punto .)/0 del Diagrama de Clapeyron es
entonces1
Ec. 5
De igual modo, la ecuaci"n de la adiab%tica del gas,, se escribe
Ec. 6
La pendiente de la adiab%tica en el mismo punto .)/0 es entonces1
Ec. 7
Comparando 2 y 3 se obtiene1
Ec. 8
, es por la tanto, igual a la raz"n de las pendientes de la adiab%tica y de la
isoterma en el mismo punto .)/0.
$l abrir la llave, durante un tiempo muy corto, en la que se produce una
e&pansi"n adiab%tica, el estado del gas est% pr"&imo a un estado de equilibrio,
dada la sobrepresi"n.
4ea el aumento de volumen durante esta e&pansi"n que (a enfriado el gas.
$similando la adiab%tica a un segmento de recta, laza pendiente es entonces
Ec. 9
'na vez que la llave se vuelve a cerrar, asistimos a un calentamiento del gas, a
volumen constante, el cual alcanza de nuevo la temperatura ambiente .
El estado final del gas viene representado por el punto 3 que est% sobre la
misma isoterma que el punto 2 que representa el estado inicial.
La pendiente de la isoterma es en este caso
Ec. 10
'tilizando la relaci"n de la Ec. 5, se deduce, al dividir miembro a miembro las
e&presiones 6 y 7.
6
Ec. 11
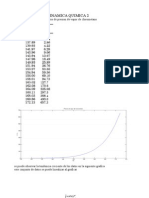
Resultados y discusin
Coeficiente de dilatacion
ENSAYO hi(cm) ha(cm) hf(cm) H=hi-ha H2=hf-ha
=H/(H-
H2)
1 40,8 28,3 30 12,5 1,7 1,157
2 37,3 30 31,5 7,3 1,5 1,258
3 39,3 25 27,7 14,3 2,7 1,232
4 39,2 27,4 29,5 11,8 2,1 1,216
5 36,8 24,5 27 12,3 2,5 1,255
6 39,9 26,2 29,1 13,7 2,9 1,268
7 40,3 24,4 27,8 15,9 3,4 1,272
8 39 25,2 27,7 13,8 2,5 1,221
Coeficiente promedio de dilatacin
Calculo del C
vm
:
$plicando la definici"n de C
v,m
, tenemos1
$dem%s, como C
vm
8 C
pm
+
C
pm8
C
vm 9
+
You might also like
- Capitulo 1 Maestria NacionalDocument16 pagesCapitulo 1 Maestria NacionalGustavo Adolfo RodriguezNo ratings yet
- For Do 050 Formato Evaluacion de AnteproyectoDocument1 pageFor Do 050 Formato Evaluacion de AnteproyectoGustavo Adolfo RodriguezNo ratings yet
- Ali MentosDocument1 pageAli MentosGustavo Adolfo RodriguezNo ratings yet
- Modelo Semifísico de Base Fenomenológica de Un Evaporador de Jugo de Caña de Azúcar Tipo RobertsDocument7 pagesModelo Semifísico de Base Fenomenológica de Un Evaporador de Jugo de Caña de Azúcar Tipo RobertsDaniel RoseroNo ratings yet
- Perdidas de EnergiaDocument22 pagesPerdidas de EnergiaBismarck Matew DectrNo ratings yet
- For-do-055-Formato Notificacion de Evaluacion de AnteproyectoDocument1 pageFor-do-055-Formato Notificacion de Evaluacion de AnteproyectoGustavo Adolfo RodriguezNo ratings yet
- Perdidas de EnergiaDocument22 pagesPerdidas de EnergiaBismarck Matew DectrNo ratings yet
- Impuestos A PagarDocument2 pagesImpuestos A PagarGustavo Adolfo RodriguezNo ratings yet
- Modulo 3 Sobre Programacion MatlabDocument15 pagesModulo 3 Sobre Programacion MatlabJunior FigueroaNo ratings yet
- Modulo Balance Unidad 1Document19 pagesModulo Balance Unidad 1Gustavo Adolfo RodriguezNo ratings yet
- Logistic ADocument4 pagesLogistic AGustavo Adolfo RodriguezNo ratings yet
- 01 - Introduccion A Las Computadoras, Internet y WebDocument14 pages01 - Introduccion A Las Computadoras, Internet y WebRoiner CamachoNo ratings yet
- ProyeccionesDocument5 pagesProyeccionesGustavo Adolfo RodriguezNo ratings yet
- AutomatizacionDocument11 pagesAutomatizacionGustavo Adolfo RodriguezNo ratings yet
- Sistema de ProyeccionesDocument5 pagesSistema de ProyeccionesGustavo Adolfo RodriguezNo ratings yet
- El Origen Del Yoga No Está en La IndiaDocument55 pagesEl Origen Del Yoga No Está en La IndiaGustavo Adolfo RodriguezNo ratings yet
- Tipos de LineasDocument5 pagesTipos de LineasGustavo Adolfo RodriguezNo ratings yet
- Estudio de Los Niveles de Plomo Cadmio Zinc y Arsenico en Aguas de La Provincia de SalamancaDocument13 pagesEstudio de Los Niveles de Plomo Cadmio Zinc y Arsenico en Aguas de La Provincia de SalamancaGustavo Adolfo RodriguezNo ratings yet
- Clase 4 Magnitudes Molares ParcialesDocument66 pagesClase 4 Magnitudes Molares ParcialesEduardo Escobar AlvarezNo ratings yet
- Sintesis de ChalconasDocument8 pagesSintesis de ChalconasRafael Ricardo Celin ManceraNo ratings yet
- La Visión de Alce NegroDocument60 pagesLa Visión de Alce NegroGustavo Adolfo RodriguezNo ratings yet
- Capitulo Dos de Varias VariablesDocument54 pagesCapitulo Dos de Varias Variablesvisalex100% (1)
- Mate AplicadaDocument2 pagesMate AplicadaGustavo Adolfo RodriguezNo ratings yet
- El Origen Del Yoga No Está en La IndiaDocument55 pagesEl Origen Del Yoga No Está en La IndiaGustavo Adolfo RodriguezNo ratings yet
- Relación CPDocument5 pagesRelación CPGustavo Adolfo RodriguezNo ratings yet
- Mate AplicadaDocument2 pagesMate AplicadaGustavo Adolfo RodriguezNo ratings yet
- Clo Rome TanoDocument4 pagesClo Rome TanoGustavo Adolfo RodriguezNo ratings yet
- Clo Rome TanoDocument4 pagesClo Rome TanoGustavo Adolfo RodriguezNo ratings yet
- Clase 4Document37 pagesClase 4Gustavo Adolfo RodriguezNo ratings yet
- CATALIZADORDocument15 pagesCATALIZADORMadeleine damiaNo ratings yet
- Carta PrimosDocument5 pagesCarta PrimosKarla VDNo ratings yet
- Implantación de La Estrategia LogísticaDocument45 pagesImplantación de La Estrategia LogísticaAbel Insua LagoNo ratings yet
- ¿Discriminas o Te Discriminan?Document51 pages¿Discriminas o Te Discriminan?Brisa LinaresNo ratings yet
- Codigos de Falla ChryslerDocument151 pagesCodigos de Falla ChryslerRobert Nunez84% (25)
- Actividades de Motricidad Fina 2Document4 pagesActividades de Motricidad Fina 2santos771100% (1)
- Maduración de La AfinidadDocument2 pagesMaduración de La AfinidadMarieta MOreira PincayNo ratings yet
- Referencias de Ecuaciones Diferenciales PDFDocument74 pagesReferencias de Ecuaciones Diferenciales PDFRulo May TzucNo ratings yet
- Bajo Piso Tekno Step PDFDocument3 pagesBajo Piso Tekno Step PDFRicci RománNo ratings yet
- Diagnóstico Precoz de Gestación Por Ecografía Transrectal en La OvejaDocument8 pagesDiagnóstico Precoz de Gestación Por Ecografía Transrectal en La OvejaBei RebolledoNo ratings yet
- Cartilla Co-Cre-Ar 2016 PDFDocument84 pagesCartilla Co-Cre-Ar 2016 PDFdanilo rosasNo ratings yet
- Curvas PDF e IDFDocument54 pagesCurvas PDF e IDFRodrigo SandovalNo ratings yet
- Verbos. Usos Rectos y DislocadosDocument4 pagesVerbos. Usos Rectos y Dislocadosmoncaci100% (1)
- Cat Lavadora HsDocument12 pagesCat Lavadora HsCamilo Andres CotesNo ratings yet
- Cambio de La Demanda y Cantidad DemandadaDocument3 pagesCambio de La Demanda y Cantidad DemandadaLeo FernandezNo ratings yet
- Cómo hacer aceite de marihuana siguiendo el método de Rick SimpsonDocument4 pagesCómo hacer aceite de marihuana siguiendo el método de Rick SimpsonBandu SifuentesNo ratings yet
- 8 Ejercicios para Pecho: Press Banca y másDocument18 pages8 Ejercicios para Pecho: Press Banca y másJose MedinaNo ratings yet
- Ensayo torsión barrasDocument6 pagesEnsayo torsión barrasJUAN FELIPE MARTINEZ RODRIGUEZNo ratings yet
- Roles en El Desarrollo de SoftwareDocument30 pagesRoles en El Desarrollo de SoftwareMáximo SoriaNo ratings yet
- Analisis TecnicoDocument5 pagesAnalisis TecnicoDaniel BasanteNo ratings yet
- Problemas PC3Document3 pagesProblemas PC3LUIS RODRIGO KEVIN GOMEZ CHAVEZNo ratings yet
- Resumen Practica 2Document13 pagesResumen Practica 2Nei TalentoNo ratings yet
- Nota de VentaDocument2 pagesNota de Ventaisai santosNo ratings yet
- NumerosDocument4 pagesNumerosYulei YanNo ratings yet
- Titulaciones redoxDocument13 pagesTitulaciones redoxGerman CarleNo ratings yet
- Tipos de Contratación y Afiliación Al Sistema de Seguridad SocialDocument14 pagesTipos de Contratación y Afiliación Al Sistema de Seguridad SocialDiana Marcela Ochoa PerezNo ratings yet
- El Señor eDocument114 pagesEl Señor eArte Gráfico GutenbergNo ratings yet
- Opera de ParisDocument2 pagesOpera de ParisAngela100% (1)
- Los PelambresDocument134 pagesLos Pelambresnelson_budini100% (1)
- 9 - HirschhornDocument26 pages9 - HirschhornPaula Constanza TrimanoNo ratings yet