Professional Documents
Culture Documents
Tipos de Procesos
Uploaded by
Jose R. HernandezOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Tipos de Procesos
Uploaded by
Jose R. HernandezCopyright:
Available Formats
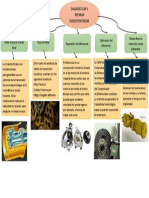
Tipos de procesos[editar]
Procesos Iso[editar]
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia
manteniendo cierta proporcionalidad en su transformacin. Se les asigna el prefijo iso-.
Ejemplo:
Isotrmico: proceso a temperatura constante
Isobrico: proceso a presin constante
Isomtrico o isocrico: proceso a volumen constante
Isoentlpico: proceso a entalpa constante
Isoentrpico: proceso a entropa constante
Proceso isocrico[editar]
Un proceso isocrico, tambin llamado proceso isomtrico o isovolumtrico es un proceso
termodinmico en el cual el volumen permanece constante; . Esto implica que el
proceso no realiza trabajo presin-volumen, ya que ste se define como ,
donde es la presin (el trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinmica, podemos deducir que , el cambio de
la energa interna del sistema es:
para un proceso isocrico: es decir, todo el calor que transfiramos al sistema se sumar a su
energa interna, . Si la cantidad de gas permanece constante, entonces el incremento de
energa ser proporcional al incremento de temperatura,
donde es el calor especfico molar a volumen constante. En un diagrama P-V, un proceso
isocrico aparece como una lnea vertical
Proceso isobrico[editar]
Proceso isobrico es aquel proceso termodinmico que ocurre a presin constante. En l, el
calor transferido a presin constante est relacionado con el resto de variables.
Proceso adiabtico[editar]
En termodinmica se designa como proceso adiabtico a aquel en el cual el sistema
(generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un
proceso adiabtico que es adems reversible se conoce como proceso isentrpico. El extremo
opuesto, en el que tiene lugar la mxima transferencia de calor, causando que la temperatura
permanezca constante, se denomina como proceso isotrmico.
El trmino adiabtico hace referencia a elementos que impiden la transferencia de calor con el
entorno. Una pared aislada se aproxima bastante a un lmite adiabtico. Otro ejemplo es la
temperatura adiabtica de llama, que es la temperatura que podra alcanzar una llama si no
hubiera prdida de calor hacia el entorno. En climatizacin los procesos de humectacin
(aporte de vapor de agua) son adiabticos, puesto que no hay transferencia de calor, a pesar
que se consiga variar la temperatura del aire y su humedad relativa. El calentamiento y
enfriamiento adiabtico son procesos que comnmente ocurren debido al cambio en la presin
de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
Proceso isotrmico
(Redirigido desde Isotrmico)
Proceso isotrmico.
Se denomina proceso isotrmico o proceso isotermo al cambio reversible en un sistema
termodinmico, siendo dicho cambio a temperatura constante en todo el sistema.
La compresin o expansin de un gas ideal puede llevarse a cabo colocando el gas en
contacto trmico con otro sistema de Capacidad calorfica muy grande y a la misma
temperatura que el gas; este otro sistema se conoce como foco calrico. De esta manera, el
calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo.
Como la energa interna de un gas ideal slo depende de la temperatura y sta permanece
constante en la expansin isoterma, el calor tomado del foco es igual al trabajo realizado por
el gas: Q = W.
Una curva isoterma es una lnea que sobre un diagrama representa los valores sucesivos de
las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en
un diagrama P-V, llamado diagrama de Clapeyron, son hiprbolas equilteras, cuya ecuacin
es PV = constante.
Proceso isotrmico de un gas[editar]
Una expansin isotrmica es un proceso en el cual un gas se expande (o contrae),
manteniendo la temperatura constante durante dicho proceso, es decir que T
1
= T
2
para los
estados inicial (1) y final (2) del proceso isotrmico. Aplicando el primer principio de la
termodinmica se obtiene:
Entonces integrando la expresin anterior, tomando como estado inicial el estado 1 y
estado final el estado 2, se obtiene:
..........(1)
Por la definicin de trabajo dada en mecnica se tiene que:
Pero la fuerza se puede expresar en funcin de la presin que se ejerce el
gas, y el desplazamiento se puede escribir como dx, entonces:
Pero Adx equivale a dV, el aumento en el volumen del gas durante esta
pequea expansin, entonces el trabajo efectuado por el gas sobre los
alrededores como resultado de la expansin es:
..........(2)
Ahora reemplazando (1) en (2) se puede integrar:
..........(3)
Pero para integrar la tercera integral, es necesario conocer la forma
de variacin de la presin P con el volumen, durante el proceso
tratado.
En el caso de tratar con gases ideales, se tendra la relacin:
..........(4)
Por lo tanto reemplazando (4) en (3) se tiene que:
Como los valores n y R son constantes para cada gas ideal, y
en este caso la temperatura tambin es constante, stas
pueden salir fuera de la integral obtenindose:
Ahora integrando:
..........(5)
Pero se sabe que la energa interna depende
slo de la temperatura (Ver: La energa
interna como funcin de la temperatura), y
como en este proceso sta se mantiene
constante, no hay cambio en la energa
interna del gas, por lo que la expresin (5)
se reduce a:
Por lo tanto, en una expansin
isotrmica de un gas perfecto, el
calor de entrada es igual al
trabajo efectuado por el gas.
Proceso isobrico
(Redirigido desde Isobrico)
Grfica Volumen vs Presin: en el proceso isobrico la presin es constante. El trabajo (W) es la integral de la
presin respecto al volumen.
Un proceso isobrico es un proceso termodinmico que ocurre a presin constante. La
Primera Ley de la Termodinmica, para este caso, queda expresada como sigue:
,
Donde:
= Calor transferido.
= Energa interna.
= Presin.
= Volumen.
En un diagrama P-V, un proceso isobrico aparece como una lnea horizontal.
Proceso isobrico de un gas[editar]
Una expansin isobrica es un proceso en el cual un gas se expande (o
contrae) mientras que la presin del mismo no vara, es decir si en un estado
1 del proceso la presin es P
1
y en el estado 2 del mismo proceso la presin
es P
2
, entonces P
1
= P
2
. La primera ley de la termodinmica nos indica que:
Integrando la expresin anterior, tomando como estado inicial el estado 1
y estado final el estado 2, se obtiene:
..........(1)
Por la definicin de trabajo dada en mecnica se tiene que:
Pero la fuerza se puede expresar en funcin de la presin que
se ejerce el gas, y el desplazamiento se puede escribir como
dx, entonces:
Pero Adx equivale a dV, el aumento en el volumen del gas
durante esta pequea expansin, entonces el trabajo
efectuado por el gas sobre los alrededores como resultado
de la expansin es:
..........(2)
Ahora reemplazando (1) en (2) se puede integrar:
Como la presin P es constante, puede salir fuera de
la integral:
Integrando:
Evaluando en los lmites:
Proceso isocrico
(Redirigido desde Isocrico)
Proceso isocrico en un diagrama P-V.
Un proceso isocrico, tambin llamado proceso isomtrico o isovolumtrico es
un proceso termodinmico en el cual el volumen permanece constante; . Esto
implica que el proceso no realiza trabajo presin-volumen, ya que ste se define como:
,
donde P es la presin (el trabajo es positivo, ya que es ejercido por el sistema).
En un diagrama P-V, un proceso isocrico aparece como una lnea vertical.
ndice
[ocultar]
1 Clculos del proceso
o 1.1 Clculo del Trabajo (W)
o 1.2 Clculo de la Variacin de la Energa Interna (U)
o 1.3 Clculo del calor entregado
2 Vase tambin
3 Enlaces externos
Clculos del proceso[editar]
Clculo del Trabajo (W)[editar]
Puesto que no existe desplazamiento, el trabajo realizado por el gas es nulo.
Clculo de la Variacin de la Energa Interna (U)[editar]
Aplicando la primera ley de la termodinmica, podemos deducir que U, el cambio de
la energa interna del sistema, es:
para un proceso isocrico, es decir a volumen constante, todo
el calor que transfiramos al sistema aumentar a su energa interna U.
Clculo del calor entregado[editar]
Si la cantidad de gas permanece constante, entonces el incremento de
energa ser proporcional al incremento de temperatura,
donde C
V
es el calor especfico molar a volumen constante.
Proceso adiabtico
En termodinmica se designa como proceso adiabtico a aqul en el cual
el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su
entorno. Un proceso adiabtico que es adems reversible se conoce como proceso
isoentrpico. El extremo opuesto, en el que tiene lugar la mxima transferencia de calor,
causando que la temperatura permanezca constante, se denomina proceso isotrmico.
El trmino adiabtico hace referencia a elementos que impiden la transferencia de calor con el
entorno. Una pared aislada se aproxima bastante a un lmite adiabtico. Otro ejemplo es la
temperatura adiabtica de llama, que es la temperatura que podra alcanzar una llama si no
hubiera prdida de calor hacia el entorno. En climatizacin los procesos de humectacin
(aporte de vapor de agua) son adiabticos, puesto que no hay transferencia de calor, a pesar
que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabtico son procesos que comnmente ocurren debido al
cambio en la presin de un gas. Esto puede ser cuantificado usando laley de los gases
ideales.
En otras palabras se considera proceso adiabtico a un sistema especial en el cual no se
pierde ni tampoco se gana energa calorfica. Esto viene definido segn la primera ley de
termodinmica describiendo que Q=0
Si se relaciona el tema del proceso adiabtico con las ondas, se debe tener en cuenta que el
proceso o carcter adiabtico solo se produce en las ondas longitudinales
ndice
[ocultar]
1 Formulacin matemtica
o 1.1 Derivacin de la frmula
2 Representacin grfica de las curvas adiabticas
3 Enfriamiento adiabtico del aire
4 Procesos adiabticos en mecnica cuntica
5 Vase tambin
Formulacin matemtica[editar]
Durante un proceso adiabtico, la energa interna del fluido que realiza el trabajo debe necesariamente
decrecer.
Esquema de una expansin adiabtica.
La ecuacin matemtica que describe un proceso adiabtico en un gas es
donde P es la presin del gas, V su volumen y
el coeficiente adiabtico, siendo el calor especfico molar a presin constante
y el calor especfico molar a volumen constante. Para un gas monoatmico
ideal, . Para un gas diatmico (como el nitrgeno o el oxgeno, los
principales componentes del aire)
Derivacin de la frmula[editar]
La definicin de un proceso adiabtico es que la transferencia de calor del sistema es
cero, .
Por lo que de acuerdo con el primer principio de la termodinmica,
donde U es la energa interna del sistema y W es el trabajo realizado por el
sistema. Cualquier trabajo (W) realizado debe ser realizado a expensas de la
energa U, mientras que no haya sido suministrado calor Q desde el exterior. El
trabajo W realizado por el sistema se define como
Sin embargo, P no permanece constante durante el proceso adiabtico sino
que por el contrario cambia junto con V.
Deseamos conocer cmo los valores de y se relacionan entre s
durante el proceso adiabtico. Para ello asumiremos que el sistema es una
gas monoatmico, por lo que
donde R es la constante universal de los gases.
Dado y entonces y
Ahora sustituyendo las ecuaciones (2) y (3) en la ecuacin (1)
obtenemos
simplificando
dividiendo ambos lados de la igualdad entre PV
Aplicando las normas del clculo diferencial obtenemos
que
que se puede expresar como
Para ciertas constantes y del estado
inicial. Entonces
elevando al exponente ambos lados de
la igualdad
eliminando el signo menos
por lo tanto
y
Representacin grfica de las curvas adiabticas[editar]
Las propiedades de las curvas adiabticas en un diagrama P-V son las siguientes:
Cada adiabtica se aproxima asintticamente a ambos ejes del diagrama P-V (al igual que las
isotermas).
Cada adiabtica se interseca con cada isoterma en un solo punto.
Una curva adiabtica se parece a una isoterma, excepto que durante una expansin, una
adiabtica pierde ms presin que una isoterma, por lo que inclinacin es mayor (es ms
vertical).
Si las isotermas son cncavas hacia la direccin "noreste" (45), entonces las adiabticas
son cncavas hacia la direccin "este noreste" (31).
Si adiabticas e isotermas se dibujan separadamente con cambios regulares en la
entropa y temperatura, entonces a medida que nos alejamos de los ejes (en direccin
noreste), parece que la densidad de las isotermas permanece constante, pero la densidad
de las adiabticas disminuye. La excepcin se encuentra muy cerca del cero absoluto,
donde la densidad de las adiabticas cae fuertemente y se hacen muy raras (Vase
tambin: Teorema de Nernst).
Enfriamiento adiabtico del aire[editar]
Existen, tres relaciones en el enfriamiento adiabtico del aire:
La relacin ambiente de la atmsfera, que es la proporcin a la que el aire se enfra a
medida que se gana altitud.
La tasa seca adiabtica, es de unos -1 por cada 100 metros de subida.
La tasa hmeda adiabtica, es de unos -0,6 - 0,3 por cada 100 metros de subida.
La primera relacin se usa para describir la temperatura del aire circundante a travs del cual
est pasando el aire ascendente. La segunda y tercera proporcin son las referencias para
una masa de aire que est ascendiendo en la atmsfera. La tasa seca adiabtica se aplica a
aire que est por debajo del punto de roco, por ejemplo si no est saturado de vapor de agua,
mientras que la tasa hmeda adiabtica se aplica a aire que ha alcanzado su punto de roco.
El enfriamiento adiabtico es una causa comn de la formacin de nubes.
El enfriamiento adiabtico no tiene por qu involucrar a un fluido. Una tcnica usada para
alcanzar muy bajas temperaturas (milsimas o millonsimas de grado sobre el cero absoluto)
es la desmagnetizacin adiabtica, donde el cambio en un campo magntico en un material
magntico es usado para conseguir un enfriamiento adiabtico.
You might also like
- Concepto de Yacimiento de HidrocarburosDocument2 pagesConcepto de Yacimiento de HidrocarburosJose R. HernandezNo ratings yet
- La Tectónica de PlacasDocument2 pagesLa Tectónica de PlacasJose R. HernandezNo ratings yet
- Yacimientos MineralesDocument2 pagesYacimientos MineralesJose R. HernandezNo ratings yet
- Procesos SupérgenosDocument2 pagesProcesos SupérgenosJose R. HernandezNo ratings yet
- Qué Es Un Registro GeofísicoDocument1 pageQué Es Un Registro GeofísicoJose R. HernandezNo ratings yet
- Registro de DensidadDocument14 pagesRegistro de DensidadJose R. HernandezNo ratings yet
- Estructura de La TierraDocument16 pagesEstructura de La TierraJose R. HernandezNo ratings yet
- Qué Es La GeologíaDocument3 pagesQué Es La GeologíaJose R. HernandezNo ratings yet
- Etapas de La Adquisición Sísmica de ReflexiónDocument10 pagesEtapas de La Adquisición Sísmica de ReflexiónWiler Wagner Siacara Perez0% (1)
- Creación y Protocolización Del Acta ConstitutivaDocument2 pagesCreación y Protocolización Del Acta ConstitutivaJose R. Hernandez67% (3)
- Compactación de SuelosDocument4 pagesCompactación de SuelosJose R. HernandezNo ratings yet
- Prismas Basálticos de HidalgoDocument1 pagePrismas Basálticos de HidalgoJose R. HernandezNo ratings yet
- Historia de La Sismologi de ExploracionDocument2 pagesHistoria de La Sismologi de ExploracionJose R. HernandezNo ratings yet
- Historia de La Sismologi de ExploracionDocument2 pagesHistoria de La Sismologi de ExploracionJose R. HernandezNo ratings yet
- Tipos de Porosidad Según La Clasificación de ChoquetteDocument1 pageTipos de Porosidad Según La Clasificación de ChoquetteJose R. HernandezNo ratings yet
- Sulfato de CobreDocument2 pagesSulfato de CobreJose R. HernandezNo ratings yet
- Historia de La Sismologi de ExploracionDocument2 pagesHistoria de La Sismologi de ExploracionJose R. HernandezNo ratings yet
- Historia de La Sismologi de ExploracionDocument2 pagesHistoria de La Sismologi de ExploracionJose R. HernandezNo ratings yet
- Estructura de La TierraDocument16 pagesEstructura de La TierraJose R. HernandezNo ratings yet
- PannotiaDocument1 pagePannotiaJose R. HernandezNo ratings yet
- Era PaleozoicaDocument4 pagesEra PaleozoicaJose R. HernandezNo ratings yet
- Magnetismo de RocasDocument5 pagesMagnetismo de RocasJose R. HernandezNo ratings yet
- Era PaleozoicaDocument4 pagesEra PaleozoicaJose R. HernandezNo ratings yet
- Cantos de Arcillas AglomeradosDocument1 pageCantos de Arcillas AglomeradosJose R. HernandezNo ratings yet
- Estructura QuímicasDocument3 pagesEstructura QuímicasJose R. HernandezNo ratings yet
- Textura Granular y CristalinaDocument6 pagesTextura Granular y CristalinaJose R. Hernandez100% (2)
- Los Alisios Son Vientos Regulares y Moderados Que Soplan Sobre La Mitad Del Globo A Una Velocidad Media de Unos 20 KMDocument5 pagesLos Alisios Son Vientos Regulares y Moderados Que Soplan Sobre La Mitad Del Globo A Una Velocidad Media de Unos 20 KMJose R. HernandezNo ratings yet
- CIBERFOBIADocument2 pagesCIBERFOBIAJose R. HernandezNo ratings yet
- Paleo Magnetism oDocument8 pagesPaleo Magnetism oJose R. HernandezNo ratings yet
- Mineria ChiapasDocument1 pageMineria ChiapasJose R. HernandezNo ratings yet
- Laboratorio Fisica II - #2. OscilacionesDocument7 pagesLaboratorio Fisica II - #2. OscilacionesDanna EscobarNo ratings yet
- CFSA3220 s10 Tarea 03Document5 pagesCFSA3220 s10 Tarea 03Juan Ignacio0% (1)
- Mecanica de Fluidos Ii. Sesion #03 PDFDocument78 pagesMecanica de Fluidos Ii. Sesion #03 PDFDanielMondragonHuimanNo ratings yet
- Magnitudes, Unidades y SímbolosDocument3 pagesMagnitudes, Unidades y SímbolosespectNo ratings yet
- Semana - 1 Cpu 2012 IiiDocument7 pagesSemana - 1 Cpu 2012 IiiRetyelseNo ratings yet
- La Fuerza Tangencial WTDocument1 pageLa Fuerza Tangencial WTKleyder HernandezNo ratings yet
- Física Grado NovenoDocument68 pagesFísica Grado NovenoSandra María Londoño100% (4)
- Descarga de Orificios y Trayectoría de ChorroDocument17 pagesDescarga de Orificios y Trayectoría de Chorrovictor jeronimo cuervo delgadoNo ratings yet
- Informe de LaboratorioDocument10 pagesInforme de LaboratorioSantiago CañasNo ratings yet
- InformeDocument15 pagesInformemarhuaNo ratings yet
- CentroideDocument14 pagesCentroideValeria Bracho ParraNo ratings yet
- Analisis Estructural 9 16 1 ResumenDocument9 pagesAnalisis Estructural 9 16 1 ResumenLiz castillo castilloNo ratings yet
- Tema 04 Fuerzas Sobre Superficies SumergidasDocument47 pagesTema 04 Fuerzas Sobre Superficies Sumergidas77915297No ratings yet
- Reporte de Práctica de Hidráulica Presion VelocidadesDocument8 pagesReporte de Práctica de Hidráulica Presion VelocidadesRubén AbaroaNo ratings yet
- Trabajo 5Document1 pageTrabajo 5Angel Fernandez BarzolaNo ratings yet
- Unidad 2 - Estructura de La Materia. Modelos AtómicosDocument6 pagesUnidad 2 - Estructura de La Materia. Modelos AtómicosFederico H. CalabresiNo ratings yet
- Relacion de VelocidadesDocument14 pagesRelacion de VelocidadesJuan Vicente TenecotaNo ratings yet
- Irradianza Solar y Temperatura Del Aire Superficial en Una Atmosfera EstaticaDocument5 pagesIrradianza Solar y Temperatura Del Aire Superficial en Una Atmosfera EstaticaManuel CarmonaNo ratings yet
- Extras 1Document12 pagesExtras 1InGridBaCulimaNo ratings yet
- Act - 2.1 CINEMATICA EN UNA DIMENSIONDocument4 pagesAct - 2.1 CINEMATICA EN UNA DIMENSIONFabio GraciaNo ratings yet
- Lab PRQ-2240 (Ensayo de Corte)Document10 pagesLab PRQ-2240 (Ensayo de Corte)Jose Luis Llave MuñozNo ratings yet
- Biomecanica - Ángulo de TracciónDocument1 pageBiomecanica - Ángulo de Tracciónagostina aguero50% (2)
- Practica de Ecuación DimensionalDocument3 pagesPractica de Ecuación Dimensionaloctavio ruben zare laizaNo ratings yet
- Informe 3 Fisica 3Document10 pagesInforme 3 Fisica 3Jeoshua LucchiniNo ratings yet
- Hoja de Trabajo No 5 v2Document4 pagesHoja de Trabajo No 5 v2Ronny Recalde MerchanNo ratings yet
- Mduarman TallerEstudio10%examen PropiedadesMecanicasDocument14 pagesMduarman TallerEstudio10%examen PropiedadesMecanicasDiego PeñaNo ratings yet
- Guia #1 Trabajo y EnergíaDocument8 pagesGuia #1 Trabajo y Energíay84sydf2fmNo ratings yet
- Ejercicios de MecanismosDocument11 pagesEjercicios de MecanismosJose ValderaNo ratings yet