Professional Documents
Culture Documents
Tema 5-1
Uploaded by
api-257268727Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Tema 5-1
Uploaded by
api-257268727Copyright:
Available Formats
MIOGLOBINA
ESTRUCTURA CUATERNARIA
Unin de varias cadenas polipeptdicas
(subunidades monmeros)
Especialmente enlaces dbiles
La protena completa se llama
oligomrica polimrica
Posibilita la existencia de fenmenos de
cooperatividad y alosterismo
LA HEMOGLOBINA
Se encuentra en clulas especializadas,
los eritrocitos
Une oxgeno en los pulmones y lo
transporta, va sangre arterial, a los tejidos
donde lo libera
Adems, une CO
2
procedente del
metabolismo en los tejidos, y lo transporta,
va sangre venosa, a los pulmones para
ser eliminado
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
ESTRUCTURA DE LA HEMOGLOBINA (Hb)
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
Tetrmero (a,b)
2
cuyas subunidades son similares a la Mb
TRANSPORTE DE OXGENO POR LA HEMOGLOBINA
La Hb capta oxgeno cuando es abundante (pulmones P
O2
100 mm Hg) y lo cede cuando disminuye (capilares P
O2
30
mm Hg)
La curva de unin del oxgeno a la Hb es SIGMOIDEA:
Este comportamiento se debe a
fenmenos de COOPERATIVIDAD
en la unin de oxgeno. Cada
molcula de Hb tiene 4 lugares de
unin de O
2
. La unin del primer
O
2
produce un cambio
conformacional en la molcula, lo
que facilita la unin de los
siguientes y viceversa
P
O2
en los tejidos
P
O2
en los pulmones
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
FENMENOS DE COOPERATIVIDAD
En el tetrmero de Hb (ab)2, las cadenas a /b establecen
interacciones fuertes.
Al pasar del estado desoxigenado al oxigenado se
produce un cambio estructural que afecta, sobre todo, a
la interaccin entre subunidades (estructura
cuaternaria). Un par a /b rota y se desliza respecto al
otro
En menor medida
cambia la estructura
terciaria de cada
subunidad
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
CAMBIOS ESTRUCTURALES QUE ACOMPAAN A LA
UNIN DEL OXGENO
El paso de la forma desoxigenada a la oxigenada explica la
unin cooperativa del oxgeno:
1. Se rompen una serie de puentes salinos y enlaces de
hidrgeno que afectan a los C-terminales
2. Se crean otros enlaces dando lugar a la conformacin
ms laxa llamada forma relajada (R)
Por tanto, la entrada del primer O
2
es ms difcil porque
han de romperse enlaces inicos entre subunidades. El
resto de las molculas de O
2
encuentran los enlaces rotos
y la situacin espacial es ms favorable
Cuando sale el O
2
la Hb vuelve a su conformacin desoxi o
forma tensa (T) restablecindose los puentes salinos)
CMO SE COMUNICA LA ENERGA DE LA UNIN DE O
2
AL CAMBIO CONFORMACIONAL
Existe un reordenamiento
de la estructura terciaria y
tambin de la cuaternaria
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
Cambio de conformacin
EFECTOS ALOSTRICOS DE OTROS LIGANDOS SOBRE LA Hb
La Hb es una protena alostrica (=otro sitio), es decir, su
afinidad por el O
2
se altera por determinados efectores que
no actan directamente sobre el grupo hemo sino que
interaccionan en otro lugar de la protena
EFECTORES ALOSTRICOS:
1. CO
2
2. H
+
3. 2,3-bisfosfoglicerato (2,3-BPG)
Todos ellos disminuyen la afinidad de la Hb por el O
2
(desplazan las curvas de saturacin hacia la derecha)
TRANSPORTE DE CO
2
La liberacin de CO
2
por los tejidos que respiran, reduce la
afinidad de la Hb por el O
2
de dos formas:
El CO
2
se fija en parte a la Hb formando grupos carbamato
(N-terminal) cuyo grupo carboxilo forma puentes salinos
entre cadenas a y b, caractersticos del estado desoxiHb
-NH-COO
-
El CO
2
origina bicarbonato y H
+
, reduciendo el pH, mediante
la reaccin catalizada por la anhidrasa carbnica
(localizada en los eritrocitos)
CO
2
+ H
2
O HCO
3
-
+ H
+
LA Hb RESPONDE A LOS CAMBIOS DE pH MEDIANTE EL EFECTO BOHR
Hb 4O
2
+ nH
+
Hb nH
+
+ 4O
2
En los capilares: hacia la derecha (liberacin de O
2
)
En los pulmones: hacia la izquierda
(liberacin de H
+
y, como consecuencia, de CO
2
)
Este mecanismo puede explicarse porque los sitios de
unin de H
+
presentan ms afinidad en la forma desoxiHb
que en la oxiHb
El aumento de H
+
( pH)
es una seal de la demanda de O
2
y
reduce la afinidad de la Hb por el O
2
Adems de la liberacin de CO
2
por los tejidos que
respiran, la falta de O
2
(msculo en ejercicio) puede dar
lugar a la formacin anaerobia de cido lctico que
tambin reduce el pH
EFECTO BOHR EN LA HEMOGLOBINA
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
LOS EFECTOS DEL CO
2
Y H
+
SE PUEDEN RESUMIR
MEDIANTE EL CICLO RESPIRATORIO
En los pulmones:
O
2
oxiHb liberacin de CO
2
En los tejidos:
CO
2
H+ desoxiHb liberacin de O
2
unin de CO
2
Hiperventilacin: prdida de CO
2
y menor estimulacin de la
liberacin de O
2
en los tejidos
BISFOSFOGLICERATO (BPG)
El CO
2
y la [H
+
] actan de forma rpida para facilitar el
intercambio de O
2
y CO
2
El BPG es un efector que acta a ms largo plazo,
permitiendo la adaptacin a cambios graduales de la
disponibilidad de O
2
.
El BPG reduce la afinidad de la Hb por el O
2
:
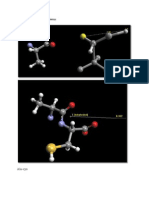
Se une a la Hb en una cavidad existente entre las
cadenas b, donde establece interacciones con los grupos
(+) que rodean esta cavidad
En la forma oxiHb la cavidad es pequea y no puede
unirse el BPG
En la forma desoxiHb se une estabilizando esta
conformacin.
Unin del 2,3-BPG a la desoxihemoglobina
Bioqumica Mathews, van Holde y Ahern. Addison Wesley 2002
CONSECUENCIAS FISIOLGICAS
A gran altitud la P
O2
es menor y provoca una cierta angustia
Nos aclimatamos porque se produce un aumento de la
sntesis de Hb y de BPG (favorece la liberacin de O
2
).
La en la sangre de fumadores es mayor. El CO se une
a la Hb en el mismo lugar que el O
2
formando carboxiHb e
impidiendo el transporte de O
2
.
Durante el periodo fetal, el feto obtiene el O
2
de la sangre de
la madre. La Hb fetal tiene cadenas g en lugar de b y
presentan menor afinidad por el BPG, lo que hace que la Hb
F tenga mayor afinidad por el O
2
que la adulta.
[BPG]
ANEMIA FALCIFORME
(Cada esfera representa una molcula de hemoglobina)
You might also like
- Proteinas TerciariasDocument22 pagesProteinas Terciariasapi-257268727No ratings yet
- Metabolismo NutricinDocument32 pagesMetabolismo Nutricinapi-257268727No ratings yet
- Tema4 1Document15 pagesTema4 1api-257268727No ratings yet
- Bioq Term y AaDocument15 pagesBioq Term y Aaapi-257268727No ratings yet
- Tema 6Document22 pagesTema 6api-257268727No ratings yet
- Tipos de CelulaDocument57 pagesTipos de Celulaapi-257268727No ratings yet
- Tema 3 SecuenciaDocument9 pagesTema 3 Secuenciaapi-257268727No ratings yet
- Tema 3 PeptidosDocument12 pagesTema 3 PeptidosJulio Soria QuispeNo ratings yet
- Tema 5-1Document27 pagesTema 5-1api-257268727No ratings yet
- Respiracin Celular y Ciclo de KresDocument12 pagesRespiracin Celular y Ciclo de Kresapi-257268727No ratings yet
- Tema 3 - AminoacidosDocument24 pagesTema 3 - Aminoacidosapi-257268727No ratings yet
- Tema 2-ProteinasDocument5 pagesTema 2-Proteinasapi-257268727No ratings yet
- Metabolismo de LipidosDocument73 pagesMetabolismo de LipidosLeonard StuyvesantNo ratings yet
- Metabolismo de LipidosDocument73 pagesMetabolismo de LipidosLeonard StuyvesantNo ratings yet
- Ciclo de KrebsDocument24 pagesCiclo de Krebsapi-257268727No ratings yet
- Metabolismo y CaractersticasDocument49 pagesMetabolismo y Caractersticasapi-257268727No ratings yet
- Metabolismo de Sustancias ImportantesDocument17 pagesMetabolismo de Sustancias Importantesapi-257268727No ratings yet
- El Metabolismo CelularDocument10 pagesEl Metabolismo Celularapi-257268727No ratings yet
- Saray Escalante Codigo GeneticoDocument9 pagesSaray Escalante Codigo Geneticoapi-259221039No ratings yet
- Metabolismo de CarbohidratosDocument14 pagesMetabolismo de Carbohidratosapi-257268727No ratings yet
- Ciclo Del Acido CitricoDocument17 pagesCiclo Del Acido Citricoapi-257268727No ratings yet
- Ciclo de KrebsDocument24 pagesCiclo de Krebsapi-257268727No ratings yet
- Yarineth Marchena Lab Virtual 1Document3 pagesYarineth Marchena Lab Virtual 1api-257268727No ratings yet
- Presentacion de BioquimicaDocument17 pagesPresentacion de Bioquimicaapi-257268727No ratings yet
- Lesión en Rotación Anterior DEL ILIACO IZQUIERDODocument2 pagesLesión en Rotación Anterior DEL ILIACO IZQUIERDOfridaleNo ratings yet
- Israel Fluoracion 8pDocument8 pagesIsrael Fluoracion 8pEneko LandaburuNo ratings yet
- Consentimiento Informado para CirugíaDocument2 pagesConsentimiento Informado para CirugíaJavier Sánchez GómezNo ratings yet
- Michel Perrin Enfoque Antropologico de Las DrogasDocument4 pagesMichel Perrin Enfoque Antropologico de Las Drogaslunalunera_78No ratings yet
- Toxicologia - FinalDocument42 pagesToxicologia - FinalFanita Alarcon TourisNo ratings yet
- MOF-321 Antisepticos y DesinfectantesDocument52 pagesMOF-321 Antisepticos y DesinfectantescarlosarnaldoNo ratings yet
- DOLGENAL 30mg Inyectable 09.03.2017 ISP hv6kDocument6 pagesDOLGENAL 30mg Inyectable 09.03.2017 ISP hv6kAlejandra RojasNo ratings yet
- Presentación Sin TítuloDocument27 pagesPresentación Sin TítuloMagaly Garcia100% (1)
- EnsayoDocument3 pagesEnsayoRuben Meneses SanchezNo ratings yet
- Células de La Inmunidad INNATA 1Document8 pagesCélulas de La Inmunidad INNATA 1imane imaneNo ratings yet
- Ejercicio Sobre Las Enfermedades de Transmisión SexualDocument4 pagesEjercicio Sobre Las Enfermedades de Transmisión Sexualvilloso1936100% (1)
- Célula Madre (WIKIPEDIA)Document10 pagesCélula Madre (WIKIPEDIA)Ricardo WeschenfellerNo ratings yet
- Guia Lab YogurtDocument4 pagesGuia Lab YogurtCristian MedinaNo ratings yet
- PDF Lesiones DeportivasDocument14 pagesPDF Lesiones DeportivasMatilde Espinoza Olivares100% (1)
- Cuestionario de Biología y QuímicaDocument3 pagesCuestionario de Biología y QuímicaManuel Carranza VillanuevaNo ratings yet
- Superintensivo Residentado2019Document7 pagesSuperintensivo Residentado2019Jesus ManriqueZavaleta100% (1)
- Evaluacion Nutricional Pautas SVPPDocument43 pagesEvaluacion Nutricional Pautas SVPPcarlos hernandezNo ratings yet
- Principio de OrganicidadDocument23 pagesPrincipio de OrganicidadPaola Garcia AmaroNo ratings yet
- Vademecum GT 2022Document32 pagesVademecum GT 2022Eduardo LopezNo ratings yet
- Comisión Permanente de EnfermeríaDocument3 pagesComisión Permanente de EnfermeríaUnicha EnfermeríaNo ratings yet
- Cateterismo de Vasos Umbilicales en El NeonatoDocument6 pagesCateterismo de Vasos Umbilicales en El NeonatoNirka SánchezNo ratings yet
- Materia Médica Completa IDocument574 pagesMateria Médica Completa IItzayana SalazarNo ratings yet
- Ojo RojoDocument3 pagesOjo RojoAdela Marìa P LNo ratings yet
- 05 Obesidad, Sind. Metabolico y Diabetes Mellitus en Niños - Dr. CARLOS DEL AGUILADocument53 pages05 Obesidad, Sind. Metabolico y Diabetes Mellitus en Niños - Dr. CARLOS DEL AGUILAgabita_0099310No ratings yet
- Sesion 14 Estandarizados para Productos OtrosDocument5 pagesSesion 14 Estandarizados para Productos OtrosGlisseth LizanoNo ratings yet
- Informe CovidDocument7 pagesInforme CovidMarcela CarvajalNo ratings yet
- Sitio de Aplicación y Absorción de Los Medicamentos Por La Vía Oral y Nasal en Las AvesDocument14 pagesSitio de Aplicación y Absorción de Los Medicamentos Por La Vía Oral y Nasal en Las AvessamanthaNo ratings yet
- Polihidramnios y OligoamniosDocument19 pagesPolihidramnios y OligoamniosSkate Nheo Rosas TeranNo ratings yet
- Revista de Neuro PsiquiatriaDocument11 pagesRevista de Neuro PsiquiatriaAbigaill Quipe VelasquezNo ratings yet
- 2 para Que Sirve La ManzanillaDocument6 pages2 para Que Sirve La ManzanillaRafa PeralesNo ratings yet