Professional Documents
Culture Documents
Preparación de Soluciones Amortiguadoras y Determinación de PH
Uploaded by
macpollo940 ratings0% found this document useful (0 votes)
431 views4 pagesOriginal Title
Preparación de Soluciones Amortiguadoras y Determinación de Ph
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
431 views4 pagesPreparación de Soluciones Amortiguadoras y Determinación de PH
Uploaded by
macpollo94Copyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 4
1
DETERMINACIN DE pH Y PREPARACIN DE SOLUCIONES AMORTIGUADORAS
OBJETIVOS:
1. Que los estudiantes estn en capacidad de preparar soluciones acuosas de cidos y bases y de titular
soluciones.
2. Que los estudiantes estn en capacidad de preparar soluciones patrones amortiguadoras.
3. Que el estudiante adquiera destrezas en el manejo del potencimetro.
FUNDAMENTO
Todos los organismos vivos requieren regular la concentracin de iones hidrgeno, en un margen estrecho de
pH. Para ello utilizan unas soluciones amortiguadoras, tambin llamadas tampn o buffer. Una solucin
amortiguadora es una solucin acuosa de un cido dbil y su sal o una base dbil y su sal (Por ejemplo, cido
actico y acetato de sodio; hidrxido de amonio y cloruro de amonio), de tal forma que la adicin de un cido o
una base produce cambios pequeos de pH. La mxima eficacia de amortiguamiento ocurre cuando la
proporcin base / cido es de 1/1. Esta composicin 50:50 (equimolar) se la puede calcular para fines prcticos y
el problema est en decidir las cantidades que se necesitan del cido y de su base conjugada, para amortiguar la
solucin a un pH predeterminado y es la misma relacin de los constituyentes la que fija el pH.
A partir de la ecuacin
pH
=
pKa + log [base]
[cido]
Conociendo el pKa y el pH al que se quiere una solucin amortiguadora, podemos determinar la relacin
base/cido. El pKa de una solucin se lo determina experimentalmente y es el logaritmo negativo de Ka. El
mismo anlisis se hace para pKb.
Empleo del potencimetro.
Uno de los dispositivos ms utilizados para medir el pH es el electrodo de vidrio, el cual consiste en una
membrana delgada de vidrio especial, colocada entre una media celda de plata-cloruro de plata y la solucin
cuyo pH se requiere establecer. La otra mitad de la celda es un electrodo de calomel, formado por cloruro
mercurioso slido, sobre mercurio metlico. Dentro de la celda de vidrio que contiene el electrodo Ag-AgCl se
encuentra HCl 0.1M, lo cual establece en uno de los lados de la membrana de vidrio un pH (actividad de iones
hidrgeno) constante y conocido con exactitud. La solucin de pH desconocido y la media celda estn unidas por
un p puente de KCl.
En resumen, la celda electroltica completa sera del tipo:
Ag AgCl
(s)
HCl vidrio solucin
desconocida
KCl
(sat)
Hg
2
Cl
2
Hg
Experimentalmente se ha visto que el potencial elctrico del electrodo de vidrio vara con los cambios de pH de
la solucin problema (desconocida). Adems este potencial es una funcin lineal del pH. En
otros trminos si se construye una curva empleando uno de los ejes del potencial del electrodo de vidrio y en el
otro el pH, se obtiene una lnea recta cuya pendiente, E / pH es de 0.0591 voltios por unidad de pH.
2
REACTIVOS Y MATERIALES
HCl 0.5M probeta graduada de 100 ml.
NaOH 0.5M 8 vasos de precipitados de 50 ml.
cido actico 0,5 M Pipeta graduada de 10ml.
Acetato de sodios 1 M pipeta graduada de 1ml
Acetato de amonio 1M 10 tubos de ensayo de 10 mL.
Fosfato dicido de sodio 1 M 5 pHmetros
Fosfato cido de sodio 1 M Papel indicador universa
Glicina 0.1 M
5 vasos de precipitados de 50 mL
Pipeta de 10 mL
Probeta de 50 mL
Agitador magntico
Bureta de 50 mL
PROCEDIMIENTO:
1. PREPARACIN DE UNA SOLUCIN AMORTIGUADORA.
En un vaso de precipitados de 50 ml. rotulado A, limpio y seco, deposite 20 ml de solucin de cido actico
0.5M y mida el pH con peachmetro. En otro vaso de precipitados rotulado B, limpio y seco, deposite 20 ml de
solucin de acetato de sodio 0.5M y mida su pH.
Vierta la solucin de acetato de sodio (vaso B ) en el vaso de precipitados que contiene la solucin de cido
actico (vaso A ) y mida nuevamente el valor de pH. En todos los casos anote el valor de pH.
A continuacin, coloque en dos vasos de precipitados de 50 ml, rotulados C y D, 20 ml de agua destilada en
cada uno. Mida el pH del agua destilada contenida en el vaso C, y luego adicione 2 ml de HCl 0.5 M, agite y
mida nuevamente el pH.
Al vaso D, adicinele 3 ml de NaOH 0.5 M, agite y determine el valor de pH.
En otros dos vasos de precipitados de 50 ml, rotulados E y F, coloque en cada uno 20 ml de la solucin
amortiguadora de acetato que se encuentra en el vaso A.
Al vaso E adicinele 2 ml de HCl 0.5 M, agite y determine el valor del pH.
Al vaso G adicinele 2 ml de NaOH 0.5 M, agite y determine el valor del pH.
2. PREPARACIN DE OTRAS SOLUCIONES AMORTIGUADORAS.
A partir de las soluciones que aparecen en la mesa de reactivos, cada grupo debe preparar 50 ml de una de las
siguientes soluciones amortiguadoras (asignada por el profesor):
Acetato 0.1 M, pH 4.5. pKa = 4.76 para el cido actico y acetato
Acetato 0.5 M, pH 5.0 pKa = 2.14 para H
3
PO
4
Fosfato 0.1 M, pH 7.0 pKa = 7.20 para H
2
PO
4
-
Fosfato 0.5 M, pH 7.5 pKa = 12.4 para HPO
4
-2
Amonio 0.1 M, pH 9.0 Kb = 1.8 x 10
-5
para el hidrxido y cloruro de amonio
Amonio 0.5 M, pH 9.5
3
Mida el pH de la solucin amortiguadora preparada por usted y compruebe si coincide con el valor que se
intentaba obtener de acuerdo a los clculos. Compruebe la eficacia de su solucin agregando 1 ml de cido
clorhdrico 0,1 M y luego midiendo nuevamente el pH.
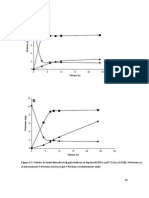
3. CURVA DE TITULACIN DE GLICINA
a) En un vaso de precipitados de 50 mL, coloque 20 mL de Glicina 0.1M. Determine el pH de la muestra con el
potencimetro.
Seguidamente titule aadiendo varios volmenes de HCl 0.1M que se indican en la tabla 1.2 y registre sus
resultados en la tabla.
Realice la misma operacin utilizando 20 mL de glicina 0,1 M y titule con varios volmenes de NaOH 0,1 M y
registre sus resultados en la tabla 1.3.
Tabla N 1.2
mL agregados de
HCl 0.1M
pH de la
solucin de
Glicina
mL agregados de
HCl 0.1M
pH de la
solucin de
Glicina
aadidos acumulados aadidos acumulados
0
1 1 2 12
1 2 2 14
2 4 2 16
2 6 2 18
2 8 2 20
2 10 2 22
Tabla N 1.3
mL agregados de
NaOH 0.1M
pH de la
solucin de
Glicina
mL agregados de
NaOH 0.1M
pH de la
solucin de
Glicina
aadidos acumulados aadidos acumulados
0
1 1 2 12
1 2 2 14
2 4 2 16
2 6 2 18
2 8 2 20
2 10 2 22
Elabore la grfica de pH en funcin del volumen acumulado de HCl y NaOH. En la curva de
titulacin, calcule los pKa de los grupos amino y carboxilo. Compare los pKa obtenidos en la curva, con
los valores tericos para Glicina .
RESULTADOS.
4
1. Explique porqu se pueden preparar soluciones amortiguadoras con el mismo pH y diferentes
concentraciones de los mismos componentes o con diferentes pH pero igual concentracin, como en el
punto 7.
2. Realice la curva de titulacin de cada una de las soluciones. pH vs. HCl adicionado.
You might also like
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadFrom EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNo ratings yet
- PRACTICA 3 Ley DE BOYLEDocument4 pagesPRACTICA 3 Ley DE BOYLEKevin Brandon Vargas RamosNo ratings yet
- Titulación de Aminoácidos: Determinación de pka, pk y plDocument8 pagesTitulación de Aminoácidos: Determinación de pka, pk y plEliana Valentina Perez CardenasNo ratings yet
- Araceli 2 Borrador 1Document6 pagesAraceli 2 Borrador 1Efrainmt Pucheta RosseessNo ratings yet
- Informe de Laboratorio 3 BioquimicaDocument8 pagesInforme de Laboratorio 3 Bioquimicamarcelavt16No ratings yet
- Teoría Sensorial y Molecular Del Sabor DulceDocument9 pagesTeoría Sensorial y Molecular Del Sabor DulceDuvan Alexis Mira MarinNo ratings yet
- Destilación vapor mandarinaDocument5 pagesDestilación vapor mandarinaMauricio Monguí RodríguezNo ratings yet
- Cromatografía de aminoácidosDocument7 pagesCromatografía de aminoácidosAngel ZurielNo ratings yet
- Determinación de acidez y almidón en salchichasDocument11 pagesDeterminación de acidez y almidón en salchichasDomenica Gisell MuñozNo ratings yet
- Amilasa y CatalasaDocument4 pagesAmilasa y CatalasaYULISA ZURITA CARRASCONo ratings yet
- Post Carne 10 AnalisisDocument7 pagesPost Carne 10 AnalisisSebastian DelgadoNo ratings yet
- 05 04 Extraccion de CafeinaDocument6 pages05 04 Extraccion de CafeinaNatalia TorresNo ratings yet
- Bioenergética y Metabolismo de CarbohidratosDocument24 pagesBioenergética y Metabolismo de CarbohidratosaymethNo ratings yet
- 1 Destilacion Por Arrastre de VaporDocument6 pages1 Destilacion Por Arrastre de VaporOz Hdz100% (1)
- SaponificacionDocument4 pagesSaponificacioncarlos condoriNo ratings yet
- Extraccion CAFEÍNADocument26 pagesExtraccion CAFEÍNAJesús Adrián Gómez Ortiz100% (1)
- Informe EquilibrioDocument13 pagesInforme EquilibrioEstefany Duran LondoñoNo ratings yet
- Determinacion de BicarbonatosDocument3 pagesDeterminacion de BicarbonatosCgamez 123No ratings yet
- Ciclo de KrebsDocument19 pagesCiclo de KrebsCamila Vargas VeraNo ratings yet
- Isotermas de Adorsión.Document8 pagesIsotermas de Adorsión.96884643*50% (2)
- AmortiguadoresDocument4 pagesAmortiguadoresrocio_11No ratings yet
- Valoraciones Precipitación ComplejosDocument29 pagesValoraciones Precipitación ComplejosGustavo BarrazaNo ratings yet
- Informe 5 Descenso CrioscópicoDocument14 pagesInforme 5 Descenso CrioscópicoCATHERINE MARQUEZ TILANONo ratings yet
- Preparaciones de Soluciones Amortiguadoras CompletoDocument9 pagesPreparaciones de Soluciones Amortiguadoras CompletoAbdielE.AraúzNo ratings yet
- Informe de NitraciónDocument6 pagesInforme de Nitraciónandres guerreroNo ratings yet
- Papas FritasDocument7 pagesPapas FritasLESLY VANESSA CASTILLO ORDAZNo ratings yet
- 9Document2 pages9CHAQUITONo ratings yet
- Preparación de soluciones amortiguadoras de pH en laboratorio de química analíticaDocument3 pagesPreparación de soluciones amortiguadoras de pH en laboratorio de química analíticaJessica Carreño C.No ratings yet
- Taller Primera LeyDocument4 pagesTaller Primera LeyScribdLibros11No ratings yet
- Informe 2 CineticaDocument7 pagesInforme 2 CineticaFernando GabrielNo ratings yet
- TITULACION DE AMINOACIDOS LabDocument12 pagesTITULACION DE AMINOACIDOS LabDaniela AvendañoNo ratings yet
- Practica #3 Extracción de La PiperinaDocument12 pagesPractica #3 Extracción de La PiperinaAngelica UsugaNo ratings yet
- Informe de Aminoácidos - Grupo 9Document9 pagesInforme de Aminoácidos - Grupo 9Jonathan Andres Ortiz ForeroNo ratings yet
- Cinetica LactasaDocument122 pagesCinetica LactasaalvarezriNo ratings yet
- Bombeo de Protones en Levaduras y Sus Procesos InhibitoriosDocument9 pagesBombeo de Protones en Levaduras y Sus Procesos InhibitoriosLina VidalNo ratings yet
- Qué son las proteínas y sus funciones principalesDocument9 pagesQué son las proteínas y sus funciones principalesOscar E RSNo ratings yet
- TABLAS DE ETERES - Identificación Química.Document3 pagesTABLAS DE ETERES - Identificación Química.angelcaido666xNo ratings yet
- Manjar de LecheDocument39 pagesManjar de Lechejohanna stefaniaNo ratings yet
- Síntesis de benzocaína y acetilación de amina primariaDocument7 pagesSíntesis de benzocaína y acetilación de amina primariaIsberto Martínez0% (1)
- PRACTICA 6 Fosfolipi 2014 IDocument4 pagesPRACTICA 6 Fosfolipi 2014 IYvonne MillsNo ratings yet
- Informe Practica #01 Determinación de Azucares Reductores Por El Método DNSDocument6 pagesInforme Practica #01 Determinación de Azucares Reductores Por El Método DNSOsiris Zuleima Algarin MorenoNo ratings yet
- Práctica de laboratorio sobre fermentación y formación de piruvatoDocument22 pagesPráctica de laboratorio sobre fermentación y formación de piruvatoMARIA FERNANDA GUERRA MANCERANo ratings yet
- Calor Especifico Del Cuerpo HumanoDocument7 pagesCalor Especifico Del Cuerpo HumanoMichelle CorredorNo ratings yet
- Acido Acetico - En.esDocument21 pagesAcido Acetico - En.esLAURA VALENTINA ARIAS RINCONNo ratings yet
- METODOLOGÍA BiuretDocument4 pagesMETODOLOGÍA BiuretAnibalNo ratings yet
- Extraccion de ProteinasDocument17 pagesExtraccion de ProteinasPedro CUICAPUSA QUISPENo ratings yet
- Isotermas de adsorción: Laboratorio de química de alimentosDocument8 pagesIsotermas de adsorción: Laboratorio de química de alimentosCésar Fernando Melquiades BravoNo ratings yet
- Informe 1 CarbohidratosDocument11 pagesInforme 1 CarbohidratosStevenFelipeNo ratings yet
- Prácticas QIV56de PDFDocument15 pagesPrácticas QIV56de PDFLuis BowsNo ratings yet
- FQ - 2QV1 - Eq. 1 - P. 9 Adsorción IDocument10 pagesFQ - 2QV1 - Eq. 1 - P. 9 Adsorción IJesus Alberto Martinez GutierrezNo ratings yet
- Laboratorio Biología PrácticaDocument8 pagesLaboratorio Biología PrácticaAlejandroNo ratings yet
- Saponinas EsteroidesDocument3 pagesSaponinas EsteroidesNathaliaVegaNo ratings yet
- Reconocimiento de BiomoléculasDocument9 pagesReconocimiento de BiomoléculasNelsonForeroNo ratings yet
- Determinación de Acidez Del Acido Acético en VinagreDocument6 pagesDeterminación de Acidez Del Acido Acético en Vinagrewilber gutierrezNo ratings yet
- Determinación de Azúcares Reductores Por El Método DNSDocument9 pagesDeterminación de Azúcares Reductores Por El Método DNSlindaNo ratings yet
- Informe 3 - Extracción de La CafeínaDocument5 pagesInforme 3 - Extracción de La CafeínaStephanie GabriellaNo ratings yet
- Practica de Analisis, 4 PH y AcidezDocument7 pagesPractica de Analisis, 4 PH y AcidezDiana Muñoz CisnerosNo ratings yet
- Informe Propiedades de Los PolisacaridosDocument5 pagesInforme Propiedades de Los PolisacaridosjairoNo ratings yet
- PH y Soluciones Amortiguadoras. QuimicaDocument4 pagesPH y Soluciones Amortiguadoras. QuimicaestebanNo ratings yet
- Determinación de PH y Soluciones AmortiguadorasDocument3 pagesDeterminación de PH y Soluciones AmortiguadorasBrayan MejíaNo ratings yet
- Determinación Experimental Del PHDocument14 pagesDeterminación Experimental Del PHCharlieTitoValleLeon67% (3)
- Guia Estandarizacion de NaohDocument15 pagesGuia Estandarizacion de NaohDeya DeyaNo ratings yet
- Diagrama distribución especies Pb-nitratoDocument5 pagesDiagrama distribución especies Pb-nitratoJavier JuarezNo ratings yet
- Informe de Laboratorio (En Grupo) 10.Document6 pagesInforme de Laboratorio (En Grupo) 10.Melissa Ruiz PérezNo ratings yet
- 6-Ordene Las Siguientes Especies en Orden Decreciente de Acidez. Justifique Su RespuestaDocument1 page6-Ordene Las Siguientes Especies en Orden Decreciente de Acidez. Justifique Su RespuestaJubitza Maribel Izaguirre HernandezNo ratings yet
- Estimulación Carbonatos E3Document34 pagesEstimulación Carbonatos E3SantiagoVélezSNo ratings yet
- Guia Acidos y Bases Grado NovenoDocument6 pagesGuia Acidos y Bases Grado NovenoLauraNo ratings yet
- Laboratorio Virtual Simulador Titulación Ácido BaseDocument17 pagesLaboratorio Virtual Simulador Titulación Ácido BaseKatty Doris Cordova ValverdeNo ratings yet
- Electrodos de PH Características: Ficha TécnicaDocument3 pagesElectrodos de PH Características: Ficha TécnicaCLAUDIONo ratings yet
- Formulario Reacciones Acido BaseDocument3 pagesFormulario Reacciones Acido BaseMisael OrellanoNo ratings yet
- Lab 1Document6 pagesLab 1Jhony Garcia RomeroNo ratings yet
- Guía 6 - Determinar Acidez Total, Fija, Volátil 2020Document5 pagesGuía 6 - Determinar Acidez Total, Fija, Volátil 2020Celina Ramos CervantesNo ratings yet
- PRÁCTICA de PH en SimuladorDocument9 pagesPRÁCTICA de PH en SimuladorIsabella GomezNo ratings yet
- Actividad de Puntos Evaluables - Escenario 6 - SEGUNDO BLOQUE-CIENCIAS BASICAS - VIRTUAL - FUNDAMENTOS DE QUÍMICA - (GRUPO B04)Document8 pagesActividad de Puntos Evaluables - Escenario 6 - SEGUNDO BLOQUE-CIENCIAS BASICAS - VIRTUAL - FUNDAMENTOS DE QUÍMICA - (GRUPO B04)SantiagoNo ratings yet
- Exp 1 Practica 5Document4 pagesExp 1 Practica 5Adder Alferez QuispeNo ratings yet
- Qma-111-U5 Guía de LecturaDocument10 pagesQma-111-U5 Guía de LecturaiWant PS PludNo ratings yet
- Momenclatura Inorganica QuimicaDocument2 pagesMomenclatura Inorganica QuimicaRafael JulcarimaNo ratings yet
- Guía de Ejercicios Clase 4Document3 pagesGuía de Ejercicios Clase 4Martin LuraschiNo ratings yet
- Nomeclatura Nomenclatura InorganicaDocument3 pagesNomeclatura Nomenclatura InorganicamelquiadesNo ratings yet
- Taller Equilibrio 2011Document5 pagesTaller Equilibrio 2011Juliana Cardona NorenaNo ratings yet
- Informe de Titulación de AminoacidosDocument5 pagesInforme de Titulación de AminoacidosAurita RojasNo ratings yet
- Determinación de carbonato y bicarbonato mediante potenciometría ácido-baseDocument9 pagesDeterminación de carbonato y bicarbonato mediante potenciometría ácido-baseLuisa GonzalezNo ratings yet
- Calculo PH Soluciones BufferDocument1 pageCalculo PH Soluciones Bufferlulo_30% (2)
- Guia Ejercicios Acido-BaseDocument2 pagesGuia Ejercicios Acido-BaseElio Yañez DuarteNo ratings yet
- Química I - Ejercicios de equilibrio químico y pHDocument2 pagesQuímica I - Ejercicios de equilibrio químico y pHMarlonFabricioCayoNo ratings yet
- Hidruros No Metálicos e Hidróxidos.Document9 pagesHidruros No Metálicos e Hidróxidos.Carla Gabriela FelicianoNo ratings yet
- Informe Sistemas AmortiguadoresDocument6 pagesInforme Sistemas AmortiguadoresSara JimenexNo ratings yet
- Equilibrio químico de una disolución de amoníacoDocument51 pagesEquilibrio químico de una disolución de amoníacoMr ADCNo ratings yet
- PH, Acidez y Alcalinidad (Nueva)Document25 pagesPH, Acidez y Alcalinidad (Nueva)maria acostaNo ratings yet
- PRACTICA 8 AmortiguadoresDocument8 pagesPRACTICA 8 AmortiguadoresAide L. HurtadoNo ratings yet