Professional Documents
Culture Documents
Quimica Orgánica
Uploaded by
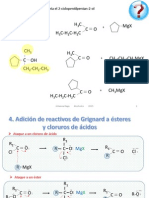
Natalia Romero Córdoba0 ratings0% found this document useful (0 votes)
7 views4 pagesCopyright
© © All Rights Reserved
Available Formats
DOC, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
7 views4 pagesQuimica Orgánica
Uploaded by
Natalia Romero CórdobaCopyright:
© All Rights Reserved
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
You are on page 1of 4
1
Construccin y caracterizacin de compuestos de carbono con el uso de modelos moleculares
Construction and characterization of carbons chains using molecular models
RESUMEN
El carbono es un elemento que se encuentra en el grupo IV, por tal razn tiene
cuatro electrones en el nivel de valencia, la posicin que ocupa en la tabla
peridica indica que tiene las propiedades necesarias para formar variedad de
cadenas carbonadas, es all en dnde la qumica orgnica tiene su campo de
estudio.
P!"RS C!#ES$, Frmula molecular, grupo funcional, ibridacin,
idrocarburos, isomera,
"S%RC%
The carbon is an element which is found in the IV group, for this reason it has
four electrons in its last energy level, the position that it occupy in the periodic
table indicates that it has the necessary properties for do variety of carbon
chains, this is where the chemistry has its scope.
&E'()R*S$ functional group, hybridization, hydrocarbons, isomerism,
molecular formula,
N%!+ R)MER) C)R*)"
!"1!1"1"""#
$niversidad %istrital F&'
lcaponteb (correo.udistrital.edu.co
*N+E! MEN*), )!R%E
!"1!1"1""")
$niversidad %istrital F&'
dmendozao(correo.udistrital.edu.co
-. +N%R)*UCC+/N
En la naturaleza e*iste gran cantidad de compuestos de
carbono surgiendo as la necesidad de clasificarlos +
estudiarlos antiguamente se crea que los compuestos
orgnicos solo se encontraban en los seres vivos + no se
podan sintetizar a partir compuestos inorgnicos o+
sabemos que esto no es cierto + se sintetizan con materia
inorgnica, es as como se facilito su estudio pues para
ello se tienen en cuenta las diferentes propiedades que
presentan + que generan similitudes entre ellos logrando
organizarlos.
,ara el estudio de los compuestos se observan las
cadenas idrocarbonadas que lo forman, la forma en la
que comparten los electrones los tomos de carbono + los
tipos de enlaces que poseen los mismos, as como su
estructura molecular, los grupos funcionales que se
encuentran en la mol-cula + los tipos de tomos de
carbonos pues todas estas caractersticas le otorgan
propiedades fsicas + qumicas especificas a cada
compuesto.
'on el modelo de barras + esferas se puede lograr una
representacin molecular de una cadena idrocarbonada
este modelo es .til pues en su construccin se logran
observar los tipos de ibridacin que poseen los tomos
de carbono los grupos funcionales as como la estructura
de la misma.
0. RESU!%*)S ' N1!+S+S *E RESU!%*)S
0.-. %ipos de hibridacin del carbono
El carbono, debido a estar en el grupo IV presenta cuatro
electrones en su .ltimo nivel de energa, de -sta manera
tiene la propiedad de enlazarse presentando enlaces
sencillos, dobles + triples los cules determinan el ngulo
que presentar en enlace, siendo -stos 11"/, 1!"/ + 1#"/,
respectivamente estos ngulos en las mol-culas se deben
seg.n lo reportado por 0c 0urr+ 1!""#2 a la geometra
molecular de cada tomo de carbono seg.n la teora de
repulsin de pares de electrones de valencia la geometra
es tetragonal en los dobles es trigonal + la de enlace triple
lineal. El carbono presenta tres tipos de ibridacin sp),
sp! + sp, -stos dependen de la clase de enlace, de -sta
manera3
Enlace sencillo
Imagen1. 4ibridacin sp)
Enlace doble
Imagen!. 4ibridacin sp!
Enlace triple
Imagen). 4ibridacin sp
0.0 %ipos de Carbonos
5os carbonos se dividen seg.n la cantidad de idrgenos
con los que se enlacen
'arbono ,rimario3 se enlaza a un tomo de carbono + a
tres tomos de idrogeno
'arbono secundario3 se enlaza a ! tomos de idrogeno
+ posee ! enlaces con otro u otros tomos
'arbono terciario3 se enlaza a 1 tomo de idrogeno +
posee ) enlaces con otro u otros tomos diferentes al
idrogeno
'arbono cuaternario3 no posee enlaces con tomos de
idrogeno
0.2 3rupos funcionales
$n grupo funcional es el tomo o con6unto de tomos que
le confiere unas caractersticas propias a las mol-culas,
entre estos3
7lcanos3
5os 7lcanos son poco mu+ poco reactivos + tienen la
formula molecular 'n4!n8! estos compuestos son
insolubles en agua
7lquenos3
El doble enlace que presenta el alqueno es su parte
ms reactiva este doble enlace no puede rotar por lo
que mucos de estos muestran isomera geom-trica
seg.n lo e*puesto por 9ade 1!"":2. 5a formula
general de los alquenos es 'n4!n
7lquinos3
5a formula general de un alquino es 'n4!n;! son
poco polares + por esto insolubles en agua los puntos
de fusin + ebullicin aumentan con el peso molar
7lcooles3
5os alcooles son mu+ polares esto se debe a su
grupo <4 estos tienen un punto de ebullicin muco
ma+or a los idrocarburos debido a que el o*igeno
tiene pares de electrones sin compartir puede actuar
como base de 5e=is seg.n lo reportado por Velasco
1!"">2
?teres3
5os -teres son muco ms polares que los
idrocarburos + los puntos de ebullicin ms altos
que los alcanos son estables.
@ioles3
Aon ms cidos que los alcooles
7ldedos3
Aon compuestos altamente reactivos por su grupo
carbonilo la solubilidad en agua depende de la
longitud de la cadena asta B carbonos son
significativamente solubles con mas carbonos su
solubilidad disminu+e
'etonas3
Es fuertemente polar + la ma+ora se disuelven en
agua
Ccidos carbo*licos
Aon fuertemente polares + relativamente solubles en
agua son la combinacin entre un grupo carbonilo +
un grupo idro*ilo
4alogenuros
,oseen un punto de ebullicin ms alto que los
alcanos + este depende del peso atmico que
tenga el algeno + del n.mero de carbonos de
la cadena
Esteres3
Ae forman por la reaccin de un acido con un
alcool, son slidos cristalinos se solubilizan en
compuestos orgnicos pero no en agua + su
densidad es menor que la del agua
7midas3
!
Acientia et @ecnica 7Do EIII, Fo *, 0es de !""*. $niversidad @ecnolgica de ,ereira.
Ae derivan de cidos que se forman de la
combinacin de un acido amoniaco con una
amina
7ndridos 3
,oseen ba6os puntos de fusin + ebullicin son mu+
reactivos
0.4 +somer5a
Ismeros son dos o ms compuestos que tienen la misma
frmula molecular pero pueden variar en diferentes
aspectos, de esta manera los ismeros se clasifican en3
Funcional3 %iferente grupo funcional al
construir el ismero de funcin es importante
tener en cuenta el tipo de enlace en su grupo
funcional pues si estando con enlace doble pasa
a sencillo se pierde un idrogeno lo que ace
que la formula molecular no se cumpla por lo
cual no ser un ismero del compuesto inicial.
Imagen:.Ismero funcional
%e posicin3 'ambia la posicin del grupo
funcinales la cadena. En el butanol + el !;
butanol se presenta isomera de posicin seg.n
,-rez 11GG>2
ImagenB. Ismero de posicin
%e esqueleto3 @ienen diferente esqueleto
carbonado
,ara la formula molecular 'B41! se
encontraron ) ismeros de esqueleto que se
diferencian en sus ramificaciones lo cual est de
acuerdo con lo reportado por 9ade1!"":2 el
punto de ebullicin en los ismeros de cadena
lineal es ma+or que en los ismeros que
presentan cadena ramificada los ismeros de
cadena aumentan al mismo tiempo que aumenta
la cantidad de tomos de carbono seg.n este
anlisis los ismeros son3
Imagen>.Ismero de esqueleto
Heom-trica3 Es necesario que e*ista un doble
enlace + que el carbono tenga dos sustitu+entes
diferentes del idrgeno lo cual es coerente
con lo presentado por 9ade 1!"":2 quien
e*pone que son ismeros geom-tricos o
estereoisomeros cuando se diferencian en la
orientacin espacial de los grupos que van
unidos al doble enlace. El grupo cis tiene los
sustitu+entes diferentes del idrogeno en el
mismo lado + el trans en lados opuestos
ImagenI.Ismero geom-trico, de trans a cis
Jptica3 Ae presenta el enantiomero 1imagen
especular2 + el diastermero 1cambia la
disposicin los carbonos quirales pues se rotan2.
%e acuerdo con lo e*puesto por ,-rez 11GG>2
debe e*istir un carbono quiral la cantidad de
ismeros pticos esta determinada por la
formula !Kn donde n es el numero de carbonos
quirales
Imagen#.Ismero ptico. I + II L III + IV Enantimeros
I + III L II + IV %iasteremeros
MMMMMMMMMMMMMMMMMMMMMMMMMMMM
1. 5as notas de pie de pgina debern estar en la pgina donde se citan. 5etra @imes Fe= Noman de # puntos
)
I
III
II
IV
2. C)NC!US+)NES ' REC)MEN*C+)NES
5os tomos de carbono al formar cuatro enlaces
acen posible la combinacin con diversos
elementos por lo que se crean bastantes
compuestos que tienen como caracterstica
principal una cadena idrocarbonada en su
estructura
5os grupos funcionales le otorgan caractersticas
qumicas propias a cada compuesto, es
importante tener en cuenta en su construccin si
el grupo funcional puede ir en cualquier
posicin o es terminal en la cadena
idrocarbonada.
En la construccin de ismeros se debe revisar
que al girar la mol-cula esta no va+a a ser igual
al compuesto original
5a forma ms fcil de realizar un ismero
funcional es cambiarlo de acuerdo al tipo de
enlace que presente, se cambia un doble enlace
por doble enlace + enlace sencillo por enlace
sencillo teniendo en cuenta la formula molecular
del compuesto
E*iste una forma que puede a+udar al momento
de clasificar los tipos de carbono + es contando
la cantidad de enlaces que presente el carbono
sin tener en cuenta los enlaces con idrogeno si
presenta un enlace diferente a los enlaces con el
idrogeno ser primario dos secundario tres
terciario cuatro cuaternario aunque lo que prima
realmente al momento de clasificar es la
cantidad de idrgenos que posea
4. RE6ERENC+S "+"!+)3R16+CS
O1P 5.'. 9ade, Qumica orgnica, B ed., ,eters, Ed
0adrid3 0cHra=;4ill, !"":, pp B:;I).
O!P &.7 ,erez, Qumica teoras y problemas vol. I, &.
,eters, Ed. 3 tebar flores,1GG>, pp. !BI;!I".
O)P &. 0c0urr+, Qumica orgnica, I ed., 0-*ico3
'engage 5earning,!""#, pp 1!;1G
O:P 0. Velasco !rupos funcionales nomenclatura y
reacciones 1 ed., 0-*ico3 $F70 ,!""> pp 1);:I
OBP &. Qarrio "sica y #umica Vol I 3Edite*, !""# pp
1G";1G)
:
You might also like
- Recinas NaturalesDocument32 pagesRecinas Naturalesjose bari regalado andoaNo ratings yet
- Manual de Capacitación AmbientalDocument190 pagesManual de Capacitación AmbientalRaulFarrerAraujo67% (3)
- TEJIDOS DE PUNTO - FinalDocument44 pagesTEJIDOS DE PUNTO - Finalanon_600990830% (1)
- Clasificación de Los AnionesDocument3 pagesClasificación de Los AnionesJoelsant60% (5)
- Cito EsqueletoDocument28 pagesCito EsqueletoAle CruzNo ratings yet
- Composicion ShimabukuVega NaomiDocument82 pagesComposicion ShimabukuVega NaomiAnni JulcaNo ratings yet
- Los CarbohidratosDocument10 pagesLos CarbohidratosHeydy Pamela Lucero PurihuamanNo ratings yet
- TP 12 - Cetogénesis y Cetolisis. Cetoacidosis - 2015Document6 pagesTP 12 - Cetogénesis y Cetolisis. Cetoacidosis - 2015docsamu78No ratings yet
- Química Orgánica - Tercero de BachilleratoDocument13 pagesQuímica Orgánica - Tercero de BachilleratoPotato Pato100% (1)
- Trigliceridos RepasoDocument9 pagesTrigliceridos RepasoPatrick Ansport PvNo ratings yet
- Actividad IndividualDocument22 pagesActividad IndividualAleja Carmona BermudezNo ratings yet
- Examen de C y ADocument7 pagesExamen de C y AJulia GarciaNo ratings yet
- Lab SuspirosDocument13 pagesLab SuspirosSaura Daniela Prado BastidasNo ratings yet
- Clasificación de Los Seres VivosDocument34 pagesClasificación de Los Seres Vivosatman17No ratings yet
- Adulteraciones de La Crema de Leche PDFDocument8 pagesAdulteraciones de La Crema de Leche PDFMauroNo ratings yet
- Alcoholes. Parte IIDocument33 pagesAlcoholes. Parte IIMarvin 'RmirezNo ratings yet
- TAREA Metodos de Prueba Vino Tinto Laura MéndezDocument4 pagesTAREA Metodos de Prueba Vino Tinto Laura MéndezDianaNo ratings yet
- E Book KimchiDocument11 pagesE Book KimchiKelton von KeysNo ratings yet
- Cables para Telecomunicaciones Acometidas Telefonicas para Uso Exterior DWTDocument3 pagesCables para Telecomunicaciones Acometidas Telefonicas para Uso Exterior DWTGustavo Jesus Taboada VasquezNo ratings yet
- Practica 1 Obtencion de Amarillo MartiusDocument5 pagesPractica 1 Obtencion de Amarillo MartiusorlandoaguilarNo ratings yet
- Informe Exposición Grupo N2 BioinformáticaDocument4 pagesInforme Exposición Grupo N2 BioinformáticaNADIA NICOLE CELI BOHORQUEZNo ratings yet
- Procesos Claves de IntercambioDocument19 pagesProcesos Claves de IntercambioFedericoFerminNo ratings yet
- Elaboracion de Nectares en AnalisisDocument28 pagesElaboracion de Nectares en AnalisisalexNo ratings yet
- Bielementos Biomoleculas Inorganicas Agua Sales Minerales Biomoleculas Organicas Carbohidratos LecturaDocument10 pagesBielementos Biomoleculas Inorganicas Agua Sales Minerales Biomoleculas Organicas Carbohidratos LecturajamerNo ratings yet
- Introducciòn A La Quimica OrganicaDocument21 pagesIntroducciòn A La Quimica OrganicaAshely CarmonaNo ratings yet
- Laboraotrio MarinaDocument23 pagesLaboraotrio MarinaElizabeth VelasquezNo ratings yet
- Tesis de María AlexandraDocument178 pagesTesis de María AlexandraXavi D100% (1)
- Nomenclatura de Compuestos de Coordinacion PDFDocument61 pagesNomenclatura de Compuestos de Coordinacion PDFGato JhonatanNo ratings yet
- Vol. Pptacion, Complexometria y RedoxDocument27 pagesVol. Pptacion, Complexometria y RedoxNayely VillarroelNo ratings yet
- Clase 8 - Unidad 3Document28 pagesClase 8 - Unidad 3BernaMValenzuelaNo ratings yet