Professional Documents
Culture Documents
Practica 1 Bloque II Analitica II
Uploaded by
Laura MaresCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Practica 1 Bloque II Analitica II
Uploaded by
Laura MaresCopyright:
Available Formats
Reactivo: EDTA
Volumen 100ml
Concentracin .05M
g EDTA calculados 1.8685g
Peso del vaso de pp 28.1359g
Cantidad real pesada de EDTA 1.8689g
Concentracin real .05001M
Reactivo: MgCl
2
Volumen 50ml
Concentracin .1M
g MgCl
2
calculados .9774g
Peso del vaso de pp 28.1359g
Cantidad real pesada de MgCl
2
.995g
Concentracin real .0969M
Reactivo: AlCl
3
Volumen 50ml
Concentracin .1M
g AlCl
3
calculados 1.2194g
Peso del vaso de pp 28.1359g
Cantidad real pesada de AlCl
3
1.2404g
Concentracin real .1017M
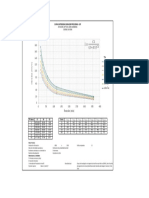
Podemos conocer las concentraciones en la alcuota de cada ion
De acuerdo al diagrama de solubilidad podemos proponer intervalos de pH donde un ion se
encuentre precipitado en un 98% mientras que el otro solo lo haga en 2%
Separacin 98%
Mg(OH)
2
(S) Al(OH)
3
(S)
Precip 98% Precip 2%
Log s=-3.013 Log s=-1.3
pH10 3.6 pH11.8
Intervalo 11.8 pH14
Separacin 98%
Mg(OH)
2
(S) Al(OH)
3
(S)
Precip 2% Precip 98%
Log s=-1.32 Log s=-2.99
pH9 4.2 pH10
Intervalo 4.2 pH9
Como podemos darnos cuenta de acuerdo al pH experimental que obtuvimos de separacin el
cual fue de 5.72, se encuentra dentro del intervalo de 4.2 pH9 donde el ion precipitado es
Al(III) y el ion que permanece en solucin es Mg(II),por lo que podemos justificar nuestra
separacin de estos iones metlicos por precipitacin
La ecuacin qumica representativa del proceso de precipitacin es la siguiente:
Mediante Ley de Hess es posible conocer el valor de la constante de precipitacin Kp
La constante condicional al pH de filtrado (5.75) adquiere el siguiente valor.
As mismo mediante el uso del diagrama logartmico de solubilidad podemos calcular el porcentaje
de precipitacin al pH de separacin (filtrado)
Haciendo uso de una regla de tres:
Lo que nos indica que solo se encuentra presente un .001% de Al (III) en solucin, lo que quiere
decir que nuestro porcentaje de precipitacin fue del 99.999%.
Lo cual se puede hacer de manera ms exacta mediante la siguiente ecuacin qumica:
] (
)
Donde:
+ (
Por lo tanto el porcentaje de precipitacin queda definido como:
Podemos establecer tambin la ecuacin qumica representativa de la valoracin complejometrica
al pH experimental
Por lo tanto:
Donde:
Haciendo el anlisis matemtico necesario, podemos conocer la ecuacin con la cual nos es
posible conocer el valor de la constante bicondicional. La ecuacin es la siguiente:
Donde:
Para calcular la concentracin del BUFFER
Datos:
* (
* (
(
*
,}
En la valoracin complejometrica se llev a cabo la siguiente reaccin:
Pero a las condiciones de amortiguamiento (pNH3 y pH):
Por lo tanto tenemos la siguiente ecuacin qumica generalizada:
Donde las especies qumicas representativas son las siguientes:
[
Tenemos las siguientes constantes, con su respectiva ley de accin de masas
Al aplicar la ley de accin de masas correspondiente a cada especie generalizada, obtenemos las
siguientes expresiones:
[
Y a su vez:
As podemos conocer el valor de
((
*)
(
,
)
De acuerdo a los valores de las constantes termodinmicas antes conocidos, y los siguientes
valores experimentales, podemos conocer el valor numrico de
sin aproximaciones:
((
*)
(
+)
)
Si hacemos uso de la ecuacin de segundo de la valoracin de un ion metlico con un ligando,
podemos conocer la concentracin de
en el punto de equivalencia
Y asi podemos conocer el porcentaje de conversin
Tenemos para la entrada
Y para la salida
Con ayuda de los datos obtenidos de la valoracin de Mg (II) con EDTA podemos conocer tanto la
concentracin de entrada y de salida de Mg, y as calcular el porcentaje de recuperacin de Mg
teniendo en cuenta la siguiente reaccin:
CONCENTRACION ENTRADA:
CONCENTRACION SALIDA:
El factor de dilucin de las aguas madre fue de 20ml/50ml. Por lo tanto la concentracion real de
Mg a la salida es de:
Porcentaje de recuperacin
You might also like
- Practica CorrosionDocument11 pagesPractica CorrosionLaura MaresNo ratings yet
- Medidores de Flujo Reporte 3Document7 pagesMedidores de Flujo Reporte 3Laura MaresNo ratings yet
- Reporte Final Descarg de Un TanqueDocument16 pagesReporte Final Descarg de Un TanqueLaura MaresNo ratings yet
- Previo 9 LemiDocument7 pagesPrevio 9 LemiLaura MaresNo ratings yet
- Lemi Intercambiador de Tubos y CorazasDocument1 pageLemi Intercambiador de Tubos y CorazasLaura MaresNo ratings yet
- UntitledDocument7 pagesUntitledLaura MaresNo ratings yet
- Clima OrganizacionalDocument4 pagesClima OrganizacionalGerardo Ortiz GuerraNo ratings yet
- El Concepto de MamposteríaDocument11 pagesEl Concepto de MamposteríaMaria Emilia CasalsNo ratings yet
- Pre Tarea - Pre Saberes - Cuestionario de EvaluaciónDocument12 pagesPre Tarea - Pre Saberes - Cuestionario de EvaluaciónJackson MontoyaNo ratings yet
- Cabrera Cap27 (1 5 9 11 16 20 23 28 33 34 39 46 56 60 64 71)Document7 pagesCabrera Cap27 (1 5 9 11 16 20 23 28 33 34 39 46 56 60 64 71)Alvaro Cabrera Diaz33% (3)
- CAPRA El Nuevo Paradigma EcológicoDocument8 pagesCAPRA El Nuevo Paradigma EcológicoJorge MeritanoNo ratings yet
- Introducción: Laboratorio de Física Mecánica Guía No: 4 Movimiento Uniformemente AceleradoDocument8 pagesIntroducción: Laboratorio de Física Mecánica Guía No: 4 Movimiento Uniformemente AceleradoDana Carolina CollazosNo ratings yet
- Anteproyecto La Maquina Petrolera TomasDocument11 pagesAnteproyecto La Maquina Petrolera Tomasjhoany leivaNo ratings yet
- Riesgos Vidrio PDFDocument29 pagesRiesgos Vidrio PDFVero A DeNo ratings yet
- Optimización de pozos BESDocument42 pagesOptimización de pozos BESEdiyen NoelithNo ratings yet
- Informe #4 Medidores de FlujoDocument14 pagesInforme #4 Medidores de FlujoChristian GarciaNo ratings yet
- Átomos y Eucaristía: interacciones históricasDocument14 pagesÁtomos y Eucaristía: interacciones históricasEl Dragon BetNo ratings yet
- Taller de Integracion de Lenguajes ArtisticosDocument8 pagesTaller de Integracion de Lenguajes ArtisticosRosana BottaroNo ratings yet
- CÓMO HACER UN VOLCÁN CASERO CMDocument4 pagesCÓMO HACER UN VOLCÁN CASERO CMThebairi PerezNo ratings yet
- Preguntas Exposiciones EGR-1Document13 pagesPreguntas Exposiciones EGR-1Juan Manuel Galindo MNo ratings yet
- 1-Ley de Coulomb, Gauss - PotencialDocument33 pages1-Ley de Coulomb, Gauss - Potencialrubenq3aNo ratings yet
- Idf 26125060 Apto El EdenDocument1 pageIdf 26125060 Apto El Edenjuan jose saavedraNo ratings yet
- Guia Ejercicios de EstequiometriaDocument4 pagesGuia Ejercicios de EstequiometriaDarwin Contreras Pacheco100% (1)
- Historia y evolución del sistema internacional de medidas (SIDocument6 pagesHistoria y evolución del sistema internacional de medidas (SIJc-master Ormaeche100% (1)
- DOF - CNH-Lineamientos Tecnicos en Materia de Medicion de Hidrocarburos PDFDocument31 pagesDOF - CNH-Lineamientos Tecnicos en Materia de Medicion de Hidrocarburos PDFMcClickNo ratings yet
- Procesos No Radiativos. Transferencia de Energia y Carga. FotoquímicaDocument42 pagesProcesos No Radiativos. Transferencia de Energia y Carga. FotoquímicaPilarNo ratings yet
- Tercera Ley de Newton Del MovimientoDocument8 pagesTercera Ley de Newton Del Movimientoangile diazNo ratings yet
- Impermeabilización CubiertaDocument34 pagesImpermeabilización CubiertaAntonio ValdiviaNo ratings yet
- Diseño y construcción de una planta piloto de refinación continuaDocument42 pagesDiseño y construcción de una planta piloto de refinación continuaLionel Villarroel SalazarNo ratings yet
- Ficha Tecnica Perla Poliestireno Expandido Eps PDFDocument3 pagesFicha Tecnica Perla Poliestireno Expandido Eps PDFManuel José González AcostaNo ratings yet
- 3.3 Formato Del Permiso para Trabajos Con Energía Peligrosas.Document2 pages3.3 Formato Del Permiso para Trabajos Con Energía Peligrosas.MaycolNo ratings yet
- Cuerpo y GestaltDocument18 pagesCuerpo y GestaltfisiovirNo ratings yet
- Rudy Rucker - SoftwareDocument93 pagesRudy Rucker - SoftwarecigarroycaffeNo ratings yet
- Revista Ingeniería y Tecnología No. 19Document68 pagesRevista Ingeniería y Tecnología No. 19LleiLleiNo ratings yet
- Factores de Gradiente AritmeticoDocument4 pagesFactores de Gradiente AritmeticoValentina CedielNo ratings yet
- Programa Completo AlejandroDocument130 pagesPrograma Completo Alejandrohender88No ratings yet