Professional Documents
Culture Documents
Nitracion
Uploaded by
merida1234asdOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Nitracion
Uploaded by
merida1234asdCopyright:
Available Formats
NITRACION DE LA ACETANILIDA
I.- OBJETIVOS :
Aprender el mecanismo de nitracion
Obtener la nitracion de la acetanilida
II.- FUNDAMENTO TEORICO :
La sustitucin de un tomo de hidrgeno sobre el ncleo aromtico por el grupo
nitro se conoce como nitracion aromtica . Algunos de los compuestos aromticos
nitrados son de gran importancia practica, por lo cual sus preparaciones y en
particular la nitracion de los compuestos aromticos han sido estudiados con
gran detalle . Como consecuencia de ello se sabe con exactitud como llevar a
cabo con eficacia el proceso de nitracion y tambin se tienen bastante
conocimiento sobre el mecanismo de la nitracion aromtica que sobre cualquier
otra de las reacciones de sustitucin aromtica .
La nitracion se origina ordinariamente tratando el compuesto aromtico con una
mezcla de cido ntrico y sulfrico concentrados. El agente nitrante es el ion
nitronio cargado positivamente (NO
2
)
+
, el cual se forma segn la siguiente
reaccin :
HNO
3
+ 2H
2
SO
4
(NO
2
)
+
+ 2HSO
4
-
El cido ntrico puede reaccionar consigo mismo de modo anlogo , por lo cual
puede actuar por si solo como agente nitrante, aunque nicamente frente a
determinados compuestos aromticos como el fenol :
NO
3
H (NO
2
)
+
+ 2NO
3
-
+ H
3
O
4
Los compuestos aromticos nitrados presentan inters por su empleo como
explosivos y porque pueden ser transformados fcilmente por reduccin a las
aminas primarias correspondientes , las cuales son a su vez sustancias de partida
para la preparacin de muchos colorantes .
Los compuestos nitrados contienen un enlace carbono nitrgeno R-NO
2
, como se
demuestra al poder ser reducidos a las aminas primarias . En cambio los esteres
nitrosos como R-O-N =O , isomeros de los compuestos nitrados , no dan por
reduccin compuestos que contienen un nitrgeno unido a carbono.
El proceso de nitracion siempre va acompaado de una destruccin parcial de la
sustancia orgnica tomada de oxidacin , ruptura del propano solo alrededor del
40% se transforma en un nitro compuesto.
La mezcla de nitrocompuestos tiene la sgte composicin :
CH
3
CH
2
CH
3
+ HNO
3
CH
3
NO
2
+ C
2
H
5
NO
2
+ C
3
H
7
NO
2
La nitracion es tanto menos fcil cuantos mas grupos nitros existan en la
molcula . otros sustituyentes suelen facilitar la nitracion en la industria se opera
en reactores de fundicin de ferrosilicio con dobles paredes , para poder calentar
o enfriar , como las derivados son insolubles en agua, una vez terminada la
reaccin se vierte el producto sobre agua con hielo , despus se recoge el
precipitado por filtracin y del filtrado se recupera el cido sulfrico por
concentracin.
1.- Estructura de los Derivados Nitrados
En los derivados nitrados existe un enlace C-N que por reduccin de aminas
primarias :
reduccin
NO
2
NH
2
oxidacion
Nitrobenceno Anilina
Mientras esto suceda con los nitritos , isomeros de alquenos adems los nitritos se
hidrolizan.
H
2
O
R-O-NO R-OH + HONO
Nitrito de alcolino Alcohol Acido Nitroso
El enlace C-N de los derivados nitrados es muy estable con excepcin de los
derivados que tiene grupos nitro en O y P en lo que uno de ellos se puede sustituir
por grupos -OH , -NH
2
, y OCH
3
, debido a al activacin de las posiciones O
-
o
P
-
.
El grupo nitro constituye un ejemplo de resonancia
O
-N=O
O
- N O
En la nitracion se produce la reaccin probablemente por el ataque del ion
electroltico NO
2
-
que se origina en la disociacin del acido ntrico en presencia
de ac. Sulfrico.
2(SO
4
H)
-
+ (NO
2
)
+
HNO
3
+ 2H
2
SO
4
2.- Nitracion de la Acetanilida
El mecanismo de la nitracion de la acetanilida es que un ion nitronio de la mezcla
es el que efecta el ataque electroltico en el ncleo aromtico.
La nitracin directa de la anilina y de las otras muchas aminas en solucin de
acido sulfrico concentrado origina generalmente una mezcla de productos
resinosos coloreados a menos que la solucin se diluya con un considerable
exceso de acido sulfrico concentrado.
En estas ultimas condiciones la nitracion de la acetanilida , suministra una mezcla
de las 3 nitroacetanilidas isomeras ( o , m y p ).
La nitracion directa de la anilina origina generalmente una mezcla de productos
resinosos coloreados para obtener el isomero Para generalmente se refiere 2
etapas :
Nitracion de la Acetanilida
Hidrlisis de la Para Nitroacetanilida a p nitroanilida.
O
NH - C CH
3
NO
3
O
NH - C CH
3
+HNO
3
H
2
SO
4
+H
2
O
Son cristales blancos , solubles en alcohol y ter muy ligeramente en agua fra,
soluble en agua caliente y soluciones de hidrxido de potasio.
Se usa en la produccin de p-nitronilida que se usa para intermedios de
colorantes ,especialmente rojo de p-nitronilida, inhibidores de gomas de gasolina ,
inhibidores de corrosin.
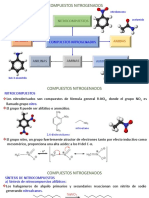
GRUPOS ACTIVANTES Y DIRECTORES ORTO PARA
-O : > -N-R > -O-H > -O-R > -N C R > -R sin pares aislados.
Fenoxidos > anilina > fenoles > ter de fenilo >anilidas >alquilbencenos
RESUMEN DE GRUPOS DESACTIVANTES DIRECTORES META
Grupo estructuras resonantes ejemplo
NO
2
nitro
SO
3
H
R H O
:O:
R R
:N
:OH :O R
H O
:N-C-R
R
O: O
-
N N
O
-
O:
NO
2
nitrobenceno
Acido
sulfonico
O O O
-S- O H -S H - S O - H
O O O
SO
3
H
acetofenona
- C =N : - C =N - C =N :
C =N
- N R
3
- N
+
USOS DE LA NITROACETANILIDA
ciano
benzonitrilo
O
O
-C - R
O O:
-
- C R - C - R
C CH
3
Acido bencesulfonico
Cetona o
aldehido
O
- C O - R
O O O
O
- C O R - C =O R - C =O - R
C - OCH
3
ester
Benzoato de metilo
R
R
R
N ( CH
3
)
3
I
-
Amonio cuaternario
Yoduro de trimetilonilio
Produccin de la nitroanilida .- ( intermedio de colorantes ), sntesis de
agente fotogrfico contra el empaado o fenilendiamina, coccidiosfatos.
La acetanilida obtenida se somete a la nitracion en cuyo proceso el nitragrupo
ocupa la posicin para respecto al grupo amino.
CH
3
CONH H + HO +NO
2
CH
3
COOH
NO
2
+H
2
O
P - nitroacetaniulida
Saponificando la p- nitroacetanilida se obtiene la p- nitroanilina . Es uno de los
productos bsicos en la produccin de colorantes . El proceso de saponificacin
se realiza segn el esquema :
O
2
H NHCOCH
3
+NaOH O
2
H
+CH
3
COONa
Tambin se emplean como disolventes , explosivos perfumes, materiales
colorantes ( en especial amarilla ) tambin son materias primas de sntesis
muy importantes para preparar colorantes azoicos.
III.- MATERIALES Y REACTIVOS
MATERIALES : REACTIVOS :
Tubo de ensayo Acetanilida
Bagueta Acido Nitrico
Vaso de precipitados Acido Sulfrico
Embudo Agua ( hielo ).
Papel de filtro
IV.- PROCEDIMIENTO EXPERIMENTAL :
NH
2
P - nitroanilina
P - nitroacetamilida
En un tubo de ensayo se agrega 1 ml de HNO
3
Y 2 ml de H
2
SO
4
luego se
agrega 1 gr. De Acetanilida y se mueve con la bagueta el tubo se coloca dentro
de un vaso de precipitado con hielo y se sigue moviendo hasta diluir luego colocar
esto en un vaso de agua fra formndose precipitado ligeramente amarillo plido,
seguidamente lo llevamos a filtrar , del cual podemos obtener precipitados de color
amarillo o blanco , lo cual nos indica que hemos obtenido : o nitroacetanilida o
p nitroacetanilida respectivamente.
De obtener un color amarillento se agrega alcohol para eliminar las impurezas
que hubiesen podido quedar en la filtracin y adems as poder obtener
solamente p nitroacetanilida ya que el o nitroacetanilida es soluble en alcohol.
V . CONCLUSIONES :
Se demuestra que el orto nitroacetanilida es menos estable ya que se puede
diluir en el alcohol
El producto nitrado que obtuvimos es insoluble en agua ya que reacciona con
este formando precipitado.
Tiene que ver como se trabaja en le medio para que se forme el para y orto.
A la nitracin pueden someterse no solo diferentes hidrocarburos aromticos (
incluyendo polinucleares ) sino tambin los compuestos que ya tienen en el
ncleo otros grupos : los halgenos, hidrxidos, grupos sulfos, grupos aminos,
y otros. Los compuestos a obtener tienen gran importancia con los
semiproductos en la sntesis de los colorantes preparados farmacuticos y
otros .
V.- RECOMENDACIONES :
Antes de la reaccin del H
2
SO
4
con el HNO
3
tener un deposito de H
2
O con
hielo porque la reaccin es exotrmica .
En caso de que no se diluya la acetanilida en medio acido , agregar la misma
proporcin de 2 volmenes de H
2
SO
4
con un volumen de HN0
3
El agua que va a disolver la solucin tiene que ser helada y no en exceso ya
que puede disolver el NO
2
+
.
La acetanilida tiene que estar diluida completamente para que se forme el
precipitado.
VI.- BIBLIOGRAFA :
Gua para el anlisis de los compuestos del carbono. Por : Segundo Gibaja
Oviedo.
Curso practico de Qumica Orgnica , Ray Q. Brewter.
Qumica Orgnica , J orge Vidal.
Curso Qumica Universitaria . Brace Maham.
You might also like
- Info 3Document8 pagesInfo 3Giuliana Katia Morales FuertesNo ratings yet
- NitracionDocument15 pagesNitracionIvan BerlotNo ratings yet
- Sales de DiazonioDocument13 pagesSales de DiazonioLo PoNo ratings yet
- Sales de DiazonioDocument13 pagesSales de DiazonioGOMEZ CASTRO CLEISON STEVENNo ratings yet
- Reduccion de Compuestos Nitrogenados PDFDocument23 pagesReduccion de Compuestos Nitrogenados PDFEli RoNo ratings yet
- Nitración de La AcetanilidaDocument9 pagesNitración de La AcetanilidaGilvert J Vasquez MendozaNo ratings yet
- Determinación Del Contenido Proteico Total - Determinación de NitrógenoDocument6 pagesDeterminación Del Contenido Proteico Total - Determinación de NitrógenoAstharotNo ratings yet
- Nitración de La AcetanilidaDocument9 pagesNitración de La AcetanilidaGuisela Quispe Velez100% (1)
- Nitracion de La AcetanilidaDocument13 pagesNitracion de La AcetanilidazanniazorzaNo ratings yet
- 4to Informe Nitracion de La Acetanilida 1 1Document25 pages4to Informe Nitracion de La Acetanilida 1 1Ariane Guevara BernardoNo ratings yet
- Derivados NitradosDocument32 pagesDerivados NitradosMjior100% (1)
- TERMINADO NITRACIONjjjjjjDocument19 pagesTERMINADO NITRACIONjjjjjjANDERSSONNo ratings yet
- Nitracion de La Acetanilida FinalDocument14 pagesNitracion de La Acetanilida FinalCynthia Liliana Roca PelayoNo ratings yet
- INFORME 4 (Nitracion)Document21 pagesINFORME 4 (Nitracion)Adriana RimarachinNo ratings yet
- Práctica 3 Quimica Organica IIDocument4 pagesPráctica 3 Quimica Organica IIIrving Soto0% (1)
- Tema 6Document46 pagesTema 6Pablo Matías Silvera QuirogaNo ratings yet
- NitraciónDocument14 pagesNitraciónGaby Lizana VásquezNo ratings yet
- Aminas FiqDocument16 pagesAminas Fiqfiqunac100% (1)
- CBGQ NitrogenoDocument29 pagesCBGQ NitrogenoVictor Alexandro Leandro ParedezNo ratings yet
- 4Document3 pages4yojanaNo ratings yet
- Reacciones de Las AminasDocument6 pagesReacciones de Las AminasVictor Hugo Quiroz T100% (1)
- Tema 4 - Grupo Del NitrógenoDocument20 pagesTema 4 - Grupo Del NitrógenoAlexander VillarrroelNo ratings yet
- FORMATO PRACTICA 7 Q ORG II Acetanilida Version CorrectaDocument11 pagesFORMATO PRACTICA 7 Q ORG II Acetanilida Version CorrectaNayeli1140No ratings yet
- Reacciones de Las AminasDocument7 pagesReacciones de Las AminasKaren Patricia Polo LozanoNo ratings yet
- Reacciones de Las AminasDocument6 pagesReacciones de Las AminasKarla DelgadoNo ratings yet
- Reacciones de Las AminasDocument6 pagesReacciones de Las AminasKelly BuitragoNo ratings yet
- AminasDocument26 pagesAminasFabricio CarrilloNo ratings yet
- Tema 4 - Grupo Del NitrógenoDocument20 pagesTema 4 - Grupo Del NitrógenoMario Jesus Salvatierra MuñozNo ratings yet
- Reacciones de Las AminasDocument6 pagesReacciones de Las AminasANNo ratings yet
- Reacciones de Las Aminas Con HonoDocument6 pagesReacciones de Las Aminas Con HonoPaul Sanchez GNo ratings yet
- COMPUESTOS NITROGENADOS - 2022-DepuradoDocument29 pagesCOMPUESTOS NITROGENADOS - 2022-DepuradoEnriqueNo ratings yet
- AminasDocument5 pagesAminasJulio Salgado LucioNo ratings yet
- Nitración Del FenolDocument8 pagesNitración Del Fenolmarisa_boo5924No ratings yet
- Identificación de Aminas y Algunas ReaccionesDocument10 pagesIdentificación de Aminas y Algunas ReaccionesMarbel ZuresNo ratings yet
- Reacciones de Las AminasDocument6 pagesReacciones de Las AminasMila MilasNo ratings yet
- Sales de Diazonio FinalDocument13 pagesSales de Diazonio FinalMachetin MachetinNo ratings yet
- Introducción A Compuestos de CoordinaciónDocument36 pagesIntroducción A Compuestos de CoordinaciónSergioTorresCortésNo ratings yet
- Nitrocompuestos2014 26535 PDFDocument142 pagesNitrocompuestos2014 26535 PDFMario RojasNo ratings yet
- Notas Sobre AMINASDocument18 pagesNotas Sobre AMINASHector Fabio Guaza LNo ratings yet
- Reacciones Analiticas de Nitrocompuestos PDFDocument22 pagesReacciones Analiticas de Nitrocompuestos PDFANGELA MARIA VARGAS TABORDANo ratings yet
- Aromatic OsDocument17 pagesAromatic OsJonathan CorreaNo ratings yet
- Practica 6 - de AminasDocument10 pagesPractica 6 - de Aminashigienequimica5041100% (1)
- Reporte 10 QOFHDocument4 pagesReporte 10 QOFHSaid MossoNo ratings yet
- Reacciones de Las AminasDocument5 pagesReacciones de Las AminasCarlos Noe Odar ArroyoNo ratings yet
- 5 CopulacionDocument39 pages5 CopulacionSabina LopezNo ratings yet
- Ácido Pícrico y FenolftaleínaDocument33 pagesÁcido Pícrico y FenolftaleínafernandaNo ratings yet
- CalaveritaDocument44 pagesCalaveritaIrving DumNo ratings yet
- P NitroacetanilidaDocument18 pagesP NitroacetanilidaAntuUanett Leslieexitaa64% (11)
- L25ABQUI16Document2 pagesL25ABQUI16Diego MartínezNo ratings yet
- Compuestos Organicos Nitrogenados SelectividadDocument17 pagesCompuestos Organicos Nitrogenados SelectividadAMYNNXXXX100% (1)
- Info 4. Orga Ii CarbajalDocument27 pagesInfo 4. Orga Ii CarbajalGuillermo CarbajalNo ratings yet
- Lab 5 Nitrogeno y FosforoDocument4 pagesLab 5 Nitrogeno y FosforoRocio Belen De La IglesiaNo ratings yet
- Practica No 6 Aldehidos CetonasDocument7 pagesPractica No 6 Aldehidos CetonasCarito MontecinoNo ratings yet
- Nitracion Del Benzonato de MetiloDocument15 pagesNitracion Del Benzonato de MetiloKade CadeNo ratings yet
- Hidrocarburos Aromaticos (Valeria Ocampo, Jonathan Correa, Lianna Idrobo Torres)Document17 pagesHidrocarburos Aromaticos (Valeria Ocampo, Jonathan Correa, Lianna Idrobo Torres)Jonathan CorreaNo ratings yet
- PiridinaDocument95 pagesPiridinaUTANIRIOS100% (1)
- Ácido NitrosoDocument4 pagesÁcido NitrosoJorge Alberto Estrada TorresNo ratings yet
- Analisis QuimicoDocument7 pagesAnalisis QuimicoLidia Choque CachiNo ratings yet
- Qui MicaDocument3 pagesQui MicaCarlos YagualNo ratings yet
- Apunte Clase 1 - Célula - Membranas BiológicasDocument13 pagesApunte Clase 1 - Célula - Membranas BiológicasGui LlermoNo ratings yet
- Guion Metodologico 2o ParcialDocument14 pagesGuion Metodologico 2o ParcialSolo ParaNo ratings yet
- BiologíaDocument4 pagesBiologíaFernando Lopez CortezNo ratings yet
- Practica 5 CompletaDocument19 pagesPractica 5 CompletaHADID ESTEBAN MORALESNo ratings yet
- Clasificacion de La Tabla PeriodicaDocument5 pagesClasificacion de La Tabla Periodicachristian de la cruzNo ratings yet
- Balanceo Ion ElectronDocument4 pagesBalanceo Ion ElectronJoelAnguianoNo ratings yet
- Ejercicio 2 Corregido 3 y 4 Qumica OrganicaDocument6 pagesEjercicio 2 Corregido 3 y 4 Qumica OrganicaWilliam Fernando Esquiivel DiazNo ratings yet
- Problemas para Resolver de GravimetriaDocument5 pagesProblemas para Resolver de GravimetriaCesar GuerreroNo ratings yet
- Tabla Periodica PDFDocument1 pageTabla Periodica PDFBrayan VelásquezNo ratings yet
- Grupo 2-Identificacion Del Carbono e Investigación de Nitrógeno, Azufre y Halógenos en Compuestos OrgánicosDocument8 pagesGrupo 2-Identificacion Del Carbono e Investigación de Nitrógeno, Azufre y Halógenos en Compuestos OrgánicosJhon ToalaNo ratings yet
- Formulacion 3 ESO 030512Document8 pagesFormulacion 3 ESO 030512Manuel DelgadoNo ratings yet
- Isomerizacion CataliticaDocument39 pagesIsomerizacion CataliticaAlexander Cuellar CossioNo ratings yet
- Paper CarbonilacionDocument28 pagesPaper CarbonilacionGabriela Cuellar MurilloNo ratings yet
- Desarrollo y Caracterización de Compósito TiO2-ABS Mediante Espectroscopia Infrarroja Por Transformada de Fourier (FTIR) y XRD.Document11 pagesDesarrollo y Caracterización de Compósito TiO2-ABS Mediante Espectroscopia Infrarroja Por Transformada de Fourier (FTIR) y XRD.papiux soldierNo ratings yet
- Documento ADLDocument16 pagesDocumento ADLFredy MartinezNo ratings yet
- Práctica 5 Presencial Preguntas PreviasDocument4 pagesPráctica 5 Presencial Preguntas PreviasLuisa CastañedaNo ratings yet
- Ejercicios de Concentración de Soluciones ResueltosDocument9 pagesEjercicios de Concentración de Soluciones ResueltosGuille Aguilar100% (1)
- Ejercicios Resueltos Calculos Estequiometricos PDFDocument6 pagesEjercicios Resueltos Calculos Estequiometricos PDFJonaNo ratings yet
- Sistema de CristalizacionDocument6 pagesSistema de CristalizacionTAILY LILI ARAUCO ORIHUELANo ratings yet
- Tabla Periodica2Document1 pageTabla Periodica2Pascalino alfaroNo ratings yet
- Práctica Nº05 - NeutralizaciónDocument11 pagesPráctica Nº05 - NeutralizaciónKEVIN JORDAN ARROYO VALERIONo ratings yet
- Diseño de Planta de Producción de CaprolactamaDocument14 pagesDiseño de Planta de Producción de CaprolactamaAngelo VarelaNo ratings yet
- Guia de Bioquimica 2010 PDFDocument98 pagesGuia de Bioquimica 2010 PDFrosa sanchezNo ratings yet
- Bacterias AnaerobiasDocument70 pagesBacterias AnaerobiasDIANA MILAGRO MIRANDA YNGANo ratings yet
- Q AUNI Sem7 DomDocument3 pagesQ AUNI Sem7 DomMicaela Gutiérrez QuispeNo ratings yet
- 2.-Deshidratacion de AlcoholesDocument14 pages2.-Deshidratacion de AlcoholesLoly QuezadaNo ratings yet
- 6.enlace Quimico PDFDocument4 pages6.enlace Quimico PDFIván Gamarra CalcinaNo ratings yet
- FisicoquimicaDocument8 pagesFisicoquimicaDaniela Ibarra100% (1)