Professional Documents
Culture Documents
Calorimetro
Uploaded by
Christina JamesOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Calorimetro
Uploaded by
Christina JamesCopyright:
Available Formats
LABORATORIO DE FISICOQUMICA II
ESTUDIO CALORIMTRICO DE LA REDUCCIN DE
HIPOCLORITO DE SODIO
PITALUA K
1
, ROSALES F
1
, TEJEDOR J
1
, VSQUEZ
Y1, MARTNEZ E
2
Estudiante VI qumica de la universidad de Cartagena. 2. docente laboratorio de fisicoqumica
RESUMEN: en este experimento se estudia la reaccin del hipoclorito de sodio en
presencia de un agente reductor como el ion tiosulfato o ion yoduro, siguiendo el
mtodo de variacin continua para determinar la estequiometria de la reaccin.
Tambin se determina la cantidad de medida de calor en el calormetro.
ABSTRACT: in this experiment is studied the reaction of sodium hypochlorite in the
presence of a reducing agent such as thiosulphate ion or iodide ion, using the method
of determining the continuous variation of the stoichiometric reaction. It also determines
the amount of heat as the calorimeter
OBJETIVOS
Determinar la reaccin estequiometria
en la se combinan los reactivos en una
reaccin, aplicando el mtodo de jod.
Identificar el reactivo limite en una
reaccin cuantitativa y cualitativamente
Determinar la medida de calor en la
mezcla
INTRODUCCION
El mtodo que se utiliza en este
laboratorio para determinar la
estequiometria de la reaccin es el
mtodo de variacin continua tambin
llamado el mtodo de jod este mtodo
este mtodo puede emplearse para
encontrar la estequiometria y las
contastes de formacin para los
complejos, supngase que se lleva a
cabo una reaccin entre el metal incoloro
M y el ligando incoloro L para dar un
complejo bastante colorido.
Mm, Ln .
Mm +nL Mm Ln
[ ]
[][]
Si se forma nicamente un complejo y si
KF es alta, el mtodo de jod es til para
determinar n/m y KF;
El mtodo funciona as, se prepara una
serie de matrices en los cuales la suma
del numero de moles del ligando mas el
numero de moles del metal se mantiene
constante
(Numero de moles de M) + (Numero de
moles L)= constante
Mientras la suma permanezca constante,
los agregados pueden variar, se prepara
una serie de soluciones del metal de
fraccin molar variable y se grafican sus
absorbancias contra la fraccin molar o
del ligando.
Fraccin molar de M
XM
Fraccin molar de L
XL=
La grafica resultante es una curva en
forma de montculo como la que se
muestra en la figura 1.
Las porciones de curva recta se
extrapolan, el punto sobre la abscisa
correspondiente a su interaccin se
llama XMINT , que es la fraccin molar
de M en la mxima cantidad de
complejos que se deba formarse y
tambin donde se observa la mxima
absorbancia posible , la disociacin
explica la curvatura.
XLINT= 1-XMINT
MARCO TEORICO
Mediante la calorimetra se puede medir
el calor en una reaccin qumica o un
cambio fsico usando un instrumento
llamado calormetro.
La medida de la cantidad de calor se
basa en dos mtodos que podemos
definir como el mtodo de intercambio y
el mtodo de comparacin
El mtodo de intercambio que es el ms
frecuente consiste en establecer una
diferencia de temperaturas entre el
sistema y un sistema referencial una vez
que ambos alcanzan el equilibrio por
separados a temperaturas diferentes se
ponen en contacto y se permite el
intercambio de calor mantenindolos
aislados del exterior. Gracias a este
intercambio calorfico es, es posible
deducir propiedades del primer sistema
en funcin de las propiedades del
segundo sistema .durante mucho tiempo,
la sustancia referencial utilizada fue el
agua, en la que se sumerga la muestra,
lo cual le confiri al procedimiento
mtodo de mezclas.
El mtodo de comparacin consiste en
realizar dos veces el mismo
procedimiento, llevando el sistema desde
un mismo estado inicial hasta un mismo
estado final. En el primer paso se le
suministra la cantidad de calor a medir
mientras que en la otra se disipa en su
seno la cantidad de trabajo adiabtico
necesaria .la comparacin de ambas
cantidades permite extraer las
propiedades trmicas del sistema, este
fue el mtodo utilizado por joule para
establecer el equivalente mecnico de la
calora.
PARTE EXPERIMENTAL
Se preparo una solucin de 0,5 M de
hipoclorito de sodio a partir de una
solucin de un blanqueador comercial
Para ello se tomaron 10 ml de
blanqueador y se diluyen con agua hasta
un volumen de 250 ml.
Luego se preparo una solucin de
Na
2
S
2
O
3
en soda 1,1; una vez listas
estas soluciones, se determinan en el
calormetro los cambios en la
temperatura correspondientes a las
mezclas que se citan a continuacin.
Tabla 2.0: mezcla para el estudio calorimtrico de
la reduccin del hipoclorito
Mezcla VNaOCl(ml) Vreductor(ml)
1 10 90
2 30 70
3 40 60
4 50 50
5 55 45
6 60 40
7 65 35
8 70 30
9 80 20
10 90 10
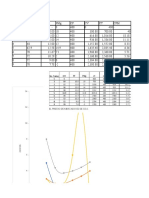
RESULTADOS EXPERIMENTALES
Tabla 2.1: prueba con el agua caliente y a
temperatura ambiente.
Prue
bas
Temperat
ura
Prueba
s
Temper
atura
1 42 C 9 44C
2 47C 10 44C
3 44C 11 44C
4 44C 12 44C
5 43C 13 44C
6 44C 14 44C
7 44C 15 44C
8 44C 16 44C
mezcla T C mezcla
1 40
2 42
3 46
4 50
5 34
6 38
x 41.6
Tabla 2.2: temperaturas de mezcla Tiosulfato e
Hipoclorito en la tabla 2.0
CALCULOS
Se prepara 500 mL de una solucin de
Na2S2O3 0,5M
Para ello se pes 61,7530g de
Na2S2O3*5H2O
Se preparan 500mL de una solucin de
NaClO 0,5M a partir de NaClO al 5,25%
(cloro comercial).
1.
2.
3.
4.
5.
DISCUSIN
Los resultados obtenidos en el estudio
calorimtrico de la reduccin de
hipoclorito de sodio, nos muestra se
fue aumentando a medida que va
disminuyendo el volumen de Tiosulfato, y
aumentaba el volumen de hipoclorito.
CONCLUSION
En esta prctica de laboratorio
concluimos en el estudio calorimtrico de
la reduccin de hipoclorito de sodio,
BIBLIOGRAFIA
[1]http://www.slideshare.net/rafaelino/cal
orimetra
[2]http://www.educaplus.org/play-243-
Calorimetr%C3%ADa.html
You might also like
- 08 Cap 8 MercadosOpciones 2020 03 10Document30 pages08 Cap 8 MercadosOpciones 2020 03 10Rolf P VenegasNo ratings yet
- Doc-EL REACTIVO LÍMITEDocument15 pagesDoc-EL REACTIVO LÍMITEMixu AlbanesNo ratings yet
- 19 Angelica MontenegroDocument11 pages19 Angelica Montenegrodicababy11No ratings yet
- Mod Carta RecomendacionesDocument2 pagesMod Carta RecomendacionesMoo QuirogaNo ratings yet
- EJERCICIO 2 (Recuperado Automáticamente)Document19 pagesEJERCICIO 2 (Recuperado Automáticamente)jhunior alexanderNo ratings yet
- Economia Matematica IIDocument20 pagesEconomia Matematica IIAnonymous GH5TSp7No ratings yet
- Tarea Actividad IIIDocument4 pagesTarea Actividad IIIMarino Gonzales JNo ratings yet
- FAUA UPAO Expo Tesis Hotel 4 Estrellas Con Centro de Convenciones en El Balneario de Pimentel - ChiclayoDocument150 pagesFAUA UPAO Expo Tesis Hotel 4 Estrellas Con Centro de Convenciones en El Balneario de Pimentel - ChiclayoNelly Amemiya Hoshi100% (3)
- Padre Rico y Padre PobreDocument4 pagesPadre Rico y Padre PobreIbeth Alanya QuispeNo ratings yet
- Recetas Al Aire LibreDocument5 pagesRecetas Al Aire LibrearquimazNo ratings yet
- Politica FinancieraDocument2 pagesPolitica FinancieraGaby Macias100% (1)
- InfografiaDocument4 pagesInfografiayadira palaciosNo ratings yet
- Casos Prácticos 2013 2014Document10 pagesCasos Prácticos 2013 2014Vir CanoNo ratings yet
- Analisis de Costos Unitarios - Xls - Recuperado - Hoja1Document8 pagesAnalisis de Costos Unitarios - Xls - Recuperado - Hoja1Alejandra CuevaNo ratings yet
- Resumen PresupuestosDocument29 pagesResumen PresupuestosJuan David GUERRERO MOLINANo ratings yet
- 9.PQP-Sulfato Ferroso HeptahidratadoDocument9 pages9.PQP-Sulfato Ferroso HeptahidratadoBrando Martinez HernandezNo ratings yet
- Caso Ingenia Muebles S.ADocument10 pagesCaso Ingenia Muebles S.AMia ContrerasNo ratings yet
- 9474 Propuesta Inspección SCI Planta Cemex Maceo Rev.1Document3 pages9474 Propuesta Inspección SCI Planta Cemex Maceo Rev.1electricistas electricistasNo ratings yet
- Requisitos de Competencia Técnica para La Inscripción en El Registro de Instaladores de Gas Natural RCD-067-2016-OS-CD PDFDocument5 pagesRequisitos de Competencia Técnica para La Inscripción en El Registro de Instaladores de Gas Natural RCD-067-2016-OS-CD PDFosiris_apoloNo ratings yet
- Diaz Frank Los Mensajeros de La Serpiente EmplumadaDocument88 pagesDiaz Frank Los Mensajeros de La Serpiente EmplumadaMemo Gonzalez AlemanNo ratings yet
- 1 - Pronóstico FinancieroDocument4 pages1 - Pronóstico FinancieroJeaneth Huanca AlvarezNo ratings yet
- Programación PresupuestalDocument17 pagesProgramación PresupuestalDanitza La RosaNo ratings yet
- Coordinacion de Prote PDFDocument138 pagesCoordinacion de Prote PDFAnonymous MaK5u5muXNo ratings yet
- ANOLAIMADocument12 pagesANOLAIMAguruclef_mkrNo ratings yet
- Qué Es El Cash ManagementDocument11 pagesQué Es El Cash ManagementDANNY HERNANDEZNo ratings yet
- SolucionesDocument48 pagesSolucionesDavid AriasNo ratings yet
- GRUPO NUTRESA Indicadores 1Document14 pagesGRUPO NUTRESA Indicadores 1Shallsyn CulmaNo ratings yet
- SV Tecnicas Creditos y Cobranzas 2Document2 pagesSV Tecnicas Creditos y Cobranzas 2Luz Ximena Arenas ParedesNo ratings yet
- Resumen Tema 8Document21 pagesResumen Tema 8maravillosa96100% (1)
- Panaderia MarruecosDocument21 pagesPanaderia Marruecossignal006No ratings yet