Professional Documents
Culture Documents
Universidad de Carabobo
Uploaded by
Davis Bernardo0 ratings0% found this document useful (0 votes)
23 views10 pagesad
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this Documentad
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
23 views10 pagesUniversidad de Carabobo
Uploaded by
Davis Bernardoad
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 10
Universidad de Carabobo
Facultad de Ciencias y Tecnologa
Departamento de Qumica
Laboratorio de Qumica Inorgnica
Profesor: Luis Puerta
Integrantes: Alfonso Dominguez; Luis Lopez; Edwina Gerig; Bernardo David;
Richard Medina
INFORME #11. APLICACIN DE LOS DIAGRAMAS DE TANABE-
SUGANO PARA CLCULO DEL DE LOS COMPLEJOS
K3[Cr(C2O4)3]3H2O, K3[Fe(C2O4)3]3H2O Y [Cr(en)3] Cl3
RESUMEN
MARCO TEORICO
Reglas de seleccin.
Las intensidades relativas de las bandas de absorcin son gobernadas por una
serie de reglas. Sobre la base de la simetra y de la multiplicidad de espn del
estado electrnico basal y de los estados electrnicos excitados, dos de estas
reglas pueden ejemplificar de la siguiente forma:
1- Las transiciones entre estados de la misma paridad (simetra con respecto al
centro de inversin) son prohibidas. Por ejemplo, las transiciones entre
orbitales d estn prohibidas (transiciones g g , los orbitales de son
simtricos a la inversin), pero entre entre orbitales p y d estn permitidas (
transiciones g u, los orbitales p son anti simtricos a la inversin). Esto es
conocido como regla de seleccin de Laporte.
2- Las transiciones entre estados de diferente multiplicidad de espn estn
prohibidas. Por ejemplo las transiciones entre estados
4
A
2
y
4
T
1
son
permitidas por espn , pero entre estados
4
A
2 y
2
A
2
son prohibidas por
espn . Esto es llamado regla de seleccin de espn.
Estas reglas pareceran aplicar para la mayora de las transiciones electrnicas
para los metales complejos de transicin. Sin embargo, muchos de estos
complejos son vivamente coloreados, una consecuencia de varios mecanismos
por las cuales estn reglas pueden ser rotas. Algunos de estos mecanismos
importantes son los siguientes:
1- Los enlaces en los complejos de los metales de transicin no son rgidos,
sufren vibraciones que pueden cambiar temporalmente la simetra. Los
complejos octadricos, por ejemplo, vibran en formas en la cual el centro
de simetra es temporalmente perdido; este fenmeno, llamado
acoplamiento vibronico, provee una forma de evadir la primera regla de
seleccin. Como una consecuencia las transiciones d-d que tienen
absortividades molares en el rango de aproximadamente 10 a 50
L.(mol.cm)-1 comnmente les ocurre (y son frecuentemente responsables
de los colores poco intensas de estos complejos.
2- El acoplamiento espn-orbita en algunos casos provee un mecanismo de
evasin de la segunda regla de seleccin con el resultado de que las
transiciones pueden ser observadas desde un estado fundamental de una
multiplicidad de espn a un estado de diferente multiplicidad de espn. Tales
bandas de absorcin para los complejos de los metales de transicin de la
primera serie son usualmente muy dbiles. Para los complejos de la
segunda y tercera serie el acoplamiento espn-orbita puede ser ms
importante
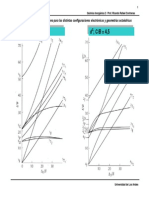
DIAGRAMAS DE TANABE-SUGANO
Los diagramas de Tanabe-Sugano son diagramas especiales de correlacin que
son particularmente utilizados en la interpretacin de espectros electrnicos de
compuestos de coordinacin. En los diagramas de Tanabe-Sugano, el estado de
mejor energa es graficado a los largo del eje horizontal; consecuentemente, la
distancia vertical por encima de este eje es una medida de la energa de los
estados excitados por encima del estado fundamental
Los espectros de absorcin de los compuestos de coordinacin pueden ser
usados para determinar la magnitud de separacin de campo de ligandos, la cual
es para los complejos octadricos. Debera ser claro que la precisin con la
cual se puede ser determinado el esta en alguna forma limitado por las
herramientas matemticas usadas para resolver el problema.
La facilidad con la cual el puede ser determinado depende de la configuracin
d-electrnica del metal; en algunos casos puede ser ledo fcilmente a partir
del espectro, pero en otros casos un anlisis ms complicado es necesario.
Se presentan la discusin para el caso del d3 y d5
La configuracin electrnica d3 tiene un trmino de estado fundamental F. en un
campo de ligando octadricos un trmino F se separa entres trminos, A
2g
, T
2g
y
T
1g
. como se muestra en la siguiente figura
El A
2g
es el trmino de menor energa para la configuracin d3. Para esta
configuracin, la diferencia de energa entre los dos trminos de menor energa, el
A
2g
y T
2g
, es igual al . Por lo tanto, para encontrar el simplemente
encontramos la energa de la transicin de menor energa en el espectro de
absorcin.
Para la configuracin d5 (alto spin) en los iones metlicos de transicin no se
encuentran estados excitados de la misma multiciplidad de espin (6) que el estado
basal. La bandas que son observadas son por la tanto la consecuencia de
transiciones prohibidas por espin y son tpicamente muy dbiles como, por
ejemplo, en Mn(H
2
O)
6
2+
.
Diagrama para la configuracin d3 y d5
Figura 1: diagrama de TANABE-SUGANO para una configuracin d3
Figura 2: diagrama de TANABE-SUGANO para una configuracin d5
Tabla de datos y resultados
1) Reactivos usados para K3[Fe(C2O4)3]3H2O
Reactivo PM Peso (0.0001g) %pureza
H
2
C
2
O
4
2H
2
O 126.07 2.5282 99.5
Fe(NH
4
)
2
(SO
4
)
2
6H
2
O 392.14 5.0930 99
K
2
C
2
O
4
H
2
O 184.24 3.5955 99.5
Se emplearon 8ml de H
2
O
2
20 volmenes para oxidar el hierro +2 a hierro +3
Las reacciones involucradas son las siguientes:
Fe(NH
4
)
2
(SO
4
)
2
6H
2
O + H
2
C
2
O
4
2H
2
O FeC
2
O
4
2H
2
O +H
2
C
2
O
4
2H
2
O
+H
2
SO
4
+H
2
O
FeC
2
O
4
2H
2
O + K
2
C
2
O
4
H
2
O + H
2
O
2
+ 4H
2
O 2 Fe(OH)
3
+ C
2
O
4
-2
+4K
+
4H
+
2Fe(OH)
3
+ 5C
2
O
4
-2
+ 6K
+
4H
+
+ 2H
2
C
2
O
4
2 K3[Fe(C2O4)3]3H2O
Rendimiento de la sntesis del K3[Fe(C2O4)3]3H2O
%Rendimiento Rendimiento real Rendimiento terico
69.76 4.4048 6.31426
2) Reactivos usados para K3[Cr(C2O4)3]3H2O
Reactivo PM Peso (0.0001g) %pureza
H
2
C
2
O
4
2H
2
O 126.07 14.1287 99.5
K
2
Cr
2
O
7
294 5.2436 99
K
2
C
2
O
4
H
2
O 184.24 6.0647 99.5
La reaccin es la siguiente:
K
2
Cr
2
O
7
+ H
2
C
2
O
4
2H
2
O + 2K
2
C
2
O
4
H
2
O 2 K3[Cr(C2O4)3]3H2O + H
2
O 6CO
2
Rendimiento de la sntesis del K3[Fe(C2O4)3]3H2O
%Rendimiento Rendimiento real Rendimiento terico
87.9067 15.2708 17.3716
1) Reactivos usados para [Cr(en)3] Cl3
Reactivo PM Peso (0.0001g) %pureza
CrCl
3
6H
2
O 266.48 6.7315 99
Se emple 10ml etilenodiamina para realizar la reaccin
La reaccin es la siguiente:
CrCl
3
6H
2
O + 3NH
2
-CH
2
-NH
2
[Cr(en)3] Cl3
Rendimiento de la sntesis del [Cr(en)3] Cl3
%Rendimiento Rendimiento real Rendimiento terico
65.5019 8.0364 12.2989
Tabla de mximos de absorcin de cada complejo
Para el complejo K3[Cr(C2O4)3]3H2O
(nm) Absorbancia
375.00 0.392
571.00 0.179
Para el complejo [Cr(en)3] Cl3
(nm) Absorbancia
352.50 0.071
Falta esta
Para el complejo K3[Fe(C2O4)3]3H2O
Consta de una seria de absorciones muy dbiles las cuales el equipo no
grafico ya que es un complejo d5
Discusin
Para el complejo K3[Fe(C2O4)3]3H2O es un complejo octadrico donde el tomo
central es el Hierro presenta una configuracin presenta una configuracin
[Ar]3d64s2, pero como el estado de oxidacin del hierro dentro de este complejo
es +3 la verdadera configuracin es [Ar]3d5, catalogndolo como un complejo d5.
Estructura del complejo:
Para este complejo ocurre algo muy particular en donde se observaron de
absorciones muy dbiles, por esta razn no se presenta ningn espectro
experimental.
El complejo al poseer un ncleo de Hierro con ligandos oxalato a su alrededor el
cual es catalogado como ligando campo dbil, se establece por medio de la
separacin entre niveles energticos y que la energa de estabilizacin del campo
cristal a campo dbil es igual a cero y no presenta transiciones permitidas de
energa entre los orbitales, esto con el fin de no tener un gasto energtico. Las
transiciones que ocurren son prohibidas y no observables como estn en el
diagrama de Tanabe-Sugano figura 2
Viendo el diagrama de la figura 2 y debido a que el Fe
3+
presenta una
configuracin d5 y presenta como termino fundamental 6S y un nico estado basal
6A1g, la regla del spin es S=0 presentando una multiplicidad 6 para spin alto
donde no se observan transiciones y la coloracin verde obtenida se debe a la
transicin de menor energa que es:
2T2g 2A2g
Tambin las transiciones que no son observables se presentan debido a que
existen bandas d-d con transiciones prohibidas pero permitidas por spin, llamando
as el acoplamiento espin-orbita establecido por la regla de seleccin de Laporte.
Por consiguiente en el espectro de UV-V, se presentan transferencias de carga del
metal al ligando y del ligando al metal. Estas bandas de absorcin son
caractersticas para cada uno de los compuestos y tambin depende del carcter
de fuerza que tenga el ligando en la energa de estabilidad del campo cristalino,
Para el Fe3+, que presenta una configuracin d5, existen bandas de
transferencias tipo d-d, que son prohibidas por Laporte pero permitidas por espn,
lo cual indica que el compuesto presenta absorbancia gracias a este tipo de saltos
energticos (excitacin de los electrones).
Si se considera el oxalato como ligando de campo dbil no se esperaran
transiciones d-d permitidas por espin. Para poder que existan transiciones d-d
permitidas es necesario considerar al oxalato como ligando de campo fuerte. Esto
lo podemos lograr teniendo en cuenta la serie espectro-qumica:
I < F- < urea < OH- < CH
3
CO
-2
< C
2
O
4
-2
H
2
O < NCS- < acac NH
3
< en
Se observa que el ion oxalato est muy cerca del H2O, por lo cual su
comportamiento con respecto al desdoblamiento de los orbitales d del metal ser
muy semejante. Adems, y ms importante an, el hierro se encuentra en estado
3+ por cual presentar un mayor valor de o que el ion 2+. Por estas dos razones,
se podra considerar al oxalato como si fuera ligando de campo fuerte. En el
caso en que el estado de oxidacin del hierro fuera 2+, y el ligando fuera de
campo an ms dbil que el oxalato, se esperara que no apareciera ninguna
banda. Considerando el oxalato como campo fuerte se puede observar en el
diagrama de Tanabe Sugano, existen tres transiciones presentes para este
complejo.
You might also like
- Recepcion de Materia Prima-ProcedimientosDocument7 pagesRecepcion de Materia Prima-ProcedimientosNAYBEA100% (1)
- CC - Cenm PDFDocument268 pagesCC - Cenm PDFCristina Garcia100% (3)
- 26280-220-V11-VA30-10325 - RC Code 2CRDocument1 page26280-220-V11-VA30-10325 - RC Code 2CRCarlos LujanNo ratings yet
- Grin GardDocument9 pagesGrin GardDavis Bernardo100% (1)
- Bizcochuelo EspecialDocument11 pagesBizcochuelo EspecialJusto Angel Vasquez TrujiilloNo ratings yet
- Ejercicios Resueltos EconomA A 1Aº Tema 8Document7 pagesEjercicios Resueltos EconomA A 1Aº Tema 8MV C CharlesNo ratings yet
- Un Camino Al PurgatorioDocument7 pagesUn Camino Al PurgatorioSandra Milena RondonNo ratings yet
- TDR Expediente Tecnico Pnsu CondeDocument13 pagesTDR Expediente Tecnico Pnsu CondeRonalito ScNo ratings yet
- GalvanismoDocument34 pagesGalvanismoEdgar Mauricio Arcos BeltránNo ratings yet
- Sulfato Sulfito y TiosulfatoDocument12 pagesSulfato Sulfito y TiosulfatoDavis BernardoNo ratings yet
- Practica No 2 Extraccion de AdnDocument8 pagesPractica No 2 Extraccion de AdnDavis BernardoNo ratings yet
- Actividad 1 La ComunicacionDocument2 pagesActividad 1 La ComunicacionDavis BernardoNo ratings yet
- Inuyasha El Castillo de Sueños en El Interior Del Espejo (Español)Document1 pageInuyasha El Castillo de Sueños en El Interior Del Espejo (Español)Davis BernardoNo ratings yet
- CanizzaroDocument4 pagesCanizzaroDavis BernardoNo ratings yet
- Diagramas de Tanabe-Sugano y OrgelDocument10 pagesDiagramas de Tanabe-Sugano y OrgelDavis BernardoNo ratings yet
- Practica 1 PeroxiboratoDocument3 pagesPractica 1 PeroxiboratoDavis BernardoNo ratings yet
- CR (Acac) 3Document2 pagesCR (Acac) 3Davis Bernardo0% (2)
- Maria Soledad Fernandez (2013) - La Cotidianeidad de La Tarea Docente en Una Escuela Con Jornada ExtendidaDocument13 pagesMaria Soledad Fernandez (2013) - La Cotidianeidad de La Tarea Docente en Una Escuela Con Jornada ExtendidaAlejandro EtcheverryNo ratings yet
- Desarrollo Del Proyecto de VidaDocument5 pagesDesarrollo Del Proyecto de Vidaana milena garcia dazaNo ratings yet
- Ambulancias Nom 020 SsaDocument11 pagesAmbulancias Nom 020 SsaIng Manuel Jaime Diez AlcantaraNo ratings yet
- Prevencion CuaternariaDocument3 pagesPrevencion CuaternariaNicole Margarita Moreano GuajardoNo ratings yet
- Ficha EsaviDocument1 pageFicha EsaviJefferson Rojas GuimarayNo ratings yet
- 2016 Ecolab Corp Sustainability Report Spanish LA Finalpdf PDFDocument21 pages2016 Ecolab Corp Sustainability Report Spanish LA Finalpdf PDFsusana lopezNo ratings yet
- Asperger. Historia Del Síndrome Por Alicia RoisteinDocument4 pagesAsperger. Historia Del Síndrome Por Alicia RoisteinGisela LudueñaNo ratings yet
- Aspectos Sanitarios en La Nutrición y La AlimentaciónDocument5 pagesAspectos Sanitarios en La Nutrición y La AlimentaciónDairo PeñaNo ratings yet
- Gaceta CDMX 529 BisDocument48 pagesGaceta CDMX 529 BisAdrián Martin RiveraNo ratings yet
- Taller #1 Final Estadística InferencialDocument1 pageTaller #1 Final Estadística InferencialMiss Maira - Pastoral ciclo I -No ratings yet
- Fisiopatologia PC4 PDFDocument54 pagesFisiopatologia PC4 PDFDavid Ignacio Reyes FloresNo ratings yet
- Los Rasgos Que Determinan A Las Personas Más Inteligentes Que El Resto - El MostradorDocument23 pagesLos Rasgos Que Determinan A Las Personas Más Inteligentes Que El Resto - El MostradorJAIME GONZALEZ RAENERGYNo ratings yet
- Objetivos de La Carrera Ing CivilDocument7 pagesObjetivos de La Carrera Ing CivilJeremias Josue MedinaNo ratings yet
- KIELBASADocument14 pagesKIELBASACarlos Alberto ZambranoNo ratings yet
- Sade, Masoch y Su Lenguaje - DeLLEZDocument12 pagesSade, Masoch y Su Lenguaje - DeLLEZRodrigo Diaz EsterioNo ratings yet
- Cuadro Comparativo de La Historia de GuatemalaDocument2 pagesCuadro Comparativo de La Historia de GuatemalaNelson Alfredo Vind0% (2)
- Taller Habitos ParafuncionalesDocument5 pagesTaller Habitos ParafuncionalesLAURA DANIELA MARIN TRUJILLONo ratings yet
- 2023.05.05 Bases Tecnicas PNAC Producto Purita Pro1 PP1Document50 pages2023.05.05 Bases Tecnicas PNAC Producto Purita Pro1 PP1Yvonne UribeNo ratings yet
- Actividad No 6. Fraude y PlagioDocument19 pagesActividad No 6. Fraude y Plagioaixavoley87No ratings yet
- Diseño MetodológicoDocument5 pagesDiseño MetodológicoEber Huayhua Vargas100% (1)
- Perfil de Personalidad 16pf5Document3 pagesPerfil de Personalidad 16pf5J Davi SalaNo ratings yet
- La Tecnología en Tiempos de PandemiaDocument2 pagesLa Tecnología en Tiempos de Pandemiaedwin huamacctoNo ratings yet