Professional Documents
Culture Documents
ANATOMI LAMBUNG
Uploaded by
HuiLeeOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
ANATOMI LAMBUNG
Uploaded by
HuiLeeCopyright:
Available Formats
BAB 2
TINJAUAN PUSTAKA
2.1. Lambung ( Gaster)
2.1.1. Anatomi Lambung
Lambung adalah organ pencernaan yang paling melebar, dan terletak di
antara bagian akhir dari esofagus dan awal dari usus halus (Gray, 2008).
Lambung merupakan ruang berbentuk kantung mirip huruf J , berada di bawah
diafragma, terletak pada regio epigastrik, umbilikal, dan hipokondria kiri pada
regio abdomen (Tortora & Derrickson, 2009).
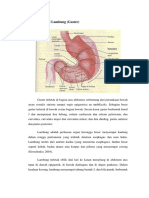
Secara anatomik, lambung memiliki lima bagian utama, yaitu kardiak,
fundus, badan (body), antrum, dan pilori (gambar 2.1). Kardia adalah daerah
kecil yang berada pada hubungan gastroesofageal (gastroesophageal junction)
dan terletak sebagai pintu masuk ke lambung Fundus adalah daerah berbentuk
kubah yang menonjol ke bagian kiri di atas kardia. Badan (body) adalah suatu
rongga longitudinal yang berdampingan dengan fundus dan merupakan bagian
terbesar dari lambung. Antrum adalah bagian lambung yang menghubungkan
badan (body) ke pilorik dan terdiri dari otot yang kuat. Pilorik adalah suatu
struktur tubular yang menghubungkan lambung dengan duodenum dan
mengandung spinkter pilorik (Schmitz & Martin, 2008).
Gambar 2.1 Pembagian daerah anatomi lambung
(Tortora & Derrickson, 2009)
Universitas Sumatera Utara
2.1.2 Histologi Lambung
Dinding lambung tersusun dari empat lapisan dasar utama, sama halnya
dengan lapisan saluran cerna secara umum dengan modifikasi tertentu yaitu
lapisan mukosa, submukosa, muskularis eksterna, dan serosa (Schmitz &
Martin, 2008).
1. Lapisan mukosa terdiri atas epitel permukaan, lamina propia, dan
muskularis mukosa. Epitel permukaan yang berlekuk ke dalam lamina
propia dengan kedalaman yang bervariasi, dan membentuk sumur-sumur
lambung disebut foveola gastrika. Epitel yang menutupi permukaan dan
melapisi lekukan-lekukan tersebut adalah epitel selapis silindris dan
semua selnya menyekresi mukus alkalis. Lamina propia lambung terdiri
atas jaringan ikat longgar yang disusupi sel otot polos dan sel limfoid.
Muskularis mukosa yang memisahkan mukosa dari submukosa dan
mengandung otot polos (Tortora & Derrickson, 2009).
2. Lapisan sub mukosa mengandung jaringan ikat, pembuluh darah, sistem
limfatik, limfosit, dan sel plasma. Sebagai tambahan yaitu terdapat
pleksus submukosa (Meissner) (Schmitz & Martin, 2008).
3. Lapisan muskularis propia terdiri dari tiga lapisan otot, yaitu (1) inner
oblique, (2) middle circular, (3) outer longitudinal. Pada muskularis
propia terdapat pleksus myenterik (auerbach) (Schmitz & Martin, 2008).
Lapisan oblik terbatas pada bagian badan (body) dari lambung (Tortora &
Derrickson, 2009).
4. Lapisan serosa adalah lapisan yang tersusun atas epitel selapis skuamos
(mesotelium) dan jaringan ikat areolar (Tortora & Derrickson, 2009).
Lapisan serosa adalah lapisan paling luar dan merupakan bagian dari
viseral peritoneum (Schmitz & Martin, 2008).
Universitas Sumatera Utara
Gambar 2.2 Histologi dari lambung (Tortora & Derrickson, 2009)
2.1.3. Fisiologi Sekresi Getah Lambung
Setiap hari lambung mengeluarkan sekitar 2 liter getah lambung. Sel-sel
yang bertanggung jawab untuk fungsi sekresi, terletak di lapisan mukosa
lambung. Secara umum, mukosa lambung dapat dibagi menjadi dua bagian
terpisah : (1) mukosa oksintik yaitu yang melapisi fundus dan badan (body), (2)
daerah kelenjar pilorik yang melapisi bagian antrum. Sel-sel kelenjar mukosa
terdapat di kantong lambung (gastric pits), yaitu suatu invaginasi atau kantung
pada permukaan luminal lambung. Variasi sel sekretori yang melapisi
invaginasi ini beberapa diantaranya adalah eksokrin, endokrin, dan parakrin
(Sherwood, 2010).
Ada tiga jenis sel tipe eksokrin yang ditemukan di dinding kantung dan
kelenjar oksintik mukosa lambung (Gambar 2.3), yaitu :
1. Sel mukus yang melapisi kantung lambung, yang menyekresikan mukus
yang encer.
Universitas Sumatera Utara
2. Bagian yang paling dalam dilapisi oleh sel utama (chief cell) dan sel
parietal. Sel utama menyekresikan prekursor enzim pepsinogen.
3. Sel parietal (oksintik) mengeluarkan HCl dan faktor intrinsik. Oksintik
artinya tajam, yang mengacu kepada kemampuan sel ini untuk
menghasilkan keadaan yang sangat asam.
Semua sekresi eksokrin ini dikeluarkan ke lumen lambung dan mereka
berperan dalam membentuk getah lambung (gastric juice ) (Sherwood, 2010).
Sel mukus cepat membelah dan berfungsi sebagai sel induk bagi
semua sel baru di mukosa lambung. Sel-sel anak yang dihasilkan dari
pembelahan sel akan bermigrasi ke luar kantung untuk menjadi sel epitel
permukaan atau berdiferensiasi ke bawah untuk menjadi sel utama atau sel
parietal. Melalui aktivitas ini, seluruh mukosa lambung diganti setiap tiga hari
(Sherwood, 2010).
Kantung-kantung lambung pada daerah kelenjar pilorik terutama
mengeluarkan mukus dan sejumlah kecil pepsinogen, yang berbeda dengan
mukosa oksintik. Sel-sel di daerah kelenjar pilorik ini jenis selnya adalah sel
parakrin atau endokrin. Sel-sel tersebut adalah sel enterokromafin yang
menghasilkan histamin, sel G yang menghasilkan gastrin, sel D menghasilkan
somatostatin. Histamin yang dikeluarkan berperan sebagai stimulus untuk
sekresi asetilkolin, dan gastrin. Sel G yang dihasilkan berperan sebagai stimuli
sekresi produk protein, dan sekresi asetilkolin. Sel D berperan sebagai stimuli
asam (Sherwood, 2010).
Universitas Sumatera Utara
Gambar 2.3 Kelenjar oksintik di lambung ( Harrison, 2008 )
2.1.3.1. Mekanisme Sekresi Asam Hidroklorida
Sel-sel parietal secara aktif mengeluarkan HCl ke dalam lumen
kantung lambung, yang kemudian mengalirkannya ke dalam lumen lambung.
pH isi lumen turun sampai serendah 2 akibat sekresi HCl. Ion hidorgen (H
+
)
dan ion klorida (Cl) secara aktif ditransportasikan oleh pompa yang berbeda
di membran plasma sel parietal. Ion hidrogen secara aktif dipindahkan
melawan gradien konsentrasi yang sangat besar, dengan konsentrasi H
+
di
dalam lumen mencapai tiga sampai empat juta kali lebih besar dari pada
konsentrasinya dalam darah. Karena untuk memindahkan H
+
melawan
gradien yang sedemikian besar diperlukan banyak energi, sel-sel parietal
memiliki banyak mitokondria, yaitu organel penghasil energi. Klorida juga
disekresikan secara aktif, tetapi melawan gradien konsentrasi yang jauh lebih
kecil, yakni hanya sekitar satu setengah kali (Sherwood, 2010).
Ion H
+
yang disekresikan tidak dipindahkan dari plasma tetapi berasal
Universitas Sumatera Utara
dari proses-proses metabolisme di dalam sel parietal. Secara spesifik, ion H
+
disekresikan sebagai hasil pemecahan dari molekul H
2
O menjadi H
+
dan OH
-.
Di sel parietal H
+
disekresikan ke lumen oleh pompa H
+
-K
+
-ATPase yang
berada di membran luminal sel parietal. Transpot aktif primer ini juga
memompa K+ masuk ke dalam sel dari lumen. Ion K
+
yang telah
ditranspotkan, secara pasif balik ke lumen, melalui kanal K
+
, sehingga jumlah
K
+
tidak berubah setelah sekresi H
+
.
Sel-sel parietal memiliki banyak enzim
karbonat anhidrase (ca). Dengan adanya karbonat anhidrase, H
2
O mudah
berikatan dengan CO
2,
yang diproduksi oleh sel parietal melalui proses
metabolisme atau berdifusi masuk dari darah. Kombinasi antara H
2
O dan CO
2
menghasilkan H
2
CO
3
yang secara parsial terurai menjadi H
+
dan HCO
3
-
(Sherwood, 2010).
HCO
3
-
dipindahkan ke plasma oleh antipoter Cl
- __
HCO
3
-
pada
membran basolateral dari sel parietal. Kemudian mengangkat Cl
-
dari plasma
ke lumen lambung. Pertukaran Cl
-
dan
HCO
3
-
mempertahankan netralitas
listrik plasma selama sekresi HCl ( gambar 2.4 ) (Sherwood, 2010).
Universitas Sumatera Utara
Gambar 2.4 Mekanisme Sekresi HCl (Sherwood, 2010)
Proses tersebut dapat dituliskan sebagai berikut :
CO
2
+H
2
O H
2
CO
3
H
+
+HCO3
Adapun fungsi dari HCl adalah sebagai berikut :
1. Mengaktifkan prekursor enzim pepsinogen menjadi enzim aktif
pepsin, dan membentuk lingkungan asam yang optimal untuk
aktivitas pepsin.
2. Membantu penguraian serat otot dan jaringan ikat, sehingga
partikel makanan berukuran besar dapat dipecah-pecah menjadi
partikel-partikel kecil.
3. Bersama dengan lisozim air liur, mematikan sebagian besar
mikroorganisme yang masuk bersama makanan, walaupun
Universitas Sumatera Utara
sebagian dapat lolos serta terus tumbuh dan berkembang biak di
usus besar (Sherwood, 2010).
2.1.4. Sistem Pertahanan Mukosa Lambung
Lambung dapat diserang oleh beberapa faktor endogen dan faktor
eksogen yang berbahaya. Sebagai contoh faktor endogen adalah asam
hidroklorida (HCl), pepsinogen/pepsin, dan garam empedu, sedangkan contoh
substansi eksogen yang dapat menyebabkan kerusakan mukosa lambung
adalah seperti obat, alkohol, dan bakteri. Sistem biologis yang kompleks
dibentuk untuk menyediakan pertahanan dari kerusakan mukosa dan untuk
memperbaiki setiap kerusakan yang dapat terjadi (Kasper, Hauser, Longo,
Braunwald, Fauci, & J ameson Epitelium, 2008).
Sistem pertahanan dapat dibagi menjadi tiga tingkatan sawar yang
terdiri dari preepitel, epitel, dan subepitel (gambar 2.5) . Pertahanan lini
pertama adalah lapisan mukus bikarbonat, yang berperan sebagai sawar
psikokemikal terhadap beberapa molekul termasuk ion hidrogen. Mukus
dikeluarkan oleh sel epitel permukaan lambung. Mukus tersebut terdiri dari
air (95%) dan pencampuran dari lemak dan glikoprotein (mucin). Fungsi gel
mukus adalah sebagai lapisan yang tidak dapat dilewati air dan menghalangi
difusi ion dan molekul seperti pepsin. Bikarbonat, dikeluarkan sebagai
regulasi di bagian sel epitel dari mukosa lambung dan membentuk gradien
derajat keasaman (pH) yang berkisar dari 1 sampai 2 pada lapisan lumen dan
mencapai 6 sampai 7 di sepanjang lapisan epitel sel (Kasper, Hauser, Longo,
Braunwald, Fauci, & J ameson Epitelium, 2008).
Lapisan sel epitel berperan sebagai pertahanan lini selanjutnya melalui
beberapa faktor, termasuk produksi mukus, tranpoter sel epitel ionik yang
mengatur pH intraselular dan produksi bikarbonat dan taut erat intraselular.
J ika sawar preepitel dirusak, sel epitel gaster yang melapisi sisi yang rusak
dapat bermigrasi untuk mengembalikan daerah yang telah dirusak
Universitas Sumatera Utara
(restitution). Proses ini terjadi dimana pembelahan sel secara independen dan
membutuhkan aliran darah yang tidak terganggu dan suatu pH alkaline di
lingkungan sekitarnya. Beberapa faktor pertumbuhan (growth factor)
termasuk epidermal growth factor ( EGF), transforming growth factor
(TGF) dan basic fibroblast growth factor (FGF), memodulasi proses
pemulihan. Kerusakan sel yang lebih besar yang tidak secara efektif
diperbaiki oleh proses perbaikan (restitution), tetapi membutuhkan proliferasi
sel. Regenerasi sel epitel diregulasi oleh prostaglandin dan faktor
pertumbuhan (growth factor) seperti EGF dan TGF . Bersamaan dengan
pembaharuan dari sel epitel, pembentukan pembuluh darah baru
(angiogenesis) juga terjadi pada kerusakan mikrovaskular. Kedua faktor yaitu
FGF dan VEGF penting untuk meregulasi angiogenesis di mukosa lambung
(Kasper, Hauser, Longo, Braunwald, Fauci, & J ameson Epitelium, 2008).
Sistem mikrovaskular yang luas pada lapisan submukosa lambung
adalah komponen utama dari pertahanan subepitel, yang menyediakan
HCO3, yang menetralisir asam yang dikeluarkan oleh sel parietal. Lebih lagi,
sistem mikrosirkulasi menyediakan suplai mikronutrien dan oksigen dan
membuang metabolit toksik (Kasper, Hauser, Longo, Braunwald, Fauci, &
J ameson Epitelium, 2008).
Prostaglandin memainkan peran yang penting dalam hal pertahanan
mukosa lambung. Mukosa lambung mengandung banyak jumlah
prostaglandin yang meregulasikan pengeluaran dari mukosa bikarbonat dan
mukus, menghambat sekresi sel parietal, dan sangat penting dalam mengatur
aliran darah dan perbaikan dari sel epitel (Kasper, Hauser, Longo, Braunwald,
Fauci, & J ameson Epitelium, 2008).
Universitas Sumatera Utara
Gambar 2.5 Komponen yang terlibat sebagai pertahanan mukosa lambung (Kasper,
Hauser, Longo, Braunwald, Fauci, & J ameson, 2008)
Setiap perubahan pada mekanisme sawar dapat membawa kepada
keadaan asidosis sel, nekrosis, dan pembentukan ulserasi. Perubahan ini dapat
terjadi sebagai hasil dari inflamasi (proteolisis mukus), pemaparan terhadap
OAINS atau kerusakan akibat iskemia (penurunan aliran darah submukosa)
(Schmitz & Martin, 2008).
2.2 Gastropati
2.2.1 Definisi Gastropati
Isitilah gastropati dibedakan dengan gastritis, karena gastropati
mengacu kepada kondisi dimana inflamasi bukanlah sesuatu hal yang paling
mendominasi, sedangkan gastritis mengacu kepada beberapa kondisi yang
melukai mukosa lambung dan menghasilkan suatu peradangan dan diciri-
cirikan dengan ditemukannya sel inflamasi (Ranjan, Eric, Gareth, & J ames,
1999). Gastropati adalah suatu keadaan mukosa lambung tanpa proses
inflamasi atau proses inflamasi yang minimal, sedangkan gastritis adalah
diagnosa secara histologis yang menunjukkan suatu inflamasi pada bagian
mukosa lambung (Marx, 2009).
Universitas Sumatera Utara
Salah satu penyebab gastropati adalah pemakaian obat anti inflamasi
non steroid, selain refluks asam empedu, asam, basa dan konsumsi sejumlah
alkohol (Nel, 2012).
2.3 Obat Anti Inflamasi Non Steroid
2.3.1 Definisi
Obat anti inflamasi non steroid adalah obat yang secara luas dikenal
sebagai pengobatan nyeri, inflamasi, dan demam. (Sinha & Gautam, 2013).
Selain itu, obat ini juga obat yang paling sering diresepkan di seluruh dunia
(Becker, Domschke, & Thorsten, 2004). OAINS adalah suatu kelompok
kimia heterogen yang memiliki efek teraputik (antiinflamasi, antipiretik, dan
analgesik) dan efek samping. OAINS terdiri dari obat non selektif tradisional
dan sub kelas obat yang secara selektif menghambat cyclooxygenase-2
(COX-2) (Brunton, Parker, Blumenthal, & Buxton, 2008).
Salisilat dan obat-obat lain yang digunakan untuk mengobati penyakit
rematik mempunyai kemampuan untuk menekan tanda dan gejala
peradangan. Beberapa dari obat ini juga mempunyai efek antipiretik dan
analgesik, dan efek antiinflamasinya membuat obat ini bermanfaat dalam
menanggulangi kelainan rasa nyeri yang berubungan dengan intensitas
proses peradangan. (Furst & Ulrich, 2007).
Universitas Sumatera Utara
2.3.2 Klasifikasi OAINS
Tabel 2.1 Klasifikasi OAINS
Universitas Sumatera Utara
Universitas Sumatera Utara
Sumber Tabel 2.1 : (Brunton, Palrker, Bluementhal, dan Buxton, 2007)
Universitas Sumatera Utara
2.3.3 Mekanisme Kerja OAINS
1. Sebagai Efek anti-inflamasi
Prostaglandin dikeluarkan bilamana sel mengalami kerusakan,
dimana aspirin dan OAINS menghambat biosintesis dari
prostaglandin di semua jenis sel. Bagaimanapun, aspirin dan OAINS
biasanya tidak menghambat pembentukan dari mediator inflamasi
lain seperti leukotrien (LTs). Sementara efek klinis dari obat ini dapat
dijelaskan dalam istilah penghambatan dari sintesis prostaglandin,
perbedaan substansi interindividu dan intraindividu juga diketahui..
Pada konsentrasi yang lebih tinggi OAINS juga diketahui
menurunkan produksi radikal superoksida, menghambat ekspresi dari
molekul adhesi, menurunkan sintesis nitric oxide (NO), menurunkan
sitokin proinflmanatori (sebagai contoh : TNF-a, IL-1), memodifikasi
aktivitas limfosit, dan mengubah fungsi membran seluler (Brunton,
Parker, Blumenthal, & Buxton, 2008). Berbagai jenis OAINS
memiliki tambahan mekanisme kerja yang mungkin melibatkan
penghambatan kemotaksis, dan keterlibatan dengan kejadian
intraseluler yang dikaitkan dengan ion kalsium (Furst & Ulrich,
2007).
Enzim pertama dalam jalur sintesis prostaglandin untuk
menghasilkan prostaglandin G/H (gambar 2.1) disebut enzim
cyclooxygenase (COX). Enzim ini mengkonversi asam arakidonat
menjadi intermediat PGG2 dan PGH2 dan membawa pada produksi
dari tromboksan A2 (TXA2) dan variasi dari prostaglandin lain.
Dosis teraputik dari aspirin dan OAINS lain mengurangi biosintesis
dari prostaglandin dengan cara memblok COX dan terdapat hubungan
yang baik dan beralasan di antara potensi sebagai penghambat COX
Universitas Sumatera Utara
dan kerja antiinflamasi (Brunton, Parker, Blumenthal, &
Buxton,2008).
Ada dua bentuk dari COX, yaitu COX-1 dan COX-2. COX-1
adalah isoform konstitutif yang dasar ditemukan pada kebanyakan sel
normal dan jaringan, sementara sitokin dan mediator inflamasi yang
menyertai inflamasi menginduksi produksi COX-2. Bagaimanapun,
COX-2 juga diekspresikan secara konstitutif pada beberapa area
tertentu pada ginjal dan otak dan diinduksi pada sel endotel melalui
laminar shear forces. Enzim COX-1 diekspresikan sebagai yang
mendominasi, isoform konstitutif pada sel epitelial lambung dan
menjadi sumber utama dari pembentukan sitoproteksi prostaglandin.
Penghambatan dari COX-1 pada sisi ini akan menghasilkan efek
samping pada lambung (Brunton, Parker, Blumenthal, & Buxton,
2008).
Gambar 2.6 Mekanisme Kerja Obat Anti Inflamasi Non Steroid
(Brunton, Parker, Blumenthal, & Buxton, 2008)
Universitas Sumatera Utara
2. Sebagai Efek Analgesik
OAINS digunakan sebagai analgesik ringan. Tetapi pengenalan
terhadap jenis dari nyeri dan intensitasnya penting dalam penilaian
efek dari analgesik. OAINS efektif ketika inflamasi telah
menyebabkan sentisisasi dari reseptor nyeri terhadap rangsangan
mekanik ataupun kimia. Bradikinin, yang dikeluarkan dari plasma
kininogen dan sitokin seperti TNF-a, IL-1, dan IL-8 tampil dalam
nyeri pada inflamasi. Agen ini melepaskan prostaglandin dan
mungkin beberapa faktor lain yang mempromosikan hiperalgesia.
Neuropeptida, seperti substansi P dan calcitonin gen related peptide
(CGRP) juga terlibat dalam terjadinya nyeri. (Brunton, Parker,
Blumenthal, & Buxton, 2008).
Kapasitas prostaglandin untuk mensentisasi reseptor nyeri
terhadap stimulasi mekanik dan kimia ternyata menghasilkan
penurunan ambang dari polimodal nosiseptor dari serabut saraf C
(Brunton, Parker, Blumenthal, & Buxton, 2008).
3. Sebagai Efek Anti-piretik
Regulasi suhu badan membutuhkan keseimbangan antara
produksi dan kehilangan panas; hipotalamus meregulasikan set poin
dimana suhu tubuh diatur. Set poin ini ditingkatkan pada saat panas
(bisa disebabkan karena infeksi, inflamasi, rejeksi graft, atau
keganasan), sebagai hasil dari pembentukan sitokin seperti IL-1,
IL-6, interferon, dan TNF-. Sitokin meningkatkan sintesis dari
PGE
2
di daerah hipotalamus dan PGE
2
meningkatkan siklik AMP
dan memacu hipotalamus untuk meningkatkan suhu tubuh dengan
meningkatkan panas dan menurunkan pengeluaran panas. Aspirin
dan OAINS menekan respon ini dengan menghambat PGE
2,
tapi
Universitas Sumatera Utara
tidak mempengaruhi temperatur tubuh ketika tubuh melakukan
latihan (exercise) (Brunton, Parker, Blumenthal, & Buxton, 2008).
2.3.4 Efek Samping dari OAINS
Efek samping dari penggunaan OAINS adalah meningkatnya resiko
dari saluran cerna bagian atas ataupun bawah, bervariasi dari dispepsia
sampai ulserasi dan perdarahan saluran cerna (Schellack, 2012). OAINS
menghasilkan efek samping pada saluran cerna berupa lesi mukosal,
perdarahan, ulkus peptikum dan inflamasi pada usus yang membawa kepada
perforasi, striktur pada usus halus dan besar, yang membawa kepada masalah
yang kronik (Sinha & Gautam, 2013).
2.4 Gastropati Obat Anti Inflamasi Non Steroid
2.4.1 Definisi
Gastropati OAINS merupakan komplikasi yang sering ditemukan yang
mempunyai karakteristik gejala sindroma dispepsia dengan keluhan perasaan
tidak nyaman di daerah epigastrium disertai kembung dan mual (Manan,
Priosoeryanto, Daldiyono, Estuningsih, & Rahminiwati, 2008). Gastropati
OAINS adalah kelainan yang mengacu kepada spektrum komplikasi saluran
cerna yang berhubungan dengan OAINS, bervariasi antara dispepsia ringan
sampai perforasi, erosi, ulserasi dan perdarahan (Roth, 2012). Gastropati
OAINS disebut sebagai suatu fenomena dimana OAINS menyebabkan
kerusakan mukosa lambung yang menghasilkan kejadian bervariasi dari
dispepsia nonspesifik seperti, ulserasi, perdarahan saluran cerna bagian atas
dan bahkan kematian (Becker, Domschke, & Thorsten, 2004).
Gastropati OAINS ini juga sering disebut sebagai gastropati kimia
(chemical gastropathy). Istilah ini lebih diutamakan karena mengacu kepada
perubahan endoskopi dan histologi dari mukosa lambung yang disebabkan
oleh jejas kimia pada mukosa lambuung (Nel, 2012).
Universitas Sumatera Utara
2.4.2 Faktor Resiko Gastropati OAINS
Faktor resiko gastropati yang perlu dipertimbangkan (tabel 2.2)
seorang individu untuk mendapat gejala gastropati adalah jika individu
tersebut merupakan pasien yang berusia di atas 60 tahun, memiliki riwayat
ulserasi sebelumnya dan sedang menjalani pengobatan osteoartitis (Roth,
2012).
Tabel 2.2 Faktor Resiko Gastropati
Usia >60 tahun
J enis kelamin perempuan
Perokok (current smoker)
Riwayat ulserasi atau perdarahan sebelumnya
Kombinasi terapi OAINS
Penggunaan yang bersamaan dari agen antiplatelet, aspirin, kortikosteroid, dan
antikoagulan
Sumber Tabel 2.2 : (Roth,2012)
2.4.3 Mekanisme OAINS menginduksi gastropati
OAINS termasuk aspirin, menyebabkan kerusakan mukosa melalui
dua cara utama, yaitu inhibisi sistemik dari prostaglandin dan iritasi epitel
lambung. Inhibisi prostaglandin berhubungan dengan penghambatan dari
COX-1, sementara efek antiinflamasinya berhubungan dengan inhibisi
COX2. Iritasi epitel lambung berhubungan dengan keasaman OAINS
(Schellack, 2012). Ada tiga mekanisme yang berbeda dari gastropati yang
disebabkan oleh OAINS dan menginduksi komplikasi saluran cerna, yaitu
melalui : penghambatan enzim COX-1 dan gastroprotektif PG,
permeabilisasi membran, dan produksi dari mediator proinflamatori
(gambar 2.2) (Sinha&Gautam, 2013).
Universitas Sumatera Utara
1. Inhibisi dari COX-1 dan Gastroprotektif PG
Ada dua isoform dari COX, yaitu COX-1 dan COX-2, yang
memiliki fungsi yang berbeda. Enzim COX-1 bertanggung jawab
terhadap proteksi normal fisiologis dari mukosa lambung. COX-1
penting untuk sintesis dari prostaglandin, yang mana melindungi
lambung dari pengeluaran asam, mengatur aliran darah di mukosa
lambung, dan menghasilkan bikarbonat. Isoform lain, COX-2,
dipicu oleh kerusakan sel, sitokin proinflamatori yang bervariasi,
dan faktor turunan tumor. Kebanyakan gastropati yang terjadi
disebabkan oleh inhibisi oleh COX-1 oleh OAINS (Sinha &
Gautam, 2013).
2. Membran Permeabilisasi
OAINS juga memiliki efek sitotoksik langsung pada sel
mukosa lambung yang menyebabkan lesi dan luka. Kerusakan
topikal pada jenis ini telah diobservasi pada kasus keasaman dari
OAINS, seperti aspirin yang menghasilkan akumulasi dari OAINS
yang terionisasi, suatu fenoma dinamakan ion trapping. Aspirin
menurunkan ketidaklarutan air dan menyebabkan difusi kembali
dari ion H
+
dan pepsin (Schellack, 2012). Hal itu menunjukkan
bahwa OAINS menyebabkan permeabilisasi membran membawa
kepada kerusakan sawar epitel. OAINS juga dapat menginduksi
baik nekrosis dan apoptosis pada mukosa sel lambung (Sinha &
Gautam, 2013).
3. Produksi tambahan dari Mediator Proinflamatori
Inhibisi dari sintesis PG oleh OAINS membawa kepada
aktivasi jalur lipooksigenase dan peningkatan sintesis leukotrien.
Leukotrien menyebabkan inflamasi dan iskemia jaringan dan
akhirnya luka pada mukosa lambung. Bersamaan dengan ini ada
Universitas Sumatera Utara
juga produksi dari mediator proinflamatori yang ditingkatkan
seperti tumor necrosing factor. Hal ini kemudian menjadikan
oklusi mikrovesel yang membawa kepada penurunan aliran
pembuluh darah dan pengeluaran radikal bebas. Radikal bebas
akan bereaksi dengan asam lemak yang tidak jenuh dari mukosa
dan akhirnya membawa kepada peroksidasi lemak dan kerusakan
jaringan (Sinha & Gautam, 2013).
Gambar 2.7 Mekanisme Gastropati yang disebabkan oleh OAINS
(Sinha & Gautam, 2013)
2.4.4 Hubungan COX-2 dengan terjadinya gastropati
Enzim COX-2 berhubungan dengan terjadinya efek samping pada
saluran cerna. Hipotesis menunjukkan bahwa penghambatan selektif COX-2
akan menghematkan pengeluaran COX-1 yang memediasi PG, dan hanya
menghambat COX-2 yang memediasi PG yang terlibat dalam proses
inflamasi. Bagaimanapun, COX-2 terlibat dalam pertahanan dan perbaikan
Universitas Sumatera Utara
mukosa, dan hal ini menunjukkan bahwa kedua isoform COX bertanggung
jawab untuk proses fisiologis dari kerusakan jaringan. Penelitian yang
dilakukan pada hewan, dimana dilakukan inhibisi COX-1 secara selektif,
tidak terlihat proses inhibisi itu menghasilkan kerusakan lambung yang
signifikan. Dalam penelitian lain dikatakan, inhibisi selektif COX-2
menghasilkan komplikasi saluran cerna yang lebih bahaya dibandingkan
penggunaan OAINS yang non selektif (Schellack, 2012).
2.4.5 Gejala Klinis Gastropati OAINS
Gejala klinis yang sering dikeluhkan oleh pasien gastropati OAINS
adalah sindroma dispepsia, perasaan tidak nyaman di daerah epigastrium,
disertai kembung dan mual. (Manan, Priosoeryanto, Daldiyono,
Estuningsih, & Rahminiwati, 2008). Gastropati OAINS mengacu kepada
spektrum yang bervariasi dari dispepsia ringan, dan ketidaknyamanan perut
sampai kepada perforasi yang lebih serius, erosi, ulserasi dan perdarahan
(Roth, 2012). Manifestasi klinis dari penggunaan OAINS dapat bergantung
pada keparahannya. Penggunaan OAINS dapat menyebabkan beberapa
keadaan serius, dan kompilkasi yang mengancam jiwa (Schellack, 2012).
2.4.6 Diagnosis dan insidensi Gastropati OAINS
Gastropati, biasanya terjadi pada region prepilorik, merupakan suatu
komplikasi umum penggunaan jangka panjang dari OAINS. Walaupun
secara superfisial gastropati OAINS dapat memberikan tanda dan gejala
dengan kelainan saluran cerna lainnya, seperti penyakit ulserasi peptikum,
gastropati OAINS berbeda dari penyakit klasik ulserasi peptikum
berdasarkan perbedaan patofisiologinya, lokasi anatomi, pola secara klinis,
dan isitilah yang digunakan untuk menekankan perbedaan tersebut (Roth,
2012).
Ulserasi peptikum yang klasik dimediasi oleh asam, berhubungan
dengan infeksi H.pyolri, usus, dan lebih sering terjadi pada orang yang
Universitas Sumatera Utara
berusia muda, biasanya lelaki sesuai demografik. Ulserasi peptikum juga
berhubungan dengan pemakaian jangka panjang dari OAINS, walaupun
non-OAINS, non-H.pyolri juga dapat menyebabkan penyakit ulserasi
peptikum (Roth, 2012).
Diagnosa gastropati OAINS dapat ditegakkan dari gejala klinis
gastropati OAINS yang dapat bervariasi mulai dari dispepsia dan nyeri
bagian perut sampai kepada komplikasi yang fatal seperti perforasi, ulserasi,
dan perdarahan. Sebagai tambahan, lesi yang tidak memberikan gejala
(asimtomatik), adalah yang paling sering ditemukan pada kasus gastropati
OAINS. Endoskopi dapat menjadi alat diagnostik pada beberapa kasus, bila
diagnosisnya masih belum jelas, dan penggunaan endoskopi tidak selalu
diindikasikan (Roth, 2012).
Diagnosis juga diperkuat dengan melihat adanya faktor resiko yang
memicu terjadinya gastropati OAINS, seperti penyakit komorbid (yang
memperparah) seperti osteoartritis, reumatoid artritis, ankylosing
spondylitis, penyakit muskuloskeletal dan penyakit kardiovaskular yang
memiliki resiko lebih besar untuk mendapatkan gastopati yang disebabkan
oleh pemakaian OAINS (Roth, 2012).
Insidensi penggunaan OAINS yang secara klinis signifikan
berhubungan dengan efek samping pada saluran cerna adalah empat kali
lebih besar dibandingkan dengan populasi umum yang tidak mendapat
terapi OAINS (Roth, 2012).
2.4.7 Pengobatan Gastropati OAINS
Ketika mengindentifikasi dan menurunkan resiko terjadinya
gastropati yang disebabkan oleh penggunaan OAINS, prinsip teraputik
dibawah ini dapat digunakan :
Universitas Sumatera Utara
1. Memberikan terapi OAINS yang bersamaan dengan proton pump
inhibitor (PPI), atau misoprostol, akan mengurangi resiko ulserasi dan
komplikasi pada pasien yang beresiko.
2. Menggunakan inhibitor COX-2 yang non-selektif, tidak secara
keseluruhan menghilangkan ulserasi dan komplikasi, tapi setidaknya
mengurangi resiko, dan tetap harus melakukan evaluasi terhadap
profil kardiovaskular pasien.
3. Ketika menggunakan strategi gastroprotektif, pasien harus di
evaluasi secara keseluruhan (Schellack, 2012)
Terapi terbaru untuk mencegah kerusaan mukosa lambung :
1. Mengidentifikasi profil pasien yang memiliki resiko
Resiko dapat diturunkan dengan substitusi OAINS dengan OAINS
non-analgesik seperti parasetamol. Hal ini mungkin tidak mudah,
khususnya pada pasien dengan kondisi inflamasi yang berat seperti artritis.
Gambar 2.3 akan menunjukkan algoritma yang mungkin untuk
manajemen pasien yang cenderung memakai OAINS dalam jangka waktu
lama, dan pasien memilki resiko kardiovaskular. (Schellack, 2012).
Gambar 2.8 Algoritma manejemen pasien yang cenderung memakai OAINS
untuk waktu yang lama (Schellack, 2012)
Universitas Sumatera Utara
2. Kombinasi Terapi OAINS dengan Gastroprotektif
Analog prostaglandin diresepkan bersama dengan OAINS untuk
mengganti prostaglandin di mukosa lambung yang telah dirusak oleh
OAINS (Sinha & Gautam, 2013). Sebagai contoh, misoprostol.
Misoprostol adalah analog sintetik dari prostaglandin E. Walaupun
penggunaan misoprostol didemonstrasikan untuk menurunkan resiko
ulserasi pada saluran cerna, telah dibuktikan bahwa misoprostol memilki
efek samping. Efek samping yang terjadi berupa, nyeri pada daerah perut,
mual, diare, dan penggunaanya harus dihindarkan pada wanita yang
menyusui (Schellack, 2012).
3. Kombinasi Terapi OAINS dengan Proton Pump Inhibitor (PPI)
PPI secara ireversibel terikat pada pompa proton ( H
+
K
+
ATPase)
yang menghambat sekresi asam lambung. Sebagai contoh Lansoprazole
telah dibuktikan untuk melindungi dan menyembuhkan mukosa lambung
setelah diinduksi oleh pemakaian OAINS, melalui inhibisi apoptosis, dan
stimulasi dari peningkatan kelangsungan hidup sel dan proliferasi sel
(Schellack, 2012). PPI efektif juga dalam pencegahan ulserasi ketika
diberikan bersamaan dengan OAINS (Sinha & Gautam, 2013).
Penambahan dari PPI terhadap pemberian OAINS telah menunjukkan
efek proteksi pada saluran cerna baik pada penggunaan OAINS jangka
pendek ataupun jangka panjang. Dibandingkan dengan prostaglandin
analog, PPI secara terapi lebih superior. Penggunaan yang lama dari PPI
berhubungan dengan resiko fraktur panggul pada orang tua. PPI juga
dapat menyebabkan penurunan serum level magnesium, dan jika
digunakan untuk periode yang lebih lama akan meningkatkan resiko
kardiovaskular. Penambahan PPI terhadap OAINS meningkatkan resiko
interaksi obat, efek samping, dan kepatuhan pasien (Roth, 2012).
Universitas Sumatera Utara
4. Kombinasi Histamin H
2
-Reseptor antagonis terhadap OAINS
Histamin H
2
-reseptor antagonis melindungi saluran cerna akibat
pemakaian OAINS dengan cara memblok kerja dari histamin pada sel
parietal di lambung, sehingga menurunkan produksi asam oleh sel ini
(Roth, 2012). H
2
reseptor antagonis adalah obat pertama yang digunakan
sebagai pencegahan mekanisme terjadinya ulserasi peptikum yang
diinduksi oleh penggunaan OAINS. Tetapi, tidak ada tanda perbaikan
yang diamati pada kasus perdarahan mukosa lambung, sehingga obat ini
tidak direkomendasikan lagi (Sinha & Gautam, 2013).
5. Penggunaan COX-2 inhibitor
Sesuai dengan namanya, obat ini bekerja dengan cara menghambat
COX-2, sebagai efek anti-inflamasi yang akan melindungi saluran cerna.
Sejauh ini, celecoxib dan rofecoxib adalah inhibitor COX-2 yang paling
efektif dan menunjukkan kemanjuran di antara OAINS nonselektif
lainnya terhadap efek pada mukosa saluran cerna dan efek samping
saluran cerna lainnya (Sinha & Gautam, 2013). Pengobatan dengan
COX-2 berhubugan dengan peningkatan resiko infark miokard, oedem
perifer, toksisitas renal, dan peningkatan tekanan darah. (Roth, 2012).
Setiap pasien yang menggunakan coxib harus dievaluasi secara teliti,
baik resiko maupun keuntungannya. Kemungkinan ada hubungan antara
dosis dan toksisitas kardiovaskular terhadap penggunaan celecoxib.
Ketika menggunakan obat ini, harus diberikan pada dosis terendah yang
paling memungkinkan, dan durasi yang paling cepat. (Schellack, 2012).
Pendekatan Terbaru terhadap pengobatan Gastropati OAINS :
1. Prodrug OAINS
Prodrug dari OAINS adalah agen potensial untuk meningkatkan
potensial aktivitas antioksidan, solubilitas dan disolusi air, dan
pengeluaran nitric oxide (NO) yang menghambat antikolinergik dan
Universitas Sumatera Utara
aktivitas asetilkolinesterase. Telah diamati bahwa NO memberikan suatu
proteksi pada saluran cerna. NO dibentuk oleh kerja dari NO sintase yang
meningkatkan mukus dan sekresi bikarbonat dan juga mikrosirkulasi dan
menurunkan perlengketan neutrofil (Sinha & Gautam, 2013). NO juga
telah diketahui sebagai vasodilator. Pemberian agen ini akan
meningkatkan resistensi dari mukosa lambung terhadap lesi yang
dihasilkan dari pemakaian OAINS atau substansi berbahaya lainnya
(Schellack, 2012).
2. Penghambatan dari COX dan 5-LOX
OAINS yang menginduksi COX juga meningkatkan produksi
leukotrien, yaitu salah satu mediator inflamasi potent. Pendekatan terakhir
terhadap terjadinya lesi pada saluran cerna yang diinduksi oleh OAINS
adalah disebabkan oleh inhibisi dari COX/ 5-LOX (Sinha & Gautam,
2013).
3. Peran Laktoferin dalam menurunkan kerusakan saluran cerna
Beberapa penelitian melaporkan bahwa kolostrum bovin memiliki
kemampuan untuk mencegah ulserasi yang disebabkan oleh OAINS.
Penelitian lebih lanjut mendemonstrasikan peran rekombinan laktoferin
pada manusia menurunkan perdarahan saluran cerna akut yang diinduksi
oleh pemakaian OAINS (Sinha & Gautam, 2013).
4. Peran Glukokortikoid sebagai gastroprotektif
OAINS yang merupakan sama dengan stimulasi stres menginduksi
produksi glukokortokoid yang membantu mukosa lambung untuk bertahan
terhadap stimulus yang berbahaya dari obat tersebut. Efek gastroprotektif
dari glukokortikoid selama pengobatan dengan OAINS dapat dimediasi
oleh beberapa mekanisme, termasuk pengaturan aliran darah mukosa
lambung, produksi mukus, dan proses perbaikan. Sebagai tambahan,
glukokortikoid akan keluar selama diinduksi oleh OAINS sebagai aktivasi
Universitas Sumatera Utara
oleh HPA aksis dan dapat berkontribusi untuk melindungi mukosa
lambung dengan mengatur homeostasis, termasuk kadar gula darah dan
tekanan darah sistemik, yang dapat sebagai pengaruh penting untuk
integritas mukosa lambung. (Filaretova, 2013).
Universitas Sumatera Utara
You might also like
- ASITESDocument8 pagesASITESfebrianaNo ratings yet
- Liposarkoma subtipe dan prognosisDocument2 pagesLiposarkoma subtipe dan prognosisWahyupuji AstutiNo ratings yet
- Hernia Hiatus EsofagusDocument4 pagesHernia Hiatus EsofagusRatnawuLan AfriyantiNo ratings yet
- Pathway CA ServiksDocument2 pagesPathway CA ServiksKurnilam Nur CiptaningsihNo ratings yet
- Sindrom Neoplasia Endokrin MultipelDocument27 pagesSindrom Neoplasia Endokrin MultipelRirin Karinda100% (1)
- LP Eklampsia TariDocument16 pagesLP Eklampsia TariMentari FajrianiNo ratings yet
- Surat Lamaran Kpu Loteng AnaDocument4 pagesSurat Lamaran Kpu Loteng AnajihadponkNo ratings yet
- Hemorrhoid-3ADocument6 pagesHemorrhoid-3ARahadiyan HadinataNo ratings yet
- PERITONITISDocument15 pagesPERITONITISNurul Gita SafitriNo ratings yet
- Bab Iii CBD KuDocument23 pagesBab Iii CBD KuUswatun HasanahNo ratings yet
- Laporan Pendahuluan Cholestasis 1Document6 pagesLaporan Pendahuluan Cholestasis 1alqadrynurNo ratings yet
- Asites Ca Ovarium PDFDocument3 pagesAsites Ca Ovarium PDFnsrinanaNo ratings yet
- Laporan Bibir SumbingDocument25 pagesLaporan Bibir SumbingLalu SahdanNo ratings yet
- Tumor Intra AbdomenDocument23 pagesTumor Intra AbdomenMaulida Puspitasari0% (1)
- PRIMING MESIN HEMODIALISADocument4 pagesPRIMING MESIN HEMODIALISAFirda RafikaNo ratings yet
- Modul Askep Kolestasis NewDocument12 pagesModul Askep Kolestasis NewtaliaadiantiNo ratings yet
- LAPORAN PENDAHULUAN TUMOR COLLIDocument10 pagesLAPORAN PENDAHULUAN TUMOR COLLIMohamad RafliNo ratings yet
- Analisa SwotDocument8 pagesAnalisa SwotLya AdeliaNo ratings yet
- Talak Dan Komplikasi Anemia GravisDocument9 pagesTalak Dan Komplikasi Anemia GravisandinisenjaNo ratings yet
- LP Sop CerebriDocument11 pagesLP Sop CerebriInekeNo ratings yet
- BPH Pro TurpDocument28 pagesBPH Pro TurpAl-amien Madridista Ibnu-jakfarNo ratings yet
- DrugStudyDocument10 pagesDrugStudyaditNo ratings yet
- Patofisiologi Dan Manifestasi Klinis Perdarahan SCBADocument3 pagesPatofisiologi Dan Manifestasi Klinis Perdarahan SCBAGabriella Clara TarukanNo ratings yet
- Laporan Pendahuluan CA Buli-BuliDocument14 pagesLaporan Pendahuluan CA Buli-Bulialfrida tambingNo ratings yet
- Askep Aneurisma Dan Diseksi AortaDocument45 pagesAskep Aneurisma Dan Diseksi AortaUul SetyaNo ratings yet
- Makalah MielodisplasiaDocument1 pageMakalah MielodisplasiaFebrian Wahyu RamadhaniNo ratings yet
- Ca OvariumDocument16 pagesCa Ovariumagustina lestariNo ratings yet
- Penyimpangan KDM Tumor Gaster 1Document1 pagePenyimpangan KDM Tumor Gaster 1ridaahrianiNo ratings yet
- SUSAH BABDocument30 pagesSUSAH BABMufthiar MuhtarNo ratings yet
- SAP HisprungDocument12 pagesSAP HisprungRonny IswahyudiNo ratings yet
- LP Amputasi FixDocument27 pagesLP Amputasi FixIfaNo ratings yet
- Edema SerebriDocument7 pagesEdema SerebriShafira TamaraNo ratings yet
- Askep CAPDocument10 pagesAskep CAPMaylin MangopoNo ratings yet
- Abses Skrotum dan DM T2Document3 pagesAbses Skrotum dan DM T2Ony Hertriandita ANo ratings yet
- Resume CKD Dan PneumoniaDocument5 pagesResume CKD Dan PneumoniaWulan Sari CahyaniNo ratings yet
- Instek RemovalDocument4 pagesInstek RemovalArdika Sulisetiyani100% (1)
- ASUHAN KEPERAWATAN CHOLELITHIASISDocument26 pagesASUHAN KEPERAWATAN CHOLELITHIASISidiaNo ratings yet
- KEPERAWATAN PERIOPERATIFDocument19 pagesKEPERAWATAN PERIOPERATIFAndi RahmawanNo ratings yet
- HIPOALBUMINEMIA DAN FUNGSINYADocument11 pagesHIPOALBUMINEMIA DAN FUNGSINYAAnonymous fH2CdpS6No ratings yet
- HEMATEMESIS MELENADocument24 pagesHEMATEMESIS MELENAreni elisabethNo ratings yet
- LP Internal BleedingDocument22 pagesLP Internal BleedingaskdfhaosljudgnNo ratings yet
- Spondilitis TBDocument35 pagesSpondilitis TBRuhil IswaraNo ratings yet
- LP EliminasiDocument11 pagesLP EliminasiGusti MilenialNo ratings yet
- Pathway SCDocument2 pagesPathway SCRoselii Firda Ratma PratiwiNo ratings yet
- Kista Duktus KoledokusDocument3 pagesKista Duktus KoledokusIra PratiwiNo ratings yet
- Anemia Pada Penyakit Ginjal KronikDocument15 pagesAnemia Pada Penyakit Ginjal KronikTyaRahmaNo ratings yet
- Laporan Kasus AMLDocument18 pagesLaporan Kasus AMLRatu PalarNo ratings yet
- Woc Tumor MedspinDocument2 pagesWoc Tumor MedspinIfa AchmadNo ratings yet
- LP TBC TulangDocument11 pagesLP TBC TulangwilliamNo ratings yet
- CML DiagnosisDocument13 pagesCML DiagnosisMaya RamadhaniNo ratings yet
- ASKEP Hematemesis MelenaDocument24 pagesASKEP Hematemesis MelenaaddiartoNo ratings yet
- Laporan Pendahuluan Dan Asuhan Keperawatan Chronic Kidney Disease Dengan Komplikasi Acute Lung OedemaDocument30 pagesLaporan Pendahuluan Dan Asuhan Keperawatan Chronic Kidney Disease Dengan Komplikasi Acute Lung OedemadesiNo ratings yet
- MASTECTOMY MODIFIEDDocument5 pagesMASTECTOMY MODIFIEDEly YaNha ImayNo ratings yet
- Pathway Tumor Abdomen1Document2 pagesPathway Tumor Abdomen1Thya Dewiiy50% (2)
- Laporan Pendahuluan PpokDocument10 pagesLaporan Pendahuluan PpokN Gita Ardiati RNo ratings yet
- Leukemia Myeloid KronikDocument31 pagesLeukemia Myeloid KronikManda UbraNo ratings yet
- Askep Snake BiteDocument11 pagesAskep Snake BitePutra Endi PratamaNo ratings yet
- Anatomi LambungDocument16 pagesAnatomi Lambungintansusmita100% (1)
- DispepsiaDocument9 pagesDispepsiaSastra MahendraNo ratings yet
- Anatomi Lambung Dan Usus HalusDocument24 pagesAnatomi Lambung Dan Usus HalusiyaanNo ratings yet
- Sindrom Nefrotik CaseDocument16 pagesSindrom Nefrotik CaseHuiLeeNo ratings yet
- Tata Laksana Sindrom Nefrotik Idiopatik Pada Anak IDAIDocument36 pagesTata Laksana Sindrom Nefrotik Idiopatik Pada Anak IDAIAlissa Yunitasari100% (3)
- Hasil Riskesdas 2013Document306 pagesHasil Riskesdas 2013NdHy_Windhy_340391% (11)
- Penyuluhan Nutrisi Ibu Hamil Dan Gizi BurukDocument33 pagesPenyuluhan Nutrisi Ibu Hamil Dan Gizi BurukHuiLee100% (2)
- Trauma Medula SpinalisDocument32 pagesTrauma Medula SpinalisHuiLeeNo ratings yet
- Terapi Schizofrenia Pada KehamilanDocument27 pagesTerapi Schizofrenia Pada KehamilanHuiLee100% (2)
- Trauma Medula Spinalis-KonsensusDocument11 pagesTrauma Medula Spinalis-KonsensusHuiLeeNo ratings yet