Professional Documents
Culture Documents
Ejercicios Termoqumica Resueltos
Uploaded by
Alquimista EstatalOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ejercicios Termoqumica Resueltos
Uploaded by
Alquimista EstatalCopyright:
Available Formats
Ejercicios de
termoqumica con
solucin
Luis Muoz Mato
www.fisicaeingenieria.es
9 Problemas de termoqumica totalmente solucionados con
clculos y procedimiento
www.fisicaeingenieria.es
Luis Muoz Mato
www.fisicaeingenieria.es
Luis Muoz Mato
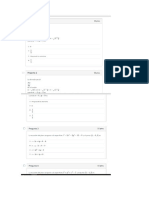
1.- Calcular el calor de la reaccin CH 4 ( g ) + Cl2 ( g ) CH 3Cl ( g ) + HCl ( g ) a partir de
los datos de las energas de enlace que aparecen en las tablas:
Enlace
Energa
CH
413 kJ/mol
H Cl
432 kJ/mol
Cl Cl
243 kJ/mol
C Cl
328 kJ/mol
2.- La combustin, a presin atmosfrica de 1 g de metano con formacin de
dixido de carbono y agua, ambos en estado gas, libera 50 KJ, a) Cul es el
valor
de
la
variacin
de
entalpa
para
la
reaccin
CH 4 ( g ) + 2O2 ( g ) CO2 ( g ) + 2 H 2O ( g ) . b) Si la entalpa normal de formacin de
dixido de carbono gas es de -395 kJ/mol y la del agua es -242 kJ/mol,
determina la entalpa normal de formacin del metano.
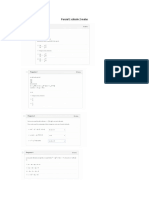
3.- En la combustin a volumen constante y a 25 C de 1 g de cido tartrtico
slido ( COOH CHOH CHOH COOH ) se desprenden 1840 cal. Las entalpas de
formacin del dixido de carbono y del agua son respectivamente -393,5
kJ/mol y -285,8 kJ/mol. Calcula la entalpa de formacin del cido tartrico.
4.- En la combustin del C2 H 6 ( g ) y del C2 H 4 ( g ) , se desprenden 372.9 kcal/mol
y 337.3 kcal/mol respectivamente. Calcular la variacin de la entalpa de la
reaccin:
C2 H 4 ( g ) + H 2 ( g ) C2 H 6 ( g )
Si la entalpa de formacin del agua es de -68.3 kcal/mol
5.- Calcular H a 25 C para la sigueinte reaccin:
2 H 2 S ( g ) + TeO2 ( s ) Te ( s ) + 2 S ( s ) + 2 H 2O ( l )
A partir de las siguientes reacciones:
S ( s ) + O2 ( g ) SO2 ( g ) H 0 reaccion = 70.96 kcal
Te ( s ) + O2 ( g ) TeO2 ( s ) H 0 reaccion = 77.69 kcal
2 H 2 S ( g ) + 3O2 ( g ) 2 H 2O ( l ) + SO2 ( g ) H 0 reaccion = 268.92 kcal
6.- Determina la entalpa normal para la siguiente reaccin a 25C:
4 NH 3 ( g ) + 5O2 ( g ) 4 NO + 6 H 2O ( g )
Datos:
H 0f , NH 3 = 11.04 kcal / mol
H 0f , NO = 21.6 kcal / mol
H 2 ( g ) + Cl2 ( g ) 2 HCl ( g ) H 0 reaccion = 44.2 kcal
4 HCl ( g ) + O2 ( g ) 2Cl2 ( g ) + 2 H 2O ( g ) H 0 reaccion = 23.2 kcal
7.- Calcular la entalpa normal a 25 C para la reaccin:
C2 H 5OH CH 3OCH 3
Sabiendo que la entalpa de formacin del C2 H 5OH es -600 kcal/mol, que la
entalpa de formacin del agua es de -68 kcal/mol, que la entalpa de
formacin del dixido de carbono es de -94 kcal/mol y que en la combustin
del CH 3OCH 3 se desprenden 348 kcal/mol.
www.fisicaeingenieria.es
Luis Muoz Mato
8.- Calcular H 0 a 25C correspondiente a la reaccin:
C2 H 2 ( g ) + H 2 O ( l ) C2 H 4 O
A partir de los siguientes datos:
H 0f , H 2O = 68.4 kcal / mol
H 0f ,CO2 = 97 kcal / mol
H 0f ,C2 H 2 = 47.8 kcal / mol
9.- Cuando se calientan 0.75 g de KClO3 se descompone en KCl y
O2 desprendindose 262 J de calor, a) escribir y ajustar la reaccin, b) Calcular
H 0 para la descomposicin del 1 mol de KClO3
10.-Cuando se queman 0,5 g de benceno lquido a volumen constante en una
bomba calorimtrica se originan 20,89 kJ, medidos a 25 C, producindose
agua lquida. Calcula: a) La entalpa normal de combustin del benceno, b) La
entalpa normal de formacin del benceno lquido tomando los datos
necesarios de problemas anteriores.
www.fisicaeingenieria.es
Luis Muoz Mato
1.- Calcular el calor de la reaccin CH 4 ( g ) + Cl2 ( g ) CH 3Cl ( g ) + HCl ( g ) a partir de
los datos de las energas de enlace que aparecen en las tablas:
Para calcular la entalpa de la reaccin, tenemos que usar la expresin que nos da
dicha entalpa en funcin de las entalpas de enlace:
H reaccion = H enlaces rotos H enlaces formados
Teniendo en cuenta la reaccin que nos da el enunciado, tenemos los siguientes
enlaces rotos y formados (teniendo en cuenta que los enlaces rotos son los que
estn en reactivos y los enlaces formados son los que estn en productos)
Enlaces rotos
4C H
1Cl Cl
Enlaces formados
3C H
1C Cl
1H Cl
Aplicando la expresin anterior y teniendo en cuenta los datos tabulados:
H reaccion = ( 4413 + 1243) ( 3413 + 1328 + 1432 ) = 104 KJ / mol
www.fisicaeingenieria.es
Luis Muoz Mato
2.- La combustin, a presin atmosfrica de 1 g de metano con formacin de
dixido de carbono y agua, ambos en estado gas, libera 50 KJ, a) Cul es el
valor
de
la
variacin
de
entalpa
para
la
reaccin
CH 4 ( g ) + 2O2 ( g ) CO2 ( g ) + 2 H 2O ( g ) . b) Si la entalpa normal de formacin de
dixido de carbono gas es de -395 kJ/mol y la del agua es -242 kJ/mol,
determina la entalpa normal de formacin del metano.
Nos dan el dato del calor que se produce al quemar 1 g de metano a presin
constante, por lo tanto nos estn dando el calor a presin constante, que
expresaremos como:
Q p = 50 kJ
Le ponemos un signo menos, ya que, el enunciado nos dice que es un calor
liberado, con lo cual, se trata de una reaccin exotrmica, la cual tiene asignados
calores negativos.
Para poder calcular el valor de la entalpa de la reaccin, tendremos que dividir este
calor entre el nmero de moles de la sustancia quemada, para ello, a partir del dato
de la masa de metano, calcularemos en nmero de moles del mismo:
1
n=
= 0.0625 moles deCH 4
12 + 4
La variacin de entalpa para la reaccin del enunciado ser:
Qp
50 kJ
H reaccion =
=
= 800 kJ / mol
nreactivo 0.0625 mol
b) Para calcular la entalpa de formacin del metano, vamos a la reaccin de
combustin y aplicamos la ley de Hess para el clculo de la entalpa de formacin
segn la cual:
CH 4 ( g ) + 2O2 ( g ) CO2 ( g ) + 2 H 2O ( g )
H 0 reaccion = H 0f , productos H 0f , reactivos
Sustituyendo los datos que nos da el problema y, teniendo en cuenta que la
entalpa de reaccin es la calculada en el apartado anterior:
H 0 reaccion = H 0f , productos H 0f , reactivos 800 = 1( 394 ) + 2( 242 ) H 0f ,CH 4
H 0f ,CH 4 = 78 kJ / mol
www.fisicaeingenieria.es
Luis Muoz Mato
3.- En la combustin a volumen constante y a 25 C de 1 g de cido tartrtico
slido ( COOH CHOH CHOH COOH ) se desprenden 1840 cal. Las entalpas de
formacin del dixido de carbono y del agua son respectivamente -393,5
kJ/mol y -285,8 kJ/mol. Calcula la entalpa de formacin del cido tartrico.
En primer lugar, tenemos en cuenta que el dato que nos da el problema es el calor
desprendido A VOLUMEN CONSTANTE, por lo tanto, nos est dando la variacin
de energa interna y no la entalpa.
Vamos a pasar el calor desprendido a kJ, para ello:
4.18 J 1 kJ
Qv = 1840 cal
= 7.69 kJ
1 cal 1000 J
Para calcular la variacin de energa interna por mol, dividimos este calor entre el
nmero de moles de reactivo:
1
ntartrico =
= 6.6710 3 mol de COOH CHOH CHOH COOH
412 + 166 + 6
La variacin de energa interna por mol ser:
7.69 kJ
U =
= 1153.5 kJ / mol
6.67103 mol
Para calcular la variacin de entalpa, usamos la relacin que hay entre ambas:
U = H nRT
Para calcular la variacin del nmero de moles en estado gaseoso, tenemos que
plantear la reaccin:
5
COOH CHOH CHOH COOH ( s ) + O2 ( g ) 4CO2 ( g ) + 3H 2O ( l )
2
5 3
n = ngas , productos ngas ,reactivos = 4 =
2 2
3
U = H nRT H = U + nRT = 1153 + 8.31103 298 = 1149.28 kJ / mol
2
Que ser la entalpa de combustin del cido tartrico, para calcular la entalpa de
formacin de dicho cido, vamos a la reaccin de combustin y planteamos la
expresin para el clculo de las entalpas en funcin de las entalpas de formacin:
5
COOH CHOH CHOH COOH ( s ) + O2 ( g ) 4CO2 ( g ) + 3H 2O ( l )
2
H 0 reaccion = H 0f , productos H 0f , reactivos 1149.28 = 4( 394 ) + 3( 242 ) H 0f ,tartico
H 0f ,tartico = 1152.72 kJ / mol
www.fisicaeingenieria.es
Luis Muoz Mato
4.- En la combustin del C2 H 6 ( g ) y del C2 H 4 ( g ) , se desprenden 372.9 kcal/mol
y 337.3 kcal/mol respectivamente. Calcular la variacin de la entalpa de la
reaccin:
C2 H 4 ( g ) + H 2 ( g ) C2 H 6 ( g )
Si la entalpa de formacin del agua es de -68.3 kcal/mol
Planteamos las reacciones de combustin de los compuestos orgnicos que nos da
el problema y la entalpa de formacin del agua:
7
C2 H 6 ( g ) + O2 ( g ) 2CO2 ( g ) + 3H 2O ( l ) H 0 reaccion = 372.9 kcal / mol
2
C2 H 4 ( g ) + 3O2 ( g ) 2CO2 ( g ) + 2 H 2O ( l ) H 0 reaccion = 337.3 kcal / mol
1
H 2 + O2 H 2O H 0 reaccion = 68.3 kcal / mol
2
Vamos a combinar las reacciones anteriores, multiplicndolas por los coeficientes
adecuados para obtener la reaccin que estamos buscando, para ello, la primera
reaccin, nos va a proporcionar el C2 H 6 ( g ) , como lo tenemos en diferente lado de la
ecuacin, tenemos que multiplicar la reaccin por un -1. Por otro lado, de la
segunda, vamos a sacar el C2 H 4 ( g ) , que ya est en el miembro que nos interesa y
con el mismo coeficiente, por lo que a esa reaccin no le tocamos, con la reaccin de
formacin del agua, vamos a obtener el hidrgeno que est en el miembro adecuado
y con el coeficiente buscado, por lo tanto, tampoco le vamos a tocar:
0
C2 H 6 ( g ) + 2 O2 ( g ) 2CO2 ( g ) + 3H 2O ( l ) H reaccion = 372.9 kcal / mol x ( 1)
0
C2 H 4 ( g ) + 3O2 ( g ) 2CO2 ( g ) + 2 H 2O ( l ) H reaccion = 337.3 kcal / mol x1
1
0
H 2 + 2 O2 H 2O H reaccion = 68.3 kcal / mol x1
Despus de haber multiplicado las reacciones, nos queda:
7
CO2 ( g ) + 3H 2O ( l ) C2 H 6 ( g ) + O2 ( g ) H 0 reaccion = 372.9 kcal / mol
2
C2 H 4 ( g ) + 3O2 ( g ) 2CO2 ( g ) + 2 H 2O ( l ) H 0 reaccion = 337.3 kcal / mol
1
H 2 + O2 H 2O H 0 reaccion = 68.3 kcal / mol
2
C2 H 4 ( g ) + H 2 ( g ) C2 H 6 ( g ) H 0 reaccion = 32.7 kcal / mol
www.fisicaeingenieria.es
Luis Muoz Mato
5.- Calcular H a 25 C para la sigueinte reaccin:
2 H 2 S ( g ) + TeO2 ( s ) Te ( s ) + 2 S ( s ) + 2 H 2O ( l )
A partir de las siguientes reacciones:
S ( s ) + O2 ( g ) SO2 ( g ) H 0 reaccion = 70.96 kcal
Te ( s ) + O2 ( g ) TeO2 ( s ) H 0 reaccion = 77.69 kcal
2 H 2 S ( g ) + 3O2 ( g ) 2 H 2O ( l ) + SO2 ( g ) H 0 reaccion = 268.92 kcal
Para obtener la entalpa de la reaccin del enunciado, debemos combinar las
reacciones que nos dan, para ello, de la primera, vamos a sacar el azufre slido,
como lo tenemos cambiado de miembro y con un coeficiente 2 en la reaccin que
estamos buscando, tenemos que multiplicar esta primera reaccin por 2, de la
segunda, sacamos el Te, como est en un miembro diferente a la reaccin objetivo,
multiplicamos esta reaccin por -1, por ltimo, de la ltima sacamos el sulfuro de
hidrgeno que est en el miso miembro y con el mismo coeficiente, por lo que a esta
reaccin no le tenemos que hacer nada, es decir, multiplicarla por 1:
0
S ( s ) + O2 ( g ) SO2 ( g ) H reaccion = 70.96 kcal x ( 2 )
Te ( s ) + O2 ( g ) TeO2 ( s ) H 0 reaccion = 77.69 kcal x ( 1)
2 H 2 S ( g ) + 3O2 ( g ) 2 H 2O ( l ) + SO2 ( g ) H 0 reaccion = 268.92 kcal x1
Despus de haber multiplicado por los coeficientes adecuados, nos queda, despus
de haber sumado todas las reacciones, la reaccin objetivo con su entalpa de
reaccin:
2 SO2 ( g ) 2 S ( s ) + 2O2 ( g ) H 0 reaccion = 141.92 kcal
TeO2 ( s ) Te ( s ) + O2 ( g ) H 0 reaccion = 77.69 kcal
2 H 2 S ( g ) + 3O2 ( g ) 2 H 2O ( l ) + SO2 ( g ) H 0 reaccion = 268.92 kcal
2 H 2 S ( g ) + TeO2 ( s ) Te ( s ) + 2 S ( s ) + 2 H 2O ( l ) H 0 reaccion = 49.31 kcal
www.fisicaeingenieria.es
Luis Muoz Mato
6.- Determina la entalpa normal para la siguiente reaccin a 25C:
4 NH 3 ( g ) + 5O2 ( g ) 4 NO + 6 H 2O ( g )
Datos:
H 0f , NH 3 = 11.04 kcal / mol
H 0f , NO = 21.6 kcal / mol
H 2 ( g ) + Cl2 ( g ) 2 HCl ( g ) H 0 reaccion = 44.2 kcal
4 HCl ( g ) + O2 ( g ) 2Cl2 ( g ) + 2 H 2O ( g ) H 0 reaccion = 23.2 kcal
En primer lugar, vamos a desarrollar todas las reacciones de formacin:
1
3
N 2 ( g ) + H 2 ( g ) NH 3 ( g ) H 0f , NH3 = 11.04 kcal / mol
2
2
1
1
N 2 ( g ) + O2 ( g ) NO ( g ) H 0f , NH 3 = 21.6 kcal / mol
2
2
H 2 ( g ) + Cl2 ( g ) 2 HCl ( g ) H 0 reaccion = 44.2 kcal
4 HCl ( g ) + O2 ( g ) 2Cl2 ( g ) + 2 H 2O ( g ) H 0 reaccion = 23.2 kcal
Ahora multiplicamos cada una de ellas por un coeficiente que nos permita obtener
la reaccin del enunciado, la primera de ellas, nos vale para obtener el amoniaco,
tenemos que cambiarlo de miembro y multiplicarlo por cuatro, por lo que hemos de
multiplicar la reaccin por -4. En cuanto a la segunda, nos servir para obtener el
NO, debemos multiplicar la reaccin por 4. La ltima nos vale para obtener el agua,
para ello, debemos multiplicar la reaccin por 3 y la tercera reaccin nos vale para
poder hacer que en la reaccin final no nos aparezca el HCl, para ello, debido a que
tenemos 12 HCl, (despus de multiplicar la 4 reaccin por 3), tenemos que
multiplicar la tercera por 6 para que se compensen los HCl y que no aparezcan en
la reaccin final.
3
1
0
2 N 2 ( g ) + 2 H 2 ( g ) NH 3 ( g ) H f , NH 3 = 11.04 kcal / mol x ( 4 )
1
1
0
2 N 2 ( g ) + 2 O2 ( g ) NO ( g ) H f , NH 3 = 21.6 kcal / mol x 4
H 2 ( g ) + Cl2 ( g ) 2 HCl ( g ) H 0 reaccion = 44.2 kcal x6
4 HCl ( g ) + O2 ( g ) 2Cl2 ( g ) + 2 H 2O ( g ) H 0 reaccion = 23.2 kcal x3
Despus de haber multiplicado las reacciones, nos queda lo siguiente:
4 NH 3 ( g ) 2 N 2 ( g ) + 6 H 2 ( g ) H 0f , NH 3 = 44.16 kcal / mol
2 N 2 ( g ) + 2O2 ( g ) 4 NO ( g ) H 0f , NH3 = 86.4 kcal / mol
6 H 2 ( g ) + 6Cl2 ( g ) 12 HCl ( g ) H 0 reaccion = 265.2 kcal
12 HCl ( g ) + 3O2 ( g ) 6Cl2 ( g ) + 6 H 2O ( g ) H 0 reaccion = 69.6 kcal
4 NH 3 ( g ) + 5O2 ( g ) 4 NO + 6 H 2O ( g ) H 0 reaccion = 377.04 kcal
www.fisicaeingenieria.es
Luis Muoz Mato
7.- Calcular la entalpa normal a 25 C para la reaccin:
C2 H 5OH CH 3OCH 3
Sabiendo que la entalpa de formacin del C2 H 5OH es -600 kcal/mol, que la
entalpa de formacin del agua es de -68 kcal/mol, que la entalpa de
formacin del dixido de carbono es de -94 kcal/mol y que en la combustin
del CH 3OCH 3 se desprenden 348 kcal/mol
Debemos calcular la entalpa para una reaccin, para ello, podemos aplicar la
expresin que nos permite calcular la entalpa de una reaccin a partir de las
entalpas de formacin:
C2 H 5OH CH 3OCH 3
H 0 reaccion = H 0f , productos H 0f , reactivos
El problema nos da como dato la entalpa de formacin del C2 H 5OH , sin embargo,
no tenemos la entalpa de formacin del CH 3OCH 3 , para poder calcularla, debemos
usar los datos que nos da el problema, es decir, la entalpa de formacin del agua y
del dixido de carbono y la entalpa de combustin del CH 3OCH 3 . Planteando la
reaccin de combustin del CH 3OCH 3 , tenemos:
CH 3OCH 3 + 3O2 ( g ) 2CO2 ( g ) + 3H 2O ( l )
H 0 reaccion = H 0f , productos H 0f , reactivos
348 = 2( 94 ) + 3 ( 68 ) H 0f ,CH3OCH 3 H 0f ,CH3OCH3 = 44 kcal / mol
Ahora ya tenemos la entalpa de formacin del CH 3OCH 3 , si vamos ahora a la
reaccin original del problema, ya tenemos todos los datos para poder calcular la
entalpa de la reaccin:
C2 H 5OH CH 3OCH 3
H 0 reaccion = H 0f , productos H 0f , reactivos H 0 reaccion = [ 44] [ 66] = 22 kcal / mol
10
www.fisicaeingenieria.es
Luis Muoz Mato
8.- Calcular H 0 a 25C correspondiente a la reaccin:
C2 H 2 ( g ) + H 2 O ( l ) C2 H 4 O
A partir de los siguientes datos:
H 0f , H 2O = 68.4 kcal / mol
H 0f ,CO2 = 97 kcal / mol
H 0f ,C2 H 2 = 47.8 kcal / mol
Sabiendo adems que en la combustin de C2 H 4O se desprenden 282 kcal.
Planteamos la ecuacin que nos da el problema junto con la expresin para calcular
la variacin de la entalpa de una reaccin a partir de los datos de las entalpas de
formacin de reactivos y productos y se obtiene:
H 0 reaccion = H 0f , productos H 0f , reactivos H 0 reaccion = H 0f ,C2 H 4O H 0f , H 2O + H 0f ,C2 H 2
En esta reaccin disponemos de todos los datos, excepto del de la entalpa de
formacin del C2 H 4O , para obtener dicho dato, recurrimos a la reaccin de
combustin de este compuesto, y aplicamos la expresin del clculo de la entalpa
de una reccin a partir de las entalpas de formacin de reactivos y productos:
5
C2 H 4O ( g ) + O2 ( g ) 2CO2 ( g ) + 2 H 2O ( l )
2
H 0 reaccion = H 0f , productos H 0f , reactivos
H 0 reaccion = 2H 0f ,CO2 + 2H 0f , H 2O H 0f ,C2 H 4O
282 = 2 ( 97 ) + 2 ( 68.4 ) H 0f ,C2 H 4O H 0f ,C2 H 4O = 48.8 kcal / mol
Ahora que tenemos calculada la entalpa de formacin del C2 H 4O , podemos ir a la
reaccin del problema y aplicar la ecuacin que nos haba quedado pendiente:
C2 H 2 ( g ) + H 2 O ( l ) C2 H 4 O
H 0 reaccion = H 0f , productos H 0f , reactivos
H 0 reaccion = H 0f ,C2 H 4O H 0f , H 2O + H 0f ,C2 H 2
H 0 reaccion = ( 48.8 ) ( 68.4 ) + ( 47.8 ) = 28.2 kcal / mol
11
www.fisicaeingenieria.es
Luis Muoz Mato
9.- Cuando se calientan 0.75 g de KClO3 se descompone en KCl y
O2 desprendindose 262 J de calor, a) escribir y ajustar la reaccin, b) Calcular
H 0 para la descomposicin del 1 mol de KClO3
a) En primer lugar, escribimos y ajustamos la reaccin que nos da el problema, al
ser una reaccin de descomposicin, tendremos que el compuesto se transforma en
dos compuestos (los que da lugar su descomposicin:
3
KClO3 KCl + O2
2
b) Ahora calcularemos el valor de la variacin de entalpa para 1 mol de KClO3 , para
ello, tendremos en cuenta que cuando se descomponen 0.75 g de KClO3 , se obtienen
262 J, por lo tanto para calcular el calor necesario para descomponer 1 mol,
debemos dividir este calor entre el nmero de moles de reactivo:
Q p = 262 J
El nmero de moles de reactivo ser:
0.75
n=
= 6.12103 moles de KClO3
39 + 35.5 + 316
La variacin de entalpa ser:
Qp
262 J
H 0 =
=
= 42.81 kJ / mol
3
n 6.1210 moles de KClO3
12
www.fisicaeingenieria.es
Luis Muoz Mato
10.-Cuando se queman 0,5 g de benceno lquido a volumen constante en una
bomba calorimtrica se originan 20,89 kJ, medidos a 25 C, producindose
agua lquida. Calcula: a) La entalpa normal de combustin del benceno, b) La
entalpa normal de formacin del benceno lquido tomando los datos
necesarios de problemas anteriores.
El problema nos est dando el calor a volumen constante obtenido al quemar una
determinada cantidad de benceno, para poder calcular la variacin de la energa
interna que sufre el benceno, debemos dividir dicho calor entre el nmero de moles
de benceno que quemamos:
Qv = 20.89 kJ
Qv
Q
20.89 kJ
U =
U = v =
= 3413 kJ / mol
0.5
3
n
n 6.12103 moles de C6 H 6
n = 612 + 6 = 6.1210 moles de C6 H 6
Ahora calcularemos la variacin de la entalpa, para ello, usaremos la relacin que
existe entre la variacin de la energa interna y la variacin de la entalpa:
U = H nRT H = U + nRT
Para calcular la variacin del nmero de moles en estado gaseoso, planteamos la
reaccin de la que nos habla el problema, es decir, la reaccin de combustin del
benceno lquido:
15
C6 H 6 ( l ) + O2 ( g ) 6CO2 ( g ) + 3H 2O ( l )
2
15
3
n = 6 =
2
2
3
H = U + nRT = 3413 + 8.3110 3 298 = 3416.7 kJ / mol
2
b) Para determinar la entalpa normal de formacin del benceno, planteamos la
ecuacin termoqumica y la expresin que nos permite calcular la variacin de
entalpa de una reaccin a partir de los datos de las entalpas de formacin de los
reactivos y los productos:
15
C6 H 6 ( l ) + O2 ( g ) 6CO2 ( g ) + 3H 2O ( l )
2
H 0 reaccion = H 0f , productos H 0f , reactivos
H 0 reaccion = 6H 0f ,CO2 + 3H 0f , H 2O H 0f ,C6 H 6
3416.7 = 6 ( 393) + 3 ( 285 ) H 0f ,C6 H 6 H 0f ,C6 H 6 = 203.7 kJ / mol
13
You might also like
- Quiz 2 60 de 70 de Calculo 3Document3 pagesQuiz 2 60 de 70 de Calculo 3Alquimista EstatalNo ratings yet
- Parcial 1 - Gestion LogisticaDocument16 pagesParcial 1 - Gestion LogisticaAlquimista EstatalNo ratings yet
- Quiz 2 60 de 70 de Calculo 3 PoligranDocument4 pagesQuiz 2 60 de 70 de Calculo 3 PoligranAlquimista EstatalNo ratings yet
- Parcial Fina Semana 80 de 80 SIST. INFOR. LOGISTICADocument7 pagesParcial Fina Semana 80 de 80 SIST. INFOR. LOGISTICAAlquimista EstatalNo ratings yet
- Examen Final Distribucion PlantasDocument5 pagesExamen Final Distribucion PlantasAlquimista EstatalNo ratings yet
- Examen Final - Gestion Logistica EditDocument7 pagesExamen Final - Gestion Logistica EditAlquimista EstatalNo ratings yet
- Examen Final - CALCULO III PoligranDocument4 pagesExamen Final - CALCULO III PoligranAlquimista EstatalNo ratings yet
- Parcial 1.1. Calculo 3Document2 pagesParcial 1.1. Calculo 3Alquimista EstatalNo ratings yet
- Quiz Calculo 3-2Document7 pagesQuiz Calculo 3-2Alquimista EstatalNo ratings yet
- PARCIAL 1 CALCULO 3 PoligranDocument3 pagesPARCIAL 1 CALCULO 3 PoligranAlquimista EstatalNo ratings yet
- Quiz Calculo 3-2Document7 pagesQuiz Calculo 3-2Alquimista EstatalNo ratings yet
- Flujogramas en WordDocument14 pagesFlujogramas en WordHu GoNo ratings yet
- Parcial 1.2 Cálculo3Document6 pagesParcial 1.2 Cálculo3Alquimista EstatalNo ratings yet
- Parcial 1 Fluidos y Termodinamica.Document1 pageParcial 1 Fluidos y Termodinamica.Alquimista EstatalNo ratings yet
- Corte Con Chorro de AguaDocument2 pagesCorte Con Chorro de AguaAlquimista EstatalNo ratings yet
- Parcial 1 Calculo 3 PoligranDocument3 pagesParcial 1 Calculo 3 PoligranAlquimista Estatal100% (1)
- Articulo BPM Bien HechaDocument10 pagesArticulo BPM Bien HechaAlquimista Estatal100% (1)
- CupCakes BasicoDocument2 pagesCupCakes BasicoAlquimista EstatalNo ratings yet
- Galletas Clásicas de Chispas de ChocolateDocument5 pagesGalletas Clásicas de Chispas de ChocolateAlquimista EstatalNo ratings yet
- Post ResDocument1 pagePost ResAlquimista EstatalNo ratings yet
- Quiz 1 - Costos y Presupuestos.Document5 pagesQuiz 1 - Costos y Presupuestos.Alquimista EstatalNo ratings yet
- Parcial 1 - Costos y PresupuestosDocument4 pagesParcial 1 - Costos y PresupuestosAlquimista EstatalNo ratings yet
- FlujogramasDocument14 pagesFlujogramasAlquimista EstatalNo ratings yet
- Parcial 1 Calculo 3Document3 pagesParcial 1 Calculo 3Alquimista EstatalNo ratings yet
- Brownies RecetaDocument2 pagesBrownies RecetaAlquimista EstatalNo ratings yet
- Allergies SP PDFDocument4 pagesAllergies SP PDFValeria PonceNo ratings yet
- Resolucion 427 10Document2 pagesResolucion 427 10Andrea Soledad Rivera BelmarNo ratings yet
- Dibujo TécnicoDocument3 pagesDibujo TécnicoAlquimista EstatalNo ratings yet
- 2017 03 30 FoodFacts Allergies SpanDocument4 pages2017 03 30 FoodFacts Allergies SpanKatherine TafurNo ratings yet
- WikiDocument2 pagesWikiAlquimista EstatalNo ratings yet
- Parcial II Agroclimatologia PDFDocument5 pagesParcial II Agroclimatologia PDFSebastian DiazNo ratings yet
- Guía de Trabajo - InterfaseDocument2 pagesGuía de Trabajo - InterfaseM Florencia LunaNo ratings yet
- El Equipo GunttDocument49 pagesEl Equipo GunttPool MoranteNo ratings yet
- Laboratorio 3 Termodinámica - Terminado Gases IdealesDocument12 pagesLaboratorio 3 Termodinámica - Terminado Gases IdealesOliver Espinoza VizcarraNo ratings yet
- Guia 2 Entorno Fisico Grado 8Document6 pagesGuia 2 Entorno Fisico Grado 8Benavides Ortiz Luis ErnestoNo ratings yet
- Ocon Tojo - Absorcion de Gases WordDocument22 pagesOcon Tojo - Absorcion de Gases WordKenyi Solano PortalesNo ratings yet
- 3 - Practica 4 - Grupo6Document6 pages3 - Practica 4 - Grupo6MariaPaulaGonzalezRojasNo ratings yet
- Fisica TermodinamicaDocument2 pagesFisica TermodinamicaSilvia Garay ovandoNo ratings yet
- Tipos de intercambiadores-JPDocument20 pagesTipos de intercambiadores-JPMaria Renee Quintanilla VidalNo ratings yet
- La SIN de SolviaDocument3 pagesLa SIN de SolviaRicardo OlmosNo ratings yet
- RESEÑADocument4 pagesRESEÑAfemfklemwklfmNo ratings yet
- Instrumentos de Medición de Temperatura y EscalasDocument5 pagesInstrumentos de Medición de Temperatura y EscalasJuan Salcedo OlmosNo ratings yet
- Brenis Termodinamica3Document13 pagesBrenis Termodinamica3edgarNo ratings yet
- FísicaII 22ADocument62 pagesFísicaII 22Azxcvuno4307No ratings yet
- Procesos Industriales-Banco de PreguntasDocument5 pagesProcesos Industriales-Banco de PreguntasLuis Bedoya JaramilloNo ratings yet
- Diseño de Una Columna de Destilación - Quispe C, Pilares PDocument34 pagesDiseño de Una Columna de Destilación - Quispe C, Pilares PAlex Quispe CanchariNo ratings yet
- Propiedades de La MateriaDocument4 pagesPropiedades de La MateriaWILSON GÓMEZ100% (1)
- Castañeda FUXIONDocument3 pagesCastañeda FUXIONjhunior carlos eduardo gamboa herreraNo ratings yet
- Ciclo BraytonDocument20 pagesCiclo BraytonIngrid Pgg100% (1)
- Diagrama Ternario Ingenieria Urrego PDFDocument3 pagesDiagrama Ternario Ingenieria Urrego PDFLUIS FABIAN URREGO SANCHEZNo ratings yet
- Temperatura de Bulbo HumedoDocument6 pagesTemperatura de Bulbo HumedoDiego Alfonso BahamondesNo ratings yet
- Balance de Energia y MasaDocument10 pagesBalance de Energia y MasaDulce Mariia0% (1)
- Metabolismo en Animales EctotermosDocument7 pagesMetabolismo en Animales EctotermosRonald YonoffNo ratings yet
- Iram 11605Document8 pagesIram 11605paula pachecoNo ratings yet
- Lab 5 Termodinamica y Fluidos. Ley de StokesDocument10 pagesLab 5 Termodinamica y Fluidos. Ley de StokesERIKA JAZMIN SANTOS BUSTOSNo ratings yet
- FT (Y) N-D Manual de Operacion - EspañolDocument24 pagesFT (Y) N-D Manual de Operacion - EspañolRicardo Molina SánchezNo ratings yet
- Historia de La Termodinamica PDFDocument11 pagesHistoria de La Termodinamica PDFMiguel Angel Otiniano ParedesNo ratings yet
- Calor y Temperatura (Ximena Rodriguez Mercado)Document9 pagesCalor y Temperatura (Ximena Rodriguez Mercado)Brayajn OrtegaNo ratings yet
- Calor Transitorio Los 4 Archivos de WordDocument28 pagesCalor Transitorio Los 4 Archivos de Wordmarit2504No ratings yet
- Calor PsuDocument13 pagesCalor PsuDavid FloresNo ratings yet