Professional Documents
Culture Documents
Química 3ro - 1er y 2do Bimestre 2005
Uploaded by
Rene Tadeo CamposOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Química 3ro - 1er y 2do Bimestre 2005
Uploaded by
Rene Tadeo CamposCopyright:
Available Formats
Consorcio Educativo El Carmelo200
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
FUNCIN QUMICA
Es un conjunto de compuestos que presentan similares propiedades, consecuencia de tener semejante
composicin o modo de formarse.
VALENCIA.- Es la capacidad de combinacin que tienen los tomos para formar un compuesto,
dependiendo ello del nmero de electrones que pierdan, ganen o compartan para alcanzar su
configuracin electrnica estable.
Reglas:
Los compuestos son neutros, por lo que la suma algebraica de las valencias de los elementos de un
compuesto es igual a cero.
El oxgeno acta como divalente negativo, excepto en perxidos donde acta con 1.
El hidrgeno acta como monovalente positivo H +1, excepto en los hidruros en donde acta como
monovalente negativo H1.
FUNCIN BINARIA:
xidos. M + O = MO
Anhdrido. Nm + O = NmO
Unin de NO METAL + OXGENO
Es la unin de METAL + OXGENO
Na1+ + O22 = Na2O
xido de sodio.
Cl1+ + O2 = Cl2O
Anhdrido hipo cloroso.
Ca2+ + O22 = CaO
xido de calcio.
Cl3+ + O2 = Cl2O3 Anhdrido cloroso.
Al3+ + O22 = Al2O3
xido de aluminio.
Cl5+ + O2 = Cl2O5 Anhdrido clorico.
Pb4+ + O22 = PbO2
xido plmbico.
Cl7+ + O2 = Cl2O7 Anhdrido hiper clorico
Hidruros. Nm + H = NmH
cido Hidrcido. Nm + H= HNm
Unin de NO METAL + HIDRGENO
Unin de METAL + HIDRGENO
El hidrgeno acta con valencia negativa 1.
Na + H2 = NaH
Hidruro de sodio.
Los no metales del grupo VII A VI A actan con
valencia negativa -1 y -2
H2 + F2 = HF
cido fluorhdrico
Be + H2 = BeH2
H2 + Cl2 = HCl
cido clorhdrico
H2 + S
cido sulfhdrico
Hidruro de berilio.
= H2S
FUNCIN TERNARIA:
MnO + H2O = M (OH)n
Hidrxidos. Unin de XIDO + AGUA
K2O +
H2O = K2O2H2 = 2 KOH
Hidrxido de potasio.
Al2O3 + 3 H2O = Al2O6H6 = 2 Al(OH)3
Hidrxido de aluminio.
HgO +
Hidrxido mercrico.
H2O = HgO2H2 = Hg(OH)2
Una manera ms sencilla de reconocer la cantidad de OH presentes es mediante la observacin de
la valencia del metal, que determina la cantidad del grupo hidrxilo
CIDO OXCIDO. Unin de ANHDRIDO + AGUA
NmO + H2O = HNmO
S6+ + O2- = SO3 + H2O = H2SO4
cido sulfrico.
N5+ + O2-
N2O5 +
H2O = H2N2O6 = 2 HNO3
cido ntrico.
Cl1+ + O2- = Cl2O + H2O = H2Cl2O2 = 2 HClO
cido hipo cloroso.
SAL OXISAL: Se consigue uniendo CIDO OXCIDO + HIDRXIDO
La nomenclatura vara: Oso = ito Ico = Ato
HNmO + M(OH) = MNmO + H2O
Sal neutra. Es cuando se desplazan completamente los hidrgenos con el elemento metlico de
la base, teniendo en cuenta la igualdad de valencias, en caso de no ser igual se ubican coeficientes
HClO
+
NaOH
=
NaNO3
+
H 2O
cido Hipo cloroso
H2SO4
hidrxido de sodio
+
Mg (OH)2
hipo clorito de sodio
=
MgSO4
H 2O
Consorcio Educativo El Carmelo201
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
cido sulfrico
hidrxido de magnesio
Lic. Max Alan Obregn Snchez
sulfato de magnesio
Sal cida. Aquellos que resultan de reemplazar parcialmente los hidrgenos de un cido por un
elemento metlico.
H2SO4
SAL HALOIDEA:
a.
NaOH
Resulta de la unin de
NaHSO4
+
Sulfato cido de sodio.
H 2O
CIDO HIDRCIDO + HIDRXIDO
HNm + MOH = MNm + H2O
Sal neutra. Se cambia la terminacin
hdrico por uro.
NaCl
+
H 2O
Cloruro de sodio
H 2S
+
Ca (OH)2
=
CaS
+
2 H 2O
Sulfuro de calcio
b. Sal cida. Se interpone la palabra cida entre los nombres genricos y especficos de la
correspondiente sal haloidea neutra.
H 2S
+
LiOH
=
LiHS
+
H 2O
Sulfuro cido de litio
HCl
NaOH
FUNCIN QUMICA
I. Relacionar:
a. Sal oxisal
b. cido oxcido
c. Anhdrido
d. xido
e. Hidruro
f. Hidrxido
g. cido hidrcido
h. Sal haloidea
(
(
(
(
(
(
(
(
)
)
)
)
)
)
)
)
metal
+ oxgeno
no metal + oxgeno
no metal + hidrgeno
metal
+ hidrgeno
anhdrido + agua
xido
+ agua
oxcido
+ hidrxido
hidrcido + hidrxido
II. FORMULAR (procedimiento) METAL + OXGENO M + O MO
NOMENCLATURA (IUPAC)
1. xido de Potasio 1+....................................................
CuO.....................................................
2. xido de Mercurioso 1+, 3+..........................................
Fe2O3..................................................
2+
3. xido de Bario .......................................................
2+
4. xido de Zinc ........................................................
5. xido Stannoso
2+, 4+
MnO....................................................
PtO2....................................................
................................................
PbO....................................................
6. xido de Litio 1+........................................................
CrO.....................................................
7. xido Mercrico.......................................................
Au2O...................................................
8. xido de Stannico....................................................
Ni2O3..................................................
2+
9. xido de Magnesio ...............................................
2+, 3+
10. xido Niqueloso
.............................................
III. FORMULAR procedimiento
MnO2.................................................
NO METAL + OXGENO Nm + O NmO NOMENCLATURA (IUPAC)
1. Anhdrido Hipobromoso.............................................
2. Anhdrido Brmico
Ag2O..................................................
1+, 3+, 5+
SO2.....................................................
.........................................
SeO....................................................
3. Anhdrido Brico 3+....................................................
Sb2O5..................................................
4. Anhdrido Ydico
1+, 3+, 5+, 7+
.......................................
P2O3...................................................
3+, 5+
...........................................
Br2O7..................................................
5. Anhdrido Fosfrico
6. Anhdrido Bromoso..................................................
Cl2O3....................................................
7. Anhdrido Hipoyodoso..............................................
CO2.....................................................
4+
8. Anhdrido Silcico ..................................................
N2O5....................................................
Consorcio Educativo El Carmelo202
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
9. Anhdrido Arsenioso 3+, 5+.........................................
TeO.....................................................
10. Anhdrido Sulfrico 2+, 4+, 6+......................................
N2O3...................................................
IV. Formular con su ecuacin a los hidrxidos: XIDO + AGUA
MnO + H2O M (OH)n
1+
1. Hidrxido de Litio
............................................................................................................
2. Hidrxido de Bario 2+
3. Hidrxido de Zinc
2+
4. Hidrxido cprico
1+, 2+
5. Hidrxido plumboso
............................................................................................................
............................................................................................................
............................................................................................................
2+,4+
...........................................................................................................
6. Hidrxido cromoso
2+,3+,6+
...........................................................................................................
7. Hidrxido niqueloso
1+,2+
...........................................................................................................
8. Hidrxido plmbico
............................................................................................................
9. Hidrxido de aluminio
3+
............................................................................................................
10. Hidrxido Stannico 2+,4+ .............................................................................................................
V. Formular con su ecuacin a los cidos oxcidos: ANHDRIDO + AGUA : NmO + H2O HNmO
1. cido carbonoso ...........................................................................................................................
2. cido brmico
...........................................................................................................................
3. cido de ydico
..........................................................................................................................
4. cido arsenioso
..........................................................................................................................
5. cido bromoso
..........................................................................................................................
6. cido hipoyodoso ..........................................................................................................................
7. cido perclrico
..........................................................................................................................
8. cido hipoteluroso ..........................................................................................................................
9. cido silcico
..........................................................................................................................
10. cido fosfrico
..........................................................................................................................
VI. Escribir la ecuacin correspondiente a las sales oxisales
(unir una base con un cido).
SAL OXISAL = CIDO OXCIDO + HIDRXIDO
HNmO + M(OH) MNmO + H2O
1. Hipobromito de sodio ..................................................................................................................
2. Perclorato de potasio .................................................................................................................
3. Sulfato ferroso
..................................................................................................................
4. Sulfato cido de potasio................................................................................................................
5. Nitrato de sodio
...................................................................................................................
6. Bromato de litio
....................................................................................................................
7. Sulfato de zinc
...................................................................................................................
8. Sulfito de calcio
...................................................................................................................
9. Carbonato de potasio..................................................................................................................
10. Carbonito de sodio.....................................................................................................................
VII. Escribir la frmula correspondiente a las sales haloideas.
Sal Haloidea = CIDO HIDRCIDO + HIDRXIDO
HNm + MOH MNm + H2O
1. Fluoruro de sodio......................................
6. Cloruro de magnesio..........................................
2. Fluoruro de calcio......................................
7. Yoduro plumboso .............................................
3. Bromuro de sodio......................................
8. Bromuro de litio
............................................
4. Cloruro de bario.........................................
9. Yoduro plmbico ............................................
5. Cloruro mercrico......................................
10. Cloruro de sodio ............................................
Consorcio Educativo El Carmelo203
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
VIII. Escribir la frmula de los siguientes Hidruros . METAL + HIDRGENO M + H = MH
1. Hidruro de Rubidio ................................
5. Hidruro de plata ........................................
2. Hidruro de Aluminio ................................6. Hidruro de litio
........................................
3. Hidruro de zinc
................................
7. Hidruro de bario .......................................
4. Hidruro de magnesio................................
8. Hidruro ferroso
.......................................
IX. Formular a los cidos hidrcidos
NO METAL + HIDRGENO Nm + H = NmH
1. cido fluorhdrico.......................................
5. cido selenhdrico ..........................................
2. cido bromhdrico......................................
6. cido sulfhdrico ..........................................
3. cido Yodhdrico........................................
7. cido Clorhdrico ..........................................
4. cido Telurhdrico.....................................
NOMENCLATURA
a) CLSICA. Se antepone el nombre del compuesto (xido, anhdrido, hidrxido, cido)
seguida del nombre del elemento.
En caso de presentarse ms de una valencia se ponen prefijos y sufijos. Ejem:
Bromo:
Br 1+, 3+, 5+, 7+
Anhdrido = Nm + O NmO
Br + O Br
1+
Binario
Anhdrido hipo bromoso
Br2O
Br + O Br 3+ O2 Br2O3
Anhdrido bromoso
Br + O Br 5+ O2 Br2O5
Anhdrido brmico
Br + O Br 7+ O2 Br2O7
Anhdrido hiper brmico
cido Oxcido = NmO + H2O H NmO
Ternario
Br2O + H2O H2Br2O2 2 HBrO
cido hipobromoso
Br2O3 + H2O H2Br2O4 2 HBrO2
cido bromoso
Br2O5 + H2O H2Br2O6 2 HBrO3
cido brmico
Br2O7 + H2O H2Br2O8 2 HBrO4
cido hiper brmico
Hierro: Fe 2+,3+
Fe + O Fe 2+ O2 FeO
Fe + O Fe 2+ O2 Fe2O3
xido = M + O MO
xido ferroso
xido frrico
Hidrxido = MO + H2O Mn (OH)n
FeO + H2O
= Fe (OH)2
Fe2O3 + 3 H2O = Fe2O6H6 2 Fe(OH)3
Hidrxido ferroso
Hidrxido frrico
b) MODERNA (IUPAC). Utiliza prefijo mono, di, tri, tetra y otros que permiten especificar
rpidamente la cantidad de tomos presentes en el compuesto:
Br2O Monxido de dibromo
FeO Monxido de hierro
Br2O3 Trixido de dibromo
Fe2O3 Trixido de dihierro
Br2O5 Pentxido de dibromo
Na2O Monxido de disodio
Br2O7 Heptxido de dibromo
SO2 Dixido de azufre
c) STOCK. Toma el nmero de valencia del elemento en el compuesto indicndose con
nmeros romanos entre parntesis al final del nombre del elemento.
FeO xido de hierro (II)
SO3
xido de azufre (IV)
Fe2O3 xido de hierro (III)
I2O5
xido de yodo (V)
(I)
K2O xido de potasio
SeO2 xido de selenio (IV)
Consorcio Educativo El Carmelo204
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
d) EWENS Y BASSET (EB). Modifica la nomenclatura Stock, coloca entre parntesis
nmeros arbigos que indican la valencia del elemento en el compuesto con su
respectivo signo.
PbO2 xido de plomo (4+)
Cl2O3 xido de cloro (3+)
(2+)
CuO xido de cobre
Cl2O5 xido de cloro (5+)
Li2O xido de litio (1+)
SeO3
xido de selenio (6+)
EVALUACIN
I) Hallar el valor del Metal o No metal.
xido mercrico
Hg 1+, 2+ = ...............
II) Formular:
Dixido de silicio
= .............................
= ...............
Trixido de selenio
= ..............................
Trixido de di nitrgeno
= ...........
Monxido de dilitio
= .............................
Pentxido de di arsnico
= ..............
Dixido de germanio = .............................
xido aurico Au 1+, 3+
= ..............
xido de cobre (2+)
xido cuproso
Cu 1+, 2+
xido hipocromoso:Cr 2+, 3+, 6+ =...............
xido de magnesio (II) = ............................
= ..............
xido de cloro (V)
Monxido de zinc
= ..............
xido de yodo
Monxido de dicesio
= ..............
Heptxido de di cloro
= ..............
Pentxido de di cloro =...............................
Trixido de dihierro = ......................
xido niquelico
Ni 2+, 3+
= .............................
(7+)
= ..............................
= ..............................
Sabiendo que: * Cl 1+, 3+, 5+, 7+
* S 2+, 4+, 6+
Elaborar ecuaciones de compuestos binarios y nombrarlas
Cl 1+ _______________________
Cl 7+________________________
a) Clsica: .................................
a) Clsica: .................................
b) IUPAC:..................................................
b) IUPAC:..................................................
c) Stock:....................................................
c) Stock:....................................................
d) EB: .......................................................
d) EB: .......................................................
Cl 3+_______________________
a) Clsica: .................................
S 2+________________________
b) IUPAC:..................................................
a) Clsica: .................................
c) Stock:....................................................
b) IUPAC:..................................................
d) EB: .......................................................
c) Stock:....................................................
Cl 5+________________________
d) EB: .......................................................
a) Clsica: .................................
S 4+________________________
b) IUPAC:..................................................
a) Clsica: .................................
c) Stock:....................................................
b) IUPAC:..................................................
d) EB: .......................................................
c) Stock:....................................................
Consorcio Educativo El Carmelo205
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
d) EB: .......................................................
d) EB: .......................................................
S 6+_________________________
C 4+_________________________
a) Clsica: .................................
a) Clsica: .................................
b) IUPAC:..................................................
b) IUPAC:..................................................
c) Stock:....................................................
c) Stock:....................................................
d) EB: .......................................................
d) EB: .......................................................
Ni 2+, 3+
N 3+_______________________ N 3+, 5+
Ni 2+______________________
a) Clsica: .................................
a) Clsica: .................................
b) IUPAC:..................................................
b) IUPAC:..................................................
c) Stock:....................................................
c) Stock:....................................................
d) EB: .......................................................
d) EB: .......................................................
N5+_________________________
Ni 3+_________________________
a) Clsica: .................................
a) Clsica: .................................
b) IUPAC:..................................................
b) IUPAC:..................................................
c) Stock:....................................................
c) Stock:....................................................
d) EB: .......................................................
d) EB: .......................................................
Al 3+_________________________
C 2+________________________ C 2+, 4+
a) Clsica: .................................
a) Clsica: .................................
b) IUPAC:..................................................
b) IUPAC:..................................................
c) Stock:....................................................
c) Stock:....................................................
d) EB: ........................................................
II) Usando la Nomenclatura Clsica, nombrar:
K2O = ......................................................
Mg(OH)2= .................................................
Hg2 O =....................................................
Ni(OH)3 =...................................................
SnO =......................................................
Cu(OH) =...................................................
SnO2=...............................................
Cr(OH)2 =..................................................
HgO =.....................................................
Au (OH)3 =.................................................
I2O = .....................................................
H BrO =..............................................
B2O3= .....................................................
H AsO2 =.....................................................
Br2O7=....................................................
H2 TeO2 =...................................................
P2O3= .....................................................
H2 SO2 =.....................................................
SeO =.....................................................
H IO4=..................................................
III) Usando la Nomenclatura IUPAC nombrar:
Cl2O5 = ......................................................
As2 O3 =
Si O3 =
.....................................................
....................................................
Consorcio Educativo El Carmelo206
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
Li2O =
....................................................
BaO =.......................................................
Zn O =
....................................................
K2O =.........................................................
I2 O7 =
....................................................
Fe2O3 =.......................................................
B2 O3 =
....................................................
Pb O2=.........................................................
S O3 =
....................................................
Al2 O3 =........................................................
Cl2O5=..........................................................
P2 O5 = ........................................................
N2 O3 =.................................................
Usando la Nomenclatura Stock nombrar:
FeO =.......................................
SO3 = ...................................................
Ti O2 =...........................................................
Br2 O7 = ................................................
Mg O = ...................................
SnO =......................................................
Na2 O =....................................
P2 O3 =.....................................................
CO2 = ...................................
N2 O5 = ...................................................
Usando la Nomenclatura Ewens y Basset nombrar:
Rb2O =.....................................................
B2 O3 = ....................................................
Ti2 O3 =.....................................................
Co O =.....................................................
NiO = .....................................................
Mn2 O7 =...................................................
Si O2 =...................................................
CrO3=........................................................
As2 O5 =..................................................
SO2=..........................................................
Te O3 = ...............................................
MgO=......................................................
SALES OXISALES Y HALOIDEAS
I. Analizando los nombres de las sales oxisales y haloideas, deducir la base y el cido presente:
CIDO OXCIDO + HIDRXIDO SAL OXISAL : HNmO + M(OH) MNmO + H2O
SALES
2) Hipoclorito de Sodio
3) Nitrato de Potasio
4) Sulfato de Sodio
5) Carbonato de Calcio
6) Sulfuro cido de Sodio
7) Cloruro Frrico
8) Yodato de Potasio
9) Hipobromito de Sodio
10) Sulfato Cuproso
10) Bromuro de Plata
11) Cloruro de Magnesio
12) Sulfito de Calcio
13) Perclorato de Potasio
BASE
CIDO
Frmula General
Consorcio Educativo El Carmelo207
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
14) Nitrito de Litio
15) Fosfato de Potasio
16) Sulfito cido de potasio
17) Fosfato dicido de litio
18) Peryodato de magnesio
19) Cloruro de bario
20) Sulfuro de calcio
21) Fluoruro de zinc
22) Yoduro plmbico
23) Hiposelenito cido de litio
24) Hipobromito de potasio
II.- Completar los recuadros conforme al cido
CIDO
H MnO4
H2CO3
NOMBRE
RADICAL
HCO3 1NOMBRE
Permanganato
CIDO
NOMBRE
cido Clrico
cido Nitroso
RADICAL
ClO3
NO2
NOMBRE
CIDO
H2SeO4
NOMBRE
cido Ntrico
RADICAL
NO3
Selenurato cido
NOMBRE
CIDO
H2 Te
HF
NOMBRE
RADICAL
F -1
NOMBRE
Teluro cido
y su radical nombrndolos.
H3PO4
H Cl
H2 Se
Cl 1Seleniuro cido
Fosfato Dicido
cido Telrico
HTe O4
cido Sulfhdrico
HS1
cido Yodhdrico
I1
H As O2
H Br O4
cido Cloroso
ClO2
Br O4 -1
Arsenito
H2CO2
cido Sulfrico
HSO4 1-
cido perclrico
Carbonito acido
perclorato
III) Formular y nombrar cada una de las sustancias, completando los recuadros:
CATIN
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
K
Fe+2
ANIN
NO
SO
PO
+2
Zn
Na+
2+
Ba
Au+3
Mg+2
Ni+3
SAL
3
2
4
3
4
NOMBRE
Fosfato de aluminio
Zn (MnO4)2
CrO4 2
H2PO4 1
HPO4 2
Fosfato tetrcido de calcio
Au Cl3
HS
Se 2
BrO4
Cu+
Perbromato Plmbico
Cu NO2
NO3
Br
HCO3
Co+3
Li 1+
Nitrato de Plata
Bromuro Ferroso
Na HCO3
Telubrito Cobltico
Li2SO4
HSeO3 1BrO 1HTeO4 1-
Selenito tricido niquelico
Mg(BrO)2
Telurato dicido de potasio
Consorcio Educativo El Carmelo208
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
Llenar el siguiente Cienciagrama:
HORIZONTALES
HORIZONTALES
1. Prefijo empleado en
nomenclatura qumica
5. Descubridor de las leyes de la
electrolisis
6. Aparato muy utilizado en el
laboratorio, de hierro
7. Osmio (inv)
8. Metal alcalino
10. Ciudad peruana
12. Cientfico frances denominado
el padre de la qumica moderna.
13. Nombre latino del estao
14. Terminacin del nombre del
compuesto con menor valencia
1. Prefijo que se emplea en la
nomenclatura qumica
5. Descubre las leyes de electrolisis
6. Aparato muy utilizado en el
laboratorio de hierro
7. Osmio (inv.)
8. Metal alcalino
10. Ciudad peruana
12. Cientfico francs denominado
Padre de la Qumica
13. Nombre latino del estao
14.
Terminacin
de
algunos
compuestos usando la menor
valencia
VERTICALES
2. Pasaje del estado lquido al
estado de vapor
3. electrodo negativo
4. Nombre
7. Sulfuro de calcio
9. Grasa (inv) 1
2
10. Sal del cido ydico
11. perezosa (inv)
3
4
13. Compuesto que resulta de la
accin de un cido sobre un
5
hidrxido
REACCIONES QUMICAS
10
11
12
Una reaccin qumica es el fenmeno
donde se produce la formacin de especies
qumicas distintas a las primitivas. Es la
interaccin de sustancias que se convierten
en nuevos elementos, compuestos; por lo
que las propiedades fisicoqumicas de las
reaccionantes difieren de las resultantes.
En estas reacciones qumicas podrn
intervenir factores colaterales como: calor,
catalizadores,
cambios
fsico-qumicos
desde el principio hasta el final. Ejem:
+ NaOH
13
Re
Producto
ECUACIN
QUMICA.
Es
la
representacin esquemtica de lo que
ocurre en una reaccin qumica. Surgen los
reactantes (primitivas) y los productos
(especie que se forma)
actante
14
Condiciones para la Validez de una Ecuacin:
1. Debe cumplir los hechos experimentales
HCl
NaCl + H2O
Consorcio Educativo El Carmelo209
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
2. Las frmulas de las especies qumicas estarn correctamente escritas
3. Que se cumpla la ley de la conservacin de la materia y energa
CLASIFICACIN DE LAS REACCIONES QUMICAS
I. POR LAS SUSTANCIAS REACCIONANTES
Reaccin de Combinacin o Adicin . (Sntesis)
A + B AB
Cuando 2 ms sustancias se combinan para formar un solo compuesto.
S + O2
SO2
(Anhdrido Sulfuroso)
Ag2S + 2 O2
Ag2SO4
(Sulfato de Plata)
BaO + SO3
BaSO4
(Sulfato de Bario)
Reaccin de Descomposicin .
AB... A +B +...
Inversa a la adicin donde de 1 slo compuesto se obtienen 2 ms sustancias.
Generalmente se emplea el calor para la descomposicin. (Calor = )
2 HgO
CaCO3
2 Cu(NO3)2
2 KClO3
2 Hg + O2
xido (pirolisis)
H2O2 Luz
H2O + O2 (fotolisis)
CaO + CO2
carbonato (pirolisis)
4 NO2 + 2 CuO + O2 nitrato (pirolisis)
2 NaCl corriente 2 Na + Cl2
Elctrica (electrolisis)
2 KCl + 3 O2
clorato (pirolisis)
Reaccin de Sustitucin o Desplazamiento.AB + C AC + B
Son las reacciones en la que los tomos de un elemento desplazan a los tomos de otro elemento en
un compuesto.
Los metales desplazan hidrgenos de los cidos formando sales.
Fe + H2 SO4
Fe SO4 + H2
Los metales activos que liberan hidrgeno del agua.
2 Na + 2 H2 O
2 NaOH + H2
Reacciones de Doble Desplazamiento o Doble Descomposicin
(Mettesis)
AB+CD AC + BC
1. cido + Hidrxido
Sal + agua
cido + hidrxido
3 H2S + 2 Al(OH)3
H2SO4 + Ba (OH)2
BaSO4 + 2 H2O
2. cido + Sal
2 HCl + FeS
Sal + cido
FeCl2 + H2S
3. Hidrxido + Sal
3 NH4(OH) + FeCl3
Sal + hidrxido
3 NH4Cl + Fe(OH)3
4. Sal + Sal
Ca(NO3)2 + Na2CO3
5. Sal + Agua
Al2S3 + H2O
6. Anhdrido + Hidrxido Sal + agua
CO2 + 2 K(OH)
K2CO3 + H2O
Sal + sal
CaCO3 + 2 NaNO3
7. xido + cido
CaO + H2SO4
Sal + agua
CaSO4 + H2O
8. Hidrosal + Sal
Sal + sal + cido
K HSO4 + Pb(NO3)2 Pb(SO4) + KNO3 + HNO3
II. POR LA ENERGA CALRICA Las reacciones qumicas pueden ser:
Endotrmicas. Son aquellas reacciones que se realizan con absorcin de
equilibro.
2 CO2 + 6 H2O
Exotrmicas.
combustin.
C6H12O6
+ 6 O2
(fotosntesis)
calor. Llevan a un
( H > 0)
Aquellas que liberan calor, llevando a un desequilibrio, corrosin de metales,
C3H8 + 5 O2
3 CO2 + 4 H2O +
( H < 0)
Entalpa (H) Indica el contenido calrico de cada sustancia qumica. Se mide a 25 C y 1 atm.(estndar)
Consorcio Educativo El Carmelo210
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
Cambio de Entalpa ( H) Es el calor de reaccin determina la energa liberada o absorbida a
condiciones estndar.
REACCIN DE COMBUSTIN.
Reacciones de combinacin violenta con el oxgeno, con
desprendimiento de calor y luz, generndose una llama.
A la sustancia que arde se le llama COMBUSTIBLE y a la que permite la combustin COMBURENTE (el
oxgeno).
La combustin puede ser completa si se produce CO2 y H2O e incompleta si se produce CO y H2O
Completa
Sustancia + O2
CO2 + H2O
Incompleta
Sustancia + O2
CO + H2O
EVALUACIN
I.
Diga el tipo de reaccin qumica que se presenta:
1) Na2CO3 + CuSO4 NaSO4 + CuCO3 ...............................................................................
2) KCl3
2KCl + 3 O2
................................................................................
3) 2 Fe + O2
2 FeO
................................................................................
4) C2H5OH + 3 O2 2 CO2 + 3 H2O
................................................................................
5) Pb + 2 HNO3
Pb(NO3) + H2.
................................................................................
6) Cl2 + 2 KI
2 KCl + I2
................................................................................
7) 2H2O
corriente
2H2 + O2
................................................................................
Elctrica
8) CaO + H2SO4
9) 4 Au + O2
CaSO4 + H2O
................................................................................
2 Au2O
................................................................................
10) BaSO4
BaO + SO3
................................................................................
11) Pb(NO3)2 (ac) + KI (ac) PbI2 (s) + KNO3 (ac)
................................................................................
II. Acerca de las reacciones de descomposicin Qu enunciados son incorrectas?
a) El H2O se descompone fcilmente por medio de un proceso piroltico.
b) La descomposicin trmica de los carbonatos y bicarbonatos produce O2 (g)
c) Algunas sustancias orgnicas se descomponen por accin de un catalizador.
III. Cul de las siguientes reacciones no es de adicin?
a) Na (g) + 3H2 (g)
2 NH3 (g)
b) 2 SO2 (g) + O2 (g)
2 SO3 (g)
c) NH3 (g) + HCl (g)
NH4Cl (s)
d) CH4 (g) + Cl2 (g)
CH3Cl (g) + HCl (g)
e) SO3 (g) + H2O (l)
H2SO4 (ac)
IV. Una de las siguientes reacciones no es de mettesis o doble descomposicin.
a) H2SO4 (ac) + BaCl2 (ac)
BaSO4 + 2 HCl
b) 2 KI (ac) + Pb (NO3)2 (ac)
PbI2 + 2 KNO3
c) Na2S (ac) + Fe (NO3)2 (ac)
FeS + 2 NaNO3
d) KNO3 (ac) + Li (ac)
K + LiNO3
e) 2 AgNO3 (ac) + K2CrO4 (ac)
Ag2CrO4 + 2 KNO3
V. Indicar lo incorrecto sobre reacciones qumicas.
a) Los tomos que participan mantienen su identidad
Consorcio Educativo El Carmelo211
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
b) Las sustancias reaccionantes pierden su identidad
c) Todos son procesos espontneos
d) Ocurren ruptura y formacin de enlaces qumicos
e) Son fenmenos que permiten la transformacin de sustancias
VI. Indique la correspondencia de las siguientes reacciones
a)
AB A + B
( ) Sustitucin
b) A + BC AC + B ( ) Descomposicin
c) AB + CD
( ) Doble sustitucin
a) a, b, c
b) b, a, c
c) c, b, a
d) b, c, a
e) a, c, b
VII. Sobre las reacciones qumicas indican la proposicin incorrecta
a) Siempre van acompaadas de cambios de energa
b) Ocurren a nivel del ncleo atmico
c) Puede ocurrir en forma espontnea o forzada
d) Generan cambios en las propiedades de las sustancias
e) Su ocurrencia se puede verificar mediante evidencias como cambio de color, formacin de precipitados,
etc.
VIII.
Definir:
Mettesis:........................................................................................................................................................
.........................................................................................................................................................................
Pirolisis:..........................................................................................................................................................
.........................................................................................................................................................................
Fotlisis:..........................................................................................................................................................
.........................................................................................................................................................................
Electrolisis:.....................................................................................................................................................
..........................................................................................................................................................................
Entalpa:..........................................................................................................................................................
..........................................................................................................................................................................
PRCTICA
OBJETIVO. Conocer las diversas formas reacciones qumicas, as
como adquirir habilidades en el trabajo experimental de la qumica.
MATERIALES
Azufre en polvo
Limadura de hierro
Bicarbonato de sodio
cido actico (vinagre)
Cuchara de combustin
Mechero
Pinza de madera
Papel filtro
Beaker
Cinta de magnesio
Hidrxido de sodio (en lentejas)
Zinc
cido clorhdrico (cido muritico)
Globos medianos (2)
Vela
xido de calcio (polvo)
Embudo
Agua oxigenada
PROCEDIMIENTO
1. Coger una cinta de magnesio con la pinza de madera, posarla encima del mechero encendido. Qu
ocurre?______________ Qu se ha formado?__________________ Realice la frmula
respectiva.____________________________ Diga el tipo de reaccin qumica_____________. Dibuje
2. Llenar un poco de azufre dentro de la cuchara de combustin, pasarlo por el fuego. Qu ocurre?
______________ Qu se ha formado? ___________________Cul es la reaccin qumica?
_________________, La ecuacin es:_______________________________graficar:
3. verter un poco de agua oxigenada sobre un trozo de carne. Qu sucede?_______________ Qu
tipo
de
reaccin
aparece?
______________________Hacer
la
frmula
respectiva:_______________________________ Dibujar.
Consorcio Educativo El Carmelo212
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
4. Unir azufre en polvo con limadura de hierro,(proporcin de 3 a 1) someterla al fuego. Qu se ha
formado?____________________ Qu tipo de reaccin se da?__________________ Hacer la ecuacin
respectiva.______________________________________________ Dibujar.
5. Echar 200 ml del cido muritico en un matraz y agregar lminas de zinc en trozos, inmediatamente
colocar un globo en la boca del matraz.Qu sucede? _________________Hacer la ecuacin qumica
______________________________Qu
tipo
de
reaccin
qumica
se
presenta?
_____________________________________________
6. En un beaker unir vinagre (cido actico) junto al bicarbonato de sodio. Qu reaccin sucede?
____________________________________
Hacer
la
ecuacin
qumica__________________________________________________________, esquemas.
7. En un beaker colocar lentejas de hidrxido de sodio, agregar agua. Qu
___________________________Qu tipo de reaccin se da?_________________________
sucede?
8. El xido de calcio es unido al agua, luego de filtrar, proceder a soplar. Qu sucede?
__________________ Qu se ha formado?_______________________ Realizar la frmula
______________________________________________________________ dibujos.
BALANCEO DE ECUACIONES
Toda reaccin qumica para que tenga validez deber cumplir con la ley de LAVOISIER o
Ley de la conservacin de la materia.
Se utilizan los siguientes mtodos:
Mtodo del tanteo o simple inspeccin .- Se realiza cuando la ecuacin qumica
no es tan compleja, se buscan los coeficientes adecuados a simple vista. Siempre los
coeficientes sern enteros. Debern balancearse en el siguiente orden:
Primero se balancean los METALES.
Tercero se balancean los HIDRGENOS
Segundo se balancean los NO METALES.
Cuarto se balancean los OXGENOS.
2 HNO3 + Ca (OH)2
Ca (NO3)2 + 2 H2O
3 H2SO4 + 2 Al (OH)3
Al2 (SO4)3 + 6 H2O
Balancear por el mtodo del tanteo las siguientes ecuaciones:
NaNO3
+ H2SO4
Na2SO4
+ HNO3
1)
2)
HCl
MnO2
MnCl2
H 2O
Cl2
3)
CaCO3
HCl
CaCl2
CO2
H 2O
4)
NaNO3
H2SO4
NaHSO4
HNO3
5)
HNO2
Br2
HNO3
HBr
6)
Cl2
NaOH
NaCl
NaOCl
H2O
7)
Fe
Al2O3
Fe3O4
Al
8)
HNO3
10)
C6H6
11)
H2SO4
H2 O
H2SO4
NO
O2
CO2
H 2O
CaSO4
H3PO4
Ca3 (PO4)2
Consorcio Educativo El Carmelo213
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
12)
CaCO3
HCl
13)
MnO2
HCl
MnCl2
H2O +
CO2
H2O
14)
C6H4
O2
15)
NaNO3
H2SO4
CaCl2
Lic. Max Alan Obregn Snchez
Na2SO4
H2O +
H2
17)
C3H8
O2
CO2 + H2O
18)
C6H12O6
CH3 CH2OH +
CO2
CH2 = CH2
C3H5 (NO3)3
H2O
H2SO4
Fe2(SO4)3
H 2O
H2
19)
C3H5 (OH)3 +
20)
Fe (OH)3
21)
Na
H2O
NaOH
22)
H2
Br2
HBr
23)
Cl2
O2
Cl2O7
24)
C5H12
O2
CO2
25)
C12H22O11 +
26)
Fe
27)
FeS2
28)
O2
CO2
HCl
O2
P4O10
NaOH
29)
HgCl2
H2S
30)
(NH4)2 Cr2O7
31)
NH3
32)
C2H5OH +
33)
CH3 COCH3 +
34)
O2
O2
O2
C6H12O6
35) H2SO4 +
H2O
H2O
H2
Fe2O3
SO2
Na3PO4
H2O
HgS
HCl
FeCl3
N2 + Cr2O3 + H2O
NO
H2O
CO2
H2O
CO2 +
H2O
NaCl +
MnO2
Cl2
HNO3
16)
HNO3
CO2
C2H5OH
MnSO4
+
+
CO2
NaHSO4 +
H2O +
Cl2
Consorcio Educativo El Carmelo214
Qumica 3er ao
Colegios Pre Universitarios con
Formacin Humanista
1
2
Lic. Max Alan Obregn Snchez
CIENCIAGRAMA 02
3
10
11
12
13
14
15
19
16
17
20
18
21
22
25
26
27
28
23
SO2
+
Br2
+
H2O
37)
Zn3
b2
+
H2O
24
36)
H2S
+
4
HBr
29
Zn(OH)2
38)
39)
Na2SO3 +
KNO3
H3Sb
I2 +
H2O
Na2SO4
HI
K2O
N2
HORIZONTALES
3. Electrodo negativo
6. Derivado del cido ioduro
10. Gas noble
11. Expulsin brusca, convulsiva y sonora
del aire contenido en los pulmones
12. Americio
13. Flores medicinales
14. Demostrativo
15. Operacin aritmtica de composicin
19. Cuerpo que carece de olor
21. Metales mezclados al estado de fusin
25. Fenmeno por el cual se depositan en
el fondo del recipiente las partculas
slidas suspendidas en un lquido
28. Parte del cuerpo de las aves
29. Cuerpo que resulta de la accin de un
cido sobre un hidrxido
VERTICALES
Metal alcalino
Desgracia y pobreza
In electropositivo
rgano de las Talofitas
Metal amarillo
Donas
Mineral que atrae el hierro
Con aspecto de aceite
16. Accin teatral
17. Vasija redonda de barro o de metal
18. Gs que se encuentra en el aire
19. Metal blanco (inv.)
20. Incertidumbre, irresolucin
22. Sustancia de color azul
23. Elemento tri y penta Valente
24. Metal de valencia 2
26. Metal alcalino (inv.)
27. Elemento que con el oxgeno forma cal viva
Consorcio Educativo El Carmelo215
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
Mtodo por Oxidacin Reduccin REDOX .- Es un proceso simultneo en que
algunos elementos sufren cambios de valencia, apareciendo la OXIDACIN (prdida de
electrones y es agente reductor por entregar electrones) y la REDUCCIN (ganancia de
electrones y agente oxidante por recibir electrones).
Para trabajar con este mtodo debemos seguir estos pasos:
1. Se debern conocer las valencias de los elementos en la ecuacin. (Recordar que toda
frmula debe dar cero)
2. Debern separarse aquellos elementos que varan su valencia en la ecuacin. Pasando a
ser comparados para equilibrarse.
3. Se deber hallar la cantidad de electrones ganados (reduccin) y los perdidos
(oxidacin).
4. Esta cantidad de electrones deber pasar a ser parte del otro elemento y debajo se
proceder a equilibrar la ecuacin.
H1N5O3-2 + 1H2S-2
S 0 + 2NO-2 + 1H2O-2
N 5+
-3 e-
N 2+
S 2-
+2 e-
S 0(Reduccin)
(Oxidacin)
N: 2
___________________________________________
2 N 5+ + 3 S-2
2 N 2+ + 3 S0
2 HNO3 + 3 H2S
3 S + 2 NO + 4 H2O
BALANCE DE ECUACIONES
01.
Zn
02.
KMnO4 +
03.
K2Cr2O7
H2O +
04.
Cu2S
05.
KMnO4 +
06.
07.
Cr(OH)3 +
NaNO3 +
S: 3
S: 3
H: 8 H: 8
O: 6
O: 6
NH3 + H2O
Na2ZnO2 +
Sb
K2SO4
MnSO4 +
Cr2O3
SO2 +
HNO3
Cu2 (NO3)2 +
KCl +
H2SO4
MnSO4
K2SO4 +
H2O +
Cl2
NaClO +
Na2CO3
Na2CrO4 +
NaCl +
H2O +
CO2
H2SO4 +
NaOH
N: 2
As2O3 + H2SO4 + Zn
AsH3
H2O
ZnSO4 +
Sb2O3 +
H 2O
KOH
+
NO +
H2O
Consorcio Educativo El Carmelo216
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
08.
PbS + HNO3
Pb (NO3)2 +
09.
Cu
Cu (NO3)2 +
HNO3
NO
H 2O +
NO +
H 2O
10.
KMnO4
HCl
11.
KClO3
K2SO3
KCl
12.
AuCl3 +
FeSO4
Fe2 (SO4) 3
FeCl2
13.
KOH
P4
KH2PO4
PH3
14.
Mn (OH)2 +
KClO4 + Na2CO3
NaMnO4
KCl +
15.
KMnO4
H3PO4 +
H2S
K3PO4 +
Mn3 (PO4) 2 +
16.
Ag (OH)
P4
H2 O
AgH2PO4
Ca +
H2 O
KCl +
SO +
18.
KNO2 +
KMnO4 +
H2SO4
KNO3 +
MnSO4 +
HNO3 +
H2O
H3AsO4 +
NO2
I2
HIO4
K2SnO2
Bi
20.
HNO3
21.
Bi (OH)3
22.
23.
Ag + HNO3
KMnO4 + HCl +
24.
FeSO4
25.
Cu +
26.
K2Cr2O7
KMnO4
KMnO4
28.
Ca(MnO4)2 +
29. H2SO4 +
31.
MnO2
HI
KCl +
Zn +
K2Cr2O7 +
+
KMnO4 +
N2O
H 2O
S+
H2O
H2 O
K2SnO3 +
H2O
H2O
H 2O
H2O
Fe2 (SO4) 3 +
K2SO4 +
MnSO4 +
Cu (NO3) 2 +
NO2
H2O
CrI3 +
Cl2 +
H2O
MnO2 +
Zn(OH)2 +
Na2SO3
Cr2(SO4)3 +
K2SO4 +
NaI
CO2 +
K2SO4 +
KI +
H 2O
Au
HCl
HCl
H2SO4 +
AgNO3 +
NO +
MnSO4 +
K2SO4 +
Cl2 +
H2SO4
HNO3
27.
30.
H2SO4
H2SO4
H2O
PH3
CaCl2 +
As2O3
Cl2 +
K2SO4
17.
19.
H 2O
MnCl2 +
MnO2
Cl2 +
MnSO4 +
I2 +
+
MnCl2 +
Na2SO4 +
H2O
H2O
KOH
Ca(OH)2
Na2SO4 +
H2O
H2O
K2SO4 + I2 +
H2O
Consorcio Educativo El Carmelo217
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
32.
KNO2
33.
34.
35).
HCl
NO
KMnO4 +
H2SO4 +
H2S
K2SO4 +
H2SO4 +
NaCl +
MnO2
H2O +
Cu (NO3) 2 +
Cu
H2S
Lic. Max Alan Obregn Snchez
HNO3
KCl
MnSO4 +
NaHSO4 +
NO +
H2O
H2O +
MnSO4 +
H 2O
Agente Oxidante y Reductor
Sea:
HNO3 + H2S S + NO + H2O
a) 1
b) 2
Luego del REDOX
Agente oxidante
1+
2-
2 HNO3
c) 3
1+
3 H2S
5+
Hallar el coeficiente del agente oxidante:
d) 4
e) 5
2-
2-
1+
2+
Oxida (pierde 2e-).3
(gana 3e-).2
Reduce
2-
3 S + 2 NO + 4 H2O
Rpta. B
1) Hallar:
Agente oxidante
Forma oxidada
Agente reductor
Forma reducida
Luego de balancear: Fe O + C Fe + CO2
a) 2,5
b) 2
c) 5
d) 0,5
e) 1,5
Agente
Agente
Forma
Forma
Oxidante reductor
reducida oxidada
2 Fe O2- + 1 C
2 Fe + 1 CO222+
Reduce
4+
(gana 2e-).2
Oxida
(pierde 4e-).1
2 1 = 1,5
Rpta. = E
1
2
2) Balancear la reaccin y determinar la relacin: Agente oxidante + Agente reductor.
Ag + HNO3 AgNO3 + NO + H2O
a) 4
b) 7
c) 6
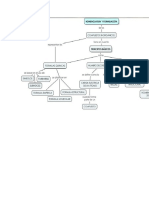
Analizar y completar el mapa conceptual
d) 10
e) 8
REACCIONES REDOX
es
un
en que
Algunos elementos
que
comprende
sufren
OXIDACIN
es
la
es
la
Ganancia de electrones
y a
la vez
y a
la vez
Agente reductor
Proceso simultneo
Prdida de electrones
Agente oxidante
Entrega de electrones
Reduccin
Cambios de valencia
Cl2
Consorcio Educativo El Carmelo218
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
pues
Lic. Max Alan Obregn Snchez
pues
Ganancia de electrones
MTODO DE COEFICIENTE INDETERMINADO
1)
K2Cr2O7
FeCl2 +
HCl
KCl
CrCl3 +
FeCl3
H 2O
1.- Se asigna coeficientes literales (a,b,c,d,......) a cada una de las sustancias de la ecuacin.
a K2Cr2O7 + b FeCl2 + c HCl
d KCl + e CrCl3 + f FeCl3 + g H2O
2.- Se realiza un balance de tomos para cada elemento, obtenindose as un sistema de
ecuaciones indeterminadas.
K 2a = d
Fe b = f
Cr 2a = e
Cl 2b+c = d + 3e + 3f
O 7a = g
H c = 2g
3.- El sistema de 6 ecuaciones con 7 incgnitas es indeterminado, se le debe asignar un valor
arbitrario(1) a cualquiera de las incgnitas (la que mas se repite) (a = 1)
d=2
g=7
b=f
e=2
c = 14
2b + 14 = 2 + 6 + 3f
2b = 3f 6 ..... b = f = 6
4.- Se reemplazan los valores en la ecuacin y esta se balancea.
K2Cr2O7 + 6
2)
I2 + HNO3
a I2 + b HNO3
FeCl2 + 14 HCl
2 KCl + 2 CrCl3 + 6 FeCl3 + 7 H2O
HIO3 + NO + H2O
c HIO3 + d NO +
I 2a = c
H b = c + 2e
e H 2O
Nb=d
O 3b = 3c + d + e
a=1
b = 2 + 2e
3(2 + 2e) = 6 + (2 + 2e) + e
c=2
d = 2 + 2e
6 + 6e = 8 + 3e
3e = 2 ....... e = 2/3
Hay que multiplicarlo por 3 para ser entero.
a=1x3=3
c=2x3=6
b = (2 + 2 2/3)x 3
d = b = 10
b = 10 x 3 = 10
e=2x3=2
3
3
3 I2 + 10 HNO3
6 HIO3 + 10 NO + 2 H2O
Resolver:
HCl + KClO3
KCl + H2O + Cl2
3)
4)
K2Cr2O7 + SnCl2 + HCl
Cr Cl3 + SnCl4 + KCl + H2O
5)
CrI3 + Cl2 + NaOH
Na2CrO4 + NaIO4 + NaCl + H2O
6)
NaMnO4 +
I2 + MnSO4 + MgSO4 + Na2SO4 + H2O
7)
Fe(NO3)3 + NH3 + H2O
Fe(OH)3
8)
CuCl2
Cu(OH)2
+ NH4Cl
9)
Ca(MnO4)2
MnO2 + Zn(OH)2 + Ca(OH)2
10)
I2
HIO3
MgI2 +
NH3 +
H2O
+ Zn +
HNO3
H2SO4
H2O
NH4NO3
NO2 + H2O
Consorcio Educativo El Carmelo219
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
11)
KOH + P + H2O
12)
C2H4O2 + KMnO4 +
13)
FeSO4
14)
NiF2
15)
Na2CO3
16)
Al2O3
17)
KMnO4
18)
MgCl2
19)
K2Cr2O7
20)
CaCO3
21)
NaOH
22)
KOH
23)
KH2PO2 +
K2SO4
FeCl3 +
H2SO4 + HBr +
Ni3N
NH4F
FeO3 +
CO
KMnCl2 + CO2 + H2O
Na3PO4
Mg3(PO4)2
HCl
KCl
H3PO4
Ca3(PO4)2
Cl2
NaCl
Cl2
KCl
H2SO4
CO2 + SO2
24)
HCl
Cl2
+ HBrO +
+
H2SO4
HCl
NH3
+
FeCr2O4 +
+ C
+
+
+
+
O2
+ Cl2
H2CO2
Lic. Max Alan Obregn Snchez
HCl
HNO3
25) FeBr2 +
SnBr4
PH3
MnSO4 + CO2 +
Na2CrO4 + CO2
AlCl3
NaCl
CrCl3
Cl2 + H2O
+ CO2 +
NaClO3
KClO3
H 2O
FeBr3 + SnBr2
H2 O
K3Fe (CN)6 + KCl
27)
K ClO3 +
HCl
KCl + Cl2 + H2O
28)
K MnO4 + HCl
KCl + Cl2 +
29)
BiCl3
30)
Na2CO3
31) CaCO3
32)
HCl
33)
+
+
H 2O
C + N2
HNO3
HNO3
H2SO4
MnCl2 + H2O
Bi(OH)3
NaCN
Ca(NO3)2
Cl2
CO2 + SO2 +
+
+
H 2O
+ H2O
+ NOCl
H 2O
K4Fe (CN)6 + Cl2
NH3
H2O
+ N2
26)
H 2O
NH4Cl
CO
+
CO2
NOCl
H2O
H 2O
H 2O
MTODO IN ELECTRN
Las reacciones qumicas en laboratorios se hacen en medios cidos, bsicos y neutros.
El mtodo consiste en dividir la reaccin con dos medias reacciones, una representa la reduccin de
la que los gana e- y la otra la oxidacin pierde e-.
1) Ecuacin en un medio cido:
x
2- =
2+
3+
3+
(Cr2 O7) + Fe
Cr + Fe
6+
2x + (7x2-) = -2
3+
1 { Cr2 + 6e- 2 Cr
Reduccin
Consorcio Educativo El Carmelo220
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
6 { Fe2+ 1e- Fe3+
2x + -14 = -2
x=6
Lic. Max Alan Obregn Snchez
Oxidacin
Cr2 + 6 Fe 2 Cr + 6 Fe
=
(Cr2 O7) + 6 Fe 2+ 2 Cr 3+ + 6 Fe 3+
por cada carga positiva use H3O+ (Hidronio) o H+ (protn)
por cada carga negativa use OH (hidroxido) o e- (electrn)
a) En medio cido usar H+ para igualar cargas positivas.
b) En medio bsico usar OH para igualar cargas negativas.
c) En medio neutro usar H+ o OH ; pero en el segundo miembro de la ecuacin.
=
2+
(Cr2 O7) + 6 Fe 2 Cr 3+ + 6 Fe 3+
2- + 6 (2+)
2 (3+) + 6 (3+)
10+
24+
Falta 14 cargas positivas a la izquierda = 14 H+
=
2+
(Cr2 O7) + 6 Fe + 14 H+ 2 Cr 3+ + 6 Fe 3+
Se balancea agregando H2O
=
(Cr2 O7) + 6 Fe
2+
14 H+ 2 Cr 3+ + 6 Fe 3+ + 7 H2O
Oxidacin Prdida de electrones.
Reduccin Ganancia de electrones.
Oxidante
Reductor
Agente que recibe los electrones.
Agente que cede electrones.
2) Ajustar la ecuacin en medio bsico.
(Mn O4)- + (H CO2)- Mn O2 + (CO3)=
7+
2 { Mn
3 { C2+
2+
7+
4+
+3e-2e-
Mn
C4+
4+
4+
Red
Ox
2 Mn + 3 C 2 Mn + 3 C
2 (-1) + 3 (-1) 2 (0) + 3 (-2)
-5
-6
02 Mn O4 + 3 H CO2 + OH- 2 Mn O2 + 3 CO3=
2 Mn O4 - + 3 H CO2- + OH- 2 Mn O2 + 3 CO3= + 2 H2O
3) MnO4 -
4) Cl2
5) MnO4-
NO2-
MnO4= +
NO3-
(Bsico)
IO3-
IO4-
Cl -
(Bsico)
Cl-
Mn2+
Cl2
(cido)
6) Cu
7) Mn2+
+
+
NO3BiO3-
Cu2+
Bi3+
+
+
NO
MnO4-
(cido)
(cido)
8) Cl2
I2
Cl -
IO4-
(Bsico)
9) Cr2+
ClO3 -
Cl -
CrO42-
(Bsico)
10) Cr(OH)3
IO3-
I-
CrO42-
(Bsico)
11) N2O4
Br -
NO2-
BrO3-
(Bsico)
Consorcio Educativo El Carmelo221
Qumica 3er ao
Colegios Pre Universitarios con Formacin Humanista
Lic. Max Alan Obregn Snchez
12) CH2O
AgO
Ag
HCO2-
(Bsico)
13) MnO41-
Cu
Cu2+
Mn2+
(cido)
14) H2O2
Cr2O72+
Cr3+
O2
(cido)
15) NO31-
Cu
Cu2+
NO
(cido)
16) CH2O
Ag2O
Ag
HCO21-
(Bsico)
17) MnO41-
Fe 2+
Mn2+
Fe3+
(cido)
18) CrO42+
SO32-
Cr(OH)41 -
SO42 -
(Bsico)
19) P4O10
H3PO4
H2PO41-
20) Sb2O3
IO31-
H7 SbO6
I1-
(cido)
21) Ce 4+
C2O3 2-
Ce 3+
CO2
(Bsico)
22) ClO1-
CoCl2
Co(OH)3
Cl1-
23) H2CO2
+
(Bsico)
Cr3+
Cr2O72-
H 2O
24) H2O1-
+
(Bsico)
SCN1-
CO32-
NO31-
SO42-
25) VO31-
Al
VO2+
Al3+
(Bsico)
26) MnO41-
H2C2O4
CO2
Mn2+
(Bsico)
27) I1-
NO21-
I2
NO
(Bsico)
28) Cr2 O7
S8
Cr2O3
SO2
(Bsico)
29) Cr2O7 2 -
H2SO3
Cr3+
H2SO41- (Bsico)
30) FeS
NO31-
NO
SO42-
31) Zn
NO31-
ZnO22-
NH3
(cido)
(Bsico)
Fe3+
(Bsico)
(Bsico)
You might also like
- Funciones Quimica Inorganicas Solo OxidosDocument13 pagesFunciones Quimica Inorganicas Solo OxidosMax WellsNo ratings yet
- Química 3ro - 1er y 2do Bimestre 2005Document29 pagesQuímica 3ro - 1er y 2do Bimestre 2005Victor Raul Palomino HuamanNo ratings yet
- NomenclaturaDocument16 pagesNomenclaturaMiriam Calderon SalvatierraNo ratings yet
- Funciones QuimicasDocument29 pagesFunciones QuimicasMitchell CalixtoNo ratings yet
- Funciones QuimicasDocument20 pagesFunciones QuimicasJusta Carmen Concha RevillaNo ratings yet
- Funciones Quimicas InorganicasDocument28 pagesFunciones Quimicas InorganicasJohn VelascoNo ratings yet
- Act. Form. QuimicaDocument11 pagesAct. Form. QuimicaRuby Santos GuzmanNo ratings yet
- Ssm-Avance 06 (Nomenclatura Inorgánica)Document23 pagesSsm-Avance 06 (Nomenclatura Inorgánica)Ana ClaudiaNo ratings yet
- 2.1 Compuestos Inorgánicos-OrgánicosDocument32 pages2.1 Compuestos Inorgánicos-OrgánicosalejandraNo ratings yet
- 4 Compuestos HidróxidosDocument12 pages4 Compuestos HidróxidosElian RiquelmeNo ratings yet
- 4-Hidróxidos y ÁcidosDocument3 pages4-Hidróxidos y ÁcidosAdriana AbrahamNo ratings yet
- Comp. QuimicosDocument5 pagesComp. QuimicosPatricia LopezNo ratings yet
- Compuestos Orga CarrilloDocument14 pagesCompuestos Orga CarrillolunahurtadoNo ratings yet
- Unciones Quimicas InorganicasDocument15 pagesUnciones Quimicas Inorganicascarcahusto Paul JhersonNo ratings yet
- Clases 2020 AnexoDocument98 pagesClases 2020 AnexorositaromeraNo ratings yet
- Sistemas de Nomenclatura de Las Funciones InorgánicasDocument18 pagesSistemas de Nomenclatura de Las Funciones InorgánicasVilma Rosario Simeon CarhuanchoNo ratings yet
- Nomenclatura de ÓxidosDocument71 pagesNomenclatura de ÓxidosNicol ArteagaNo ratings yet
- Funciones Químicas Inorgánicas Tutoria 2Document3 pagesFunciones Químicas Inorgánicas Tutoria 2NICOL ESTEFANIA BELTRAN HERRERANo ratings yet
- Tipos de Enlace QuímicoDocument6 pagesTipos de Enlace Químicoluna olivaresNo ratings yet
- Guia de Problemas 1º Parte Qca - Ing. 2020Document26 pagesGuia de Problemas 1º Parte Qca - Ing. 2020Graciela GenkinNo ratings yet
- Laboratorio 6Document25 pagesLaboratorio 6Melania Bermudo CoronadoNo ratings yet
- 5-Hidróxidos, Ácidos y SalesDocument12 pages5-Hidróxidos, Ácidos y SalesKarlitah OjedaNo ratings yet
- Compuestos InorgánicosDocument17 pagesCompuestos InorgánicosGreiis Vazquez RussoNo ratings yet
- Función Hidruros, Ácidos y SalesDocument27 pagesFunción Hidruros, Ácidos y SalesCesar Rolando Ñique CabreraNo ratings yet
- Formación de Compuestos QuímicosDocument6 pagesFormación de Compuestos QuímicosLucasJ.LenziNo ratings yet
- Catedra NomencDocument11 pagesCatedra NomencGabriel MarteNo ratings yet
- Tarea 3Document12 pagesTarea 3Luis David Lozano OrtizNo ratings yet
- PDF QuimicaDocument14 pagesPDF QuimicaSebastian Agudelo CabreraNo ratings yet
- Formulacion Quimica InorganicaDocument21 pagesFormulacion Quimica InorganicaAlejandro Escobar RuizNo ratings yet
- Teoria Funciones QuimicasDocument13 pagesTeoria Funciones QuimicasPiero Arenas AlvaradoNo ratings yet
- NomenclaturaDocument37 pagesNomenclaturaAndres Da Rocha AmorosoNo ratings yet
- Reacciones de Combinación o SíntesisDocument11 pagesReacciones de Combinación o SíntesisEadgITTGNo ratings yet
- Funciones QuímicasDocument13 pagesFunciones QuímicasJuliana QuispeNo ratings yet
- 1-09 - 1 Reacc - QcasDocument17 pages1-09 - 1 Reacc - Qcasmiruiz12113281No ratings yet
- Características de Las Principales Funciones Químicas InorgánicasDocument3 pagesCaracterísticas de Las Principales Funciones Químicas InorgánicasHernan Osorio33% (3)
- Unidad III Compuestos Organicos e InorganicosDocument26 pagesUnidad III Compuestos Organicos e InorganicosreyD1992No ratings yet
- Mapa Conceptual NomenclaturaDocument6 pagesMapa Conceptual NomenclaturaDharmanNo ratings yet
- Unidad III Compuestos Organicos e Inorganicos 1Document26 pagesUnidad III Compuestos Organicos e Inorganicos 1mmi izquierdoNo ratings yet
- Sesiones de Clase 17 SetDocument5 pagesSesiones de Clase 17 SetjmoralesboNo ratings yet
- HIDRÓXIDOSDocument6 pagesHIDRÓXIDOSmaria judith ugarte guevaraNo ratings yet
- Guia de Estudio de Reglas de NomenclaturaDocument9 pagesGuia de Estudio de Reglas de NomenclaturaAless Pako D'guivesNo ratings yet
- Nomnclatura Inorganica - QuimicaDocument8 pagesNomnclatura Inorganica - QuimicaKath MedaNo ratings yet
- TALLERDocument15 pagesTALLERErika HoyosNo ratings yet
- Guia 1 P.4 Funciones Quimicas IDocument2 pagesGuia 1 P.4 Funciones Quimicas IMelany GutierrezNo ratings yet
- Momento Ii: Equipo DocenteDocument14 pagesMomento Ii: Equipo DocenteMartin RodriguezNo ratings yet
- Guia 6.1 Decimo - OriginalDocument8 pagesGuia 6.1 Decimo - OriginalJuan Martin Sierra CarrascalNo ratings yet
- Presentacion FormulasDocument24 pagesPresentacion FormulasqfbjaimerrojasNo ratings yet
- UNIDAD 5 Curso Nivelación Química 2015 TW.P DFDocument87 pagesUNIDAD 5 Curso Nivelación Química 2015 TW.P DFSandi F. A.MNo ratings yet
- Actividad 5Document4 pagesActividad 5eduar nicolas cabiativa hernadezNo ratings yet
- Anhídridos Del Fer Toapanta1Document13 pagesAnhídridos Del Fer Toapanta1Yalesita CordovaNo ratings yet
- Nomenclatura Quimica InorganicaDocument3 pagesNomenclatura Quimica InorganicaMaicol AlexNo ratings yet
- Guia Oxidacion 2Document8 pagesGuia Oxidacion 2Leidy Carolina Carreño PabonNo ratings yet
- Nomenclatura en Química InorgánicaDocument12 pagesNomenclatura en Química InorgánicaoretedsNo ratings yet
- Compuestos InorganicosDocument23 pagesCompuestos Inorganicosロサレスアヤラ キンNo ratings yet
- Nomenclatura QuinicaDocument11 pagesNomenclatura QuinicaEduardo MedinaNo ratings yet
- Guía de Química 8 Primer PeriodoDocument8 pagesGuía de Química 8 Primer PeriodoLuís Alfonso Banguera PereaNo ratings yet
- Nomenclatura Quimica de Los Compuestos InorganicosDocument26 pagesNomenclatura Quimica de Los Compuestos InorganicosSaen ab100% (1)
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAFrom EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANo ratings yet
- Cartilla Planificacion Curricular PDFDocument24 pagesCartilla Planificacion Curricular PDFAna Maria Cabrera MarcosNo ratings yet
- QuimicaDocument5 pagesQuimicaRene Tadeo CamposNo ratings yet
- 00 Niv 1Document4 pages00 Niv 1Maira Alejandra Moyano EspitiaNo ratings yet
- AnatomiaDocument43 pagesAnatomiaRene Tadeo CamposNo ratings yet
- Biologia 1 - Plan-AnualDocument12 pagesBiologia 1 - Plan-AnualRene Tadeo CamposNo ratings yet
- Estructura AtomicaDocument5 pagesEstructura AtomicaRene Tadeo CamposNo ratings yet
- Medidas de Tendencia CentralDocument18 pagesMedidas de Tendencia CentralRene Tadeo Campos100% (1)
- Que Es El EmpresarioDocument3 pagesQue Es El EmpresarioRene Tadeo CamposNo ratings yet
- Libro PISA PDFDocument192 pagesLibro PISA PDFJorge MusajaNo ratings yet
- Preguntas Biología FotosintesisDocument51 pagesPreguntas Biología FotosintesisRene Tadeo Campos100% (1)
- Genetica ProblemasDocument13 pagesGenetica ProblemasRene Tadeo Campos100% (1)
- Armamento IncaDocument5 pagesArmamento IncaRene Tadeo CamposNo ratings yet
- Evaluación Diagnóstica CTA - 2°Document11 pagesEvaluación Diagnóstica CTA - 2°Huber Rogger Marquina QuispeNo ratings yet
- Biologia 5ºDocument1 pageBiologia 5ºRene Tadeo CamposNo ratings yet
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Captura de Carbono BolainaDocument15 pagesCaptura de Carbono BolainaRene Tadeo CamposNo ratings yet
- Idea de Negocio SnackDocument23 pagesIdea de Negocio SnackRene Tadeo Campos0% (1)
- Silabo Investigacion de Mercados 2015Document5 pagesSilabo Investigacion de Mercados 2015Rene Tadeo CamposNo ratings yet
- Eliminacion Gaussiana Con Pivoteo Parcial Metodo NumericoDocument8 pagesEliminacion Gaussiana Con Pivoteo Parcial Metodo NumericoNtc TadeoNo ratings yet
- Servicios de Salud para Pacientes GeriatricosDocument9 pagesServicios de Salud para Pacientes GeriatricosRene Tadeo CamposNo ratings yet
- Fisca - BiologiaDocument2 pagesFisca - BiologiaRene Tadeo Campos100% (1)
- Costumbres de Los Inmigrantes en PozuzoDocument3 pagesCostumbres de Los Inmigrantes en PozuzoRene Tadeo CamposNo ratings yet
- Fiestas IncasDocument4 pagesFiestas IncasRene Tadeo CamposNo ratings yet
- Proyecto Del Medio AmbienteDocument51 pagesProyecto Del Medio AmbienteRene Tadeo CamposNo ratings yet
- Carpeta Pedagogica 2015Document84 pagesCarpeta Pedagogica 2015Rene Tadeo CamposNo ratings yet
- Guia de EjerciciosDocument43 pagesGuia de Ejerciciost@j44% (9)
- 01 IntroducciónDocument48 pages01 IntroducciónRene Tadeo CamposNo ratings yet
- Ex. EstequiometriaDocument3 pagesEx. EstequiometriaRene Tadeo CamposNo ratings yet
- Aplicación de Las Integrales A La EconomiaDocument11 pagesAplicación de Las Integrales A La EconomiaRene Tadeo Campos80% (5)
- Material de LaboratorioDocument12 pagesMaterial de LaboratorioJuan Carlos Vázquez99% (156)
- 9 Sorprendentes Beneficios de Los Huevos de CodornizDocument2 pages9 Sorprendentes Beneficios de Los Huevos de CodornizPlacidoPajaQuispeNo ratings yet
- Introducción A La Ingenieria de Procesos QuimicosDocument17 pagesIntroducción A La Ingenieria de Procesos Quimicosfernand08No ratings yet
- Memoria de Calculo Estructura Metalica - ultiMODocument3 pagesMemoria de Calculo Estructura Metalica - ultiMOandrea gala floresNo ratings yet
- Monografia de Geomalla PDFDocument218 pagesMonografia de Geomalla PDFSixto Antay Anca100% (2)
- Cizalla de PalancaDocument7 pagesCizalla de PalancafelixNo ratings yet
- Diagrama Instalación Tanque ToriesfericoDocument3 pagesDiagrama Instalación Tanque ToriesfericoMinixpi RodriguezNo ratings yet
- PRACTICA 1 Estabilidad de Comp Erik y DayDocument7 pagesPRACTICA 1 Estabilidad de Comp Erik y DayerikuribeNo ratings yet
- Clasificacion de Impactos AmbientalesDocument7 pagesClasificacion de Impactos AmbientalesNathalia gamboaNo ratings yet
- 10 APU PontonDocument10 pages10 APU PontonWashington CairaNo ratings yet
- Trabajo Seguridad SoldaduraDocument387 pagesTrabajo Seguridad SoldaduraBobby bobbyNo ratings yet
- Ecologia InstrumentosDocument10 pagesEcologia InstrumentosJasmin ZoteloNo ratings yet
- Corrosion Bajo TensionDocument18 pagesCorrosion Bajo TensionJeans Heysen ZavalaNo ratings yet
- Diagrama de Flujos Proceso de Fabricación Del LadrilloDocument1 pageDiagrama de Flujos Proceso de Fabricación Del LadrilloLuiska Orozco67% (3)
- Proteccion Dentino PulparDocument13 pagesProteccion Dentino PulparRoberto Cárcamo100% (4)
- Qué Es Una Vía IntramuscularDocument5 pagesQué Es Una Vía IntramuscularDeyanira Navarro Atoche100% (1)
- Materiales de La Construccion, HPDocument17 pagesMateriales de La Construccion, HPMaria Angeles AbantoNo ratings yet
- Triptico La Capa de OzonoDocument2 pagesTriptico La Capa de OzonoCsar Steban SarmientopNo ratings yet
- Bioquimica para No Quimicos - Parte 2 - BiomoleculasDocument40 pagesBioquimica para No Quimicos - Parte 2 - BiomoleculasWilmer Cuervo33% (3)
- Manual Termo Electrico 2009Document4 pagesManual Termo Electrico 2009Matthew ThomasNo ratings yet
- Toma y Conservación de Muestra Sanguínea en Laboratorio (Autoguardado)Document104 pagesToma y Conservación de Muestra Sanguínea en Laboratorio (Autoguardado)medicoNo ratings yet
- Pruebas de Calidad de La LecheDocument73 pagesPruebas de Calidad de La LecheAna LopezNo ratings yet
- Manual Albahaca ArbitradoDocument44 pagesManual Albahaca Arbitradoberna_mty100% (1)
- Sales OrganicasDocument1 pageSales OrganicasYane Rojas ZevallosNo ratings yet
- Etanol UltimaDocument36 pagesEtanol UltimaLuis Eduardo Gale ArmestoNo ratings yet
- Tecnicas Cucharas de ColadaDocument22 pagesTecnicas Cucharas de ColadajhonathanNo ratings yet
- Intoxicaciones Por PlaguicidasDocument23 pagesIntoxicaciones Por PlaguicidasJose Luis50% (2)
- Ley de HenryDocument1 pageLey de HenryGames RaRNo ratings yet
- Sistemas de Encendido BOSCHDocument16 pagesSistemas de Encendido BOSCHgatuno7_2000No ratings yet
- Spheripol 2Document2 pagesSpheripol 2Javier JoseNo ratings yet
- Aseo, Limpieza y DesinfeccionDocument14 pagesAseo, Limpieza y DesinfeccionDaniela PatvalNo ratings yet