Professional Documents
Culture Documents
Ab DS2 2007
Uploaded by
la physique selon le programme FrançaisOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ab DS2 2007
Uploaded by
la physique selon le programme FrançaisCopyright:
Available Formats
Le 11/10/2007 Page : 1 / 5 Devoir n°2 (2h) Tale S5
I. Étude cinétique de la dismutation de l'eau oxygénée
•L'eau oxygénée commerciale est une solution aqueuse de peroxyde d'hydrogène utilisée comme désinfectant
pour des plaies, pour l'entretien des lentilles de contact ou comme agent
de blanchiment.
•Le peroxyde d'hydrogène (H2O2) intervient dans deux couples oxydant-réducteur : H2O2 (aq) / H2O(l)
et O2 (g) / H2O2 (aq).
•Le peroxyde d'hydrogène est capable dans certaines conditions de réagir sur lui-même c'est à dire de se
dismuter selon l'équation de réaction suivante : 2 H2O2 (aq) = 2 H2O(l) + O2 (g) Réaction 1
•Cette réaction est lente à température ordinaire mais sa vitesse peut être augmentée en présence d'un
catalyseur.
Donnée : Volume molaire des gaz dans les conditions de l'expérience : Vm 25 L.mol-1.
•La partie 3 est indépendante des parties 1 et 2.
1. Partie 1 : Étude de la réaction de dismutation
a) Écrire les deux demi-équations d'oxydoréduction des deux couples auxquels le peroxyde d'hydrogène
appartient.
b) Compléter le tableau d'évolution du système en annexe à remettre avec la copie.
2. Partie 2 : Détermination de la concentration initiale de la solution de peroxyde d'hydrogène
• L'eau oxygénée du commerce se présente en flacons opaques afin d'éviter que la lumière favorise la
transformation chimique précédente. Le flacon utilisé dans cette étude porte la mention suivante : eau
oxygénée à 10 volumes. Cette indication est appelée le titre de l'eau oxygénée.
• Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution
aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation dans les conditions normales de
température et de pression (réaction 1). On considérera, en première approximation, que les conditions de
l'expérience sont assimilables aux conditions normales.
• Avant de réaliser le suivi cinétique de la réaction de dismutation, on désire vérifier l'indication donnée sur le
flacon concernant le titre de l'eau oxygénée de la solution commerciale utilisée.
1. Calcul de la valeur attendue de la concentration en peroxyde d'hydrogène.
a) Par définition du titre de l'eau oxygénée, quel volume de dioxygène V(O2) serait libéré
par un volume V = 1,00 L de la solution commerciale au cours de la réaction de
dismutation du peroxyde d'hydrogène ?
b) Calculer la quantité de dioxygène formé au cours de cette transformation.
c) La transformation précédente étant considérée comme totale, calculer la concentration en peroxyde
d'hydrogène notée [H2O2]th de cette solution commerciale (valeur théoriquement attendue).
2. Détermination de la valeur réelle de la concentration en peroxyde d'hydrogène.
• Pour vérifier la valeur de la concentration précédente, on réalise le titrage d'un volume V0 = 10,0 mL de
cette solution par une solution de permanganate de potassium acidifiée de concentration en soluté
C1 = 2,0 × 10 -1 mol.L-1. Les couples oxydant-réducteur intervenant au cours du titrage sont
MnO4– (aq) / Mn2+(aq) et O2 (g) / H2O2 (aq). Le volume de permanganate de potassium versé pour obtenir
l'équivalence est Veq =14,6 mL.
• L'équation de la réaction de titrage est la suivante :
5 H2O2 (aq) + 2 MnO4- (aq) + 6 H+(aq) = 5 O2 (g) + 2 Mn2+(aq) + 8 H2O (l) Réaction 2
a) La réaction doit avoir lieu en milieu acide. Pourquoi ?
b) L'ion permanganate MnO4– (aq) donne une coloration violette aux solutions aqueuses qui
le contiennent. Comment l'équivalence est-elle repérée au cours du titrage ?
c) Quelle relation peut-on écrire entre la quantité initiale de peroxyde d'hydrogène se
trouvant dans le bécher n0(H2O2) et la quantité d'ions permanganate introduits dans le
bécher à l'équivalence neq(MnO4-) ?
d) Donner l'expression de la concentration en peroxyde d'hydrogène de la solution
commerciale [H2O2]exp en fonction de C1, V0 et Veq.
25/04/200808 2654475.doc 1/5
e) Calculer la concentration expérimentale [H2O2]exp.
f) Comparer à la valeur obtenue à la question 1.c). Les erreurs de manipulation mises à part, comment peut-on
expliquer l'écart de concentration obtenu ?
3. Partie 3 : Étude cinétique de la dismutation du peroxyde d'hydrogène
• La dismutation du peroxyde d'hydrogène est une réaction lente mais qui peut être accélérée en utilisant
par exemple des ions fer III (Fe3+ (aq)) présents dans une solution de chlorure de fer III,
un fil de platine ou de la catalase, enzyme se trouvant dans le sang.
• L'équation de la réaction associée à cette transformation est donnée dans l'introduction
(réaction 1).
a) Donner la définition d'un catalyseur.
• La transformation étudiée est catalysée par les ions fer III. On mélange 10,0 mL de la solution
commerciale d'eau oxygénée avec 85 mL d'eau. À l'instant t = 0 s, on introduit dans le système
5,0 mL d'une solution de chlorure de fer III.
• Au bout d'un temps déterminé, on prélève 10,0 mL du mélange réactionnel que l'on verse dans
un bécher d'eau glacée. On titre alors le contenu du bécher par une solution de permanganate
de potassium afin de déterminer la concentration en peroxyde d'hydrogène se trouvant dans le milieu
réactionnel.
• On obtient les résultats suivants :
t(min) 0 5 10 20 30 35
[H2O2] mol.L-1 7,30× 10-2 5,25× 10-2 4,20× 10-2 2,35× 10-2 1,21× 10-2 0,90× 10-2
b) Tracer sur la feuille de papier millimétré à remettre avec la copie l'évolution de la concentration en
peroxyde d'hydrogène en fonction du temps.
Échelles : en abscisses 2 cm pour 5 min ; en ordonnées 2 cm pour 1 × 10-2 mol.L-1
c) En utilisant le tableau d'évolution du système proposé en annexe, exprimer l'avancement de la
transformation x(t) en fonction de nt(H2O2) quantité de peroxyde d'hydrogène présent à l'instant t et
de n0(H2O2) quantité initiale de peroxyde d'hydrogène.
• Le temps de demi-réaction t1/2 est définie ainsi : c’est la durée au bout de laquelle l’avancement a atteint
la moitié de sa valeur finale : x(t1/2) = .
d) Montrer que lorsque t = t1/2 alors [H2O2] t1/ 2 =
H2O2 0 et en déduire graphiquement la
2
valeur de t1/2.
e) Si la transformation chimique étudiée avait été réalisée à une température plus élevée, tracer sur le
graphe l’allure de la courbe. Justifier.
25/04/200808 2654475.doc 2/5
II.L'énergie hydraulique
•Les énergies renouvelables constituent historiquement les premières sources d'énergies utilisées par les
hommes. Au total, on peut compter six "types" d'énergies renouvelables : l'énergie solaire, l'énergie éolienne,
l'énergie hydraulique, l'énergie géothermale, la biomasse et l'énergie des déchets. On s'intéressera en
particulier dans cet exercice à l'énergie hydraulique.
•On va étudier un prototype d'usine houlomotrice. Une plate-forme amarrée au fond et pesant 237 tonnes,
récupère l'énergie produite par les vagues "déferlantes". Elle possède un réservoir central qui se remplit en
brisant la houle. Ce réservoir se vide partiellement, à travers une conduite, dans une turbine qui génère de
l'électricité. On peut ainsi espérer une puissance d'environ 7 MW.
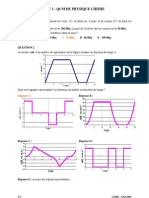
•La figure ci-dessous montre un plan en coupe.
•On modélise la houle par une onde transversale. Sur la figure 2 de l'annexe à rendre avec la copie, on a
représenté à deux instants t = 0 s et t = 1,0 s , cette houle se propageant vers
la droite.
1) Décrire qualitativement le mouvement du bout de bois représenté sur la figure 2.
2) Sur la figure 2 dessiner la position du bout de bois à t = 1,0 s.
3) Décrire en quelques lignes le principe de fonctionnement de cette usine houlomotrice. On pourra analyser
les différents type d'énergies mis en jeu.
4) À l'aide de la figure 2 de l'annexe, calculer la célérité v de l'onde.
5) Définir la longueur d'onde λ de la houle puis la déterminer à l'aide de la figure 2 de l'annexe.
6) Définir la période T de l'onde puis calculer sa valeur.
•Une série de mesures effectuées au large montre que le carré de la célérité est proportionnel à la longueur
d'onde: v² = a × λ.
7) Déterminer l’unité S.I. (Système International) de a.
8) On propose les 2 relations suivantes :
(a) v² = × λ ; (b) v² = g × λ
À l'aide des résultats des questions 4 et 5, déterminer la bonne relation entre v² et λ.
On prendra g = 9,8 m.s-2.
25/04/200808 2654475.doc 3/5
NOM : ................................................ Prénom : ................................................ Classe : TS 5
FEUILLE ANNEXE
équation-bilan 2 H2O2(aq) = O2(g) + 2 H2O(l)
Etat initial x=0 n0 (H2O2)
en cours x
Etat final x = xmax
25/04/200808 2654475.doc 4/5
NOM : ................................................ Prénom : ................................................ Classe : TS5
25/04/200808 2654475.doc 5/5
You might also like
- Corrige Exercices Conductimetrie Feuille Travaux DirigesDocument3 pagesCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- Corrige Exercices Conductimetrie Feuille Travaux DirigesDocument3 pagesCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- Tagemage AnnalesDocument32 pagesTagemage AnnalespfservantNo ratings yet
- Corrige ENI GEIPI Physique 2009Document8 pagesCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisNo ratings yet
- Eni Geipi Physique 2009Document9 pagesEni Geipi Physique 2009la physique selon le programme FrançaisNo ratings yet
- Eni Geipi Physique 2009Document9 pagesEni Geipi Physique 2009la physique selon le programme FrançaisNo ratings yet
- ENI GEIPI Physique 2010Document9 pagesENI GEIPI Physique 2010la physique selon le programme FrançaisNo ratings yet
- 08 PhysMPDocument8 pages08 PhysMPla physique selon le programme FrançaisNo ratings yet
- Corrige ENI GEIPI Physique 2009Document8 pagesCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisNo ratings yet
- Corrige Geipi QCM 2006Document7 pagesCorrige Geipi QCM 2006la physique selon le programme FrançaisNo ratings yet
- Corrige Eni Geipi Sujet 1Document7 pagesCorrige Eni Geipi Sujet 1la physique selon le programme FrançaisNo ratings yet
- Corrige GEIPI Sujet 1Document9 pagesCorrige GEIPI Sujet 1la physique selon le programme FrançaisNo ratings yet
- Devoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)Document2 pagesDevoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)la physique selon le programme FrançaisNo ratings yet
- Cours ConductimetrieDocument8 pagesCours Conductimetrienico21du13No ratings yet
- Epreuve de Physique 2005 Concours D Admission Al ESSADocument4 pagesEpreuve de Physique 2005 Concours D Admission Al ESSAla physique selon le programme FrançaisNo ratings yet
- DS de Physique-Chimie N°3 Mercredi 10 Novembre 2010Document4 pagesDS de Physique-Chimie N°3 Mercredi 10 Novembre 2010la physique selon le programme Français100% (1)
- en Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10Document3 pagesen Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10la physique selon le programme FrançaisNo ratings yet
- Cond 02Document17 pagesCond 02la physique selon le programme FrançaisNo ratings yet
- Dusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 PtsDocument3 pagesDusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 Ptsla physique selon le programme FrançaisNo ratings yet
- 1s DST 3Document4 pages1s DST 3la physique selon le programme FrançaisNo ratings yet
- 2004 Specialite SujetsDocument54 pages2004 Specialite Sujetsla physique selon le programme FrançaisNo ratings yet
- S Physique Chimie Obligatoire 2010 Metropole SujetDocument10 pagesS Physique Chimie Obligatoire 2010 Metropole SujetTHT31No ratings yet
- 2010 Pondichery Exo1 Sujet Polonium 6ptsDocument2 pages2010 Pondichery Exo1 Sujet Polonium 6ptsla physique selon le programme FrançaisNo ratings yet
- S Physique Chimie Obligatoire 2010 Metropole SujetDocument10 pagesS Physique Chimie Obligatoire 2010 Metropole SujetTHT31No ratings yet
- 2010 Pondichery Exo1 Correction Polonium 6ptsDocument2 pages2010 Pondichery Exo1 Correction Polonium 6ptsla physique selon le programme FrançaisNo ratings yet
- 2010 Pondichery Exo2 Spe Correction Eugenol 4ptsDocument2 pages2010 Pondichery Exo2 Spe Correction Eugenol 4ptsla physique selon le programme FrançaisNo ratings yet
- 2010 Polynesie Spe Exo3 Correction AnanasDocument2 pages2010 Polynesie Spe Exo3 Correction Ananasla physique selon le programme FrançaisNo ratings yet
- 2010 Pondichery Exo2 Spe Sujet Eugenol 4ptsDocument4 pages2010 Pondichery Exo2 Spe Sujet Eugenol 4ptsla physique selon le programme FrançaisNo ratings yet
- 2010 Polynesie Spe Exo3 Sujet AnanasDocument4 pages2010 Polynesie Spe Exo3 Sujet Ananasla physique selon le programme FrançaisNo ratings yet
- Parkside PKS2000-4 (Tronçonneuse)Document20 pagesParkside PKS2000-4 (Tronçonneuse)Georges KouroussisNo ratings yet
- Economie IndustrielleDocument4 pagesEconomie IndustrielleLatifa HadekNo ratings yet
- Sicareme Assurances: Certificat D'Assurances Etudes + Stages POLICE #470.2020.00000049Document1 pageSicareme Assurances: Certificat D'Assurances Etudes + Stages POLICE #470.2020.00000049Aladine MardyNo ratings yet
- MR 258 Super5 4 5 9Document259 pagesMR 258 Super5 4 5 9Van Aster EricNo ratings yet
- 0709 ArduinoDocument6 pages0709 Arduinohamza ayecheNo ratings yet
- Exposé SVT Les Minerais A MadagascarDocument7 pagesExposé SVT Les Minerais A MadagascarJohan RaharisonNo ratings yet
- Justificatif LienDocument1 pageJustificatif Lienimmavillena0No ratings yet
- Cours n2Document4 pagesCours n2Sophie BarriereNo ratings yet
- Heyman - Measurement of The Influence of Lateral Earth PressureDocument5 pagesHeyman - Measurement of The Influence of Lateral Earth PressureMarcelaMarquesNo ratings yet
- Voie LactéeDocument34 pagesVoie Lactéejulian perezNo ratings yet
- Notice de Sécurité IncendieDocument114 pagesNotice de Sécurité IncendieYasser MeftouhNo ratings yet
- Inf302 TDDocument34 pagesInf302 TDRio LoboNo ratings yet
- 201 Coute - NR 4 2023Document68 pages201 Coute - NR 4 2023luNo ratings yet
- TD1 Me ÜmoiresDocument3 pagesTD1 Me ÜmoiresalaeelhassanyNo ratings yet
- La très petite entreprise (TPE) en AfriqueDocument8 pagesLa très petite entreprise (TPE) en Afriquetheodoreahoton1No ratings yet
- Les Figures de StyleDocument4 pagesLes Figures de StylemouadhNo ratings yet
- Blondel - La Religion. Le Problème de La MystiqueDocument40 pagesBlondel - La Religion. Le Problème de La MystiquemolinerNo ratings yet
- Techniques D'elevage Intensif Et D'alimentation de Poissons Et de CrustacesDocument19 pagesTechniques D'elevage Intensif Et D'alimentation de Poissons Et de CrustacesDao SouleymaneNo ratings yet
- Corrigé UE11 - DCG 2011Document17 pagesCorrigé UE11 - DCG 2011Med Reda BouasriaNo ratings yet
- 5analyse TypomorphologiqueDocument10 pages5analyse Typomorphologiqueyasmine bouheloufNo ratings yet
- Liste Des Variétés de PoiresDocument3 pagesListe Des Variétés de Poiresmohamedadjeb2001No ratings yet
- La Grammaire Des Premiers Temps V1 Reponses Corriges PDFDocument32 pagesLa Grammaire Des Premiers Temps V1 Reponses Corriges PDFadastraperalasporci100% (2)
- Rituel CBCS Pour Chevaliers Et EcuyersDocument94 pagesRituel CBCS Pour Chevaliers Et EcuyerskimonthNo ratings yet
- Chap2 Presentation Du CloudDocument16 pagesChap2 Presentation Du CloudImene Ben SalemNo ratings yet
- Expose Equipements de Production Tarek SenigraDocument5 pagesExpose Equipements de Production Tarek Senigratarek senigraNo ratings yet
- Projet 02. Séq 02. BOUSEKKINE Anfel 2Document25 pagesProjet 02. Séq 02. BOUSEKKINE Anfel 2Renda ReziguiNo ratings yet
- Facture Freemobile 20231230Document2 pagesFacture Freemobile 20231230ashwineuNo ratings yet
- Les 7 Étapes À Franchir Afin D'être Utile Et Profitable Pour Dieu - Le Blog ParolevivanteDocument12 pagesLes 7 Étapes À Franchir Afin D'être Utile Et Profitable Pour Dieu - Le Blog ParolevivanteEmmanu’EL “1CORTH2:5” MikamonaNo ratings yet
- 7.3.3 - Herminette - Rapport FinalDocument44 pages7.3.3 - Herminette - Rapport FinalMajdouline SeddikiNo ratings yet
- Matrice Multi CritèresDocument57 pagesMatrice Multi CritèresOthmane AouinatouNo ratings yet