Professional Documents
Culture Documents
Destilacion Intermitente
Uploaded by
Robert MarleyOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Destilacion Intermitente
Uploaded by
Robert MarleyCopyright:
Available Formats
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
Prctica 1
DESTILACION
INTERMITENTE
Materia: PROCESOS DE SEPARACION POR ETAPAS
Grupo: 3IM03
Profesor: CARLOS ORTIZ HERRRERA
Objetivo
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
Destilacin intermitente para separar los componentes de una mezcla binaria de agua y alcohol
de una composicin desconocida.
Comparar los datos empricos de composicin con los tericos que pronostican los balances de
materia de Lord Rayleigh.
Marco Terico
DESTILACION INTERMITENTE
Destilacin:
Operacin unitaria consistente en la separacin de los componentes de una mezcla basndose en la
diferencia entre la presin de vapor de stos. El vapor producido tiene una composicin ms rica en
componentes voltiles que el alimento.
Destilacin intermitente o diferencial:
Es un proceso mucho ms antiguo que la destilacin continua, fue desarrollada por primera vez para
concentrar el alcohol.
Operacin intermitente en la que la mezcla se calienta hasta su temperatura de burbuja,
comenzando la ebullicin, que se mantiene. El vapor se condensa y se recoge en forma de lquido. A
medida que se va evaporando el componente ms voltil la temperatura de ebullicin de la mezcla
va aumentando. Este proceso se mantiene hasta que se recoge una cantidad prefijada de destilado
o la composicin de residuo es la que buscbamos.
Supondremos que el alimento y el vapor generado estn en equilibrio dinmico y por tanto su
composicin variar continuamente. En una mezcla binaria tenemos el componente A (ms voltil)
y el B. La ebullicin comienza a la temperatura T1 obtenindose un vapor de composicin yA1
originado a partir de la mezcla de composicin en el componente ms voltil x A1. Al separarse esta
vapor la composicin del lquido se desplaza a la izquierda siguiendo la curva de equilibrio, y por
tanto aumenta la temperatura de ebullicin. Cuando la composicin del lquido residual es x A2 el
vapor originado tiene una composicin yA2, siendo la temperatura T2. El destilado recogido tiene una
composicin comprendida entre yA1 e yA2.
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
DESTILACION CONTINUA.Es un mtodo termodinmicamente eficiente para producir grandes cantidades de material de
composicin constante, cuando se requiere pequeas cantidades de material o composiciones
variables de producto, la destilacin intermitente tiene varias ventajas.
Destilacin Fraccionada.La destilacin fraccionada es un proceso fsico utilizado para separar mezclas de lquidos mediante
el calor, y con un amplio intercambio calrico y msico entre vapores y lquidos. Se emplea
principalmente cuando es necesario separar compuestos de sustancias con puntos de ebullicin
distintos pero cercanos.
La principal diferencia que tiene con la destilacin simple es el uso de una columna de
fraccionamiento. sta permite un mayor contacto entre los vapores que ascienden con el lquido
condensado que desciende, por la utilizacin de diferentes "platos" (placas). Esto facilita el
intercambio de calor entre los vapores (que ceden) y los lquidos (que reciben). Ese intercambio
produce un intercambio de masa, donde los lquidos con menor punto de ebullicin se convierten en
vapor, y los vapores de sustancias con mayor punto de ebullicin pasan al estado lquido.
Algunos de los ejemplos ms comunes son el petrleo, y la produccin de etanol.
Destilacin por arrastre de vapor. Es una tcnica aplicada en la separacin de
sustancias poco solubles en agua. La destilacin por arrastre de vapor se emplea para separar una
sustancia de una mezcla que posee un punto de ebullicin muy alto y que se descomponen al
destilar.
De otra manera, la destilacin por arrastre de vapor de agua se lleva a cabo la vaporizacin
selectiva del componente voltil de una mezcla formada por ste y otros "no voltiles". Lo anterior
se logra por medio de la inyeccin de vapor de agua directamente en el seno de la mezcla,
denominndose este "vapor de arrastre", pero en realidad su funcin no es la de "arrastrar" el
componente voltil, sino condensarse en el matraz formando otra fase inmiscible que ceder su
calor latente a la mezcla a destilar para lograr su evaporacin. En este caso se tendrn la presencia
de dos fases insolubles a lo largo de la destilacin (orgnica y acuosa), por lo tanto, cada lquido se
comportar como si el otro no estuviera presente. Es decir, cada uno de ellos ejercer su propia
presin de vapor y corresponder a la de un lquido puro a una temperatura de referencia.
DESTILACIN SIMPLE.La destilacin simple consiste en la separacin de uno o varios componentes de una mezcla lquida
cuyos puntos de ebullicin difieren entre s en un rango suficientemente marcado (al menos 25C) y
deben ser inferiores a 150C. El lquido a destilar se coloca en un matraz, para despus, mediante la
adicin de calor, impulsar la vaporizacin. Una vez establecido el equilibrio lquido-vapor, parte del
vapor se condensa en las paredes del matraz, pero el resto (mayora) pasa por la salida lateral, para
posteriormente condensarse por efecto del enfriamiento ocasionado por agua fra que circula por un
tubo refrigerante que forma parte del equipo en esta operacin. Al producto se le conoce
como destilado, mientras la porcin que queda dentro del matraz se denomina residuo.
Con la finalidad de evitar el sobrecalentamiento de los lquidos y ocasionar la posible
desnaturalizacin de compuestos de inters en la solucin, es importante adicionar ncleos de
ebullicin, que son partculas fsicas, inertes (generalmente perlas de vidrio), utilizadas para
fomentar la homogeneidad de la mezcla y mantener constante el ritmo de destilacin.
Ejemplos de sistemas tpicos en los que se aplica este tipo de destilacin:
- Sistema Butanol-Etanol
- Sistema Agua-Metanol
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
Graficas
Sistema ideal Etanol-Agua
Constantes de Antoine:
Etanol (A):
Agua (B):
A=5.33675
A=5.11564
B=1648.22
B=1687.537
C=230.918
C=230.17
PM=46
PM=18
PT = 585 mmHg= 0.77994 bar
Ecuacin de Antoine:
log 10 P i=A
B
C+ Temp
Calculando las temperaturas de ebullicin del metanol y agua usando la ecuacin de Antoine:
1648.22
230.918=71.803 C
( 5.33675log
( 0.77994 ) )
Teb A=
10
Teb B=
1687.537
230.17=92.89 C
( 5.11564log
( 0.77994 ) )
10
T (C)
71.803
72
74
76
78
80
82
84
86
88
90
92
92.89
PA (bar)
0.77995
0.78633
0.85368
0.92581
1.00297
1.08545
1.17352
1.26749
1.36764
1.47431
1.58780
1.70846
1.76455
PB (bar)
0.33672
0.33956
0.36952
0.40168
0.43616
0.47310
0.51264
0.55491
0.60007
0.64827
0.69966
0.75441
0.77990
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
Usando la ecuacin de Antoine para calcular la presin tanto del agua como del metanol a
diferentes temperaturas, usando:
( A
P i=10
B
)
C+T
Usando la ley de Raoult y de Dalton para obtener las composiciones fase liquida xi y la fase vapor
yi:
xi=
0.779936P B
P A P B
yi=
P Axi
0.77996
T (C)
PA (bar)
PB (bar)
xA
71.803
0.77995
0.33672
0.99998
72
0.78633
0.33956
0.98569
74
0.85368
0.36952
0.84769
76
0.92581
0.40168
0.72170
78
1.00297
0.43616
0.60651
80
1.08545
0.47310
0.50108
82
1.17352
0.51264
0.40446
84
1.26749
0.55491
0.31579
86
1.36764
0.60007
0.23433
88
1.47431
0.64827
0.15940
90
1.58780
0.69966
0.09039
92
1.70846
0.75441
0.02676
92.89
1.76455
0.77990
0.00004
yA
0.99999
0.99377
0.92784
0.85667
0.77995
0.69736
0.60856
0.51320
0.41091
0.30131
0.18402
0.05862
0.00010
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
Graficando:
xA vs yA
1.00000
0.90000
0.80000
0.70000
0.60000
yA
0.50000
0.40000
0.30000
0.20000
0.10000
0.00000
0.00000
0.20000
0.40000
xA
0.60000
0.80000
1.00000
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
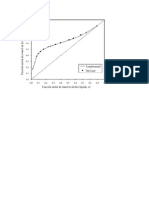
xA, yA vs Temperatura
95
90
85
xA
Temperatura (C)
yA
80
75
70
0.0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
xA , yA
ethanol-agua ( 585mmhg )
Datos Experimentales
corrid
a
inicial
T1
T2
T3
T4
T5
T6
T7
T8
T9
T10
T11
38
25
26
24
19
19
19
19
18
17
17
media
83
73
72
71
20
20
70
21
54
23
20
final
85
73
72
71
21
25
70
23
57
25
25
tiempo(m volumen
in)
(ml)
corrida
1
reflujo
destilado
densidad(gr/c
m^3)
temperatura(c)
composicion
x(w)
680
0.814
20
0.91
2
2
670
230
0.813
0.814
20
20
0.92
0.91
composicion
(n)
0.798245
614
0.818181
818
0.798245
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
XD
4
130
0.816
20
0.9
147
0.814
20
0.91
210
0.812
20.5
0.92
122
0.814
21
0.92
120
0.81
21
0.93
30000
0.973
25
0.15
2309
0.814
20
0.11
inicial xF
residuo
xW
614
0.778846
154
0.798245
614
0.818181
818
0.818181
818
0.838677
355
0.064593
301
0.046132
339
Clculos
PM etanol = 46
PM agua = 18
xF = (.15/46)/(.15/46)+(.85/18)= .0645
xD = (.91/46)/(.91/46)+(.09/18)= .798
xF = (.11/46)/(.11/46)+(.89/18)= .0461
Peso de la mezcla
PMD = (.798*46)+(.202*18) = 40.344
Los flujos molares.Balance en el condensador
V=L+D
L = V-D
L=440 cm ^3*
grmol/min
.814
L = 670-230 = 440 ml
gr
1 grmol
.
*
cm3
40.344 gr
= 8.877 grmol /2 min = 4.43
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
.813
V=670 cm ^3*
gr
1 grmol
.
*
cm 3
40.344 gr
= 13.501 grmol / 2 min = 6.75
grmol/min
D=230 cm ^3*
.814
gr
1 grmol
.
*
cm3
40.344 gr
= 4.64 grmol / 2 min = 2.32
grmol/min
Y = (L/V)x+(1-L/V)*xD
Y = (1-(4.43/6.75)(.798)) = 0.2733
Graficando por diagrama de McCabe-Thiele obtenemos: NET = 14
Y del equipo NPR = 16
NPR = (NET-1)/ Ef
Ef = ((NET-1)/NPR)*100
Ef = ((14-1)/16)*100 = 81.25 %
Balance global:
F= D + W
FxF = DxD + WxW W = F-D
Peso de la mezcla
PMF = (.06459*46) + (.93541*18) = 19.808
PMD = (.798*46) + (.202*18) = 40.344
F=30000 cm ^3*
D=230 cm ^3*
.973
.814
gr
1 grmol
.
cm 3 * 19.808 gr
gr
1 grmol
.
*
cm3
40.344 gr
= 1473.64 grmol
= 4.64 grmol
xw = (FxF-DxD)/ W
xw = (1473.64*.06459)-(4.64*.798)/(1473.64-4.64) = 0.06227
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica e Industrias
Extractivas
You might also like
- Eficiencia energética en las instalaciones de climatización en los edificios. ENAC0108From EverandEficiencia energética en las instalaciones de climatización en los edificios. ENAC0108No ratings yet
- Destilación intermitente: separación de agua y metanolDocument9 pagesDestilación intermitente: separación de agua y metanolDennis Gutierrez RiojaNo ratings yet
- Proyecto Final - Diseño de PlantasDocument72 pagesProyecto Final - Diseño de PlantasAlfalfa Nuevo HorizonteNo ratings yet
- Cuestionario Informe 4 de Calor 2Document1 pageCuestionario Informe 4 de Calor 2diegoradaf9100% (1)
- Practica Condensador VerticalDocument4 pagesPractica Condensador VerticalRivera Cervantes DavidNo ratings yet
- Diseño de SecadoresDocument19 pagesDiseño de SecadoresChilamBalamNo ratings yet
- LLLL Grafico Practica de DestilacionDocument10 pagesLLLL Grafico Practica de DestilacionSanchez Esquivel AlanNo ratings yet
- Practica 4 Potencial NormalDocument10 pagesPractica 4 Potencial NormalJonathan RamirezNo ratings yet
- Practica 8 para LlenarDocument11 pagesPractica 8 para LlenarMonserrat LópezNo ratings yet
- Problemas Diseño Intercambiadores Doble TuboDocument37 pagesProblemas Diseño Intercambiadores Doble TuboCami RodriguezNo ratings yet
- EXTRACCION LIQUIDO - LaboratorioDocument9 pagesEXTRACCION LIQUIDO - LaboratorioDaniel MurilloNo ratings yet
- Aislantes térmicosDocument51 pagesAislantes térmicosAlfredo NavarreteNo ratings yet
- Evaporador de Película AscendenteDocument2 pagesEvaporador de Película AscendenteSamara González GómezNo ratings yet
- Seminario MTBE y ETBEDocument25 pagesSeminario MTBE y ETBEcamila soto gonzalez100% (1)
- Proyecto Diseño de EquiposDocument9 pagesProyecto Diseño de EquiposEduardoQuirozCastilloNo ratings yet
- Flash MulticomponenteDocument8 pagesFlash MulticomponenteLuis Alejandro Chavero CamposNo ratings yet
- Reporte de prácticas de evaporador de simple efectoDocument57 pagesReporte de prácticas de evaporador de simple efectoeclipseazulNo ratings yet
- Cuestionario IntroDocument3 pagesCuestionario IntroFANYNo ratings yet
- Coeficiente de PelículaDocument2 pagesCoeficiente de PelículaCamiloEstradaNo ratings yet
- Diseño Termodinamico de Ic. Elmer Jiménez ÁlvarezDocument12 pagesDiseño Termodinamico de Ic. Elmer Jiménez ÁlvarezElmer Jimenez Alvarez100% (3)
- Separación de hexano y heptano por destilaciónDocument13 pagesSeparación de hexano y heptano por destilaciónLaura CruzNo ratings yet
- Reporte Estancia IndustrialDocument7 pagesReporte Estancia IndustrialmarianaNo ratings yet
- INSTITUTO POLITÉCNICO NACIONAL Tubos ConcentricosDocument23 pagesINSTITUTO POLITÉCNICO NACIONAL Tubos ConcentricosJavier Solano GaribayNo ratings yet
- El Proceso Catalítico Es Aquel Donde en Un Reacción Interviene Un Reactivo o MásDocument24 pagesEl Proceso Catalítico Es Aquel Donde en Un Reacción Interviene Un Reactivo o MásMar Silver LionNo ratings yet
- Practica 1 DestilacionDocument7 pagesPractica 1 DestilacionviannNo ratings yet
- EVAPORADORESDocument10 pagesEVAPORADORESAnthony Tapia CoariNo ratings yet
- Tarea3 - Identificación de Operaciones de SeparaciónDocument4 pagesTarea3 - Identificación de Operaciones de SeparaciónAxel Morales Piñón.No ratings yet
- Equipo 3 - Practica 2Document13 pagesEquipo 3 - Practica 2Luis Angel Castillo Ortiz100% (1)
- Circulacion NaturalDocument12 pagesCirculacion NaturalFANYNo ratings yet
- Tubos ConcentricosDocument19 pagesTubos ConcentricosPU3094100% (2)
- SeparacionDocument16 pagesSeparacionaniatilanoNo ratings yet
- Villa Morales Paola LAB1 PRQ3209Document18 pagesVilla Morales Paola LAB1 PRQ3209Paola Villa MoralesNo ratings yet
- Determinacion de La Difusividad MasicaDocument20 pagesDeterminacion de La Difusividad MasicaMARTHA ARPI MENDOZANo ratings yet
- Diseño de Reactores ElectroquimicosDocument18 pagesDiseño de Reactores Electroquimicosmaysilee-katnissNo ratings yet
- Columna PetlyukDocument6 pagesColumna PetlyukJaret WendolynNo ratings yet
- Evaporador triple efecto circulación naturalDocument10 pagesEvaporador triple efecto circulación naturaldiana040820140% (1)
- TC. P. Tubo HorizontalDocument3 pagesTC. P. Tubo HorizontalNancy ViridianaNo ratings yet
- Practica 3 Rectificación ContinuaDocument15 pagesPractica 3 Rectificación ContinuaKatia S GuillénNo ratings yet
- Torres empacadas: beneficios frente a columnas de destilaciónDocument24 pagesTorres empacadas: beneficios frente a columnas de destilaciónRoxanaTullumeNiquenNo ratings yet
- Practica 4 Laboratorio Integral IDocument15 pagesPractica 4 Laboratorio Integral IAgustínCamachoNo ratings yet
- CristalizaciónDocument47 pagesCristalizaciónYalmar Abrego Gutierrez100% (1)
- Cálculos Circulación Forzada - EsiqieDocument5 pagesCálculos Circulación Forzada - EsiqieOliverNo ratings yet
- UAMI13455Document2 pagesUAMI13455Jean SotoNo ratings yet
- Condensador VerticalDocument14 pagesCondensador VerticalJose Kalvin Rojas100% (1)
- Tema 3 IntercambiadoresDocument7 pagesTema 3 IntercambiadoresJHONATAN FRANCO MARULANDANo ratings yet
- Empaques: tipos y selecciónDocument4 pagesEmpaques: tipos y selecciónChantal AbigailNo ratings yet
- Practica 5 PEMDocument10 pagesPractica 5 PEMMario Rivas ValenciaNo ratings yet
- Evaporador doble efecto concentra jugoDocument9 pagesEvaporador doble efecto concentra jugoNayeli BecerrilNo ratings yet
- Tipos de CondensadoresDocument2 pagesTipos de CondensadoresAndrés Escorcia HerreraNo ratings yet
- Recuperación estaño hojalata proceso seco cloroDocument11 pagesRecuperación estaño hojalata proceso seco cloroWilde Huayhua PradaNo ratings yet
- CatalizadoresDocument10 pagesCatalizadoresAlfredo CervantesNo ratings yet
- Cuestionario Ips IntroducciónDocument4 pagesCuestionario Ips IntroducciónMonserrat LópezNo ratings yet
- Practica de Serpentin y CamisaDocument21 pagesPractica de Serpentin y CamisaholaNo ratings yet
- Reporte 4Document10 pagesReporte 4Luisa RodríguezNo ratings yet
- Destilación de mezcla binaria metanol-aguaDocument35 pagesDestilación de mezcla binaria metanol-aguaGuido HuertaNo ratings yet
- Practica II Determinacion de Lineas de EquilibrioDocument17 pagesPractica II Determinacion de Lineas de EquilibrioAdrian Lopez MNo ratings yet
- Reporte Tubos ConcentricosDocument13 pagesReporte Tubos ConcentricosYolandaNo ratings yet
- Intercambiador de Tubos y CorazaDocument17 pagesIntercambiador de Tubos y CorazaJoshúa BernáldezNo ratings yet
- Copia de 2 LabDocument24 pagesCopia de 2 Lab.....No ratings yet
- Métodos separación: Destilación Simple FraccionadaDocument8 pagesMétodos separación: Destilación Simple FraccionadaJunior ReyesNo ratings yet
- CócteleriaDocument42 pagesCócteleriaRobert MarleyNo ratings yet
- Estequiometria de La Comustion.Document7 pagesEstequiometria de La Comustion.Robert MarleyNo ratings yet
- Instrumentacion y ControlDocument136 pagesInstrumentacion y ControlAvelinusNo ratings yet
- Bombas CentrifugasDocument29 pagesBombas CentrifugasRobert MarleyNo ratings yet
- Normas API y ASME Aplicables A Equipos RotativosDocument1 pageNormas API y ASME Aplicables A Equipos Rotativostabiscari90% (10)
- Balance de MateriaDocument7 pagesBalance de MateriaWilliam Ramos PaucarNo ratings yet
- anaranjadoDeMetilo PDFDocument4 pagesanaranjadoDeMetilo PDFRobert MarleyNo ratings yet
- anaranjadoDeMetilo PDFDocument4 pagesanaranjadoDeMetilo PDFRobert MarleyNo ratings yet
- Normas de Fabricación Bombas ReciprocantesDocument7 pagesNormas de Fabricación Bombas ReciprocantesRobert MarleyNo ratings yet
- Procesos IIDocument114 pagesProcesos IILuis Gamarra VicuñaNo ratings yet
- Simulador Pro IiDocument32 pagesSimulador Pro IiRobert MarleyNo ratings yet
- Balance Con ReaccionDocument40 pagesBalance Con ReaccionRobert Marley90% (21)
- Destilacion IntermitenteDocument10 pagesDestilacion IntermitenteRobert MarleyNo ratings yet
- Resin AsDocument5 pagesResin AsRobert MarleyNo ratings yet
- 03-19-319-CL41 Medición de Estática de Fluido en TanquesDocument8 pages03-19-319-CL41 Medición de Estática de Fluido en Tanqueslolo_123456No ratings yet
- Guía de cableado estructuradoDocument20 pagesGuía de cableado estructuradoBrayam Stiven Figueroa Ramirez100% (1)
- FORMA 3 Gabrila Jordan MartinezDocument3 pagesFORMA 3 Gabrila Jordan MartinezgustavoagsNo ratings yet
- Técnicas - Trabajo de EquipoDocument17 pagesTécnicas - Trabajo de EquipoAstrip100% (15)
- Arterias PulsosDocument4 pagesArterias PulsosEstrella AnchilloNo ratings yet
- 604720t0028e (Capitulo 3) R1-Eett Pci Detalle Tecnico Exigido para Pci e HidranteDocument30 pages604720t0028e (Capitulo 3) R1-Eett Pci Detalle Tecnico Exigido para Pci e HidranteFabian Ramirez InsfranNo ratings yet
- Examen de Física MRU, MRUV y Tiro VerticalDocument1 pageExamen de Física MRU, MRUV y Tiro VerticalKevinNo ratings yet
- Auditoria de Cumplimiento A La MPHZ - 2019Document118 pagesAuditoria de Cumplimiento A La MPHZ - 2019Ricky RickNo ratings yet
- DS N°40 de 2012 MMA RSEIA PDFDocument105 pagesDS N°40 de 2012 MMA RSEIA PDFjavdelapenaNo ratings yet
- Desarrollo de Capacidades Fundamentales en Ciencias Naturales - MayoDocument2 pagesDesarrollo de Capacidades Fundamentales en Ciencias Naturales - Mayojose pantaleoNo ratings yet
- Modulo 3Document19 pagesModulo 3Abner Abisai Bonilla LopezNo ratings yet
- Instalar Canaima 3Document18 pagesInstalar Canaima 3Kevin Gabriel Cisnero AlvaradoNo ratings yet
- 12 Pip Menor Trocha CarrozableDocument23 pages12 Pip Menor Trocha CarrozableJorge RenattoNo ratings yet
- Laboratorio Desgaste Máquina de Los AngelesDocument11 pagesLaboratorio Desgaste Máquina de Los AngelesDUBERNEY RAMOS MONTEALEGRENo ratings yet
- Eje LocoDocument1 pageEje LocoAngelo Torres TerrerosNo ratings yet
- SRAMDocument12 pagesSRAMque buenoNo ratings yet
- Sesion de Apresndizaje de CT 3° AB 4 de OCTUBREDocument6 pagesSesion de Apresndizaje de CT 3° AB 4 de OCTUBREYliceo Gonzales ÑaupariNo ratings yet
- 4R70W Gran Marquis PDFDocument285 pages4R70W Gran Marquis PDFRichard Medrano Almaraz67% (9)
- Anexo 1 Informe 5to Secundaria DPCCDocument4 pagesAnexo 1 Informe 5to Secundaria DPCCWAYI TUSHUYNo ratings yet
- Cómo tratar hematomas y moretonesDocument4 pagesCómo tratar hematomas y moretonesKevin Andres Briñez RodriguezNo ratings yet
- Con Sabor A ColombiaDocument4 pagesCon Sabor A ColombiajoselvserenoNo ratings yet
- Calculo Dosificacion PDFDocument33 pagesCalculo Dosificacion PDFcarlos delgadoNo ratings yet
- Diligencia de Levantamiento de CadáverDocument9 pagesDiligencia de Levantamiento de CadáverRodrigo AlcaNo ratings yet
- Caso Clinico EscleritisDocument5 pagesCaso Clinico EscleritislauraNo ratings yet
- DESGLOSSAMENTDocument3 pagesDESGLOSSAMENTLucía López PeralNo ratings yet
- SEO060209C93 SAi 00093355 ASO141209F25Document1 pageSEO060209C93 SAi 00093355 ASO141209F25Ashley Elizabeth Urías IribeNo ratings yet
- S8 Francisco Gonzalez PDFDocument17 pagesS8 Francisco Gonzalez PDFGabriel J. González CáceresNo ratings yet
- AsesoriaDocument3 pagesAsesoriaJazmin Parí quispeNo ratings yet
- ESTUDIO ORGANIZACIÓN Y ASPECTOS LEGALESDocument83 pagesESTUDIO ORGANIZACIÓN Y ASPECTOS LEGALESMelvinDonaldoLopez100% (1)
- Manual de Uso: True-Rms Remote Display Digital MultimeterDocument54 pagesManual de Uso: True-Rms Remote Display Digital MultimeterManuel FuentesNo ratings yet