Professional Documents
Culture Documents
Modelo Atómico de Bohr
Uploaded by
Roberto Laguna0 ratings0% found this document useful (0 votes)
778 views5 pagesModelo atomica
Original Title
modelo atómico de bohr
Copyright
© Attribution Non-Commercial (BY-NC)
Available Formats
DOC, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentModelo atomica
Copyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
778 views5 pagesModelo Atómico de Bohr
Uploaded by
Roberto LagunaModelo atomica
Copyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as DOC, PDF, TXT or read online from Scribd
You are on page 1of 5
UNIVERSIDAD NACIONAL AUTÓNOMA DE
MÉXICO
colegio de ciencias y humanidades
plantel: Vallejo
Física 3
Contreras Ávalos Julio cesar
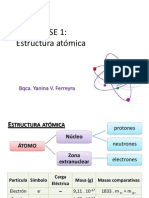
MODELO ATÓMICO DE BOHR
E l físico danés Niels Bohr (Premio Nobel de Física
1922), postuló que los electrones giran a grandes
velocidades alrededor del núcleo atómico. En ese
caso, los electrones se disponen en diversas órbitas
circulares, las cuales determinan diferentes niveles
de energía.
Bohr se basó en el átomo de hidrógeno para realizar
el modelo que lleva su nombre. Bohr intentaba
realizar un modelo atómico capaz de explicar la
estabilidad de la materia y los espectros de emisión
y absorción discretos que se observan en los gases.
Su modelo está basado en los siguientes
postulados:
El átomo de hidrógeno consta de un núcleo (+) y a
su alrededor gira en forma circular un electrón (-), de
tal manera que la fuerza centrífuga contrarreste la
fuerza de atracción electrostática.
El electrón sólo gira en determinadas órbitas de
radios definidos, llamados también niveles
cuantificados de energía.
Mientras los electrones permanezcan en un mismo
nivel de energía (llamados estados estacionarios
por Bohr) no ganan ni pierden energía.
Un electrón puede cambiar de un nivel a otro dentro
de un mismo átomo ganando o perdiendo una
cantidad de energía igual a la diferencia existente
entre ambos estados. De este modo, todo cambio
energético del electrón corresponderá a saltos que
haga entre los estados estacionarios.
Un átomo sólo emite energía cuando un electrón
salta de un nivel de energía superior a otro inferior y
absorbe energía en caso contrario. La energía
emitida o absorbida por el átomo recibe el nombre
de fotón o cuanto de luz.
Los átomos de gases calientes emiten y absorben
luz a ciertas longitudes de onda.
En el gráfico de la izquierda, se demuestran tres
espectros de emisión y uno de absorción.
Bohr llegó a establecer una ecuación que
permitió calcular la energía potencial de cada
nivel energético del átomo de hidrógeno,
tomando en cuenta factores como la masa y la
carga eléctrica del electrón. En dicha ecuación
se representa al nivel de energía mediante una
letra “n” a la que se le da el nombre de número
cuántico principal y que distingue a los
niveles de energía. Así, a cada uno de los
diferentes niveles de energía le corresponderá
un determinado valor “n”. Estos valores son
números enteros (1, 2, 3, 4, etc.).
Los átomos de los elementos más grandes que se
conocen actualmente tienen un máximo de 7 niveles
y, por ello, el valor máximo de “n” para esos es 7.
Bohr relaciona, así, los estados estacionarios 1, 2, 3,
4, etc., con las llamadas capas electrónicas K, L, M,
N, O, P y Q, y estableció que el número máximo de
electrones de una órbita o nivel de energía “n” era
igual a 2n2.
Niels Bohr logró explicar, gracias a su modelo, las
líneas espectrales del átomo de H; con el tiempo su
teoría sufrió muchas modificaciones, pero le cabe el
mérito de haber orientado las investigaciones
posteriores al fundar la mecánica cuántica.
You might also like
- Parcelador QuimicaDocument10 pagesParcelador QuimicaIngrid Rueda JaimesNo ratings yet
- Modelo Atómico de DaltonDocument3 pagesModelo Atómico de DaltonRicardo MrtnezNo ratings yet
- Modelo Mecánico Cuántico Del ÁtomoDocument8 pagesModelo Mecánico Cuántico Del ÁtomoDaniel Sopla CubasNo ratings yet
- Explicacion Tabla PeriódicaDocument5 pagesExplicacion Tabla PeriódicaJose Luis Astargo Cataldo100% (1)
- Historia Del AtomoDocument2 pagesHistoria Del AtomoMarianne Lorduy NaycirNo ratings yet
- Estructura Atomica - Química IDocument6 pagesEstructura Atomica - Química IAnonymous qmwoKAf0% (1)
- Enlace Iónico y CovalenteDocument2 pagesEnlace Iónico y CovalenteanaNo ratings yet
- Apuntes de Fisica Clasica y ModernaDocument25 pagesApuntes de Fisica Clasica y ModernahidalgusNo ratings yet
- El MovimientoDocument2 pagesEl Movimientonatalia villarroelNo ratings yet
- Actividades Tabla Periodica V1Document5 pagesActividades Tabla Periodica V1Yiham BonillaNo ratings yet
- Sustancia PuraDocument4 pagesSustancia PuraL Manuel CruzNo ratings yet
- El Modelo Atómico de DaltonDocument6 pagesEl Modelo Atómico de DaltonOrtiz WilliamNo ratings yet
- Mapa Conceptual de Todos Los Temas de QuimicaDocument4 pagesMapa Conceptual de Todos Los Temas de QuimicaChino LoqiyoNo ratings yet
- Tabla Periodica 2020 PDFDocument44 pagesTabla Periodica 2020 PDFShey LagladNo ratings yet
- Estructura de Lewis, y Enlaces Actividad 15,16,17Document9 pagesEstructura de Lewis, y Enlaces Actividad 15,16,17LUISNo ratings yet
- Guia Estructura AtómicaDocument2 pagesGuia Estructura AtómicaalsaapaNo ratings yet
- Número Atómico y Número MásicoDocument2 pagesNúmero Atómico y Número Másicoemersson peralta buitragoNo ratings yet
- Examen FinalDocument5 pagesExamen FinalManuel Jose Sandoval UrízarNo ratings yet
- EnlacesQuímicosDocument12 pagesEnlacesQuímicosFranz CaliNo ratings yet
- Practica 2Document19 pagesPractica 2Javier VGNo ratings yet
- Unidad III Química IDocument8 pagesUnidad III Química IGracielaNo ratings yet
- Modelo Atómico de RutherfordDocument3 pagesModelo Atómico de RutherfordAnónimo AnónimoNo ratings yet
- Estructura átomo carga eléctricaDocument3 pagesEstructura átomo carga eléctricaGenessis BlancoNo ratings yet
- Estructura AtómicaDocument45 pagesEstructura AtómicaprofesorcienciaslabNo ratings yet
- Modelos atómicos evolucionanDocument33 pagesModelos atómicos evolucionanMaría Del Carmen MarcíaNo ratings yet
- Modelo Atómico de SommerfeldDocument2 pagesModelo Atómico de SommerfeldRoberto SilvestreNo ratings yet
- Preinforme - Velocidad Media e Instantanea.Document4 pagesPreinforme - Velocidad Media e Instantanea.Julian VelezNo ratings yet
- Los Números CuánticosDocument3 pagesLos Números CuánticosRuth SanchezNo ratings yet
- Glosario de Física 2 de SecundariaDocument6 pagesGlosario de Física 2 de SecundariaIvan SCNo ratings yet
- Biologia - 5to AñoDocument28 pagesBiologia - 5to AñoHender Iker Llauce ChapoñanNo ratings yet
- Teoría Cuántica BaseDocument16 pagesTeoría Cuántica BaseBetty Arroyo CarroNo ratings yet
- Física AtómicaDocument5 pagesFísica AtómicaMartín SanzNo ratings yet
- Estructura átomo radiactividadDocument46 pagesEstructura átomo radiactividadDiego AmarisNo ratings yet
- Energía de Ionización y Afinidad ElectrónicaDocument15 pagesEnergía de Ionización y Afinidad ElectrónicaChispa Atómica0% (1)
- Modelos AtomicosDocument10 pagesModelos AtomicosNico GonzaNo ratings yet
- Radio Atomico PDFDocument2 pagesRadio Atomico PDFjames rvNo ratings yet
- Qué Son Los Modelos AtómicosDocument4 pagesQué Son Los Modelos Atómicosdavid lopez0% (1)
- GEOMETRÍA DE LAS MOLÉCULAS COVALENTES-ActividadesDocument4 pagesGEOMETRÍA DE LAS MOLÉCULAS COVALENTES-ActividadesAntonioGonzalezNo ratings yet
- Espectros atómicos y radiación electromagnéticaDocument11 pagesEspectros atómicos y radiación electromagnéticaRubenNo ratings yet
- Teoría atómica: del átomo griego a la física cuánticaDocument2 pagesTeoría atómica: del átomo griego a la física cuánticaRony MeCa0% (1)
- Guia Orbitales AtomicosDocument3 pagesGuia Orbitales AtomicosjessicawiederholdNo ratings yet
- Modelos atómicos: evolución histórica desde Demócrito a SchrödingerDocument6 pagesModelos atómicos: evolución histórica desde Demócrito a SchrödingerjustmealexanderNo ratings yet
- Enunciados Ejercicios Enlace Quimico QuimitubeDocument14 pagesEnunciados Ejercicios Enlace Quimico QuimitubePonchito GrajalesNo ratings yet
- Conceptos Básicos de Los Enlaces QuímicosDocument39 pagesConceptos Básicos de Los Enlaces QuímicosAlexander Rojas67% (3)
- Crucigrama átomo electrón neutron protonDocument1 pageCrucigrama átomo electrón neutron protonHypatia HurtadoNo ratings yet
- ÁtomosDocument3 pagesÁtomosdiegoNo ratings yet
- Guía Simulador Modelo Atómico de RutherfordDocument4 pagesGuía Simulador Modelo Atómico de RutherfordSebastian Matheus Londono MoralesNo ratings yet
- EL AtomoDocument6 pagesEL Atomovere100% (1)
- Protocolo de Las Reacciones de Oxido Reducción en La PlataDocument8 pagesProtocolo de Las Reacciones de Oxido Reducción en La PlataGabriela Corona TorresNo ratings yet
- Clase 7 Electricidad I Carga Eléctrica y Electricidad EstáticaDocument31 pagesClase 7 Electricidad I Carga Eléctrica y Electricidad EstáticaCamila AntoniaNo ratings yet
- Clasificacion de Los Nucleidos Tema 2Document7 pagesClasificacion de Los Nucleidos Tema 2Renato YacilaNo ratings yet
- Material de Estudio 1. Revisión de Estructura Atómica v3Document8 pagesMaterial de Estudio 1. Revisión de Estructura Atómica v3maga_azulNo ratings yet
- Taller 1-Ley de Coulomb y Superposición de Fuerzas.Document4 pagesTaller 1-Ley de Coulomb y Superposición de Fuerzas.DANIEL MAURICIO MENDIVELSO PERDOMONo ratings yet
- Configuración electrónicaDocument13 pagesConfiguración electrónicaKarenNo ratings yet
- Modelos Atómicos - Metales - No Metales - Metaloides y Elementos Quimicos y Configuracion Electronica PDFDocument27 pagesModelos Atómicos - Metales - No Metales - Metaloides y Elementos Quimicos y Configuracion Electronica PDFshadiaNo ratings yet
- Bohr y La Mecánica CuánticaDocument5 pagesBohr y La Mecánica CuánticaNabil RamírezNo ratings yet
- Modelos AtomicosDocument4 pagesModelos AtomicosLissette Espinoza MoralesNo ratings yet
- Quimica 1Document5 pagesQuimica 1Andres CodenaNo ratings yet
- Modelo Atómico de BohrDocument3 pagesModelo Atómico de Bohrdccg1112No ratings yet
- Modelo Atomico de BohrDocument2 pagesModelo Atomico de Bohrkarina matus santiagoNo ratings yet
- Primera Ley de La ElectrostáticaDocument2 pagesPrimera Ley de La ElectrostáticaRoberto Laguna60% (5)
- Electromagnetism oDocument2 pagesElectromagnetism oRoberto LagunaNo ratings yet
- Viva MéxicoDocument7 pagesViva MéxicoRoberto LagunaNo ratings yet
- Presentación 1 SagitarioDocument10 pagesPresentación 1 SagitarioRoberto LagunaNo ratings yet
- PerseusDocument14 pagesPerseusRoberto LagunaNo ratings yet
- Promovamos La DemocraciaDocument5 pagesPromovamos La DemocraciaRoberto LagunaNo ratings yet
- Libro de Los SueñosDocument252 pagesLibro de Los SueñosRoberto Laguna100% (2)
- Presentacion FisicaDocument10 pagesPresentacion FisicaRoberto LagunaNo ratings yet
- Sagitario ConstelaciónDocument14 pagesSagitario ConstelaciónRoberto LagunaNo ratings yet
- Presentación1 CONSTELACION LYRADocument12 pagesPresentación1 CONSTELACION LYRARoberto LagunaNo ratings yet
- Presentacion OrionDocument8 pagesPresentacion OrionRoberto LagunaNo ratings yet
- PISCISDocument12 pagesPISCISRoberto LagunaNo ratings yet
- Exposicion FisicaDocument10 pagesExposicion FisicaRoberto LagunaNo ratings yet
- La Nueva Presentacion de La Constelacion de CancerDocument9 pagesLa Nueva Presentacion de La Constelacion de CancerRoberto LagunaNo ratings yet
- Piscis, ConstelaciónDocument6 pagesPiscis, ConstelaciónRoberto LagunaNo ratings yet
- Cpnstelacion de Tauro El ToroDocument8 pagesCpnstelacion de Tauro El ToroRoberto LagunaNo ratings yet
- Perseo, ConstelaciónDocument10 pagesPerseo, ConstelaciónRoberto LagunaNo ratings yet
- La Constelación Del Perro MenorDocument13 pagesLa Constelación Del Perro MenorRoberto LagunaNo ratings yet
- Dragon, ConstelaciónDocument13 pagesDragon, ConstelaciónRoberto Laguna100% (1)
- Fisica Constelacion Lince.. Tarea.... !!!Document9 pagesFisica Constelacion Lince.. Tarea.... !!!Roberto LagunaNo ratings yet
- EscorpioDocument8 pagesEscorpioRoberto LagunaNo ratings yet
- Fisica Cosntelacion VirgoDocument8 pagesFisica Cosntelacion VirgoRoberto LagunaNo ratings yet
- EridanozDocument10 pagesEridanozRoberto LagunaNo ratings yet
- DRACODocument12 pagesDRACORoberto LagunaNo ratings yet
- El TriánguloDocument8 pagesEl TriánguloRoberto LagunaNo ratings yet
- ConstelacionDocument11 pagesConstelacionRoberto LagunaNo ratings yet
- Eduardo CepheusDocument6 pagesEduardo CepheusRoberto LagunaNo ratings yet
- Constelación VirgoDocument7 pagesConstelación VirgoRoberto LagunaNo ratings yet
- ConstelacionesDocument12 pagesConstelacionesRoberto LagunaNo ratings yet
- Constelación Serpiente (Fisica)Document9 pagesConstelación Serpiente (Fisica)Roberto LagunaNo ratings yet
- EC - FSAipecr011 Matriz Gestión de Riesgos Seguridad Retroexcavadoras Versión 002Document2 pagesEC - FSAipecr011 Matriz Gestión de Riesgos Seguridad Retroexcavadoras Versión 002carlos montoyaNo ratings yet
- Ejemplos de Propiedades IntensivasDocument4 pagesEjemplos de Propiedades IntensivasmarcorenxNo ratings yet
- Problemas de Física Iv Primer ParcialDocument16 pagesProblemas de Física Iv Primer ParcialLeslie LewisNo ratings yet
- Medidores de Flujo: Sonar vs Magnético para Hidrociclón en Planta ConcentradoraDocument6 pagesMedidores de Flujo: Sonar vs Magnético para Hidrociclón en Planta ConcentradoraJuan Manuel Fernandez MarcialNo ratings yet
- Informe de Concreto AditivoDocument44 pagesInforme de Concreto AditivoDanny RVNo ratings yet
- Quiz Mru G10Document3 pagesQuiz Mru G10Bernardo Correa0% (1)
- El Líquido Presenta Una Resistencia A Ser Atravesado FisiaaaaaaaaaaaaaaaaaaaaaaaaaaaDocument5 pagesEl Líquido Presenta Una Resistencia A Ser Atravesado FisiaaaaaaaaaaaaaaaaaaaaaaaaaaaIndira MelissaNo ratings yet
- Topografía general: instrumentos, métodos de levantamiento y replanteoDocument118 pagesTopografía general: instrumentos, métodos de levantamiento y replanteoJhan Marco Cabello ChaconNo ratings yet
- Transmisiones FlexiblesDocument9 pagesTransmisiones FlexiblesMichelly Jiménez0% (1)
- Preservando memorias con fotografíaDocument27 pagesPreservando memorias con fotografíaAlberto Cuevas MartínezNo ratings yet
- 776NTC PDFDocument13 pages776NTC PDFmarco caicedoNo ratings yet
- Catálog GoodfellowDocument155 pagesCatálog GoodfellowHelmutNolteNo ratings yet
- Límites de Atterberg y plasticidad de los suelos arcillososDocument28 pagesLímites de Atterberg y plasticidad de los suelos arcillososNicole Saucedo FarellNo ratings yet
- C-9 Intercambiadores de CalorDocument27 pagesC-9 Intercambiadores de CalorStewart SeguraNo ratings yet
- Análisis Circuitos BásicosDocument3 pagesAnálisis Circuitos BásicosJose Luis Arnedo Gonzalez0% (1)
- Sistemas RedoxDocument9 pagesSistemas RedoxCamila100% (1)
- Movimiento de ProyectilesDocument9 pagesMovimiento de ProyectilesAracely ParedesNo ratings yet
- 35 Trabajos de Soldadura ElectricaDocument2 pages35 Trabajos de Soldadura ElectricacharlsmagniNo ratings yet
- Clase 1 Estructura AtómicaDocument19 pagesClase 1 Estructura AtómicaAlexia Ayelén Durán ManzanelliNo ratings yet
- Matriz Varianza - Docx 2Document5 pagesMatriz Varianza - Docx 2Altagracia MLNo ratings yet
- Diseño de Vigas de Cimentación VCDocument5 pagesDiseño de Vigas de Cimentación VCMarco Flores ZuñigaNo ratings yet
- Laboratorio de AutotranformadoresDocument3 pagesLaboratorio de AutotranformadoresMariaFernandaOchoaBermudezNo ratings yet
- Informe Laboratorio Medidas de Masa y VolumenDocument4 pagesInforme Laboratorio Medidas de Masa y VolumenAldairMoralesNo ratings yet
- Sintesis y Analisis de Una Sal de Mohr Lu y PDRDocument10 pagesSintesis y Analisis de Una Sal de Mohr Lu y PDRAngelo MolinaNo ratings yet
- La gravimetría y sus fundamentosDocument79 pagesLa gravimetría y sus fundamentosYami Baudelaire100% (1)
- 05MEYE511 (Circuitos Magnéticos)Document6 pages05MEYE511 (Circuitos Magnéticos)ZEFER87No ratings yet
- Reporte Practica #5 Determinación de La Masa Molar de Un Líquido Volátil Por El Método de Las Presiones ParcialesDocument3 pagesReporte Practica #5 Determinación de La Masa Molar de Un Líquido Volátil Por El Método de Las Presiones ParcialesFelipeMarinNo ratings yet
- S1 Clase 3 Potencias en Los Circuitos ACDocument16 pagesS1 Clase 3 Potencias en Los Circuitos ACrbaideNo ratings yet
- Sintesis 5,5 DifenilhidantoínaDocument5 pagesSintesis 5,5 DifenilhidantoínaAdrian Quintanilla100% (1)
- La Producción de Sonido en Flauta TraversaDocument2 pagesLa Producción de Sonido en Flauta TraversaGabriel BuzakyNo ratings yet