Professional Documents
Culture Documents
Resumen Amina
Uploaded by
MonickCazaresCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Resumen Amina
Uploaded by
MonickCazaresCopyright:
Available Formats
RESUMEN
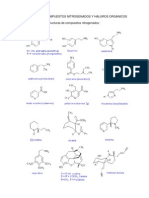
En la prctica del laboratorio se identificaron los aspectos ms representativos de las
aminas, mediante procesos, como lo son la hidrolisis de la urea en solucin alcalina; la
solubilidad en ter, basicidad de las aminas, el ensayo con cloruro frrico, y dos pruebas
adicionales, la formacin de hidrocloruros junto con la formacin de sulfatos. Cada una
nos permiti analizar las propiedades fsicas y qumicas de la aminas, como identificarlas y
cuales son reacciones tpicas.
Las aminas pueden suponerse formalmente como derivados del amoniaco, en el que se ha
sustituido uno, dos o los tres tomos de hidrgeno por radicales hidrocarbonados. Las
aminas son empleadas para la elaboracin de caucho sinttico y colorante. Son parte de los
alcaloides, compuestos complejos que se encuentran en las plantas. Algunas aminas son
biolgicamente importantes como la adrenalina y la noradrenalina. Las aminas secundarias
que se encuentran en las carnes y los pescados o en el humo del tabaco. En conclusin tiene
una gran gama de aplicaciones.
7.1 HIDROLISIS DE LA UREA EN SOLUCIN ALCALINA
La hidrlisis bsica de las amidas produce una sal de cido orgnico y amonaco o aminas,
segn el tipo de amida. Nos damos cuenta que el producto fue una amina al ver el color que
toma el papel filtro con sulfato cprico, ya que las aminas forman complejos coloreados
frente a sales de cobre (II) como el sulfato cprico, en este caso el papel se torn azulado.
La hidrlisis alcalina de una amida con a una solucin acuosa de hidrxido de sodio, puede
verificarse por aparicin del olor caracterstico del amonaco formado. Adems la presencia
de ese gas puede hacerse en la boca del tubo con un papel impregnado en sulfato cprico.
El amonaco forma un complejo azul con el cobre (II) en el papel que se encuentra en la
boca del tubo.
CO(NH2)2 (s) + 2NaOH <---> Na2CO3 + 2NH3 (g)
La hidrolisis de una amida (urea) en medio bsico forma una sal. Se llama hidrlisis a una
reaccin cido-base entre una sustancia, tpicamente una sal, y el agua. Esta reaccin es
importante por el gran nmero de contextos en los que el agua acta como disolvente.
Tambin se aplica a algunas reacciones cido-base en las que participa el agua y se rompe
un enlace covalente. Al ser disueltos en agua, los iones constituyentes de una sal se
combinan con los iones hidroxilo, OH-. Dichos iones proceden de la disociacin o
autoprotlisis del agua. Esto produce un desplazamiento del equilibrio de disociacin del
agua y como consecuencia se modifica el valor del pH.
La urea es ligeramente bsica debido a la interaccin entre el doble enlace carbonlico y el
par de electrones del tomo de nitrgeno: la carga positiva parcial que resulta sobre el
tomo de nitrgeno disminuye muchsimo su basicidad y la protonacin de las amidas, que
solo tiene lugar en condiciones fuertemente cidas, que ocurre sobre el tomo de oxgeno.
Por tanto, la urea reacciona con hidrxido de sodio, una base sumamente fuerte, formando
gas amoniaco y la respectiva sal: carbonato de sodio.
7.2. SOLUBILIDAD EN ETER
Una de las aminas ms importantes es la anilina, la amina aromtica ms sencilla, es
un lquido incoloro, soluble en disolventes orgnicos y ligeramente en agua.
La trietilamina como las aminas son bastantes solubles en ter por ser de
polaridades similares.
La urea se solubiliz completamente en agua y en ter debido a que es una sustancia
de bajo peso molecular y en cuya estructura molecular incluye oxgeno y nitrgeno.
Adems, al ser una molcula polar puede formar puentes de hidrgeno con el agua.
Las aminas son solubles en disolventes menos polares, como ter, ya que estos
compuestos orgnicos son compuestos polares, lo que se le facilita la disolucin en
solventes semejantes en cuanto a la polaridad.
7.4. ENSAYO CON CLORURO FERRRICO
Un ensayo muy eficaz para diferenciar un ster de otros compuestos neutros consiste en
tratarlo con hidroxilamina y cloruro frrico. La hidroxilamina reacciona con el ster como
lo hara una amina, para dar una amina hidroxilada. Esta forma un complejo de
coordinacin coloreado con cloruro frrico, cuando se observa el color purpura
caracterstico de este complejo solo puede proceder de un ster.
R-CO-OR +NH2OH R-CO-NH-OH + ROH
FeCl3
Complejo coloreado
En principio una amida podra haberse intercambiado para dar este tipo de derivado pero
las amidas son menos reactivas y en las condiciones del ensayo la interconversin no
ocurre. Tanto las amidas como los nitrilos pueden experimentar esta reaccin, pero solo
bajo condiciones ms drsticas.
You might also like
- Identificación de Grupos FuncionalesDocument13 pagesIdentificación de Grupos Funcionaleskeyla O´brienNo ratings yet
- Funciones oxigenadas: éteres, ésteres y aldehídosDocument26 pagesFunciones oxigenadas: éteres, ésteres y aldehídosJasmin VegaNo ratings yet
- 7 Éteres y Compuestos AzufradosDocument43 pages7 Éteres y Compuestos AzufradosAlejandra zamoraNo ratings yet
- Preparación de AlumbreDocument8 pagesPreparación de AlumbreKATHERINE LISET ORTIZ PATERNINA ESTUDIANTE ACTIVO100% (1)
- AMINASDocument7 pagesAMINAS_elsebasNo ratings yet
- Qui MicaDocument3 pagesQui MicaCarlos YagualNo ratings yet
- Propiedades y métodos de obtención de compuestos nitrogenados y haluros orgánicosDocument11 pagesPropiedades y métodos de obtención de compuestos nitrogenados y haluros orgánicosAngelica SorianoNo ratings yet
- Organica - Informe 1.2Document11 pagesOrganica - Informe 1.2Danna Gamarra CastroNo ratings yet
- FENOLESDocument6 pagesFENOLESaciferri13No ratings yet
- Ácidos Organicos e InorganicosDocument10 pagesÁcidos Organicos e InorganicosDiego SamirNo ratings yet
- Informe 10 Prueba de Caracterización de AminasDocument6 pagesInforme 10 Prueba de Caracterización de AminasCamila Caicedo Navia100% (1)
- Alcoholes y Fenoles Practica de Laboratorio de Quimica OrganicaDocument13 pagesAlcoholes y Fenoles Practica de Laboratorio de Quimica OrganicaKeila Castellano charrasquielNo ratings yet
- Reporte 7 de Laboratorio de Química Orgánica IIDocument19 pagesReporte 7 de Laboratorio de Química Orgánica IIManuel Medina PazNo ratings yet
- La BiodiversidadDocument8 pagesLa BiodiversidadTATIANA PONCENo ratings yet
- Guia 15 Grupos FuncionalesDocument14 pagesGuia 15 Grupos FuncionalesNataly Neira GuzmánNo ratings yet
- 4.-Identificacion de AlcoholesDocument13 pages4.-Identificacion de AlcoholesAurora Esperanza Rojas Huaroto100% (2)
- Pruebas de Caracterización de Acidos Carboxilicos y DerivadosDocument6 pagesPruebas de Caracterización de Acidos Carboxilicos y DerivadosJcNo ratings yet
- Cuadro ComparaticoDocument2 pagesCuadro ComparaticoMarceline Áerys Pledge60% (5)
- Obtención de acetato de isoamiloDocument4 pagesObtención de acetato de isoamiloWeimar Ortiz BarrientosNo ratings yet
- Aldehidos y Cetonas Lab de Orga 2019Document44 pagesAldehidos y Cetonas Lab de Orga 2019erizoNo ratings yet
- Obtención Del Acetato de IsoamiloDocument14 pagesObtención Del Acetato de IsoamiloCarlosNo ratings yet
- Pruebas alcoholes fenolesDocument10 pagesPruebas alcoholes fenolesCesar Ricardo ZuñigaNo ratings yet
- Informe de Laboratorio Universidad Del Cauca - AminasDocument9 pagesInforme de Laboratorio Universidad Del Cauca - AminasValentina BbenavidesNo ratings yet
- AmidaDocument13 pagesAmidaDerby NovoaNo ratings yet
- N°10 - HalógenosDocument8 pagesN°10 - HalógenosFabiana Gonzales JaureguiNo ratings yet
- Bitacora 5Document4 pagesBitacora 5Sara Vertel BenitezNo ratings yet
- AsdfghjDocument5 pagesAsdfghjAngie Chura MariacaNo ratings yet
- Monografía Sobre El AmoniacoDocument10 pagesMonografía Sobre El AmoniacoNazzly RubioNo ratings yet
- Acidos Carboxilicos. Síntesis de AcetanilidaDocument8 pagesAcidos Carboxilicos. Síntesis de AcetanilidaAlbertAlbertParedesNo ratings yet
- Compuestos Oxigenados BiologiaDocument15 pagesCompuestos Oxigenados BiologiaNatali Tarqui BarrionuevoNo ratings yet
- Ácidos y Bases PDFDocument30 pagesÁcidos y Bases PDFCharbel AbouNo ratings yet
- Informe N°1-Propiedades Fisicas y Quimicas de Alcoholes y FenolesDocument20 pagesInforme N°1-Propiedades Fisicas y Quimicas de Alcoholes y FenolesJesus100% (3)
- Analisis Organico CualitativoDocument7 pagesAnalisis Organico CualitativoHolman SanabriaNo ratings yet
- AMIDAS (Autoguardado)Document12 pagesAMIDAS (Autoguardado)Hector ChonaNo ratings yet
- QUÍMICA ORGÁNICA: CARACTERÍSTICAS DE LOS ALCOHOLESDocument48 pagesQUÍMICA ORGÁNICA: CARACTERÍSTICAS DE LOS ALCOHOLESEsme Santiago Moreno95% (19)
- AMINASDocument7 pagesAMINASJuan RealesNo ratings yet
- Quimica N° 07Document19 pagesQuimica N° 07Junior K. Gomez HuamaniNo ratings yet
- Ing industrias alim obti alcoholesDocument22 pagesIng industrias alim obti alcoholesJunior Perez CorisNo ratings yet
- AlumbreDocument49 pagesAlumbreczar11780% (5)
- Lab HidrocarburosDocument10 pagesLab HidrocarburosLucero PinedoNo ratings yet
- AlcoholesDocument12 pagesAlcoholesAndy LezametaNo ratings yet
- Practica 07Document23 pagesPractica 07Boris Anthony Coveñas LunaNo ratings yet
- Informe 5. AlcoholesDocument7 pagesInforme 5. AlcoholesAdriana MilenaNo ratings yet
- Caracterización de aminas orgánicasDocument9 pagesCaracterización de aminas orgánicasLisbeth CabezasNo ratings yet
- QUIMICA INORGANICA .-Clase IIDocument41 pagesQUIMICA INORGANICA .-Clase IINieve PerezNo ratings yet
- GUIA 2 EteresDocument6 pagesGUIA 2 Eteresyoxandra vasquezNo ratings yet
- Alcoholes, fenoles y éteresDocument8 pagesAlcoholes, fenoles y éteresLiesel Gonzalez PerezNo ratings yet
- Éteres y alcoholes. Propiedades químicas y nomenclaturaDocument20 pagesÉteres y alcoholes. Propiedades químicas y nomenclaturaLuis C VegaNo ratings yet
- En Primera Instancia Es para Hacer Llegar Mis Saludos Cordiales Hacia SuDocument10 pagesEn Primera Instancia Es para Hacer Llegar Mis Saludos Cordiales Hacia Susoloidx5758No ratings yet
- IntroducciónDocument16 pagesIntroducciónMary GuerraNo ratings yet
- Grupos Funcionales: Propiedades y Reacciones de Alcoholes, Aldehídos, Cetonas y másDocument4 pagesGrupos Funcionales: Propiedades y Reacciones de Alcoholes, Aldehídos, Cetonas y másAguirre AndrezNo ratings yet
- Derivados de Ácidos Carboxílicos1Document23 pagesDerivados de Ácidos Carboxílicos1Magda PMNo ratings yet
- QuimicaDocument2 pagesQuimica0232120032 VICTORIA ZULUAGA RAIGOSA ESTUDIANTE ACTIVONo ratings yet
- Amidas: origen, propiedades y usosDocument41 pagesAmidas: origen, propiedades y usosNatalyPomaPerezNo ratings yet
- Informe N 1 Propiedades Fisicas y Quimicas de Alcoholes y FenolesDocument20 pagesInforme N 1 Propiedades Fisicas y Quimicas de Alcoholes y FenolesChristian AyalaNo ratings yet
- Oxidos, Sales, Acidos y BasesDocument18 pagesOxidos, Sales, Acidos y BasesHarold Ivan Niño CuevasNo ratings yet
- Aldehídos y CetonasDocument33 pagesAldehídos y CetonasSergio Andrés ArizaNo ratings yet
- Análisis de Resultados Fuerzas ParalelasDocument2 pagesAnálisis de Resultados Fuerzas ParalelasMonickCazaresNo ratings yet
- Quimica OrganicaDocument16 pagesQuimica OrganicaMonickCazaresNo ratings yet
- Destilación Por Arrastre de VaporDocument10 pagesDestilación Por Arrastre de VaporMonickCazaresNo ratings yet
- Taller Biologia FundamentalDocument13 pagesTaller Biologia FundamentalMonickCazaresNo ratings yet
- Ficha Técnica NUTRIMAC MANUALDocument2 pagesFicha Técnica NUTRIMAC MANUALJeisson Lluen MontanoNo ratings yet
- Minería Metálica y No MetálicaDocument53 pagesMinería Metálica y No MetálicaJesus Abraham Navarro GonzalesNo ratings yet
- Experimento Sobre Obtención de Una Sal en El LaboratorioDocument10 pagesExperimento Sobre Obtención de Una Sal en El LaboratorioAstri RimonNo ratings yet
- Determinación Por El Método de Permanganato de Potasio12Document6 pagesDeterminación Por El Método de Permanganato de Potasio12Luis FdNo ratings yet
- Curvas de PolarizacionDocument8 pagesCurvas de PolarizacionRichard Gonzalo YtoNo ratings yet
- Normas Técnicas Peruanas - JoyeríaDocument5 pagesNormas Técnicas Peruanas - JoyeríaFedor CorzanoNo ratings yet
- Tarea 5 To 13 CyaDocument1 pageTarea 5 To 13 CyaInteligencia Comercial InternacionalNo ratings yet
- 1.2 Estequiometria Calculos 1Document2 pages1.2 Estequiometria Calculos 1ibcNo ratings yet
- Colada de AceroDocument17 pagesColada de AceroDanielle KaufmanNo ratings yet
- Clase Practica de La Unidad GavimetriaDocument2 pagesClase Practica de La Unidad Gavimetriajavier gagoNo ratings yet
- Soluciones Examen Tema 1. Teoría Atómico-MolecularDocument4 pagesSoluciones Examen Tema 1. Teoría Atómico-MolecularMarisa MarisaNo ratings yet
- Fundación de Trabajadores de La Siderurgia Integral PDFDocument58 pagesFundación de Trabajadores de La Siderurgia Integral PDFlm5734No ratings yet
- Tipos de Materiales Usados en La Fabricación de EquiposDocument6 pagesTipos de Materiales Usados en La Fabricación de Equiposketty sheila yari lozano100% (1)
- Practica de SoldaduraDocument5 pagesPractica de SoldaduraOmar Adrian Sanchez GonzalezNo ratings yet
- Marco Teorico Enlace QuimicoDocument10 pagesMarco Teorico Enlace QuimicoRosa Flor Huaroc ArhuisNo ratings yet
- Metalizado ElectroquimicoDocument45 pagesMetalizado ElectroquimicoOscarJavier100% (4)
- Segundo Simulacro Fisica y Quimica 2019Document2 pagesSegundo Simulacro Fisica y Quimica 2019Olga CarbajalNo ratings yet
- Catalogo ALUMICASA, S.A. 2017 Láminas AluminioDocument5 pagesCatalogo ALUMICASA, S.A. 2017 Láminas Aluminiocontador123No ratings yet
- Tuberia de PerforaciónDocument2 pagesTuberia de PerforaciónKarina PrietoNo ratings yet
- El convertidor Bessemer y el proceso de producción de aceroDocument17 pagesEl convertidor Bessemer y el proceso de producción de aceroVíctor SandovskyNo ratings yet
- Obturacion Del Sistema de Conductos Radiculares UnDocument158 pagesObturacion Del Sistema de Conductos Radiculares UnAlan Mateo Escobar AgudeloNo ratings yet
- 1° Grupo - Funciones Químicas OrgánicasDocument32 pages1° Grupo - Funciones Químicas OrgánicasEder Rosales PonteNo ratings yet
- Reciclaje y Refinamiento Del AluminioDocument5 pagesReciclaje y Refinamiento Del AluminioJose HidalgoNo ratings yet
- Diapositivas Materiales de IngenieriaDocument20 pagesDiapositivas Materiales de Ingenieriadebbie tatiana blanco plazasNo ratings yet
- Corrosion en SPTDocument12 pagesCorrosion en SPTbautista_tNo ratings yet
- Mini-Resumen QuimicaDocument8 pagesMini-Resumen QuimicaBernardita EspinozaNo ratings yet
- FT Seaweed ExtractDocument1 pageFT Seaweed ExtractGodofredo BosmedianoNo ratings yet
- Capítulo VIII - EjerciciosDocument3 pagesCapítulo VIII - EjerciciosSergio RamosNo ratings yet
- Libro IPNI WebDocument50 pagesLibro IPNI WebArmando Vázquez MancillaNo ratings yet