Professional Documents
Culture Documents
Adsorción de Gibbs
Uploaded by
vaneCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Adsorción de Gibbs
Uploaded by
vaneCopyright:
Available Formats
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
1.-INTRODUCCIN:
En fsica se denomina tensin superficial de un lquido a la cantidad de energa
necesaria para aumentar su superficie por unidad de rea. Esta definicin implica
que el lquido tiene una resistencia para aumentar su superficie. Este efecto
permite a algunos insectos, como el zapatero (Gerris lacustris), desplazarse por la
superficie del agua sin hundirse. La tensin superficial (una manifestacin de las
fuerzas intermoleculares en los lquidos), junto a las fuerzas que se dan entre los
lquidos y las superficies slidas que entran en contacto con ellos, da lugar a la
capilaridad.
A nivel microscpico, la tensin superficial se debe a que las fuerzas que afectan a
cada molcula son diferentes en el interior del lquido y en la superficie. As, en el
seno de un lquido cada molcula est sometida a fuerzas de atraccin que en
promedio se anulan. Esto permite que la molcula tenga una energa bastante
baja. Sin embargo, en la superficie hay una fuerza neta hacia el interior del lquido.
Rigurosamente, si en el exterior del lquido se tiene un gas, existir una mnima
fuerza atractiva hacia el exterior, aunque en la realidad esta fuerza es despreciable
debido a la gran diferencia de densidades entre el lquido y el gas.
Otra manera de verlo es que una molcula en contacto con su vecina est en un
estado menor de energa que si no estuviera en contacto con dicha vecina. Las
molculas interiores tienen todas las molculas vecinas que podran tener, pero
las partculas del contorno tienen menos partculas vecinas que las interiores y por
eso tienen un estado ms alto de energa. Para el lquido, el disminuir su estado
energtico, es minimizar el nmero de partculas en su superficie.
Energticamente, las molculas situadas en la superficie tiene una mayor energa
promedio que las situadas en el interior, por lo tanto la tendencia del sistema ser
disminuir la energa total, y ello se logra disminuyendo el nmero de molculas
situadas en la superficie, de ah la reduccin de rea hasta el mnimo posible.
Isoterma de Gibbs es una ecuacin que se podra considerar adsorcin isoterma
que conecta tensin de superficie de una solucin con la concentracin del soluto.
Las sustancias pueden tener diversos efectos en la tensin de superficie:
Ningn efecto, por ejemplo azcar
Aumento de la tensin de superficie, sales inorgnicas
PRACTICA: ADSORCION DE GIBBS
Pgina 1
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
Disminuya la tensin de superficie progresivamente, alcoholes
No disminuya la tensin de superficie y, una vez que se alcance un mnimo,
no ms de efecto: surfactantes
A partir de la consideracin de equilibrio termodinmico, Josiah Willard Gibbs
probado que la tensin de superficie y la concentracin estn ligadas a travs
concentracin superficial, , representa el exceso del soluto por el rea de unidad
de la superficie sobre cul sera presente si la concentracin a granel prevaleci
hasta el final a la superficie, l puede ser positivo, negativa o cero.
Tiene unidades de mol/m 2. En la derivacin de la ecuacin se asume que la
solucin es ideal, (tan = o + RTlnC) y la concentracin de la superficie del
solvente es cero, as que es solamente inferior vlido estas asunciones. Tambin
se considera que el interfaz es bidimensional, que no es modelos verdaderos,
posteriores como Guggenheim corrige este defecto.
OBJETIVO: Estudio de la adsorcin del fenol en los sistemas agua-aire.
DESARROLLO EXPERIMENTAL
MATERIALES:
6 vasos de precipitados 50 ml
1 Pinza Mohr
1 Aparato Otto Steinbach
REACTIVOS:
Soluciones de Fenol al 0.05, 0.1, 0.2, 0.3, 0.4, y 0.5 M
PROCEDIMIENTO
En un vaso de precipitados colocamos 35 ml de agua destilada
Sumergir el capilar de aparato a 2 cm.
Llenar el embudo de separacin con agua de la llave y cerrar el sistema
con la pinza Mohr.
PRACTICA: ADSORCION DE GIBBS
Pgina 2
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
Se abre la llave del embudo hasta que empiece el burbujeo en el capilar.
Se toma la lectura de diferencia de altura en el manmetro, si no se
estabiliza es seal de fuga as que se debe eliminar.
Repetir el experimento desde el paso 1 con las soluciones de fenol,
comenzando con la de menor concentracin.
RESULTADOS EXPERIMENTALES
DIAMETRO DEL CAPILAR
Para calcular el dimetro del capilar utilizamos una sustancia de tensin superficial
conocida como el agua (= 72.8 dn/cm), mediante la siguiente ecuacin:
r=
2
g( H man prob h)
152( 1)
978
2(78.2)
r=
CALCULO DE LA TENSIN SUPERFICIAL
r g (H man prob h)
2
Concentracin (M)
Densidad g/ml
H (cm)
0,05
14,1
65,01
0,1
1,021
14
64,24
0,2
1,03
13,9
63,61
0,3
1,035
13,4
60,87
PRACTICA: ADSORCION DE GIBBS
Pgina 3
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
0,4
1,042
12,1
53,81
0,5
1,049
9,5
39,76
Concentracion Molar
CALCULAR
d
dC
Para calcular
d
dC
se interpolan en la curva valores de concentracin antes y
despus de cada valor de concentracin conocido en la curva y as obtener d .
Se calcula con la siguiente frmula
C d
(
)
RT dC
Dnde de R esta dada cmo
PRACTICA: ADSORCION DE GIBBS
Pgina 4
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
dC
1.44 * 10-
0,05
0,1
0,2
0,3
0,4
0,5
-1,2
-1
-1,1
-1,2
-1
-1
0,02
0,02
0,02
0,02
0,02
0,02
10
2.40*10-9
5.29*10-9
8.15*10-9
9.62*10-9
1.2*10-8
Vs C
f(x) = 0x - 0
R = 0.98
Linear ()
Concentracin
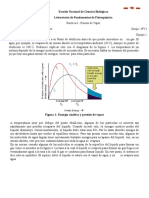
DISCUSIN
En la grafica de concentracin molar no sali muy bien debido a problemas con el
aparato, lo que se observo fue que con los datos obtenidos se observa como la
tensin superficial disminuye al aumentar la concentracin de soluto, mientras
que la concentracin superficial en exceso es positiva, lo que nos indica que el
soluto es un Tenso activo, es decir prefiere acumularse en la interfase.
PRACTICA: ADSORCION DE GIBBS
Pgina 5
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
Al graficar r/c nos sali una lnea recta definida no fue tanto problema con la
ecuacin que ahora mostramos
=
C d
(
)
RT dC
La ecuacin de Langmuir es usada en este caso y si se cumple, es el caso de
nuestro experimento hubo algunos errores debidos a los equipos utilizados por ello
no es muy acorde a la tendencia esperada,
En la derivada nos damos cuenta que el fenol es una sustancia tenso activa ya
que es menor a 0, y la tensin superficial es positiva, lo cual nos indica que hay
mayor cantidad de la sustancia en la superficie que en el total del volumen de la
solucin.
CONCLUSION:
En conclusin la tensin superficial en el lquido es una manifestacin de las
fuerzas intermoleculares, junto a las fuerzas que se dan entre los lquidos y las
superficies slidas que entran en contacto con ellos, da lugar a la capilaridad.
A nivel microscpico, la tensin superficial se debe a que las fuerzas que afectan a
cada molcula son diferentes en el interior del lquido y en la superficie.
El fenol es una sustancia tensoctiva adsorbida por el agua en este caso.
La ecuacin de Languor se cumple en esta prctica.
BIBLIOGRAFIA:
Guerasimov, Y. A. (1970), Curso de Qumica Fsica. Edit. Mir Mosc.
PRACTICA: ADSORCION DE GIBBS
Pgina 6
INSTITUTO POLITCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLGICAS
PRACTICA: ADSORCION DE GIBBS
Pgina 7
You might also like
- Adsorción de GibbsDocument5 pagesAdsorción de GibbsLuis Eduardo Berumen CoronadoNo ratings yet
- Practica 9 FQ Adsorción de Gibbs.Document4 pagesPractica 9 FQ Adsorción de Gibbs.Miriam NavaNo ratings yet
- Practica 4Document8 pagesPractica 4Evelyn Jim 3295No ratings yet
- Cromatografia Por AdsorcionDocument3 pagesCromatografia Por AdsorcionLi ClementeNo ratings yet
- Practica 2 Fisico Quimicos Influencia de Temperatura en La Velocidad de ReaccionDocument5 pagesPractica 2 Fisico Quimicos Influencia de Temperatura en La Velocidad de ReaccionDiego Roesch0% (1)
- Laboratorio de Físicoquimica - Practica 10Document11 pagesLaboratorio de Físicoquimica - Practica 10Cesar SuarezNo ratings yet
- Practica 8 Adsorcion 1Document3 pagesPractica 8 Adsorcion 1jk0% (3)
- Practica Adsorcion 1Document4 pagesPractica Adsorcion 1Tann MoralesNo ratings yet
- Practica 4. CromatografiaDocument4 pagesPractica 4. CromatografiaSxann0% (1)
- Número de Electrones Involucrados en La ReacciónDocument5 pagesNúmero de Electrones Involucrados en La ReacciónLalo TolentinoNo ratings yet
- Medicion de PH y Capacidad ReguladoraDocument5 pagesMedicion de PH y Capacidad ReguladoraManuel SalinasNo ratings yet
- Carbohidratos y Acidos OrganicosDocument5 pagesCarbohidratos y Acidos OrganicosLalo Tolentino100% (1)
- Practica 7 Reporte - Velocidad de ReaccionDocument10 pagesPractica 7 Reporte - Velocidad de ReaccionBlackPork540% (1)
- Determinacion de RiboflavinaDocument4 pagesDeterminacion de Riboflavinaalan50% (2)
- Practica de Capacidad CalorificaDocument11 pagesPractica de Capacidad CalorificaArmando Darien Santiago100% (1)
- Balance de Masa en Un Reactor QuímicoDocument8 pagesBalance de Masa en Un Reactor QuímicoKaren Pao Chikita100% (2)
- Reactor Quimico Practica No. 3Document6 pagesReactor Quimico Practica No. 3Jordan Josue Torres100% (1)
- Separacion de FosfolipidosDocument2 pagesSeparacion de Fosfolipidosfcbarcelona-08hotmail.comNo ratings yet
- Practica 6 Energia de Las Reacciones QuimicasDocument4 pagesPractica 6 Energia de Las Reacciones QuimicasLuis AngelNo ratings yet
- Ejercios Tecnicas Electroanaliticas V.paredesDocument5 pagesEjercios Tecnicas Electroanaliticas V.paredesCristian MartínezNo ratings yet
- Aislamiento y caracterización de DNA vegetal mediante espectrofotometría y cromatografíaDocument3 pagesAislamiento y caracterización de DNA vegetal mediante espectrofotometría y cromatografíafcbarcelona-08hotmail.comNo ratings yet
- ANÁLISIS ESPECTROFOTOMÉTRICO DE UN SISTEMA MÚLTIPLE CompletoDocument9 pagesANÁLISIS ESPECTROFOTOMÉTRICO DE UN SISTEMA MÚLTIPLE CompletoHoldair AndradeNo ratings yet
- Practica HuevoDocument3 pagesPractica HuevoHectorNo ratings yet
- Práctica No. 14 "Biodegradación de Plaguicidas Por Microorganismos Del Suelo".Document7 pagesPráctica No. 14 "Biodegradación de Plaguicidas Por Microorganismos Del Suelo".David Ramírez100% (1)
- Determinación Espectrofotométrica Del Pka de Un ColoranteDocument22 pagesDeterminación Espectrofotométrica Del Pka de Un ColoranteAriadna GarcíaNo ratings yet
- Sistema MultipleDocument10 pagesSistema MultipleGabriel López100% (1)
- Fisicoquimica Practica 1Document8 pagesFisicoquimica Practica 1monicaNo ratings yet
- Utilización de Carbohidratos y Ácidos Orgánicos ReporticusDocument8 pagesUtilización de Carbohidratos y Ácidos Orgánicos ReporticusDenise RangelNo ratings yet
- Cuestionario 1Document2 pagesCuestionario 1Iraiz VelazquezNo ratings yet
- Efecto del pH y concentración en la fluorescencia de la riboflavinaDocument6 pagesEfecto del pH y concentración en la fluorescencia de la riboflavinaHector100% (1)
- Practica 8. Identificación y Cuantificación de Especies Alcalinas.Document4 pagesPractica 8. Identificación y Cuantificación de Especies Alcalinas.Ivan0% (3)
- Inhibicion y SustratoDocument3 pagesInhibicion y SustratoYara HernandezNo ratings yet
- Transporte de Glucosa en LevadurasDocument18 pagesTransporte de Glucosa en LevadurasDenise RangelNo ratings yet
- Determinación de colesterol en yema de huevoDocument2 pagesDeterminación de colesterol en yema de huevoGuerrillaScribdNo ratings yet
- Aislamiento de Dna PlasmídicoDocument2 pagesAislamiento de Dna PlasmídicoGuillermo CasillasNo ratings yet
- Practica. Purifificacion Parcial de Lisozima de Clara de HuevoDocument16 pagesPractica. Purifificacion Parcial de Lisozima de Clara de HuevoReymundo Segura100% (1)
- Determinación de Riboflavina Por FluorometriaDocument3 pagesDeterminación de Riboflavina Por FluorometriaLaLoo Flores CruzNo ratings yet
- Curvas3 0Document2 pagesCurvas3 0Tuistwer GoparNo ratings yet
- Efecto de Concentración de Sustrato e Inhibición Enzimática.Document2 pagesEfecto de Concentración de Sustrato e Inhibición Enzimática.H VandortNo ratings yet
- Bioquimica Efecto PH y EnzDocument3 pagesBioquimica Efecto PH y EnzGuerrillaScribdNo ratings yet
- Practica 8. - Presion de VaporDocument11 pagesPractica 8. - Presion de VaporJohn Víctor33% (3)
- Reacciones enzimáticas redox SDH y Citocromo C oxidasaDocument6 pagesReacciones enzimáticas redox SDH y Citocromo C oxidasaRubén Serrato CondeNo ratings yet
- Práctica 1 - Transporte de Glucosa en Levaduras Seccion 2Document38 pagesPráctica 1 - Transporte de Glucosa en Levaduras Seccion 2Tania Karen Rodriguez GarciaNo ratings yet
- Práctica 10 FisicoquimicaDocument11 pagesPráctica 10 FisicoquimicaBelenNo ratings yet
- Práctica 4. Adsorción II.Document4 pagesPráctica 4. Adsorción II.Gibran Meza Castrejon100% (1)
- Reaccion de AminoácidosDocument2 pagesReaccion de AminoácidosGonzalo UribeNo ratings yet
- Separación de Una Mezcla de Azul de Metileno y Fluoresceína Usando Cromatografía Por Adsorción.Document6 pagesSeparación de Una Mezcla de Azul de Metileno y Fluoresceína Usando Cromatografía Por Adsorción.Jose Manuel Miranda OnofreNo ratings yet
- Bioquìmica ENCB DNA VegetalDocument3 pagesBioquìmica ENCB DNA VegetalDioney TellezNo ratings yet
- Practica 8 Propiedades ColigativasDocument5 pagesPractica 8 Propiedades ColigativasBlackPork54No ratings yet
- Aislamiento de Dna PlasmídicoDocument3 pagesAislamiento de Dna Plasmídicoluis3felipe3lara3ortNo ratings yet
- Cinética Química Práctica FisicoquímicaDocument3 pagesCinética Química Práctica FisicoquímicaLilu Wrathe Tempest100% (1)
- Reporte de Practica 4 Quimica Organica - ENCB-RecristalizaciónDocument4 pagesReporte de Practica 4 Quimica Organica - ENCB-RecristalizaciónLilu Wrathe TempestNo ratings yet
- DnaDocument2 pagesDnaSteele-GreyNo ratings yet
- Síntesis de Cloruro de Ter-ButiloDocument16 pagesSíntesis de Cloruro de Ter-ButiloKimberly TorresNo ratings yet
- Práctica 5.4 Efecto de La Temperatura Sobre La Velocidad de Reacción de La InvertasaDocument3 pagesPráctica 5.4 Efecto de La Temperatura Sobre La Velocidad de Reacción de La InvertasaEvelyn Jim 3295No ratings yet
- Tensión superficial: Factores y mediciónDocument9 pagesTensión superficial: Factores y mediciónIVAN DANIEL CANCHALANo ratings yet
- Adsorción IIDocument2 pagesAdsorción IIJDahmerNo ratings yet
- Informe de Tension Superficial Labo de Fisica IIDocument20 pagesInforme de Tension Superficial Labo de Fisica IIFrancisco FG0% (1)
- Tensión SuperficialDocument7 pagesTensión SuperficialHiroaki DarkNo ratings yet
- Reporte Practica 2Document7 pagesReporte Practica 2cristopher alan jimenez betancourtNo ratings yet
- Práctica de MasaDocument3 pagesPráctica de MasavaneNo ratings yet
- Materias PrimasDocument4 pagesMaterias PrimasvaneNo ratings yet
- Materias PrimasDocument4 pagesMaterias PrimasvaneNo ratings yet
- Costos de Inscripción al Congreso de Ingeniería BioquímicaDocument2 pagesCostos de Inscripción al Congreso de Ingeniería BioquímicavaneNo ratings yet
- Torres de Contacto Gas LíquidoDocument12 pagesTorres de Contacto Gas LíquidovaneNo ratings yet
- Práctica 10 - Destilación DiferencialDocument14 pagesPráctica 10 - Destilación DiferencialRaul Hinostroza TenorioNo ratings yet
- Destilación SimpleDocument12 pagesDestilación SimplevaneNo ratings yet
- Destilación DiferencialDocument4 pagesDestilación DiferencialvaneNo ratings yet
- Práctica 10 - Destilación DiferencialDocument14 pagesPráctica 10 - Destilación DiferencialRaul Hinostroza TenorioNo ratings yet
- Práctica 10 - Destilación DiferencialDocument14 pagesPráctica 10 - Destilación DiferencialRaul Hinostroza TenorioNo ratings yet
- Torres de Contacto Gas LíquidoDocument12 pagesTorres de Contacto Gas LíquidovaneNo ratings yet
- Tiempo de MezcladoDocument12 pagesTiempo de MezcladovaneNo ratings yet
- Separación de Una Mezcla de Azul de MetilenoDocument8 pagesSeparación de Una Mezcla de Azul de MetilenovaneNo ratings yet
- Proyecto IluminaciónDocument36 pagesProyecto IluminaciónvaneNo ratings yet
- GlobalizaciónDocument3 pagesGlobalizaciónvaneNo ratings yet
- Separación de Una Mezcla de Azul de MetilenoDocument8 pagesSeparación de Una Mezcla de Azul de MetilenovaneNo ratings yet
- Clasificación de Los IntercambiadoresDocument13 pagesClasificación de Los IntercambiadoresvaneNo ratings yet
- Recombinación GenéticaDocument9 pagesRecombinación GenéticavaneNo ratings yet
- Tratamiento preliminar y capacidad intercambio iónicoDocument3 pagesTratamiento preliminar y capacidad intercambio iónicovane100% (1)
- Principales Productores de Mermelada Dentro Del Ambito NacionalDocument4 pagesPrincipales Productores de Mermelada Dentro Del Ambito NacionalvaneNo ratings yet
- Retorno de InversiónDocument9 pagesRetorno de InversiónvaneNo ratings yet
- Balance de FermentaciónDocument12 pagesBalance de FermentaciónvaneNo ratings yet
- Balance de FermentaciónDocument12 pagesBalance de FermentaciónvaneNo ratings yet
- Separación de Una Mezcla de Azul de MetilenoDocument8 pagesSeparación de Una Mezcla de Azul de MetilenovaneNo ratings yet
- Practica de LecheDocument10 pagesPractica de LechevaneNo ratings yet
- Separación e Identificación de Aminoácidos de Jugos de FrutosDocument11 pagesSeparación e Identificación de Aminoácidos de Jugos de FrutosvaneNo ratings yet
- Programavendedor JStudioDocument7 pagesProgramavendedor JStudioAnyela AponzaNo ratings yet
- Uml PresentacionDocument71 pagesUml PresentacionNelson Rodriguez PalaciosNo ratings yet
- Concurso Fiscalía - Acuerdo No. 001 de 2021Document31 pagesConcurso Fiscalía - Acuerdo No. 001 de 2021Ronald Rincon SalgadoNo ratings yet
- 4° Grado Experiencia - 7Document10 pages4° Grado Experiencia - 7alejandro guzman valverdeNo ratings yet
- Estrategias Promocionales Hotel TRS Cap CanaDocument2 pagesEstrategias Promocionales Hotel TRS Cap Canaeva mar reyesNo ratings yet
- Burdge y VanclayDocument21 pagesBurdge y VanclayImmunotec PeruNo ratings yet
- Bolein Isabella 1Document1 pageBolein Isabella 1David Fernandez GuerreroNo ratings yet
- Estabilidad Estática y Dinámica del AviónDocument5 pagesEstabilidad Estática y Dinámica del AviónGuillermo MartínezNo ratings yet
- Psico Organización DisgregadoraDocument2 pagesPsico Organización Disgregadorarita de menendez50% (2)
- 4 - Tdr. Maestro de ObraDocument3 pages4 - Tdr. Maestro de ObraDenis Rolan Gutierrez Barrientos100% (1)
- Philosophia Vulgaris 16Document29 pagesPhilosophia Vulgaris 16Federico CaivanoNo ratings yet
- BELARÚSDocument214 pagesBELARÚSejgarciacabralNo ratings yet
- Mora Eps SanitasDocument2 pagesMora Eps SanitasAdriana Liceth G ANo ratings yet
- TE-Calentamiento Global y Acidificación de Los OcéanosDocument29 pagesTE-Calentamiento Global y Acidificación de Los OcéanosLeysi Pasache GonzalesNo ratings yet
- Funciones del lenguaje en titulares de prensa chichaDocument8 pagesFunciones del lenguaje en titulares de prensa chichaArEl PANo ratings yet
- El Origen Del Concepto "Modelo de Negocio" - Business Model SCOPE (Castellano)Document5 pagesEl Origen Del Concepto "Modelo de Negocio" - Business Model SCOPE (Castellano)HectorDelRosarioNo ratings yet
- Problemas Ambientales y SocialesDocument7 pagesProblemas Ambientales y SocialesLili Zapana VelásquezNo ratings yet
- Gerencia de Desarrollo Urbano y Rural solicita acciones legales por incumplimiento de consultorDocument4 pagesGerencia de Desarrollo Urbano y Rural solicita acciones legales por incumplimiento de consultorRolan RamírezNo ratings yet
- Actividad de Puntos Evaluables - Escenario 2 - PRIMER BLOQUE-CIENCIAS BASICAS - CALCULO II - (GRUPO B02)Document3 pagesActividad de Puntos Evaluables - Escenario 2 - PRIMER BLOQUE-CIENCIAS BASICAS - CALCULO II - (GRUPO B02)JulyBerrioMejiaNo ratings yet
- Alexis GonzalesDocument3 pagesAlexis GonzalesMaicol Mio NegreirosNo ratings yet
- Cuáles Son Los Algoritmos de BúsquedaDocument4 pagesCuáles Son Los Algoritmos de BúsquedaJosé Larssen TrujilloNo ratings yet
- ¿Cómo Citar Con Normas APADocument9 pages¿Cómo Citar Con Normas APAJose Manuel Narvaez CantilloNo ratings yet
- TALLER MINERO Informe 2Document20 pagesTALLER MINERO Informe 2Ignacio Garrido ContulianoNo ratings yet
- CASTILLO IVÁN Métodos Discontínuos de EentrenamientoDocument111 pagesCASTILLO IVÁN Métodos Discontínuos de EentrenamientoRaúl RamírezNo ratings yet
- Texto Expositivo Autor ModernoDocument6 pagesTexto Expositivo Autor ModernoDharma MaitéNo ratings yet
- Mediacion Proyecto Consultorio Juridicos Ucc PastoDocument17 pagesMediacion Proyecto Consultorio Juridicos Ucc PastoJuan Sebastian Rosero PNo ratings yet
- Ensamblado AvionetaDocument17 pagesEnsamblado AvionetaAlbert LouisNo ratings yet
- Proceso de forja: clasificación, métodos y defectosDocument24 pagesProceso de forja: clasificación, métodos y defectosJhoseph Rafael Paucar PradoNo ratings yet
- Contáctenos Facultad de Ciencias Jurídicas y SocialesDocument1 pageContáctenos Facultad de Ciencias Jurídicas y SocialesWb Eduardo Solis0% (1)