Professional Documents
Culture Documents
Série D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDF
Uploaded by
AzizElheniOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Série D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDF
Uploaded by
AzizElheniCopyright:
Available Formats
Exercice N1
Prparez votre baccalaurat 2013
Mr Sdiri anis
On tudie exprimentalement la cintique doxydation des ions iodures I- par les ions peroxodisulfate S 2 O82- selon
lquation : 2 I- + S 2 O 8 2- I 2 + 2 SO 4 2- .
On mlange , t = 0 , un volume V 1 = 70 mL dune solution
diodure de potassium KI de concentration C 1 = 0,03 mol.L-1
et un volume V 2 = 30 mL dune solution de proxodisulfate de
potassium K 2 S 2 O 8 de concentration C 2 = 0,03 mol.L-1 dans
des conditions diffrentes :
Exprience 1 ralise une temprature de 17C
Exprience 2 ralise une temprature de
29C
Exprience 3 ralise une temprature de
29C et en prsence des ions Fe2+.
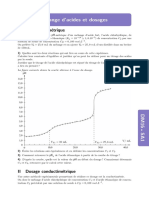
Les rsultats de mesures ont permis de tracer les courbes du
graphe ci-contre correspondant aux trois expriences ralises.
a) Vrifier, par le calcul, la valeur de la Concentration initial de S 2 O 8 2- affiche sur le Graphe.
b) A partir des courbes, comparer, sans faire de calcul, mais en justifiant la rponse, la vitesse de la raction t = 0
pour les trois expriences
c) Attribuer chaque exprience la courbe correspondante. Justifier la rponse
Exercice N2
Lacide chlorhydrique (H3O+ + Cl-) ragit sur le zinc Zn selon
une raction totale, en donnant du dihydrogne H 2 et des
ions zinc(II) Zn2+ . A linstant t = 0 , on introduit une masse
m = 2,3 g de zinc en grenaille dans un ballon contenant un
volume V A = 100 mL dune solution dacide chlorhydrique de
concentration C A = 0,2 mol.L-1 . Les rsultats de cette
exprience permettent de tracer la courbe ci-contre donnant
la concentration en Zn2+ de la solution en fonction du temps
On donne: M Zn = 65,4g.mol-1
Lquation chimique de la raction :
Zn(Sd) + 2 H 3 O+ Zn2+ + H 2 (g) + 2 H 2 O
1)a) Dresser un tableau descriptif de lvolution du systme. Dduire le ractif limitant de cette transformation.
b) Dfinir le temps de demi raction t 1/2 et le dterminer sur le graphe.
c) En dduire la composition du systme pour t = t 1/2 .
2) a) Dfinir la vitesse volumique de la raction.
b) Montrer quon peut la calculer partir de la courbe prcdente.
c) Dterminer graphiquement sa valeur linstant t 0 = 0. Prciser la mthode sur la courbe. Comment varie la vitesse
de la raction au cours du temps ? Prciser la cause de cette variation.
Exercice N3
leau oxygne H 2 O 2 ragit, en milieu acide , avec les ions iodures selon la raction totale reprsente par lquation
H 2 O 2 +2I- +2H 3 O+ 4 H 2 O +I 2 ; la raction est suppose totale
A la date t=0 et une temprature constante, on mlange :
Un volume V 1 =50ml dune solution aqueuse deau oxygn de concentration molaire C 1 =5.10-2 mol .L-1
Un volume V 2 =50mLdune solution aqueuse diodure de potassium de concentration molaire C 2 =16.10-2 mol .L1
une solution dacide chlorhydrique
quelques gouttes dempois damidon
a la date t, on prlve, du mlange ractionnel, un volume V = 10 mL quon lui ajoute de leau glace et on
1
Prparez votre baccalaurat 2013
Mr Sdiri anis
dose la quantit de diode I 2 forme par une solution de thiosulfate de sodium Na 2 S 2 O 3 selon la raction rapide
et totale dquation :
1. crire lquation de la raction de dosage (raction entre les ions thiosulfate et le diode)
2.
a) Calculer les concentrations
molaires initiales des ions iodure
[I-] 0 et de leau
oxygne [H 2 O 2 ] 0 dans
8
le mlange ractionnel
b) Dresser le tableau
davancement de la raction qui
7
se produit dans chaque
prlvement en utilisant
6
lavancement volumique
3. Les rsultats des dosages ont permis de
5
tracer la courbe rgissant les variations
de la concentration des ions iodure au
4
cours du temps (voir figure)
a) Prciser en le justifiant le ractif
3
limitant
b) Dterminer la concentration
2
finale en ion iodure [I-] f
c)
1
)
Dfinir la vitesse
volumique dune raction
chimique
)
Donner son
expression en fonction de [I-]
d) Dterminer graphiquement sa valeur a la date t=20min
e) Sachant que le temps de demi-raction t 1/2 est la date a la quelle lavancement volumique est
gale la moiti de lavancement volumique final
) Montrer quau temps de demi-raction t 1/2 on a
4. Trois expriences sont ralises dans diffrentes conditions exprimentales indiques dans le tableau cidessous
on suit, au cours de chacune des trois expriences ralises, la variation la concentration de diode form [I 2 ] en
fonction du temps t
a) Dterminer, pour chacune de ces expriences, lavancement volumique final en fonction de c
b) Comparer les vitesses initiales des 3 ractions
c) Tracer sur le mme graphe (figure ci-dessus) lallure des courbes [I 2 ] = f(t)
Exercice N4
Les ions peroxydes S 2 O 8 2- oxydent les ions iodure I- selon la raction lente et totale dquation bilan
S 2 O 8 2- + 2 I- 2 SO 4 2- + I 2 (1)
A la date t=0 et une temprature fixe, on mlange dans un bcher
Un volume V 1 , dune solution aqueuse de peroxodisulfate dammonium (S 2 O 8 2- , 2NH+ 4 )de concentration
molaire C 1 =16.10-2 mol.L-1
2
Prparez votre baccalaurat 2013
Mr Sdiri anis
Un volume V 2 =25 mL dune solution aqueuse
diodure de potassium (K+, I-) de concentration
molaire C 2
Le mlange obtenu, aprs homognation, est
quitablement rparti sur dix erlenmeyers. A un
instant t donn, on ajoute de leau glace au
contenu de lun des erlenmeyers et on le dose
par une solution aqueuse de thiosulfate de
sodium de formule chimique (2Na+, S 2 O 3 2-) et de
concentration molaire C 0 = 6.10-1mol.L-1. A
lquivalence, il ya dcoloration complte du
mlange. Lquation de la raction qui se produit
est :
2S 2 O 3 2- + I 2 S 4 O 6 2- + 2I- (2)
Cette mthode permet de suivre lvolution
temporelle de la quantit de matire des ions
iodure I- au cours de la raction (1) et de tracer
la courbe n(I-) =f(t) ( figure -1-)
1. On prpare un volume V=250mL de la solution aqueuse (S 1 ) de peroxodisulfate dammonium (S 2 O 8 2-,
2NH 4 +) de concentration molaire C 1 =16.10-2 mol.L-1 partir dune solution note (S) de peroxodisulfate
dammonium (S 2 O 8 2- ; 2NH 4 + de concentration molaire C=0.32 mol .L-1
Pour raliser cette tache, on prlve 20 mL de la solution (S) laide dune pipette jauge de 20 mL, on
verse le prlvement dans un bcher et on complte avec leau distille jusqu' la graduation 250mL en
agitant.
au cours de cette opration on a commis deux erreurs. Lesquelles ?
2.
) A la date t, et avant le dosage. Prciser lintrt de lajout de leau glace
) Interprter la dcoloration du mlange
) Dterminer la quantit de matire n(I 2 ) form a la date t. sachant que le volume de la
solution de thiosulfate de sodium ajout est V 0 =10mL
) En dduire la quantit de matire n(I-) contenu dans chaque tube essai cet instant t
dont on dterminera graphiquement sa valeur
3. En exploitant la courbe n(I-) =f(t) . dterminer
) La valeur de la quantit de la quantit de matire initialement introduite des ions iodure(I-) dans
chaque tube essai
) La valeur de lavancement final x max
) Montrer que le peroxodisulfate (S 2 O 8 2) est le ractif limitant. En dduire le volume V 1 utilis
4.
) Dfinir la vitesse instantane v(t) dune raction chimique
) Calculer la valeur de la vitesse instantane v de la raction tudie la date t= 1 min
Exercice N5
A t=0 s, On introduit un volume V 1 =200 mL dune solution (S 1 ) diodure de potassium KI de concentration molaire C 1 ,
un volume V 2 =300 mL dune solution (S 2 ) de proxodisulfate de potassium K 2 S 2 O 8 de concentration molaire
C 2 =10-2 mol.L-1 et quelques gouttes dempois damidon. Une tude exprimentale a permis de tracer la courbe des
variations de la concentration de lion iodure I- en fonction du temps ( Voir figure ci- dessous ).
1- a- Ecrire lquation de la raction chimique symbolisant la raction doxydorduction suppose lente et totale.
Prciser les couples rdox mis en jeu.
2- a- Dfinir la vitesse de la raction la date t.
Prparez votre baccalaurat 2013
Mr Sdiri anis
V d[I-]
b- Montrer que son expression scrit sous la forme v =- .
. Avec V volume du mlange ractionnel.
2 dt
c- Comment varie cette vitesse au cours du temps ? Justifier.
d- Dterminer sa valeur maximale.
3- a- Dfinir la vitesse moyenne V moy de la raction. Donner son expression en fonction de
variation de la concentration des ions I- pendant la dure t.
[I-]
o [I-] est la
t
b- Calculer sa valeur entre les instants t 1 =0 et t 2 = 4 min.
4-
a- Dresser le tableau descriptif dvolution du systme chimique.
b- En utilisant le graphe, dterminer la quantit de matire initiale n 0 (I-) dans le mlange. Dduire la valeur de C 1 .
c- Dfinir le temps de demi-raction (t 1/2 ). Sachant que t 1/2 = 4 min, dterminer lavancement final (maximal) de la
raction.
d- Quel est le ractif limitant ?
e- Complter la courbe de [I-]=f(t) sachant que la raction se termine la date t f =32min
[I-] (10-3 mol.L-1)
t(min)
You might also like
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniNo ratings yet
- SerieDocument7 pagesSeriemehdi benmassoudNo ratings yet
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 pagesSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiNo ratings yet
- Série Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Document4 pagesSérie Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Aicha DaouNo ratings yet
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 pagesSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahNo ratings yet
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 pagesSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- Dipole Rc-Cinetique Chimique: Exercice 1Document2 pagesDipole Rc-Cinetique Chimique: Exercice 1Alaoui Amine0% (1)
- Equilibre ChimiqueDocument5 pagesEquilibre ChimiqueJabri ImeneNo ratings yet
- Simili 2Document3 pagesSimili 2Noureddine ElmabroukiNo ratings yet
- 10038734Document36 pages10038734dam 12100% (1)
- Devoir 1 pc2 PDFDocument6 pagesDevoir 1 pc2 PDFالغزيزال الحسن EL GHZIZAL HassaneNo ratings yet
- Dipôles RL - RC - RLC - 2012 - LSLL PDFDocument7 pagesDipôles RL - RC - RLC - 2012 - LSLL PDFAnis DahnenNo ratings yet
- Examens Nationaux de 2008 À 2021 - PCTIZNIT PDFDocument194 pagesExamens Nationaux de 2008 À 2021 - PCTIZNIT PDFMaroua SekkoutNo ratings yet
- Bac Math Pysh Acide Base Serie 4Document1 pageBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 pagesSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 pagesExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalNo ratings yet
- Controle2 Partie 2 2022ههDocument4 pagesControle2 Partie 2 2022ههMouhibi Abdellah100% (1)
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniNo ratings yet
- Bac Blan de Ndongo 2021Document5 pagesBac Blan de Ndongo 2021Amadou Makhtar SeckNo ratings yet
- Durée Estimée: Date:: Univup Ma 2h00min 31 12 021Document7 pagesDurée Estimée: Date:: Univup Ma 2h00min 31 12 021Khaouda DrissNo ratings yet
- Devoir de Révision N°1 - Sciences Physiques Chimie Cinétiques Physique Dipôles RC Et RL Et RLC - Bac Sciences Exp (2012-2013) MR El Hafi MustaphaDocument7 pagesDevoir de Révision N°1 - Sciences Physiques Chimie Cinétiques Physique Dipôles RC Et RL Et RLC - Bac Sciences Exp (2012-2013) MR El Hafi MustaphaAyoub AbidNo ratings yet
- DSFR 2 Bac 4Document3 pagesDSFR 2 Bac 4Mouhibi AbdellahNo ratings yet
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 pagesDM16 1112 - Dosage PH Metrique Es PDFEmma LovaNo ratings yet
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pages4 Exercice Suivi D'une Transformation Chimiquenabil echerrarNo ratings yet
- PH SolutionDocument5 pagesPH SolutionBelgasem AsselNo ratings yet
- Contrôle 2Document3 pagesContrôle 2Mery EmNo ratings yet
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- p4 GravitationDocument6 pagesp4 GravitationNajimou Alade TidjaniNo ratings yet
- Devoir Bac MathDocument5 pagesDevoir Bac MathLotfi Khemili100% (1)
- Oscillations Mécaniques Libres PDFDocument6 pagesOscillations Mécaniques Libres PDFAzizElheniNo ratings yet
- 2 Bac Sobhi 03-Propagation-Dune-Onde-LumineuseDocument11 pages2 Bac Sobhi 03-Propagation-Dune-Onde-Lumineusekhalifa El harfiNo ratings yet
- Devoir de Synthèse N°1 - Physique - Bac Tech (2009-2010)Document8 pagesDevoir de Synthèse N°1 - Physique - Bac Tech (2009-2010)KhaoulaMaatoug100% (1)
- Exercice Suivi Temporelle ChimieDocument4 pagesExercice Suivi Temporelle ChimiePhobos ElfaNo ratings yet
- Série 1Document4 pagesSérie 1saidisalma412No ratings yet
- Cours - Physique DEVOIR CONTROLE N°2 - Bac Sciences Exp (2012-2013) MR TLILI TOUHAMIDocument3 pagesCours - Physique DEVOIR CONTROLE N°2 - Bac Sciences Exp (2012-2013) MR TLILI TOUHAMIMohamed HamdeneNo ratings yet
- Série D'exercices N°8 Avec Correction - Sciences Physiques - Révision - Bac Sciences Exp (2019-2020) MR Amine Touati PDFDocument7 pagesSérie D'exercices N°8 Avec Correction - Sciences Physiques - Révision - Bac Sciences Exp (2019-2020) MR Amine Touati PDFsiwar kokoNo ratings yet
- PH7 Ondes ProgressivesDocument11 pagesPH7 Ondes ProgressivesHadhri HadhriNo ratings yet
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebNo ratings yet
- Exercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFDocument5 pagesExercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFBouba KhedherNo ratings yet
- dc2 Sadiki2010Document4 pagesdc2 Sadiki2010Mohsen ArfaouiNo ratings yet
- Serie 2 PHDocument3 pagesSerie 2 PHWassim Ben TanfousNo ratings yet
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoNo ratings yet
- ds3 4eme Sadiki 13 ScExpDocument4 pagesds3 4eme Sadiki 13 ScExpLotfi Bouchareb0% (1)
- Examen National Physique Chimie SPC 2013 Rattrapage SujetDocument6 pagesExamen National Physique Chimie SPC 2013 Rattrapage Sujetothmane GbNo ratings yet
- Devoir Blanc 2 Bac PCDocument2 pagesDevoir Blanc 2 Bac PCSABOUR MOHAMMEDNo ratings yet
- Bac - Blancn°1 - SM - 2024 - MR - SABOURDocument6 pagesBac - Blancn°1 - SM - 2024 - MR - SABOURsalmakouhail40No ratings yet
- 2010 AmNord Exo1 Correction Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Correction Eau 6 5ptsla physique selon le programme FrançaisNo ratings yet
- Devoir de Contrôle N°1 2019 2020 (MR Jawher Ben Kahla)Document4 pagesDevoir de Contrôle N°1 2019 2020 (MR Jawher Ben Kahla)sonilola100% (1)
- Révision Et Coltrol 2Document5 pagesRévision Et Coltrol 2Arfa Bouchta67% (3)
- Série, Les Ondes LumineusesDocument6 pagesSérie, Les Ondes LumineusesTEST - TEST0% (1)
- Controle N1 2BAC PC BIOF 22 OmarDocument4 pagesControle N1 2BAC PC BIOF 22 Omarassad saisNo ratings yet
- SM Ondes MécaniquesDocument4 pagesSM Ondes MécaniquesZaynab MouchtachiNo ratings yet
- Noyau Masse Energie PDFDocument4 pagesNoyau Masse Energie PDFHadjer Jojo100% (1)
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImeneNo ratings yet
- C1Chim Transformations Lentes Rapides Exercices PDFDocument6 pagesC1Chim Transformations Lentes Rapides Exercices PDFAzizElheniNo ratings yet
- Serie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Document4 pagesSerie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Babacar NdiayeNo ratings yet
- Ob s1 Cinetique ChimiqueDocument2 pagesOb s1 Cinetique Chimiquemedabdellahisamba34No ratings yet
- Cinétique ChimieDocument6 pagesCinétique ChimieMouhamed BarroNo ratings yet
- 14 Ondes ProgressivesDocument6 pages14 Ondes ProgressiveslemiaNo ratings yet
- 11-Oscill Mec Libres PDFDocument9 pages11-Oscill Mec Libres PDFAzizElheniNo ratings yet
- 18 Reaction Nucleaire PDFDocument10 pages18 Reaction Nucleaire PDFAzizElheniNo ratings yet
- 13b Mec Forcees ScExp PDFDocument5 pages13b Mec Forcees ScExp PDFAzizElheniNo ratings yet
- 17 SpectreDocument8 pages17 SpectrelemiaNo ratings yet
- 10-rlc Force PDFDocument5 pages10-rlc Force PDFAzizElheniNo ratings yet
- 11-Oscill Mec Libres PDFDocument9 pages11-Oscill Mec Libres PDFAzizElheniNo ratings yet
- 2016 Sadiki PDFDocument5 pages2016 Sadiki PDFAzizElheniNo ratings yet
- 13 Mec Forcees PDFDocument5 pages13 Mec Forcees PDFAzizElheniNo ratings yet
- 15 Interaction Onde PDFDocument7 pages15 Interaction Onde PDFAzizElheniNo ratings yet
- Re Capitulatif Avancement PDFDocument4 pagesRe Capitulatif Avancement PDFAzizElheniNo ratings yet
- 2 RC PDFDocument7 pages2 RC PDFAzizElheniNo ratings yet
- 9-rlc Force PDFDocument7 pages9-rlc Force PDFAzizElheni50% (2)
- 8 LC PDFDocument3 pages8 LC PDFAzizElheniNo ratings yet
- 1 Condensateur PDFDocument3 pages1 Condensateur PDFAzizElheni100% (1)
- 3 RC PDFDocument4 pages3 RC PDFAzizElheniNo ratings yet
- 4 Ind MagnDocument4 pages4 Ind MagnBoussetta ZouhaierNo ratings yet
- 4 RL PDFDocument8 pages4 RL PDFAzizElheniNo ratings yet
- S6 Chapitre 6 Cinetique Chimique PDFDocument12 pagesS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- Os Chimie Corrige ch7 PDFDocument38 pagesOs Chimie Corrige ch7 PDFAzizElheniNo ratings yet
- 5 RL PDFDocument3 pages5 RL PDFAzizElheni100% (1)
- C13Phy Aspects Energetiques PDFDocument4 pagesC13Phy Aspects Energetiques PDFAzizElheniNo ratings yet
- C11Phy Mouvements Plans PDFDocument5 pagesC11Phy Mouvements Plans PDFAzizElheniNo ratings yet
- C12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFDocument4 pagesC12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFAzizElheniNo ratings yet
- C11Chim - Controle - Evolution - Exos - SavondeMarseille PDFDocument8 pagesC11Chim - Controle - Evolution - Exos - SavondeMarseille PDFAzizElheniNo ratings yet
- C10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFDocument14 pagesC10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFAzizElheniNo ratings yet
- C10Chim Esterification Hydrolyse PDFDocument5 pagesC10Chim Esterification Hydrolyse PDFAzizElheniNo ratings yet
- C13Phy - Aspects - Energetiques - Exos - EcEpEm PDFDocument6 pagesC13Phy - Aspects - Energetiques - Exos - EcEpEm PDFAzizElheniNo ratings yet
- C12Phy - Systemes - Oscillants - Oscillateur - Elastique - Exos - Ressort PDFDocument4 pagesC12Phy - Systemes - Oscillants - Oscillateur - Elastique - Exos - Ressort PDFAzizElheniNo ratings yet
- C10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFDocument7 pagesC10Chim - Esterification - Hydrolyse - Equilibre - Exos - Fischer - 2 PDFAzizElheniNo ratings yet
- Correction TD2 Opérations Unitaires (EST) 2020-2021Document14 pagesCorrection TD2 Opérations Unitaires (EST) 2020-2021Fahim salwaNo ratings yet
- 03 Le Courant ElectriqueDocument4 pages03 Le Courant ElectriqueBachiro Mohamed OuedraogoNo ratings yet
- CHAPITRE 3 ACI 546 - Compressed FRDocument24 pagesCHAPITRE 3 ACI 546 - Compressed FRAmel RADJEFNo ratings yet
- 2021stg DAE5 Toussaint Cyril RapportDocument77 pages2021stg DAE5 Toussaint Cyril Rapportleandre fauster tchakouaNo ratings yet
- Elastopan S 7089-156 187-53 270-14 TDS FR PDFDocument3 pagesElastopan S 7089-156 187-53 270-14 TDS FR PDFA MahmoodNo ratings yet
- 28 - Induction Électromagnétique Cours PDFDocument6 pages28 - Induction Électromagnétique Cours PDFEld AyoubNo ratings yet
- Etat AvancementDocument21 pagesEtat Avancementhouda amzineNo ratings yet
- Chapitre1 Ondes Et VibrationsDocument13 pagesChapitre1 Ondes Et VibrationsahmedNo ratings yet
- Rapport SDCC FinalDocument56 pagesRapport SDCC Finalyouness100% (2)
- Support TP Chimie1Document21 pagesSupport TP Chimie1Âmįþăf BłłNo ratings yet
- Programme 12 Cinétique Chimique Dynamique NewtonienneDocument1 pageProgramme 12 Cinétique Chimique Dynamique NewtonienneAchilleNo ratings yet
- Hacini LaggouneDocument51 pagesHacini Laggounelionel BecketNo ratings yet
- 3M Ch3 CoursDocument2 pages3M Ch3 Coursmanar.elwadiNo ratings yet
- 06 TechIng Salager EmulsionsDocument17 pages06 TechIng Salager EmulsionsYAKOUB MARICHENo ratings yet
- Chapitre 6 - L'AnilineDocument7 pagesChapitre 6 - L'AnilineBeatrice Florin100% (1)
- TD 09 Perturbation Niveaux DegeneresDocument2 pagesTD 09 Perturbation Niveaux DegeneresHadjer JojoNo ratings yet
- C1-1-Classification Periodique Des ElementsDocument18 pagesC1-1-Classification Periodique Des Elementsgreento0% (1)
- Exposé Mesure DéphasageDocument15 pagesExposé Mesure Déphasage202134022430No ratings yet
- Chapitre 5 Interactions Fondamentales Et Champs ProfDocument5 pagesChapitre 5 Interactions Fondamentales Et Champs Profdorcaslisa15No ratings yet
- Hydro Distillation 2Document4 pagesHydro Distillation 2krim gasmiNo ratings yet
- Controle 1 - 2 S1 PC 1bac FRDocument2 pagesControle 1 - 2 S1 PC 1bac FRElmahdi BenhNo ratings yet
- WP 310 Essai Des Materiaux 50kN Gunt 1575 PDF - 1 - FR FRDocument3 pagesWP 310 Essai Des Materiaux 50kN Gunt 1575 PDF - 1 - FR FRNana Vladimid Ronald TATMENNo ratings yet
- CH8 EXERCICES Concentration Molaire Des Espèces Moléculaires Dans Une Solution TCSbiof Prof - Mardi (WWW - Pc1.ma)Document3 pagesCH8 EXERCICES Concentration Molaire Des Espèces Moléculaires Dans Une Solution TCSbiof Prof - Mardi (WWW - Pc1.ma)Yassine BerchilNo ratings yet
- TD8 Magnétisme PDFDocument4 pagesTD8 Magnétisme PDFNadaNo ratings yet
- 07 - Fiche de Mémorisatino Active-Chapitre 7-Structure Entités OrganiquesDocument2 pages07 - Fiche de Mémorisatino Active-Chapitre 7-Structure Entités OrganiquesJojo DouldoumNo ratings yet
- Physique Nucléaire (Réparé) (Réparé)Document23 pagesPhysique Nucléaire (Réparé) (Réparé)Mëđï Bëñmãššøůđ BnmssdNo ratings yet
- TD 5 Extraction Liquide Liquide 2016 2017Document2 pagesTD 5 Extraction Liquide Liquide 2016 2017fifi fifi88% (8)
- Physique Chimie PSI 2020Document16 pagesPhysique Chimie PSI 2020Younes JaafarNo ratings yet
- Epi 04 2021Document18 pagesEpi 04 2021hardyloussoukouNo ratings yet
- 10 Les Traitements Des BoisDocument5 pages10 Les Traitements Des BoismpanNo ratings yet